Similar presentations:
Капиллярный электрофорез
1.
Капиллярныйэлектрофорез
работу подготовила
студентка 308 группы
Воронина Екатерина Геннадьевна
Научный руководитель: Боровский Борис
Владимирович
2.
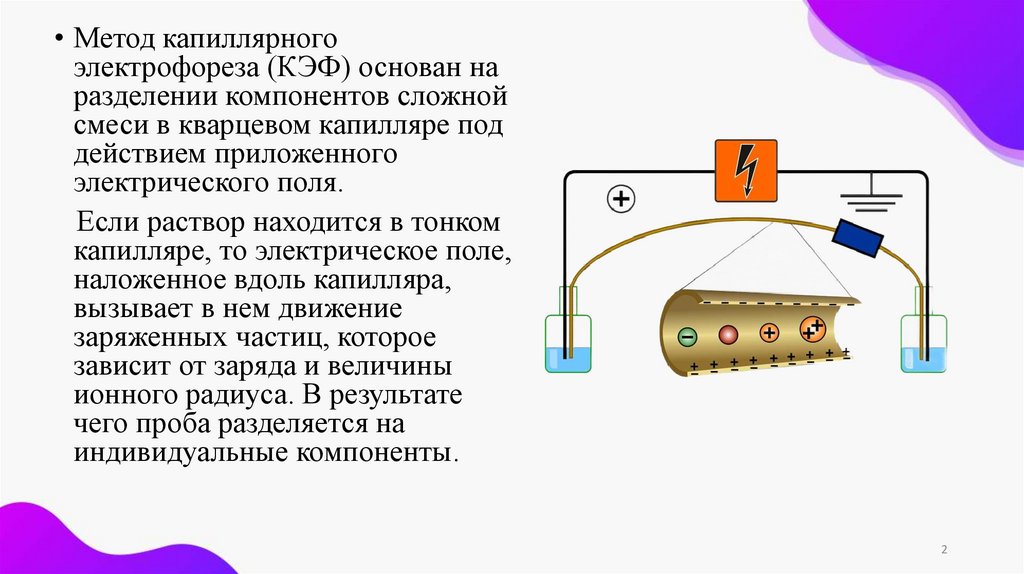
• Метод капиллярногоэлектрофореза (КЭФ) основан на
разделении компонентов сложной
смеси в кварцевом капилляре под
действием приложенного
электрического поля.
Если раствор находится в тонком
капилляре, то электрическое поле,
наложенное вдоль капилляра,
вызывает в нем движение
заряженных частиц, которое
зависит от заряда и величины
ионного радиуса. В результате
чего проба разделяется на
индивидуальные компоненты.
2
3.
• Развитие метода капиллярногоэлектрофореза началось в 30-х годах
XX столетия, когда А. Тиселиус
разделял белки сыворотки крови,
используя электрофорез с подвижной
границей. Это первый случай
использования электрофореза для
разделения биологически активных
соединений.
• В 1967 году С. Хертен впервые
использовал капилляры в
электрофорезе белков, нуклеиновых
кислот и неорганических ионов.
Арне Тиселиус
3
4.
Основные виды электрофорезаКапиллярный зонный
электрофорез (CZE)
Мицеллярная
электрокинетическая
хроматография(МЕКС)
• Изотахофорез (ITP)
Капиллярный гель-электрофорез
(CGE)
Микроэмульсионная
электрокинетическая
хроматография (МЕЕКС)
Капиллярная изоэлектрическая
фокусировка (CIEF)
4
5.
• Минимальный состав системы, реализующей метод капиллярногоэлектрофореза, должен включать следующие узлы: кварцевый
капилляр, источник высокого напряжения, устройство ввода
пробы, детектор и систему сбора, обработки и вывода
информации.
5
6.
Основными принципами детектирования в КЭ являются:• фотометрическое в УФ-видимой области спектра (прямое и
косвенное)
• флуориметрическое (прямое и косвенное)
• Кондуктометрическое
• амперометрическое (прямое и косвенное)
• Радиометрическое
• рефрактометрическое.
Наиболее распространенным вариантом детектирования
продолжает оставаться фотометрическое, основанное на
поглощении веществом УФ или видимого света.
6
7.
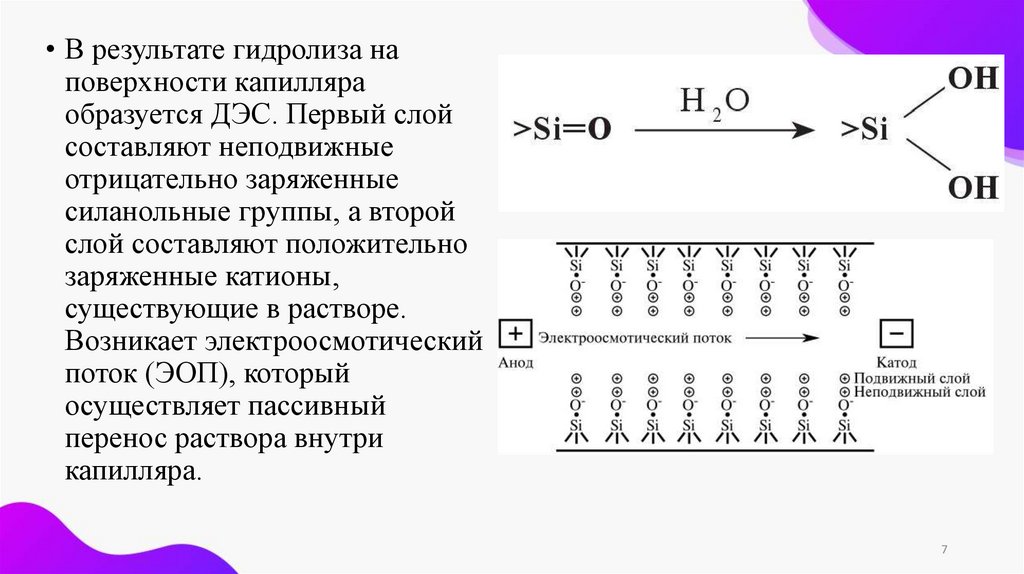
• В результате гидролиза наповерхности капилляра
образуется ДЭС. Первый слой
составляют неподвижные
отрицательно заряженные
силанольные группы, а второй
слой составляют положительно
заряженные катионы,
существующие в растворе.
Возникает электроосмотический
поток (ЭОП), который
осуществляет пассивный
перенос раствора внутри
капилляра.
7
8.
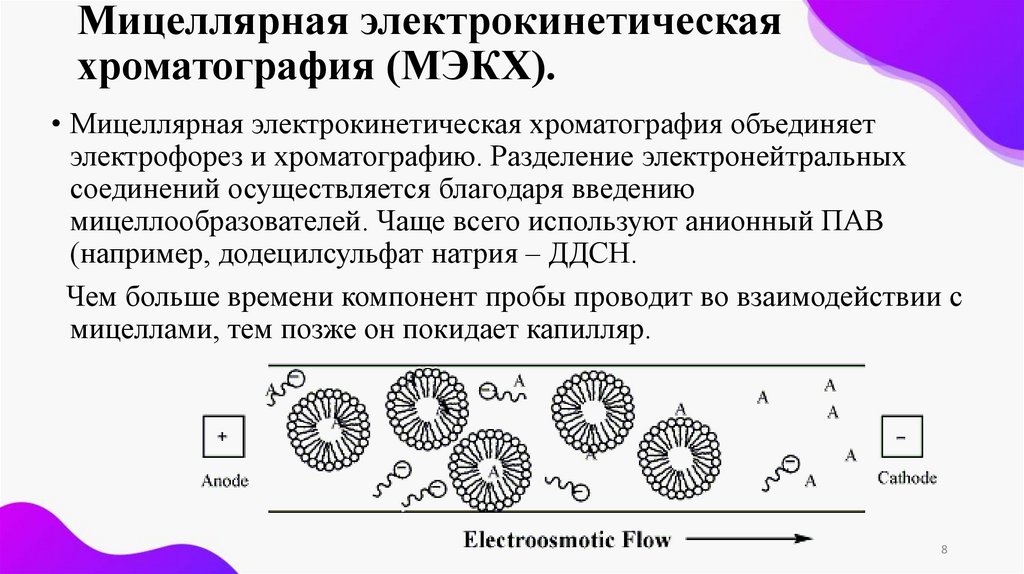
Мицеллярная электрокинетическаяхроматография (МЭКХ).
• Мицеллярная электрокинетическая хроматография объединяет
электрофорез и хроматографию. Разделение электронейтральных
соединений осуществляется благодаря введению
мицеллообразователей. Чаще всего используют анионный ПАВ
(например, додецилсульфат натрия – ДДСН.
Чем больше времени компонент пробы проводит во взаимодействии с
мицеллами, тем позже он покидает капилляр.
8
9.
Разделение катионов• Мицеллы, имеющие заряд на своей поверхности, могут
привлекать противоположные по заряду компоненты пробы,
задерживая их в капилляре. Так, мицеллы из ДДСН, имея
отрицательный заряд на поверхности, будут
задерживать катионы. Именно поэтому катионы покинут
капилляр позже всех остальных компонентов пробы. Разделение
катионов также зависит от их соотношения заряд/масса. То есть,
катионы с большей массой покинут капилляр позже катионов с
меньшей массой.
9
10.
Разделение анионов• Отрицательно заряженные компоненты пробы, наоборот, будут
отталкиваться от отрицательно заряженных мицелл и от
отрицательно заряженной стенки капилляра, а значит, покинут
капилляр в первую очередь. Разделение анионов также
происходит с учетом их молекулярной массы. Чем меньше
масса аниона, тем быстрее он покинет капилляр.
10
11.
Разделение нейтральных соединений• Нейтральные компоненты пробы взаимодействуют с
гидрофобными ядрами мицелл, причем это взаимодействие будет
прямо пропорционально степени гидрофобности компонента
пробы. Чем более гидрофобна нейтральная молекула, тем сильнее
она задержится в капилляре, и тем позже его покинет. Масса
нейтральных гидрофобных компонентов не играет роли в
разделении путем МЭКХ.
11
12.
анионы с малой молекулярной массойанионы с большой молекулярной массой
нейтральные молекулы с большой гидрофобностью
нейтральные молекулы с меньшей гидрофобностью
катионы с меньшей массой
12
13.
Область применения капиллярногоэлектрофореза
Криминалистическая
экспертиза
Контроль качества
пищевой продукции
Фармация и
клиническая биохимия
13
14.
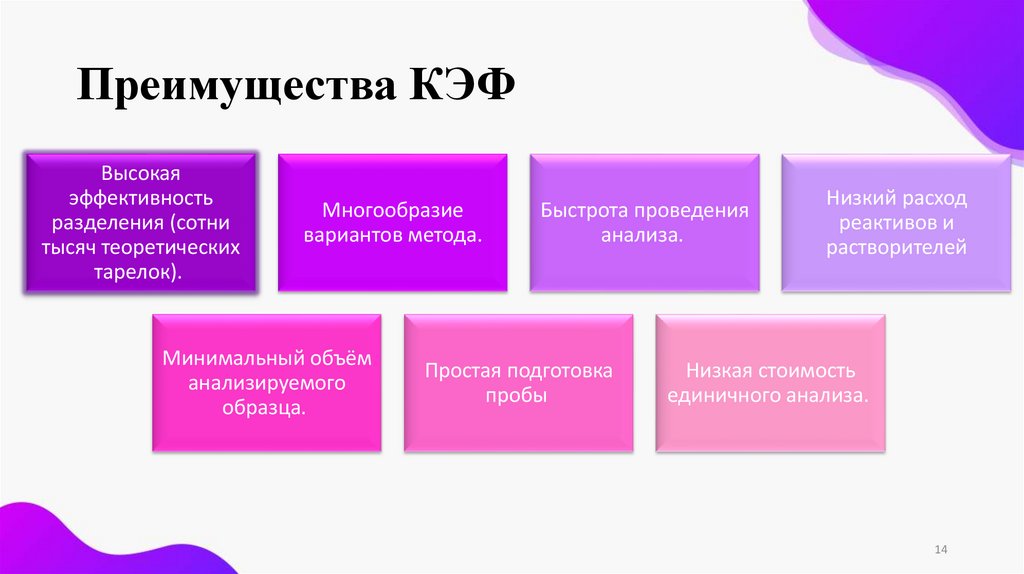
Преимущества КЭФВысокая
эффективность
разделения (сотни
тысяч теоретических
тарелок).
Многообразие
вариантов метода.
Минимальный объём
анализируемого
образца.
Быстрота проведения
анализа.
Простая подготовка
пробы
Низкий расход
реактивов и
растворителей
Низкая стоимость
единичного анализа.
14
15.
Недостатки КЭФНевысокая концентрационная
чувствительность по сравнению с
ВЭЖХ.
Требование к анализируемым
соединениям растворяться в воде и
разбавленных водно-органических
смесях.
Хрупкость кварцевого капилляра.
Адсорбция анализируемых веществ
на стенках капилляра, приводящая
к потере эффективности.
15
16.
Спасибо за внимание!16











 chemistry
chemistry








