Similar presentations:
Общая характеристика галогенов. Химические свойства на примере хлора
1.
ОБЩАЯХАРАКТЕРИСТИКА
ГАЛОГЕНОВ.
ХИМИЧЕСКИЕ
СВОЙСТВА НА
ПРИМЕРЕ ХЛОРА
2.
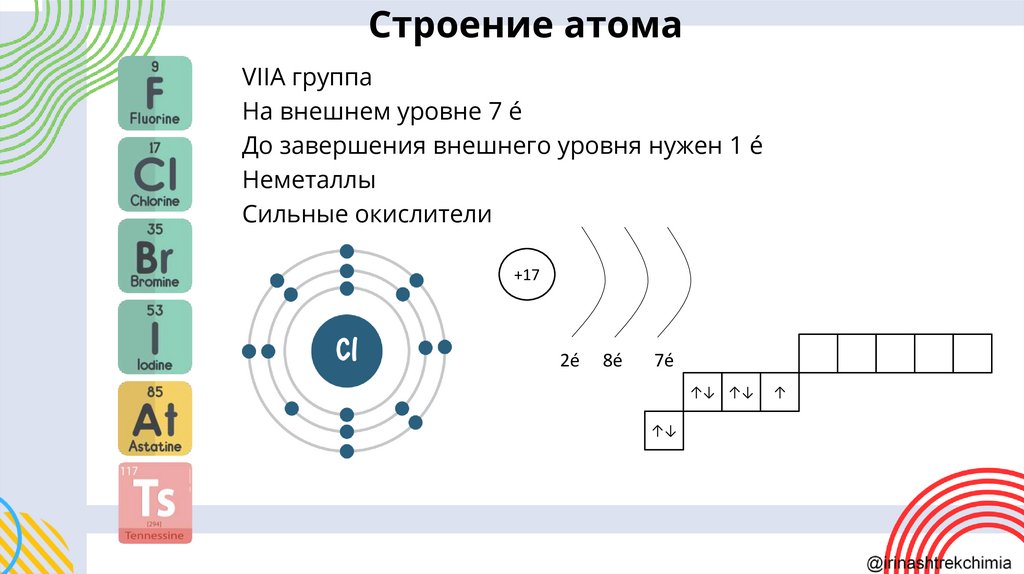
Строение атомаVIIА группа
На внешнем уровне 7 é
До завершения внешнего уровня нужен 1 é
Неметаллы
Сильные окислители
+17
2é
8é
7é
↑↓ ↑↓
↑↓
↑
3.
Нахождение в природефлюорит
криолит
фторапатит
галит
сильвинит
сильвин
4.
Нахождение в природеи
5.
Физические свойствафтор - светло-жёлтый газ с резким раздражающим запахом,
ядовит. Активно реагирует с водой.
хлор - жёлто-зелёный газ с удушающим запахом, ядовит.
Растворяется в воде ограниченно.
бром
красно-бурая
зловонная
жидкость,
ядовит.
Растворимость в воде 3,5 г на 100 г, лучше растворяется в
органических растворителях.
йод - серо-чёрные кристаллы с металлическим блеском. При
нагревании возгоняется (переходит в газ), превращаясь в
фиолетовые пары. Ядовит. Растворимость - 0,02 г на 100 г воды
6.
Хлор - первое боевоеотравляющее вещество,
которое применили
германские войска в
Первую мировую войну
7.
Получение галогеновВ промышленности:
2NaCl + 2H2O = 2NaOH + Cl2↑ + H2↑
Фтор получают только из расплавов солей, так как при электролизе
водных растворов фторидов выделяется кислород, а не фтор
В лаборатории:
4HCl + MnO2 = MnCl2 + Cl2↑ + 2H2O
16HCl + 2KMnO4 = 2KCl + 2MnCl2 + 5Cl2↑ + 8H2O
14HCl + K2Cr2O7 = 2KCl + 2CrCl3 + 3Cl2↑ + 7H2O
8.
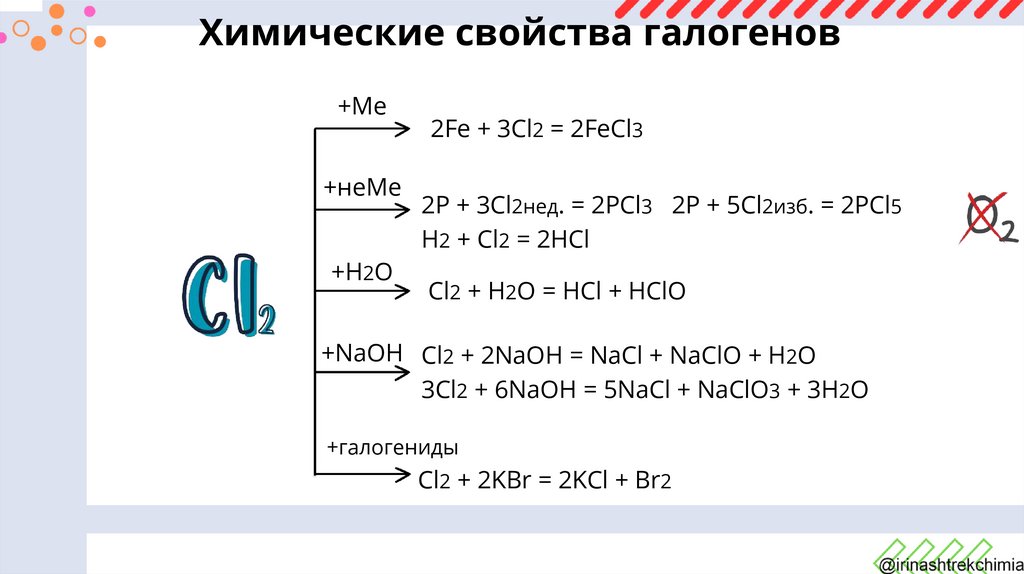
Химические свойства галогенов+Ме
+неМе
+H2O
2Fe + 3Cl2 = 2FeCl3
2P + 3Cl2нед. = 2PCl3 2P + 5Cl2изб. = 2PCl5
H2 + Cl2 = 2HCl
Cl2 + H2O = HCl + HClO
+NaOH Cl2 + 2NaOH = NaCl + NaClO + H2O
3Cl2 + 6NaOH = 5NaCl + NaClO3 + 3H2O
+галогениды
Cl2 + 2KBr = 2KCl + Br2







 chemistry
chemistry








