Similar presentations:
Свойства газов и жидкостей
1.
Свойства газов и жидкостей1
2.
АГРЕГАТНЫЕ СОСТОЯНИЯ ВЕЩЕСТВАСостояние
вещества.
Расположение частиц.
Твердое.
Расстояния сравнимы с
размерами частиц.
Твердые тела имеют
кристаллическую структуру.
Колебания около
положения
равновесия.
Жидкое.
Расположены почти
вплотную друг к другу.
В основном
Сохраняют объем,
колеблются около
но не сохраняют
положения равновесия, форму. Мало
изредка перескакивая в сжимаемы. Текучи.
другое.
Бензин, спирт,
ртуть, вода.
Хаотическое движение Не сохраняют ни
с многочисленными
форму, ни объем.
столкновениями.
Легко сжимаемы.
Скорости сравнительно Заполняют весь
большие.
предоставленный
им объем.
Кислород, азот.
Газообраз- Расстояния много
больше
ное.
размеров частиц.
Расположение
совершенно
хаотическое.
Характер движения Некоторые
частиц.
свойства.
Сохраняют форму и
объем.
Упругость.
Прочность.
Твердость.
Примеры
(при 20 0 С)
Графит, алмаз,
медь, железо.
2
3.
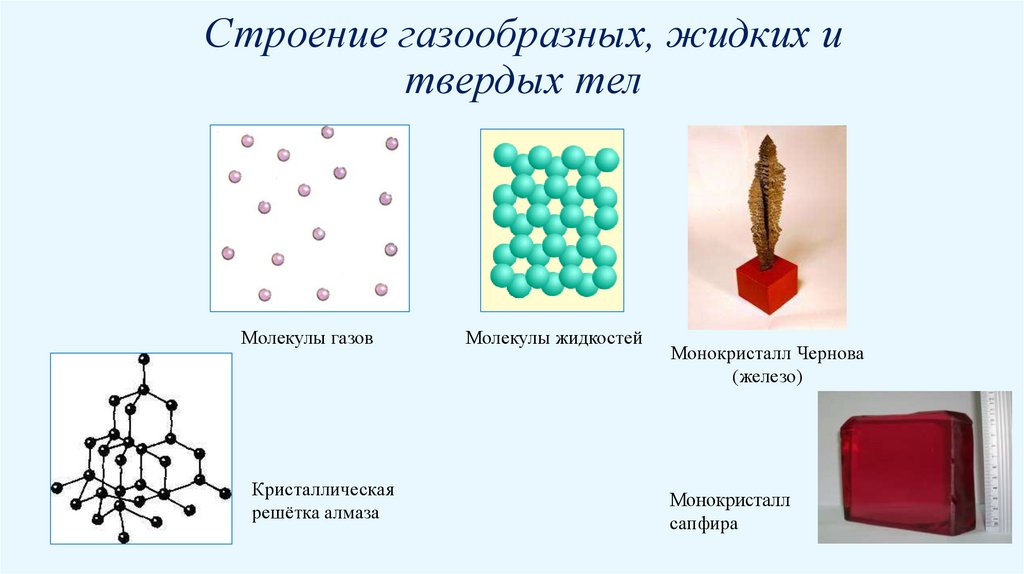
Строение газообразных, жидких итвердых тел
Молекулы газов
Кристаллическая
решётка алмаза
Молекулы жидкостей
Монокристалл Чернова
(железо)
Монокристалл
сапфира
4.
На поверхности земли мынаблюдаем H2O в трёх
агрегатных состояниях: водяной пар, лёд, вода. Из всех
разделов
физики
только
молекулярная физика даёт
возможность показать почему
вещество может находиться в
газообразном,
жидком
и
твердом состояниях.
Водяной пар
Лёд
Вода
5.
Газообразное состояниеОни не сохраняют не формы, ни объема.
Многочисленные удары молекул о стенки сосуда
создают давление газа.
В газах расстояние между атомами и молекулами
в среднем во много раз больше размеров самих
молекул. Газы легко сжимаемы, при этом
уменьшается
среднее
расстояние
между
молекулами, но молекулы не сдавливают друг
друга. Они могут неограниченно расширятся. Они
не
cохраняют
ни
формы,
ни
объема.
Многочисленные удары молекул о стенки сосуда
создают давление газа.
5/40
6.
Свойства газовОбъём и форму не сохраняют.
Расстояние между молекулами большое, во много раз больше
самих молекул .
Легко сжимаемы.
Молекулы газов совершают беспорядочное движение,
поэтому заполняют собой весь предоставленный им объём.
При повышении температуры расширяются. Если сосуд
отсутствует, то расширяются неограниченно.
6/40
7.
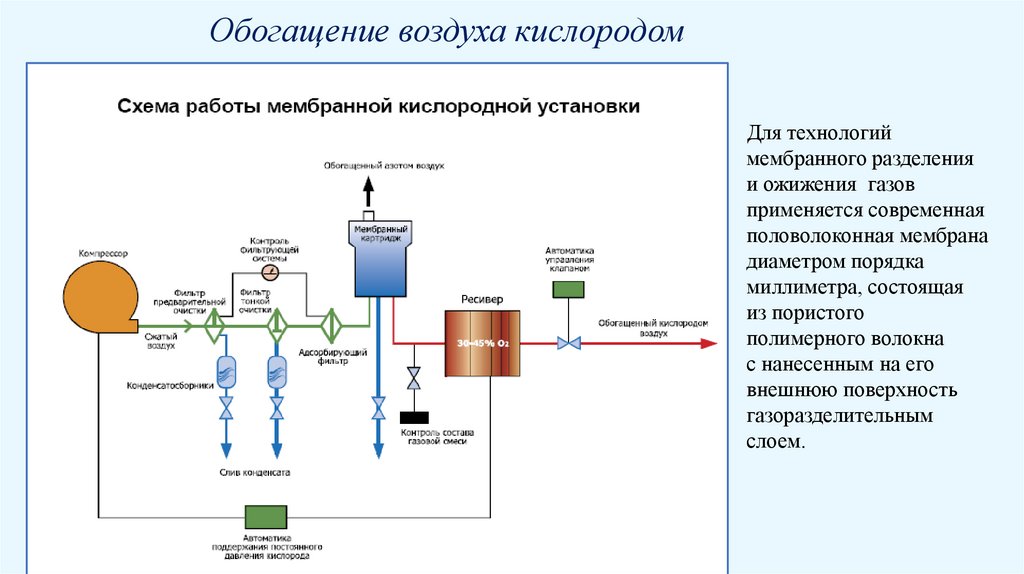
Обогащение воздуха кислородомДля технологий
мембранного разделения
и ожижения газов
применяется современная
половолоконная мембрана
диаметром порядка
миллиметра, состоящая
из пористого
полимерного волокна
с нанесенным на его
внешнюю поверхность
газоразделительным
слоем.
8.
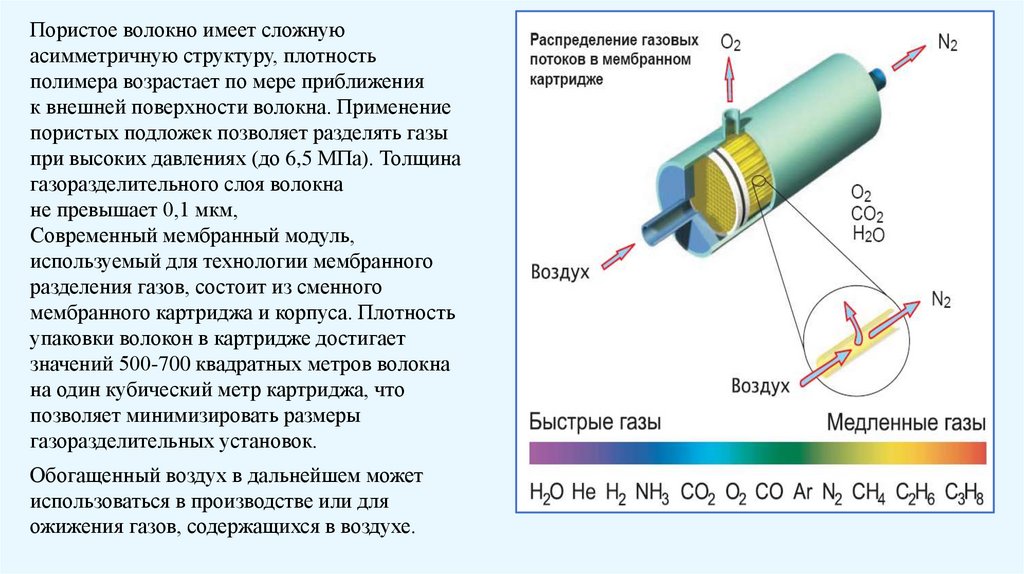
Пористое волокно имеет сложнуюасимметричную структуру, плотность
полимера возрастает по мере приближения
к внешней поверхности волокна. Применение
пористых подложек позволяет разделять газы
при высоких давлениях (до 6,5 MПа). Толщина
газоразделительного слоя волокна
не превышает 0,1 мкм,
Современный мембранный модуль,
используемый для технологии мембранного
разделения газов, состоит из сменного
мембранного картриджа и корпуса. Плотность
упаковки волокон в картридже достигает
значений 500-700 квадратных метров волокна
на один кубический метр картриджа, что
позволяет минимизировать размеры
газоразделительных установок.
Обогащенный воздух в дальнейшем может
использоваться в производстве или для
ожижения газов, содержащихся в воздухе.
9.
Жидкое состояниеМолекулы жидкости расположены почти вплотную друг к другу, поэтому молекулы
жидкости ведет себя иначе чем молекулы. Зажатая, как в клетке, другими молекулами,
она совершает «бег на месте» (колеблется около положения равновесия, сталкиваясь с
соседними молекулами). Жидкость не сохраняют формы. Время оседлой жизни
молекулы воды т.е. время колебаний около одного определенного положения
равновесия при комнатной температуре, равно в среднем 10-11 с.
9/40
10.
Время оседлой жизни молекулыВремя оседлой жизни
молекулы воды, т. е. время
колебаний около одного
определенного положения
равновесия при комнатной
температуре, равно в
среднем 10-11 с.
Время же одного колебания
значительно меньше (1012—10-13 с). С повышением
температуры время
оседлой жизни молекул
уменьшается.
10/40
11.
Вывод:1.
В зависимости от условий одно и то же вещество может
находиться в различных агрегатных состояниях.
Вещество может переходить из одного агрегатного состояния в
другое.
2.
Переход из одного состояния вещества в другое называется
фазовым переходом.
11
12.
Почему монетка и водомерка не тонут?У жидкостей имеется свободная поверхность – граница раздела
жидкости и газа.
На молекулу на этой границе действуют разные силы,
равнодействующая направлена внутрь жидкости и перпендикулярно
поверхности. Поэтому молекулы «втягиваются» внутрь жидкости
12
13.
Способность жидкости сокращать свою поверхность называютповерхностным натяжением
Поверхностное натяжение - явление молекулярного давления на жидкость, вызванное,
притяжением молекул поверхностного слоя к молекулам внутри жидкости.
13
14.
Энергия поверхностного слояМолекулы поверхностного слоя обладают избыточной по
сравнению с молекулами внутри жидкости потенциальной
энергией, т.е. поверхностной энергией:
Еп= σ S;
σ - коэффициент поверхностного натяжения
Жидкость принимает такую форму при которой эта энергия
будет иметь минимальное значение, а ее площадь
оказывается минимальной для данного объема жидкости.
Коэффициент поверхностного натяжения σ – это
физическая величина, равная отношению силы, с которой
поверхностный слой жидкости действует на
ограничивающий его контур к длине этого контура.
Измеряется в Н/м
Fп.н.= σ L;
14
15.
Жидкость в свободном состоянии принимает форму шара15
16.
Как может сокращаться поверхность?1. Кольцо затянуто
мыльной плёнкой,
нить свободна.
2. Нить натянута,
приняв форму дуги
окружности.
16
17.
Сложные мыльные пузыриИз всего вышесказанного можно сделать вывод о
том, что жидкости стремятся образовать фигуры
с минимальной площадью поверхности при
максимальном объеме
18.
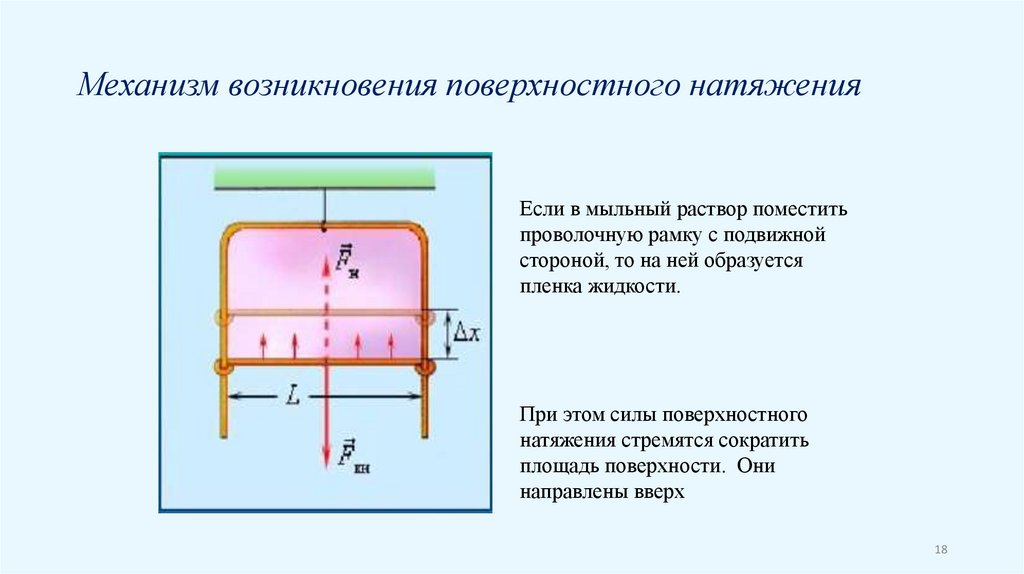
Механизм возникновения поверхностного натяженияЕсли в мыльный раствор поместить
проволочную рамку с подвижной
стороной, то на ней образуется
пленка жидкости.
При этом силы поверхностного
натяжения стремятся сократить
площадь поверхности. Они
направлены вверх
18
19.
От чего зависит коэффициентповерхностного натяжения?
А. От рода и характеристик жидкости
Б. Наличия примесей
В. От температуры (при высокой температуре
коэффициент поверхностного натяжения
стремится к нулю.)
19
20.
Молекулы жидкости притягиваются друг у кругу слабее, чем к молекуламтвердого тела. В результате жидкость стремится прижаться к поверхности,
расплывается по ней. Так ведет себя ртуть на цинковой пластине, вода на
чистом стекле или дереве. В этом случае говорят, что жидкость смачивает
поверхность.
20/40
21.
Молекулы жидкости притягиваются друг у кругу сильнее, чем к молекуламтвердого тела. В результате силы притяжения между молекулами жидкости
собирают её в капельку. Так ведет себя ртуть на стекле, вода на парафине или
"жирной" поверхности. В этом случае говорят, что жидкость НЕ смачивает
поверхность.
21
22.
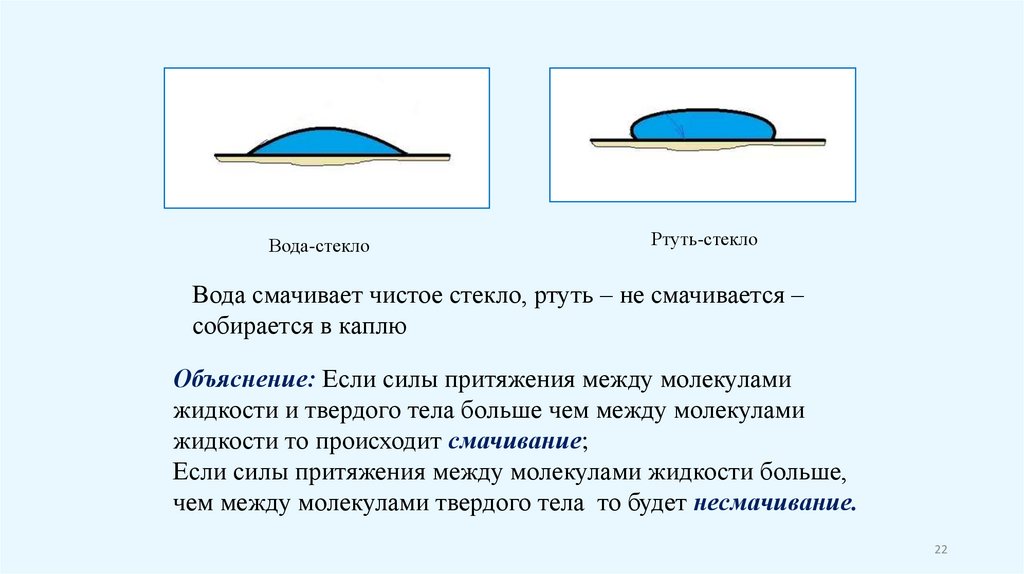
Вода-стеклоРтуть-стекло
Вода смачивает чистое стекло, ртуть – не смачивается –
собирается в каплю
Объяснение: Если силы притяжения между молекулами
жидкости и твердого тела больше чем между молекулами
жидкости то происходит смачивание;
Если силы притяжения между молекулами жидкости больше,
чем между молекулами твердого тела то будет несмачивание.
22
23.
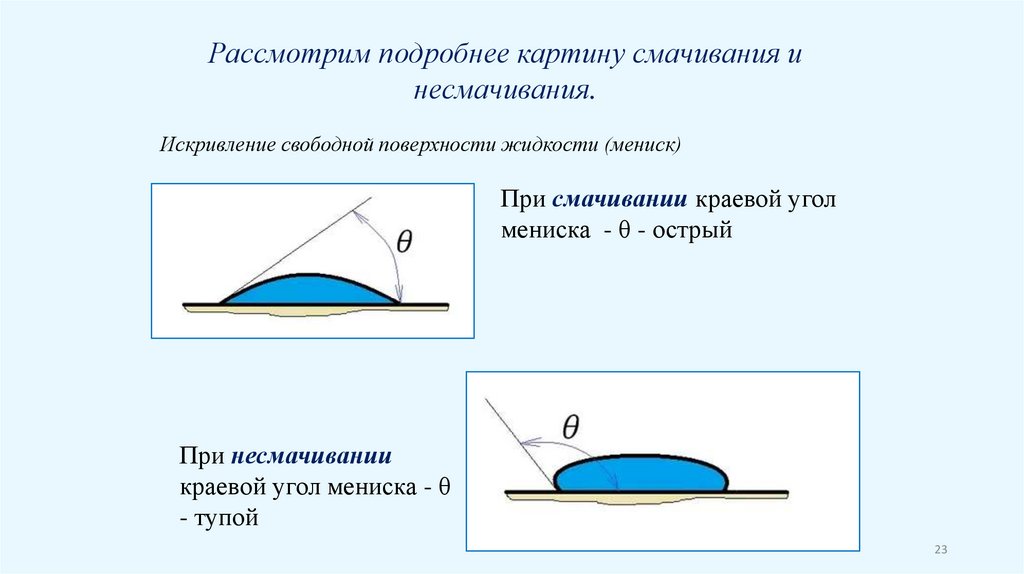
Рассмотрим подробнее картину смачивания инесмачивания.
Искривление свободной поверхности жидкости (мениск)
При смачивании краевой угол
мениска - θ - острый
При несмачивании
краевой угол мениска - θ
- тупой
23
24.
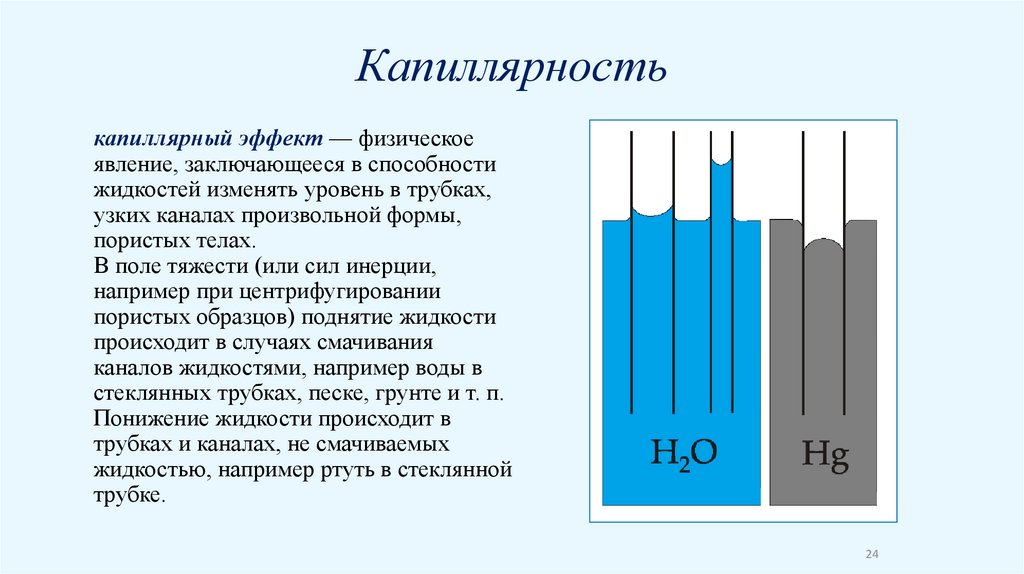
Капиллярностькапиллярный эффект — физическое
явление, заключающееся в способности
жидкостей изменять уровень в трубках,
узких каналах произвольной формы,
пористых телах.
В поле тяжести (или сил инерции,
например при центрифугировании
пористых образцов) поднятие жидкости
происходит в случаях смачивания
каналов жидкостями, например воды в
стеклянных трубках, песке, грунте и т. п.
Понижение жидкости происходит в
трубках и каналах, не смачиваемых
жидкостью, например ртуть в стеклянной
трубке.
24
25.
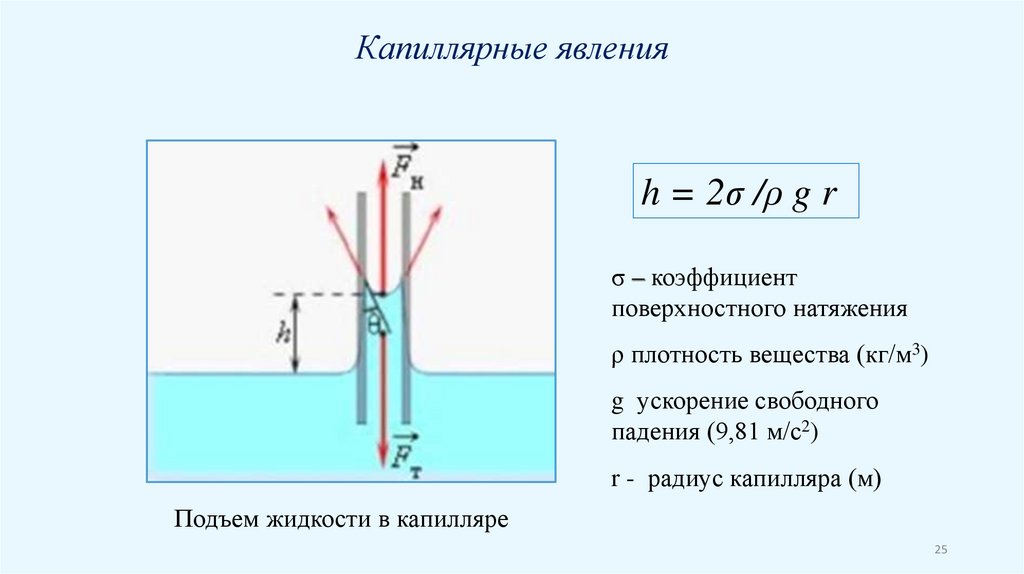
Капиллярные явленияh = 2σ /ρ g r
σ – коэффициент
поверхностного натяжения
ρ плотность вещества (кг/м3)
g ускорение свободного
падения (9,81 м/с2)
r - радиус капилляра (м)
Подъем жидкости в капилляре
25
26.
Проявление поверхностного натяженияКапилляры в почве
Кровеносные капилляры
27.
Контроль качества сварных швов пенетрантамиСтрелками показаны микродефекты сварных швов
Пенетранты - вещества, обладающими малым поверхностным натяжением и высокой световой и цветовой
контрастностью, позволяющей легко их увидеть
27
28.
Применение в медицинеРаствор, под действием силы тяжести, поступает из флакона в
полиэтиленовую трубку, проходит воздушный клапан
(каплеобразователь) с фильтром и опять же через трубку попадает
через иглу в вену. Если бы не было воздушного клапана, в флаконе
создалось бы отрицательное давление и жидкость из него
перестала бы выходить. После каплеобразователя как правило
находится регулирующее устройство, с помощью которого
регулируется скорость поступления раствора
Устройство медицинской капельницы
Капиллярный электрофорез, известный также как капиллярный
зональный электрофорез, используется для разделения ионов по
заряду. В случае обычного электрофореза заряженные молекулы
перемещаются в проводящей жидкости под действием электрического
поля. В 1960-х годах была предложена методика капиллярного
электрофореза для разделения молекул по заряду и размеру в
тонком капилляре, заполненном электролитом
Капиллярный электрофорез
29.
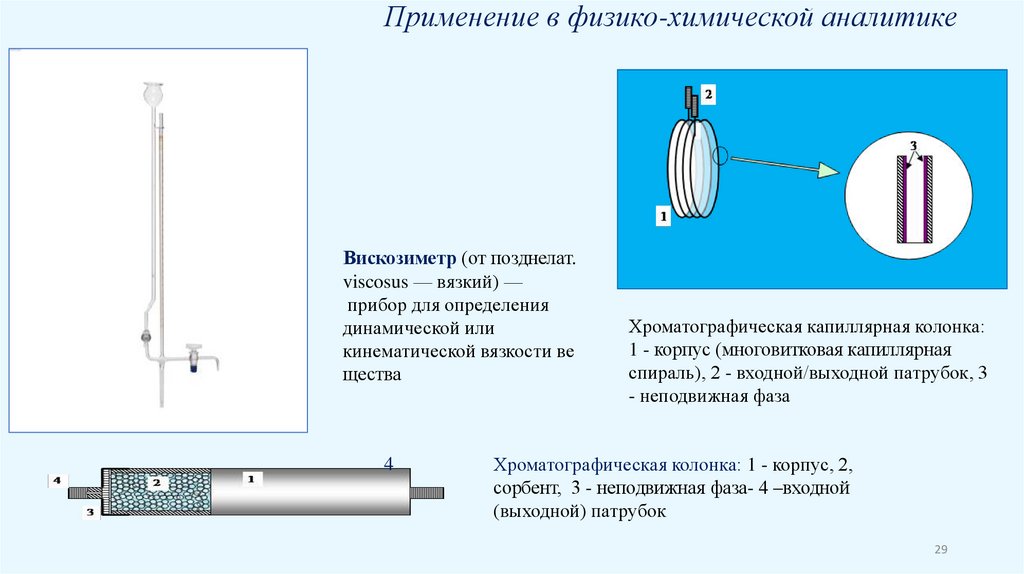
Применение в физико-химической аналитикеВискозиметр (от позднелат.
viscosus — вязкий) —
прибор для определения
динамической или
кинематической вязкости ве
щества
4
Хроматографическая капиллярная колонка:
1 - корпус (многовитковая капиллярная
спираль), 2 - входной/выходной патрубок, 3
- неподвижная фаза
Хроматографическая колонка: 1 - корпус, 2,
сорбент, 3 - неподвижная фаза- 4 –входной
(выходной) патрубок
29
30.
Примеры решения задач1. В капиллярной трубке радиусом 0,5 мм жидкость поднялась на высоту 11 мм. Оценить плотность
данной жидкости, если ее коэффициент поверхностного натяжения равен 22 мН/м.
Решение


























 physics
physics








