Similar presentations:
Физико – химические методы лабораторных исследований (лекции 5,6)
1. раздел 2
Физико – химические методылабораторных исследований
2. Лекция № 4
Основные технологии физико-химическихисследований.
Оптические методы исследования.
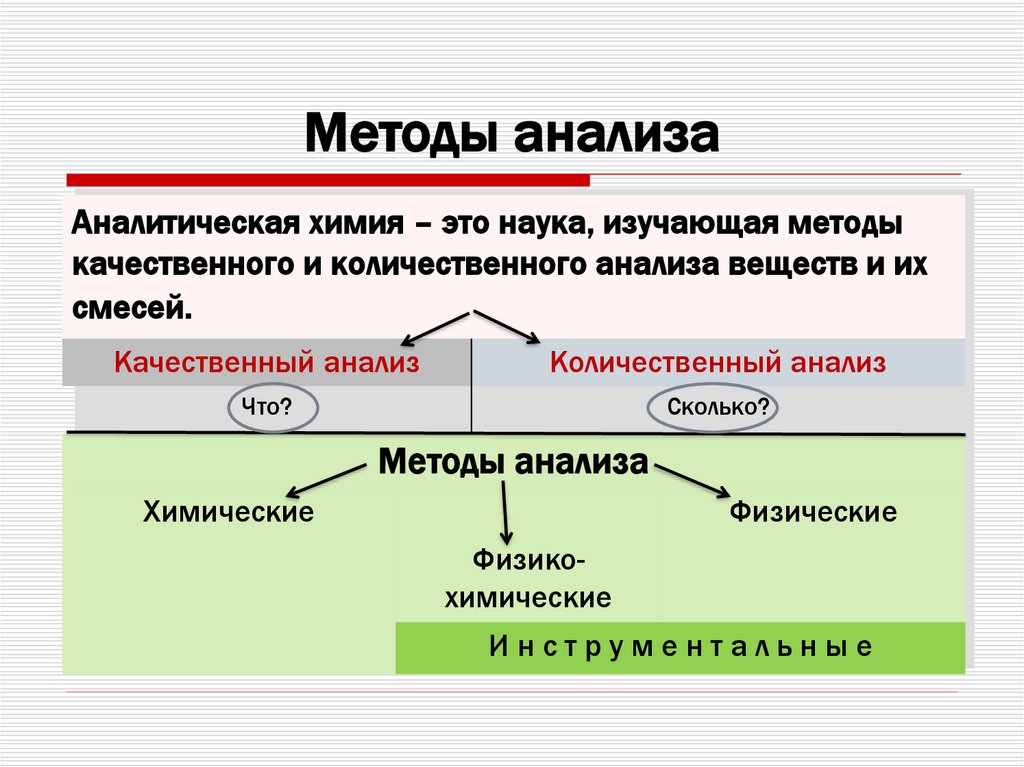
3. Методы анализа
Аналитическая химия – это наука, изучающая методыкачественного и количественного анализа веществ и их
смесей.
Качественный анализ
Количественный анализ
Что?
Сколько?
Методы анализа
Химические
Физические
Физикохимические
Инструментальные
4. Физико-химические методы анализа.
Физико-химические методы анализа основаны нанаблюдении за изменением физических свойств
анализируемой системы, происходящих в результате
определенных химических реакций.
Достоинства физико-химических методов анализа
• Селективность
• Экспрессность
• Низкий предел обнаружения
• Легкость автоматизации
5. Классификация физико-химических методов анализа
Физико-химические методы анализаклассифицируют в зависимости от используемых
физических свойств.
Методы анализа
Физические свойства
спектральные (оптические)
оптические свойства
электрохимические
электрохимические свойства
хроматографические
явление избирательной адсорбции
радиометрические
радиоактивное излучение
масс-спектрометрические
определение масс отдельных атомов,
молекул, радикалов
6. Оптические методы исследования
Методы исследования веществ, основанные на их способностипорождать оптическое излучение, или взаимодействовать с ним,
называются оптическими.
Оптические методы количественного анализа веществ
основаны на регистрации изменений, происходящих с лучом
света при прохождении его через исследуемый раствор
Свет – одна из форм электромагнитного излучения, которая
распространяется в виде волн.
Светом называют область лучистой энергии, которая видна
человеческим глазом, а также ближайшие области
ультрафиолетового и инфракрасного спектра.
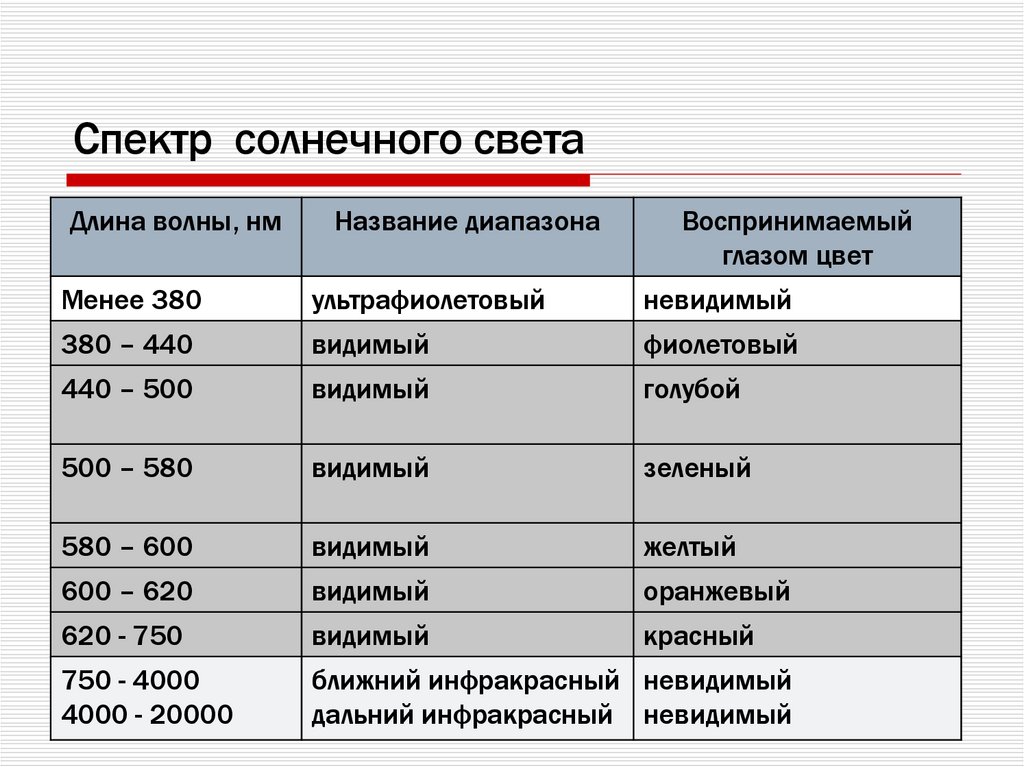
7. Спектр солнечного света
Длина волны, нмНазвание диапазона
Воспринимаемый
глазом цвет
Менее 380
ультрафиолетовый
невидимый
380 – 440
видимый
фиолетовый
440 – 500
видимый
голубой
500 – 580
видимый
зеленый
580 – 600
видимый
желтый
600 – 620
видимый
оранжевый
620 - 750
видимый
красный
750 - 4000
4000 - 20000
ближний инфракрасный невидимый
дальний инфракрасный невидимый
8. Классификация оптических методов исследования
Оптические методырефрактометрия
Рефрактометрия –
метод определения
концентрации
вещества путем
измерения показателя
преломления.
поляриметрия
фотометрия
Поляриметрия – метод
анализа, основанный
на измерении
вращения плоскости
поляризации
поляризованного
света оптически
активными
веществами.
Фотометрия - метод
анализа, основанный
на измерении
поглощения
анализируемым
веществом света с
определенной длиной
волны.
9. Классификация методов фотометрии
Фотометрические методы исследованияадсорбционный
нефелометрический флуориметрический рефлектометрия
поглощение
раствором
световой
энергии
рассеяние
световой энергии
турбидиметрический
сочетание поглощения и
рассеяния световой
энергии дисперсной
средой
излучение
раствором
световой энергии,
вызванной
энергией
возбуждения
изменение
интенсивности
энергии,
отраженной от
твердофазной
среды
хемилюминесцентный
свет
излучение раствором
световой энергии в
результате хим. реакции
10. Адсорбционный метод анализа (фотометрия)
Фотометрия (молекулярная адсорбционная спектроскопия)основана на измерении поглощения анализируемым веществом
света с определенной длиной волны.
монохроматического
(спектрофотометрия)
не строго монохроматического
(фотоколориметрия)
В основе фотометрии лежит реакция образования окрашенного
соединения.
Концентрацию веществ определяют по интенсивности окраски
окрашенных соединений.
Интенсивность окраски характеризуется физической величиной
«оптическая плотность».
11. Оптическая плотность
I0ℓ
- -- -
I
кювета
D = lg I0 / I
0 < D < ∞
Оптическая плотность раствора– это логарифм отношения
интенсивности света, падающего на раствор, к
интенсивности света, прошедшего через раствор.
12. Прозрачность раствора
Величина, обратная оптической плотности D, называется прозрачность,или светопропускание τ.
Прозрачность τ - это величина, равная отношению интенсивности света,
прошедшего через раствор I, к интенсивности света, падающего на
раствор I0.
τ = I / I0 ∙ 100%
0% < τ < 100%
D
0
…
∞
τ
100%
…
0%
13. Термины и синонимы используемых величин
Термины и синонимыПропускание
Прозрачность
Оптическая плотность
Поглощение
Экстинкция
Символы
τ (Т)
τ (Т)
D
A
E
14. Приборы, используемые в фотометрии
фотоколориметр КФК-2фотоколориметр КФК-3-01
15. Спектрофотометр UNICO 2100
16. Закон Ламберта - Бера
D=ε ∙ C ∙ ƖОптическая плотность раствора D прямо
пропорциональна концентрации раствора С и
толщине поглощающего слоя Ɩ.
ε – молярный коэффициент поглощения
C – концентрация
Ɩ – толщина поглощающего слоя раствора
17. Закон Ламберта - Бера
ε - молярный коэффициент поглощения.ε - это оптическая плотность одномолярного раствора,
измеренная в кювете толщиной 1 см.
ε характеризует чувствительность фотометрической реакции.
Чем больше ε, тем меньшее количество вещества можно
открыть.
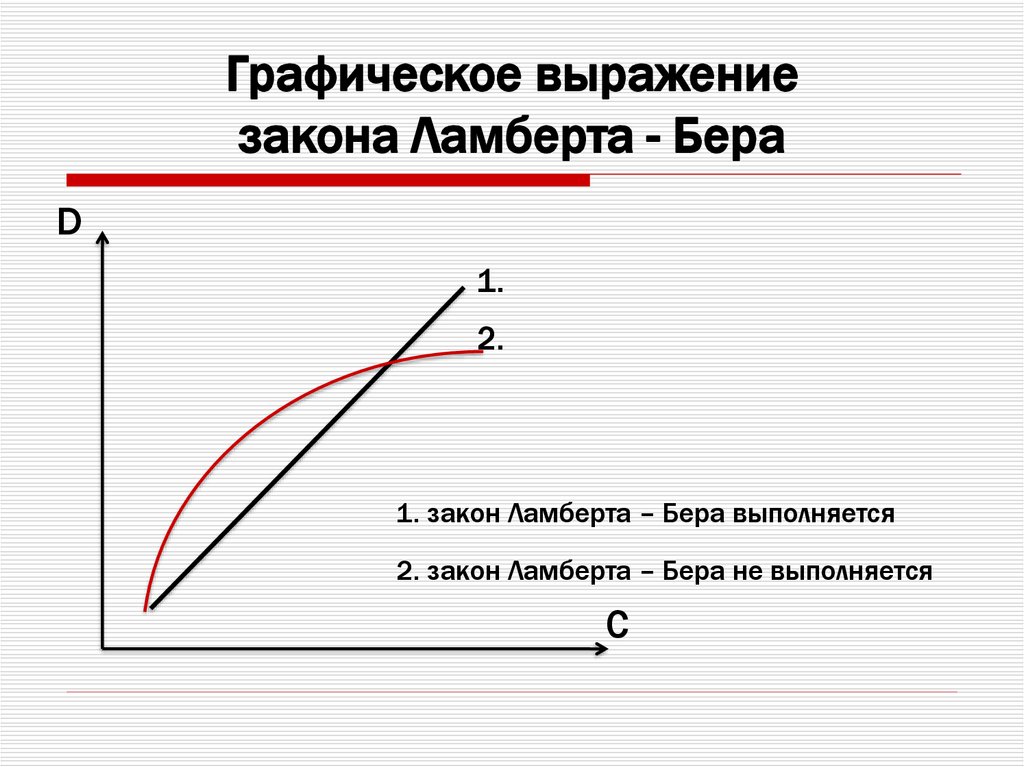
18. Графическое выражение закона Ламберта - Бера
D1.
2.
1. закон Ламберта – Бера выполняется
2. закон Ламберта – Бера не выполняется
C
19. Определение концентрации раствора по оптической плотности
I.Метод градуировочного (калибровочного) графика.
Берут 6-8 мерных колб одинакового объёма.
(для небольших объёмов можно использовать
колориметрические пробирки)
Мерные колбы
Колориметрические пробирки
20. .
•Наливают в них стандартный раствор определяемоговещества (объёмы точно измеряют пипеткой, бюреткой
или дозатором). Объёмы стандартного раствора берут в
возрастающем количестве.
! Концентрации стандартного раствора в колбах
должны отличаться не менее, чем на 30%.
.
пипетки
дозаторы
21. продолжение
В каждую колбу наливают один и тот же объём реактива
– вещества, переводящего определяемое вещество, или
ион, в окрашенное соединение.
Если нужно, то в каждую колбу добавляют вещества для
создания условий протекания реакции, один и тот же
объём.
Доводят объём в мерных колбах до метки ( чаще –
дистиллированной водой.)
Тщательно перемешивают.
Рассчитывают концентрацию стандартного раствора
определяемого вещества каждой колбе по формуле:
С в колбе = Сст. р-ра ∙ Vст. р-ра
Vмер. колбы
22. Растворы для построения градуировочного графика
23. продолжение
Измеряют оптическую плотностькаждого раствора на
фотоколориметре, или
спектрофотометре, при одних и тех
же условиях (λ – длина волны
падающего света и Ɩ – длина
кюветы)
• По полученным данным строят градуировочный график,
откладывая по оси ординат (Y) оптическую плотность D, а
по оси абсцисс (Х) – концентрацию С.
• По полученным точкам проводят прямую линию.
В соответствии с законом Ламберта-Бера этот график
должен быть линеен и прямая должна выходить из начала
координат.
24. Правила построения градуировочного графика
График должен быть расположен под углом примерно 450к осям.
Для этого масштаб по осям выбирают так, чтобы оси были
примерно одинаковой длины (максимальные значения
оптической плотности D и концентрации С должны быть
равноудалены от начала координат).
Все точки графика должны лежать на одной прямой.
Если есть отклонения точек от прямой, то график проводят
так, чтобы максимальное число точек лежало на линии и
сумма отклонений точек по одну сторону графика была равна
сумме отклонений по другую сторону графика.
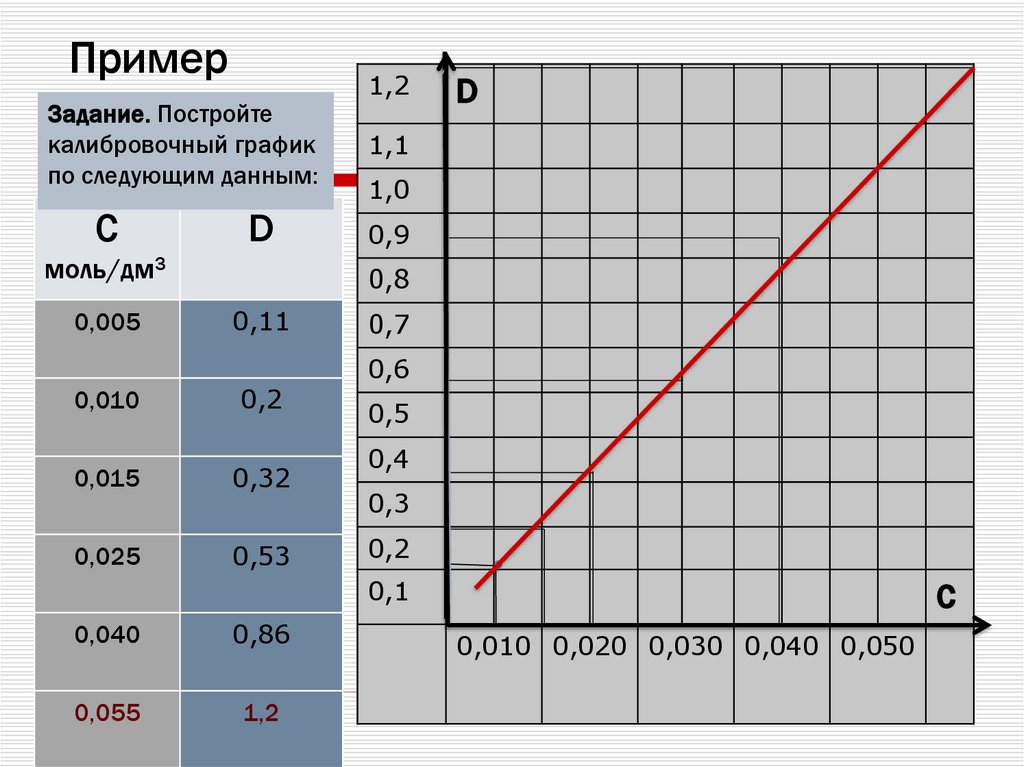
25. Пример
Задание. Постройтекалибровочный график
по следующим данным:
С
D
моль/дм3
0,005
1,2
D
1,1
1,0
0,9
0,8
0,11
0,010
0,2
0,015
0,32
0,025
0,53
0,7
0,6
0,5
0,4
0,3
0,2
0,1
0,040
0,86
0,055
1,2
C
0,010 0,020 0,030 0,040 0,050
26. Определение концентрации вещества по градуировочному графику
Исследуемый раствор готовят к фотометрированию точнотакже, как при построении градуировки:
• Измеряют его точный объём в мерную колбу и
прибавляют все реактивы, в тех же количествах и в той
же последовательности, что и при построении
градуировочного графика.
• Измеряют оптическую плотность приготовленного
раствора на том же приборе и при тех же условиях (λ и Ɩ).
• На градуировочном графике на оси D находят точку,
соответствующую измеренной оптической плотности.
• Проводят прямую параллельно оси С до пересечения с
графиком.
27. продолжение
Из точки пересечения опускают перпендикуляр на ось С.
Это концентрация раствора по графику Сграф.
D
Dиссл.
C
Cграф.
Делают перерасчет концентрации с учетом разведения
исследуемого раствора по формуле:
С иссл. = Сграф. ∙ Vмер. колбы
Vиссл.
28. II. Метод сравнения со стандартным образцом
Готовят в одинаковых условиях два раствора:стандартный, концентрация которого известна, и
исследуемый, концентрация которого неизвестна
Измеряют их оптические плотности при одинаковых
условиях.
Концентрацию исследуемого раствора вычисляют по
формуле:
Сиссл. = Сст. ∙ Dст.
Dиссл.
29. Нефелометрия и турбидиметрия
Нефелометрия и турбидиметрия– методы определенияконцентрации веществ, находящихся в состоянии тонких
взвесей, эмульсий, или коллоидных растворов, путем
измерения интенсивности их светорассеяния.
мутный раствор
I0
Iпр.
свет
Iрас.
Определяют
количество рассеянного света (нефелометрия)
ослабление прошедшего света (турбидиметрия)
nephele (греч.) облако, помутнение
30. Нефелометрия и турбидиметрия
Нефелометрия – это метод, основанный на измеренииинтенсивности потока света, рассеянного частицами,
находящимися в растворе во взвешенном состоянии
(обычно под углом 900)
Турбидиметрия – это метод, основанный на измерении
интенсивности потока света, прошедшего через раствор,
содержащий взвешенные частицы, рассеивающие свет.
Используют для количественного определения белков не
только в сыворотке или плазме крови, но и в моче, в
спинномозговой, суставной жидкостях .
31. Люминесцентный анализ
Люминесцентный анализ –это совокупностьоптических методов анализа, основанных на явлении
люминесценции.
Люминесценция – свечение вещества, возникающее
при его возбуждении различными источниками
энергии.
32. Виды люминесценции
-По длительности:
флуоресценция (быстро затухающая люминесценция)
фосфоресценция (длительная люминесценция)
По виду возбуждения:
фотолюминесценция (возбуждение светом)
радиолюминесценция (возбуждение радиацией)
триболюминесценция (возбуждение при механическом
воздействии)
электролюминесценция (возбуждение электрическим полем)
хемилюминесценция (возбуждение при хим. реакциях)
биолюминесценция (свечение биологических объектов)
лиолюминесценция (возбуждение при растворении кристаллов)
33. Флуориметрия (флуоресцентная спектрофотометрия)
«Флуоресценция» от названия природного минерала флюорита CaF2Флуориметрия – это метод анализа, основанный на измерении
интенсивности флуоресцентного света, излучаемого исследуемым образцом
в возбужденном состоянии, которое было достигнуто поглощением лучевой
энергии в результате воздействия ультрафиолетового, видимого и других
видов электромагнитного излучения.
Флуорофоры–вещества, способные к свечению.
Это аминокислоты триптофан, тирозин, фенилаланин, нуклеотиды (НАДН,
НАДФ-Н), флавины, порфирины, хлорофиллы, каротиноиды, некоторые
витамины, окисленные липиды, белки и другие.
Флуоресцентные метки (флуорофоры) широко используются в биохимии,
биотехнологии, клеточной биологии и биологии развития в качестве
маркеров экспрессии генов и локализации белков в различных
биологических системах. Для проведения исследования флуорофор
прикрепляется к изучаемому белку.
34. Рефлектометрия (отражательная фотометрия)
Рефлектометрия - вид количественного анализа, вкотором концентрацию вещества определяют по
количеству света, отраженного поверхностью
полоски (стрипа), на которой проводится цветная
биохимическая реакция в результате чего
определенная зона полоски окрашивается.
Принцип отражательной фотометрии нашел
применение при использовании различных
вариантов «сухой химии» (диагностические полоски,
многослойные аналитические элементы) для
исследования различных аналитов в крови,
сыворотке, плазме.
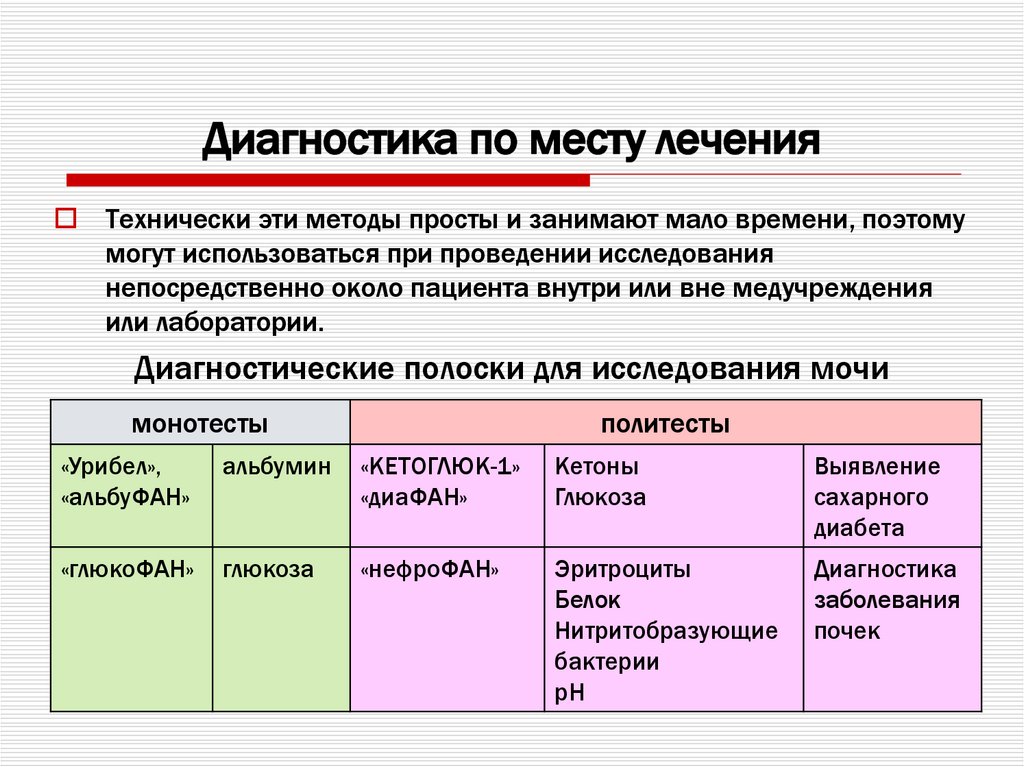
35. Диагностика по месту лечения
Технически эти методы просты и занимают мало времени, поэтомумогут использоваться при проведении исследования
непосредственно около пациента внутри или вне медучреждения
или лаборатории.
Диагностические полоски для исследования мочи
монотесты
политесты
«Урибел»,
«альбуФАН»
альбумин
«КЕТОГЛЮК-1»
«диаФАН»
Кетоны
Глюкоза
Выявление
сахарного
диабета
«глюкоФАН»
глюкоза
«нефроФАН»
Эритроциты
Белок
Нитритобразующие
бактерии
рН
Диагностика
заболевания
почек
36. Принцип действия рефлектометра
детектормикропроцессор
3
5
преобразователь
светодиод
1
результаты
тестовая зона
2
Свет от светодиода (1) попадает на тестовую зону (2) и отражается на
детектор (3), фиксирующий интенсивность отраженного света на
соответствующей длине волны. Электрический сигнал из детектора
поступает в аналого-цифровой преобразователь (4). Преобразованный
цифровой сигнал поступает в процессор (5), который рассчитывает
результаты исследований.
37.
Благодарю за внимание38. Лекция № 6
Электрохимическиеметоды исследования
39. Электрохимические методы исследования
Электрохимические методы исследования –это физикохимические методы исследования, в которых концентрациювещества в исследуемом растворе определяют путем измерения
каких-либо электрических характеристик раствора.
Классификация электрохимических методов исследования
Метод анализа
Физические свойства
Кондуктометрия
Электрическая проводимость раствора
Потенциометрия
Электродвижущая сила (ЭДС)
Вольтамперометрия
Зависимость силы тока от напряжения
Кулонометрия
Количество электричества, расходуемое в
ходе электрохимической реакции
40. Потенциометрия
Потенциометрия – электрохимический метод анализа,заключающийся в измерении электродного потенциала, и
нахождении зависимости между его величиной концентрации
потенциалопределяющего компонента в растворе.
Потенциал электрода можно измерить только по отношению к
какому-либо постоянному потенциалу другого электрода.
Электрод сравнения
(вспомогательный)
Индикаторный электрод (измерительный)
Потенциал постоянен и заранее
известен
Потенциал непостоянен, зависит от
концентрации потенциалопределяющего
компонента
ЭДС, возникающая между электродами, равна алгебраической разности
между их потенциалами
41. Электроды для потенциометрии
Потенциал электрода должен• быть воспроизводимым
• быстро устанавливаться
• быть обратимым
• обладать хим. устойчивостью
Индикаторные (измерительные) электроды.
металлические
мембранные
металлическая пластинка или
проволока, погруженная в
раствор хорошо растворимой
соли этого металла
металл, покрытый слоем
малорастворимого соединения этого
металла и погруженный в раствор
хорошо растворимого соединения
этого металла
серебро, ртуть, кадмий и др.
хлорсеребряный, каломельный и др.
Электроды сравнения (вспомогательные)
обычно применяют хлорсеребряные и каломельные электроды
42. Индикаторные (измерительные) электроды.
Стеклянный электродпредставляет собой тонкостенный
стеклянный шарик, выполненный из
литиевого стекла. Он заполнен
раствором HCl с концентрацией 0,1
моль/л. Внутрь шарика помещается
хлорсеребряный электрод, т.е.
серебряная проволока, покрытая
слоем AgCl.
Перед работой стеклянный электрод
некоторое время вымачивают в 0,1
моль/л HCl.
Используют для определения рН
растворов.
Ag (AgCl)
HCl
0,1
моль/л
шарик
Li – стекло
0,01 мм
43. Ионоселективные электроды
Ионоселективные электроды изготавливают наоснове полупроницаемых мембран, обладающих повышенной
избирательностью по отношению к определенному типу ионов.
В электрохимии мембраной (membrana - пергамент) называют слой из твердого или
жидкого электролита, разделяющий два раствора одного и того же качественного
состава. Если мембрана одинаково проницаема для всех компонентов системы, то ее
называют диафрагмой. Мембрана, которая в различной степени задерживает
переход разных по природе ионов, называется полупроницаемой.
Устройство и принцип действия стеклянных ионоселективных
электродов такое же, как и у стеклянного рН-электрода. Главное
отличие – состав стекла. Они чувствительны к ионам щелочных
металлов Li+, Na+, K+, Rb+, Cs+, а также к ионам Ag+, Tl+, NH4+.
Используют для определения концентрации ионов щелочных
металлов в крови, плазме, сыворотках и т.д.
44. Электроды сравнения (вспомогательные)
Хлорсеребряный электродпредставляет собой серебряную
проволоку или пластину, покрытую
слоем AgCl и помещенную в
насыщенный раствор КCl.
Каломельный электрод состоит из
металлической ртути, каломели и
раствора КCl.
Потенциалы хлорсеребряного,
каломельного и ряда других электродов
сравнения изучены при различных
концентрационных и температурных
условиях и их величины хорошо известны.
Хлорсеребряный
электрод
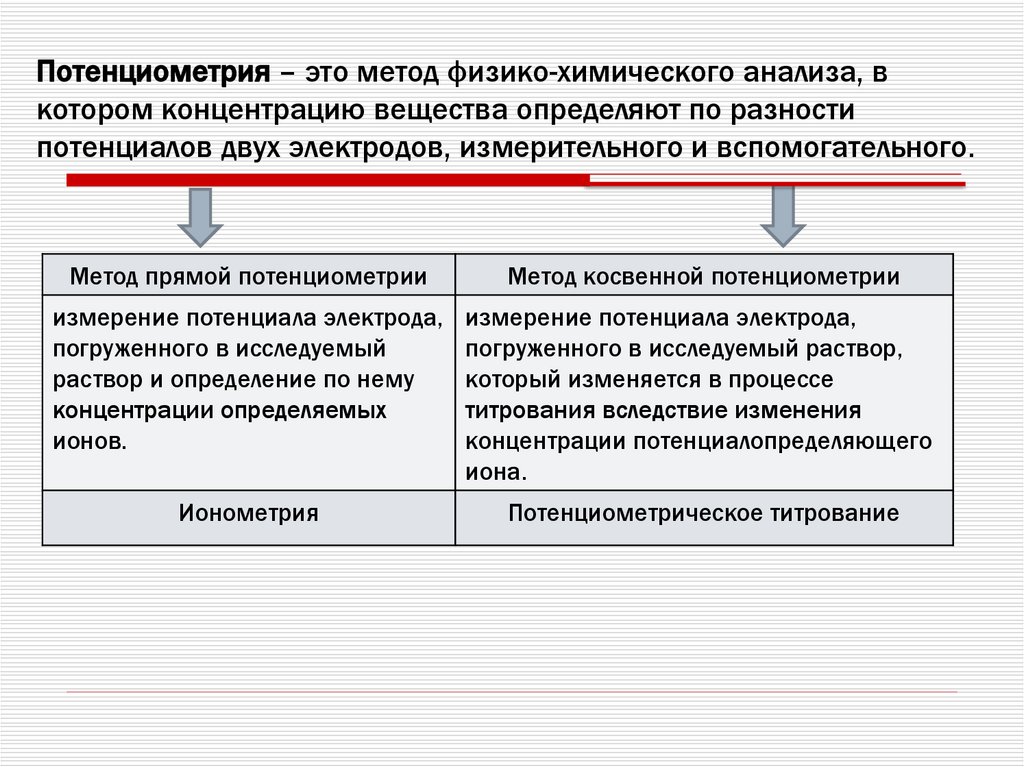
45. Потенциометрия – это метод физико-химического анализа, в котором концентрацию вещества определяют по разности потенциалов двух
электродов, измерительного и вспомогательного.Метод прямой потенциометрии
Метод косвенной потенциометрии
измерение потенциала электрода,
погруженного в исследуемый
раствор и определение по нему
концентрации определяемых
ионов.
измерение потенциала электрода,
погруженного в исследуемый раствор,
который изменяется в процессе
титрования вследствие изменения
концентрации потенциалопределяющего
иона.
Ионометрия
Потенциометрическое титрование
46. Метод прямой потенциометрии
Метод градуировочного графика.1. Берут 6-8 растворов с разной, но точно известной
концентрацией определяемого иона.
2. Измеряют ЭДС при постоянной ионной силе.
3. По полученным данным строят градуировочный график в
координатах Е – lg C
График должен быть линейным.
4. Измеряют ЭДС исследуемого раствора.
5. По градуировочному графику находят значение концентрации
раствора, соответствующее измеренному ЭДС.
47. Потенциометрическое титрование
Потенциометрическоетитрование основано на
определении точки
эквивалентности по
результатам
потенциометрических
измерений.
Вблизи точки эквивалентности
происходит резкое изменение
(скачок) потенциала
индикаторного электрода.
48. Отступление от темы Что такое титрование?
.бюретка
раствор А
раствор В
А+В → С+D
Титрование - это процесс
постепенного прибавления
раствора одного вещества
(А) к раствору другого (В) до
окончания реакции между
ними.
Конец
реакции
между
реагирующими веществами
в титриметрии называется
точкой эквивалентности.
49. Прибор для потенциометрического титрования
1. Магнитная мешалка2. Исследуемый раствор
3. Индикаторный электрод
(измерительный)
4. Электрод сравнения
(вспомогательный)
5. Бюретка
6. Потенциометр
50. Определение точки эквивалентности
Кривые потенциометрического титрованияа) - обычная кривая
б) –дифференциальная
кривая
в) – кривая Грана
51. Достоинства метода потенциометрического титрования
Высокая точность и воспроизводимость определений (особеннопри титровании разбавленных растворов)
Возможность проводить титрование в окрашенных и мутных
растворах
Легкость раздельного определение веществ при их совместном
присутствии
Метод легко поддается автоматизации
Погрешность определения при прямом потенциометрическом
измерении составляет 2 – 10 % . При проведении
потенциометрического титрования 0,5 – 1 %
52. Применение потенциометрии в клинической лабораторной диагностике
Электроды с использованием потенциометрии применяются ванализаторах – иономерах для определения рН растворов, а
также для определения электролитов – ионов натрия, калия,
кальция, лития, хлоридов, общего СО2 сыворотке, плазме,
цельной крови, моче, почечных диализатах, поте.
53. .
Технологии фракционированиякомпонентов смеси веществ.
Хроматография.
54. Хроматография
Хроматография - это метод разделения и анализасмеси веществ, основанный на различном
распределении веществ между двумя фазами:
подвижной (ПФ) и неподвижной (НФ).
55. История открытия хроматографии.
Хроматография была открытарусским физиологом и
биохимиком Михаилом
Семеновичем Цветом в 1903г.
Он впервые доложил об этом на
заседании общества
естествоиспытателей при
Варшавском Университете. Он
изучил свойства 126 сорбентов
для использования в
хроматографии и разработал
жидкостною адсорбционную
колоночную хроматографию.
56. Опыт М.С. Цвета
Впервые явление хроматографииМ.С.Цвет наблюдал при
пропускании зеленого сока
листьев растений через порошок
мела, плотно набитого в
стеклянную трубку. М.С.Цвет
писал: «При фильтровании
смешанного раствора через столб
сорбента пигменты
расслаиваются в виде отдельных,
окрашенных зон, доступных
качественному определению.
Такой расцвеченный препарат я
назвал хроматограммой, метод
анализа – хроматографическим»
57. Классификация методов хроматографии
В зависимости от типа ПФ и НФгазовая
жидкостная
В зависимости от механизма распределения
адсорбционная
распределительная
молекулярная
ионообменная
проникающая
По технике хроматографирования
колоночная
плоскостная:
бумажная,
тонкослойная
капиллярная
Хроматография в полях
(электрических, магнитных)
58. Термины и понятия хроматографии
Подвижную фазу, проходящую через неподвижную, называютэлюентом.
Растворенные вещества, покидающие неподвижную фазу вместе с
элюентом, называют элюатом.
Процесс перемещения разделяемых компонентов образца вместе
с элюентом, называют элюированием
59. Виды хроматографии
В колоночной хроматографии НФ помещают вхроматографическую колонку (трубку), размеры и
конструктивное оформление которых меняется в широких
пределах, их диаметр составляет от 2-Змм до 150мм, а высота
от Зсм до 150см и более. Колонки бывают стеклянные,
металлические (медные или из нержавеющей стали).
Тонкослойную хроматографию проводят на стеклянных,
пластмассовых или металлических пластинках (например, из
толстой алюминиевой фольги) с нанесением на них тонким
слоем сорбента, который может быть закрепленным или
незакрепленным.
В бумажной хроматографии в качестве НФ используют
фильтровальную или хроматографическую бумагу
60. Бумажная хроматография.
Метод бумажной хроматографии был открыт в 1943г. как методразделения и идентификации аминокислот.
В качестве НФ в этом виде хроматографии используют
хроматографическую бумагу, которая представляет собой
целлюлозную фильтровальную бумагу особой чистоты, однородную
по плотности текстуры и ориентации волокон.
В простейшем случае используют плотные сорта фильтровальной
бумаги.
По механизму разделения бумажная хроматография является
распределительной.
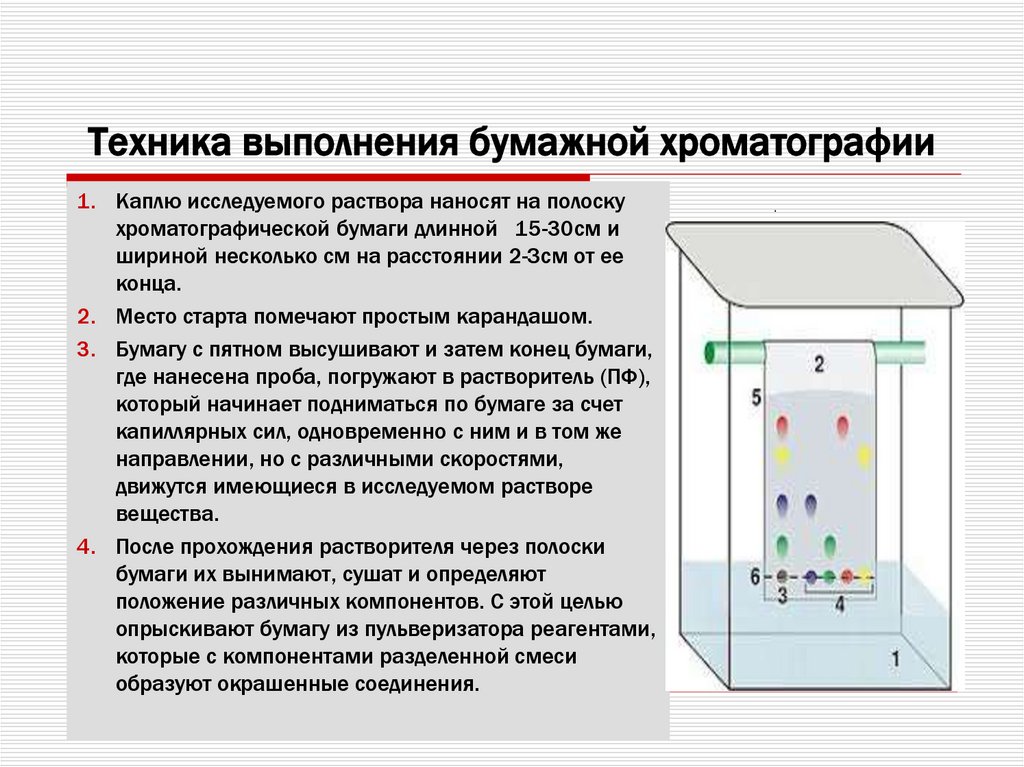
61. Техника выполнения бумажной хроматографии
1. Каплю исследуемого раствора наносят на полоскухроматографической бумаги длинной 15-30см и
шириной несколько см на расстоянии 2-Зсм от ее
конца.
2. Место старта помечают простым карандашом.
3. Бумагу с пятном высушивают и затем конец бумаги,
где нанесена проба, погружают в растворитель (ПФ),
который начинает подниматься по бумаге за счет
капиллярных сил, одновременно с ним и в том же
направлении, но с различными скоростями,
движутся имеющиеся в исследуемом растворе
вещества.
4. После прохождения растворителя через полоски
бумаги их вынимают, сушат и определяют
положение различных компонентов. С этой целью
опрыскивают бумагу из пульверизатора реагентами,
которые с компонентами разделенной смеси
образуют окрашенные соединения.
.
62. Продолжение Техника выполнения бумажной хроматографии
Часто проводят хроматографирование в присутствии «свидетелей».Для этого на расстоянии 2-Зсм от капли исследуемого раствора, на
той же линии старта, наносят каплю или несколько капель растворов
чистых веществ, предположительно входящих в состав
анализируемой смеси и сравнивают расположение пятен.
Это восходящая
хроматография
Это восходящая
хроматография.
Если движение жидкости происходит за счет гравитационных сил сверху вниз, то такой вид хроматографии называют нисходящей.
Если движение жидкости начинается из пятна - места нанесения
капли исследуемого раствора, то такой вид хроматографии
называют радиальной.
63. Двумерная бумажная хроматография
Применяют также двумерную бумажную хроматографию. В этомслучае исследуемую пробу наносят на угол квадратного листа
бумаги. Затем проводят хроматографирование в одном
направлении, как указано выше. Растворитель испаряют, лист
поворачивают на 90° и проводят хроматографирование
растворителем с другими свойствами. Так разделяют сложные
смеси, которые невозможно разделить с помощью одного
растворителя.
64. Тонкослойная хроматография (ТСХ).
Обычно хроматографирование на бумаге занимает 12-18 часов.Тонкослойная
хроматография.
Более
удобным и быстрым
оказалось хроматографирование в
«тонком слое».
Благодаря экспрессности (разделение длится несколько минут)
метод ТСХ в настоящее время занимает одно из ведущих мест в
разделении органических и биоорганических соединений.
В этом методе на стеклянную, пластмассовую или металлическую
пластину тонким слоем равномерно наносится порошкообразный
сорбент (силикагель, оксид алюминия, порошок целлюлозы). Слой
сорбента может быть закрепленным и незакрепленным.
Проведение разделения смесей в ТСХ идентично получению
хроматограмм на бумаге.
65. Ионообменная хроматография.
Ионообменная хроматография основана на обратимомстехиометрическом обмене ионов, находящихся в растворе на
ионы, входящие в состав ионообменника (ионита).
Ионит это полимерный материал, имеющий в своем составе
ионогенные группы - группы способные к обмену ионов.
Иониты делят на 3 группы: катиониты (способны к обмену
катионов), аниониты (способны к обмену анионов) и амфолиты
(способны к обмену катионов и анионов).
66. Техника выполнения ионообменной хроматографии
Перед работой катионит переводят в Н+-форму, выдерживая егов растворе 2М НСl 2 моль/л, при этом по ионогенным группам
присоединяются ионы Н+. Анионит переводят в ОН--форму,
выдерживая в растворе NaОН 1 моль/л (по ионогенным
группам присоединяются ОН-).
После заполнения колонки подготовленным ионитом, через него
пропускают исследуемый раствор.
Например, если через Н+- катионит пропустить раствор NаСl, то в
результате ионного обмена в элюате (раствор выходящий из
колонки) будет содержаться эквивалентное количество НСl, т.к.
протекает реакция Kt(H+) + NaCl → Kt (Na+) + HCl.
Концентрацию HCl можно определить, например, титрованием.
67. Желаю Успехов
ЖЕЛАЮ УСПЕХОВ68. Перечень практических занятий
№Темы занятия
Учить лекции
1.
Основы химии (зачет)
1,2,3,4
2.
Оптические методы исследования.
Фотометрия.
5
3.
Оптические методы исследования.
4.
Электрохимические методы
исследования
6
до «Хроматографии»
5.
Хроматография.
Итоговый зачет.
6 «Хроматография»
69. Подготовка к практическим занятиям
На занятии иметь:- халат
- шапочку
- перчатки, маску
- сменную обувь
o
o
o
o
тетрадь с лекциями
тетрадь для проверочных работ (12 листов)
дневник практических работ (12 листов)
ручку, карандаш, линейку
На занятия приходить с выученными лекциями
70. Примерные задания для подготовки к зачету по основам химии (практическое занятие № 1)
Теоретические вопросы1. Оксиды и гидроксиды. Их состав, классификация,
номенклатура. Примеры.
2. Соли. Их состав, классификация, номенклатура. Примеры.
3. Диссоциация кислот, оснований, солей.
4. Реакции ионного обмена. Условия их необратимости.
Примеры.
5. Состав комплексных соединений, их номенклатура.
Примеры.
6. Понятие об органических соединениях, их классификация.
Примеры.
7. Понятие о гомологах и изомерах. Примеры.
8. Углеводороды предельные, непредельные, ароматические.
Примеры.
71. .
9.Спирты и фенолы. Качественные реакции на спирты одноатомные,
многоатомные и на фенолы
10. Понятие об альдегидах и кетонах. Качественные реакции на
альдегиды.
.
11. Понятие о карбоновых кислотах. Их классификация, примеры.
Качественные реакции на кислоты.
12. Общая структура триацилглицеридов. Жирные кислоты.
Физические свойства
жиров.
13. Химические свойства жиров. Реакции гидролиза и
гидрогенизации.
14. Понятие об углеводах, их классификация. Примеры.
15. Глюкоза-бифункциональное соединение. Качественные реакции
на глюкозу.
16. Дисахариды и полисахариды, их состав и свойства.
17. Понятие о белках, их классификация.
18. Структура белков.
19. Денатурация белков.
20. Цветные реакции на белки.
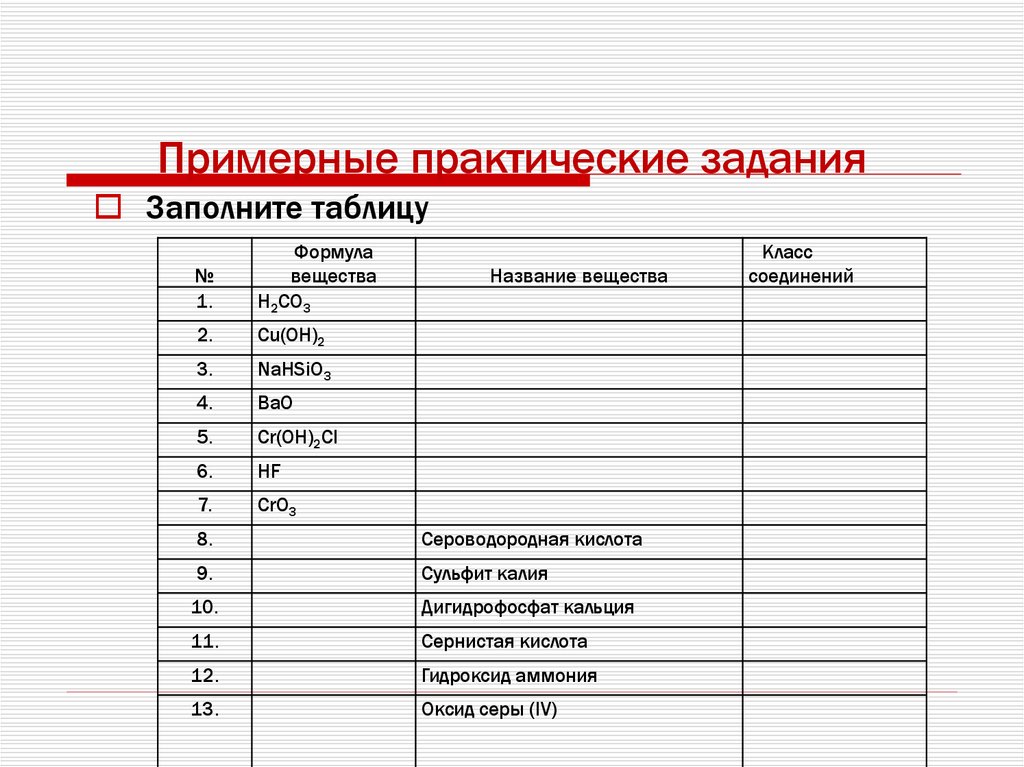
72. Примерные практические задания
Заполните таблицу№
1.
Формула
вещества
H2СO3
2.
Сu(ОН)2
3.
NaHSiO3
4.
ВаO
5.
Cr(OH)2Cl
6.
HF
7.
CrO3
Название вещества
8.
Сероводородная кислота
9.
Сульфит калия
10.
Дигидрофосфат кальция
11.
Сернистая кислота
12.
Гидроксид аммония
13.
Оксид серы (IV)
Класс
соединений
73. .
• Напишите в молекулярном и ионом виде уравнения необратимых реакций:
(NH
. 4)2SO4 + NaOH =
FeSO4 + K2S = .
CaCl2 + H3PO4 =
BaCl2 + НNO3 =
.
Назовите комплексные соединения:
Na3[FeF6], [Ni (NH3)6]Cl2, Na[Sb(ОН)6], [Cr(H2O)6]Cl3,
[Co(H2O)(NH3)4Cl]Cl2,
[Pt(NH3)2 Cl2]
(NH4)2[Fe(H2O)6](SO4)2,
• Напишите в структурном виде формулы веществ:
Пропан, уксусная кислота, 2-метилбутаналь, глюкоза, 1-стеароил-2-олеоил-3пальмитоилглицерин, этиловый спирт, глицерин, фенол, бензол, бутадиен-1,3.
К какому классу органических соединений они относятся?
• Напишите в структурном виде уравнения реакций между веществами:
а) пропандиол–1,2 + Cu(OH)2
б) глюкоза + Cu(OH)2 при нагревании
в) 1,2,3-трипальмитоилглицерин + Н2О
г) 1,3 – дигидроксибензол + FeCl3

































































 chemistry
chemistry








