Similar presentations:
Электрический ток в жидкостях
1.
2.
ЖИДКОСТИПРОВОДЯЩИЕ
Содержащие
свободные заряженные
частицы - электролиты
К ним относятся
растворы, расплавы
солей, кислот и
оснований
НЕПРОВОДЯЩИЕ
Не содержащие
свободные заряженные
частицы
К ним относятся
дистиллированная вода,
спирт, минеральное масло…
Электролитической диссоциацией
называется распад нейтральных молекул вещества в
растворителе на положительные и отрицательные
ионы
3.
Электролитическая диссоциация поваренной солиNa Cl
NaCl Na+ + ClДиссоциация других
веществ:
CuSO4 Cu 2+ + SO42HCl H + + ClH2SO4 H+ + H+ + SO42-
Na+
Cl-
CaCl2 Ca 2+ + Cl- +
Cl-
При диссоциации ионы металлов и водорода всегда заряжены
положительно, а ионы кислотных радикалов и группы ОН отрицательно
4.
Степень диссоциации зависит от:- температуры;
- концентрации раствора;
-электрических свойств растворителя.
С увеличением температуры степень
диссоциации возрастает и,
следовательно, увеличивается
концентрация положительно и
отрицательно заряженных ионов.
5.
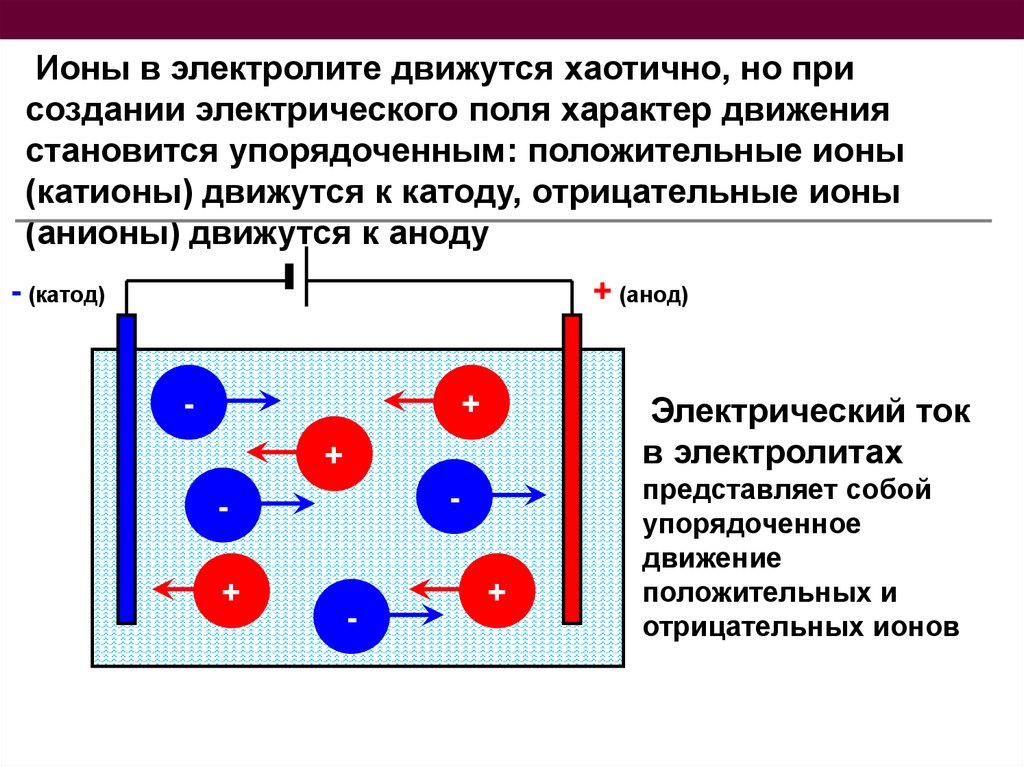
Ионы в электролите движутся хаотично, но присоздании электрического поля характер движения
становится упорядоченным: положительные ионы
(катионы) движутся к катоду, отрицательные ионы
(анионы) движутся к аноду
- (катод)
+ (анод)
-
+
Электрический ток
в электролитах
+
-
+
-
+
представляет собой
упорядоченное
движение
положительных и
отрицательных ионов
6.
ЭлектролизРассмотрим, что происходит, когда ионы достигают электродов
(на примере медного купороса)
CuSO4 Cu 2+ + SO42-
На катоде:
Положительные ионы меди,
подходя к катоду, получают два
недостающих электрона,
восстанавливаясь до
металлической меди
- (катод)
Cu 2+ + 2 е Cu 0
+
Cu 2+
+
Cu 2+
В процессе протекания тока через
электролит на катоде происходит
оседание слоя чистой меди –
электролиз раствора медного
купороса
7.
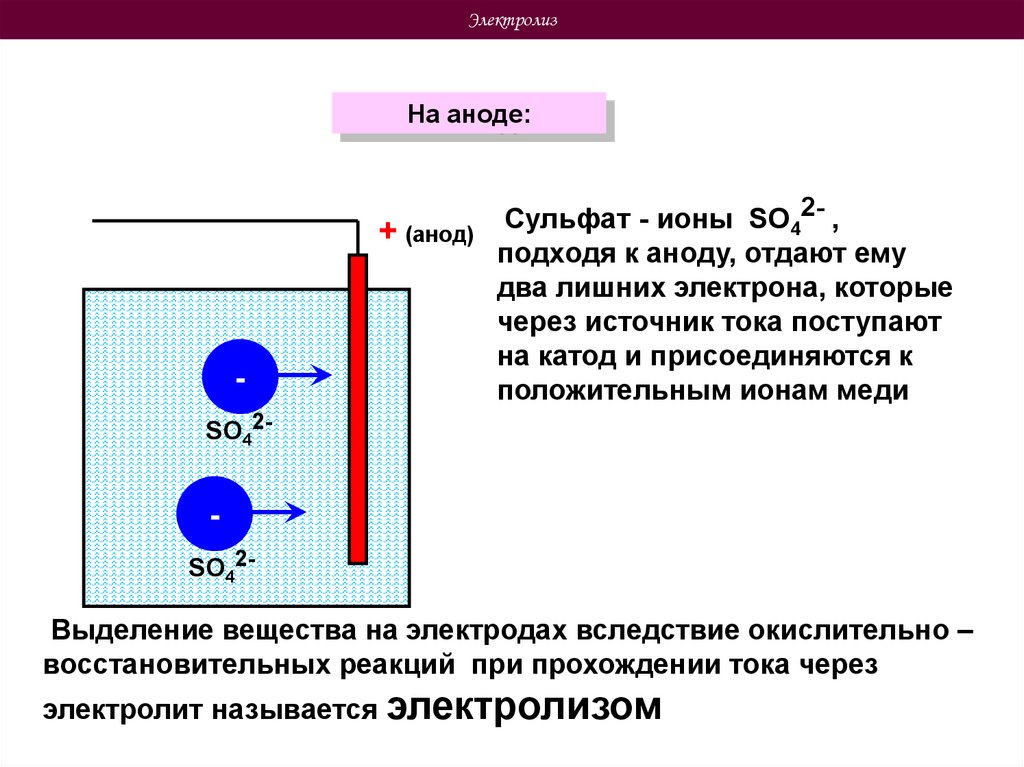
ЭлектролизНа аноде:
+ (анод)
-
Сульфат - ионы SO42- ,
подходя к аноду, отдают ему
два лишних электрона, которые
через источник тока поступают
на катод и присоединяются к
положительным ионам меди
SO42-
SO42-
Выделение вещества на электродах вследствие окислительно –
восстановительных реакций при прохождении тока через
электролит называется электролизом
8.
9.
Применение электролиза:- покрывают поверхность одного
металла тонким слоем другого
( никелирование, хромирование, и т. п.);
- получают копию с рельефной
поверхности, чистый металл из
примесей;
- изготавливают полые фигуры
(гальванопластика), печатные платы
для различных цифровых устройств.
10.
- получают оксидные защитныепленки на металлах (анодирование);
- электрохимическая обработка
поверхности металлического изделия
(полировка);
- окрашивание металлов (например, меди,
латуни, цинка, хрома и др.);
- очистка воды – удаление из нее
растворимых примесей.
- электрохимическая заточка режущих
инструментов (например, хирургических
ножей, бритв и т.д.).








 physics
physics








