Similar presentations:
Растворы. Лекция №1
1.
Кафедра биологической химии с курсами медицинской, фармацевтической итоксикологической химии
Лекция №1
РАСТВОРЫ
Для студентов первого курса специальность
стоматология
Лектор: старший преподаватель
Пащенко Светлана Ивановна
Красноярск, 2024
2.
Актуальность темы▪Растворы в широком смысле этого слова ( жидкие,
твёрдые, газообразные) распространены в природе.
▪ Растворами являются все ткани живого организма.
▪ Многие реакции ( протолитические, окислительновосстановительные, комплексообразование) зачастую
протекают в растворах.
▪ В растворах происходят такие важные в
жизнедеятельности явления как осмос и
протолитический гомеостаз.
▪ Многие лекарственные формы требуют растворения,
а значит знаний способов определения концентрации
вещества.
3.
Цель лекции• Изучить понятия растворы, дисперсные системы.
• Изучить основные положения теорий Сванте
Аррениуса ( электролитическая диссоциация) и
Брёнстеда –Лоури( протолитическая теория).
• Изучить виды концентраций растворов.
• Изучить характеристику кислотности растворов рН.
Научится рассчитывать рН растворов кислот,
оснований и солей.
• Рассмотреть гидролиз солей как один из видов
• протолитического равновесия.
4.
План лекции• Понятия о растворах и дисперсных системах.
• Способы выражения концентраций растворов
• Вода как растворитель. Ионизация воды, ионное
произведение воды, водородный показатель.
• Теория электролитической диссоциации Аррениуса.
• Протолитическая теория кислот и оснований
Брёнстеда-Лоури.
• Гидролиз солей. Расчёт рН растворов солей.
5.
Актуальность темы6.
Дисперсные системы• Растворы являются частным случаем
дисперсных систем.
• Дисперсными называются системы,
состоящие из вещества, раздробленного до
частиц большей или меньшей величины и
распределены в объёме другом веществе
• Измельчённое ( раздробленное) вещество
называют дисперсной фазой.
• Вещество, в объёме котором распределена
дисперсная фаза, называют дисперсной
средой.
7.
Учебный фильм «Дисперсные системы»8.
Растворы.• Раствор – это гомогенная (однородная) система
переменного состава состоящая из двух и более
компонентов (растворитель и растворённые
вещества) и продуктов их физического и
химического взаимодействия.
• Растворитель –компонент, который не меняет
своего агрегатного состояния при растворении
( преобладает)
• Растворённое вещество – компонент, молекулы и
ионы которого равномерно распределены в
объёме растворителя
9.
Классификация дисперсных систем поагрегатному состоянию
10.
Классификация дисперсных систем поразмеру частиц
11.
По характеру взаимодействия дисперснойфазы с дисперсионной средой:
лиофобные (гидрофобные)
лиофильные(гидрофильные)
12.
Дисперсные системы в медицине13.
Частицы, составляющие дисперснуюфазу в различных дисперсных р-рах
• Коллоидные растворы – мицеллы – это
частицы сложного строения, по размеру
гораздо большими, чем молекулы.
• Растворы ВМС (высокомолекулярные
соединения)– частицы крупных молекулы
белков, полисахаридов, нуклеиновых
кислот.
• Истинные растворы – это молекулы,
ионы.
14.
Условия для образования мицеллыЛиофобные коллоидные растворы могут быть
образованы и существовать при соединении
следующих основных условий:
- малая растворимость дисперсной фазы;
-размеры частиц дисперсной фазы( 10-9 -10-6 )
-присутствие в системе стабилизатора(вещество в
избытке).
15.
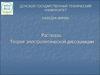
Строение мицеллы16.
«Как написать мицеллу»17.
18.
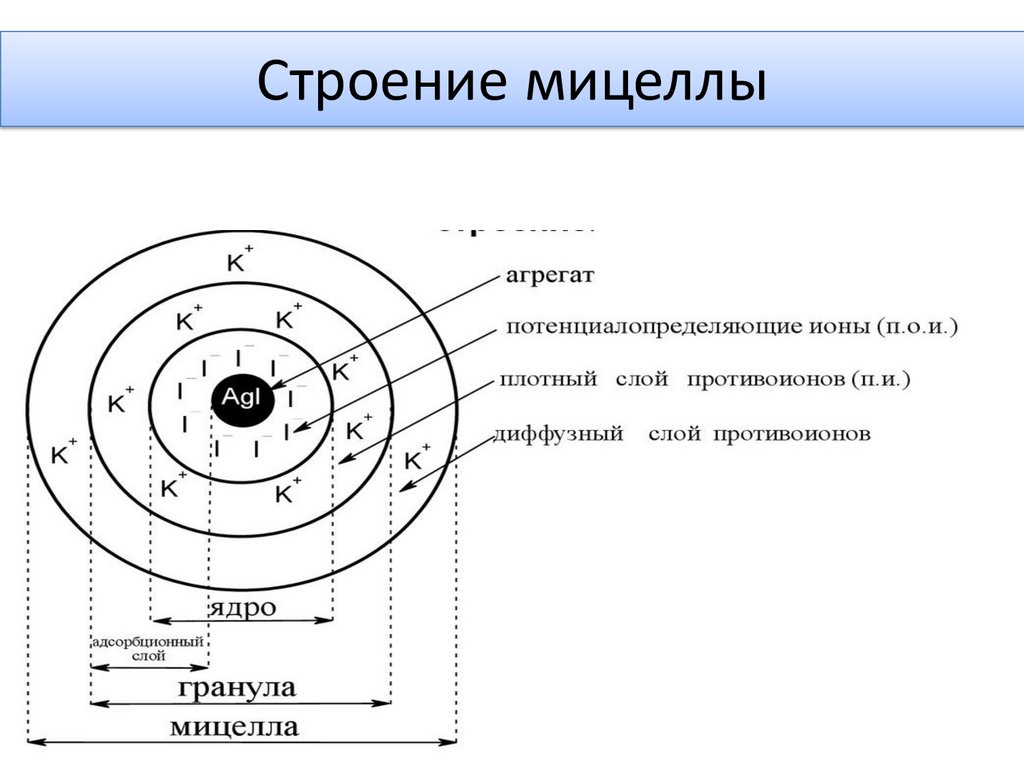
Мицелла слюны19.
коагуляция20.
Свойства коллоидных растворов21.
Применение свойств коллоидныхрастворов
22.
23.
24.
Учёные, работающие над теориейрастворов
25.
Учёные, работающие над теориейрастворов
26.
Истинные растворы27.
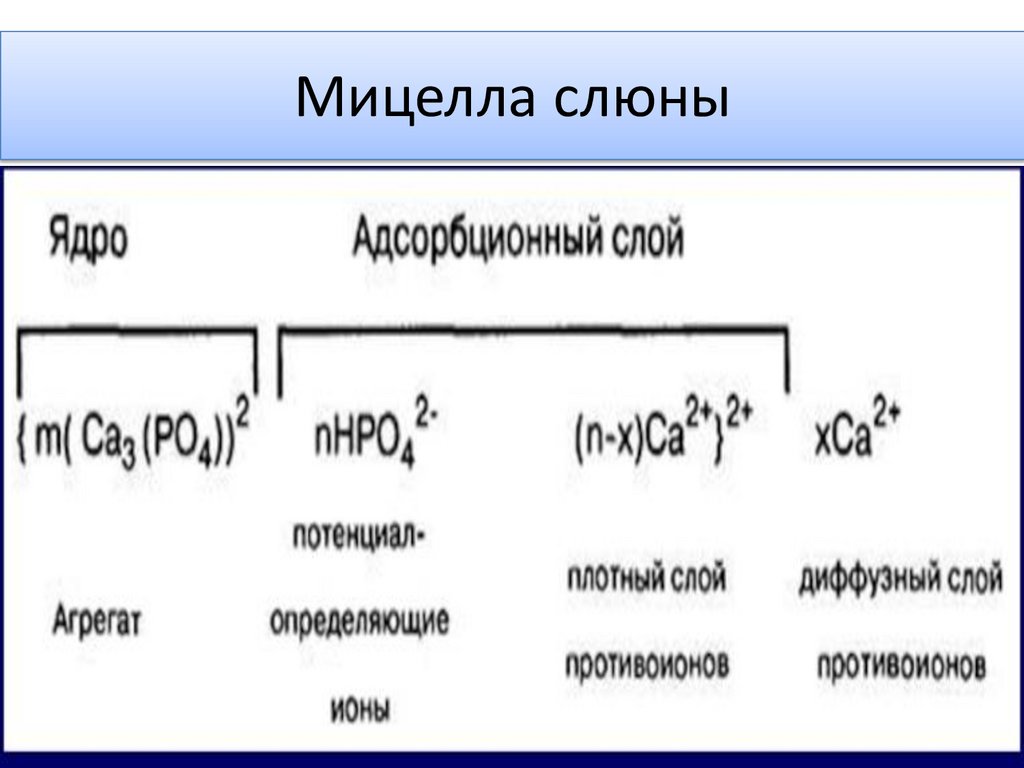
Виды концентраций растворов28.
Строение молекулы воды29.
Ионизация водыводородный показатель
автопротолиз
30.
31.
32.
33.
34.
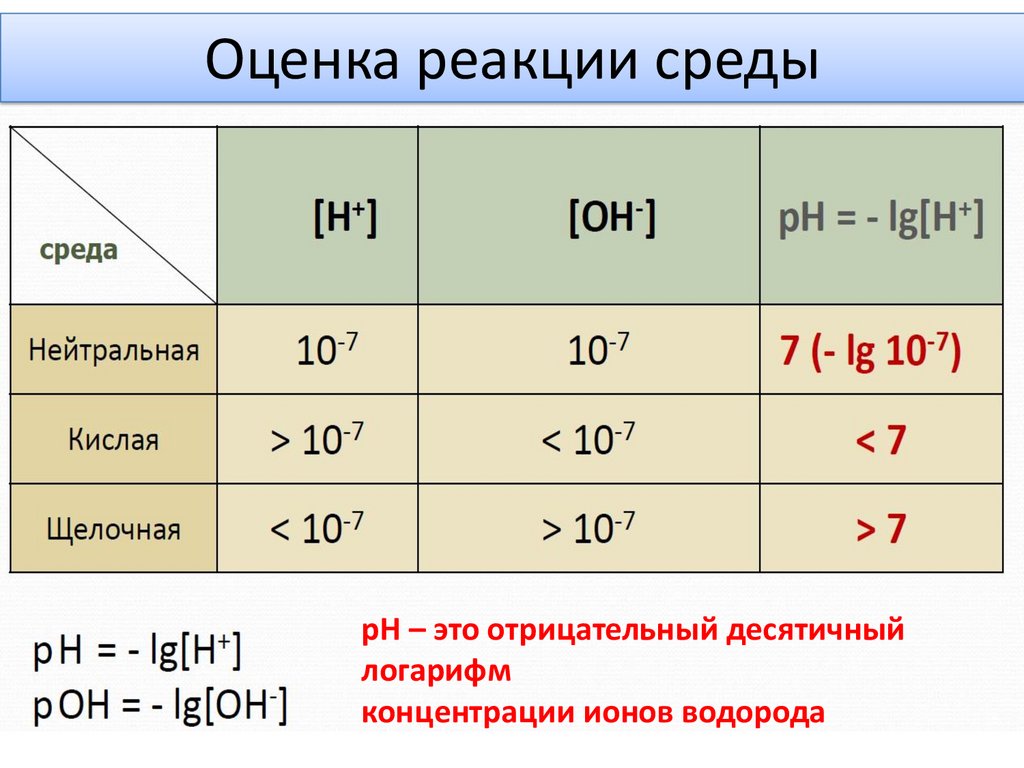
Оценка реакции средырН – это отрицательный десятичный
логарифм
концентрации ионов водорода
35.
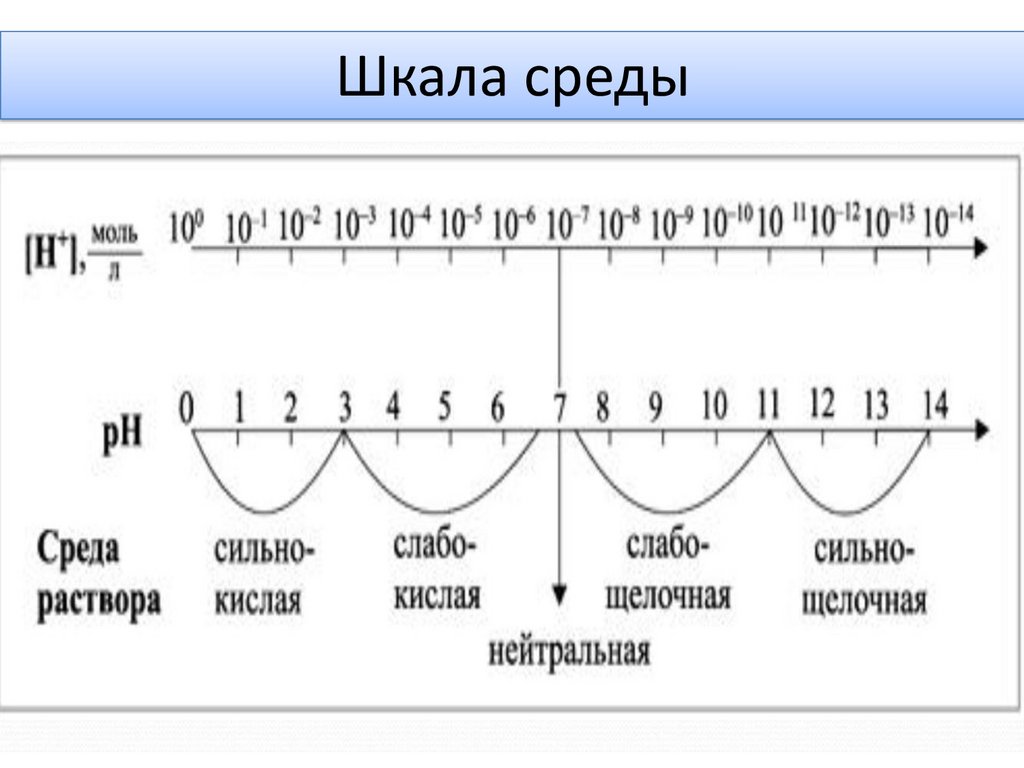
Шкала среды36.
Перевод в логарифмическую шкалу37.
38.
39.
40.
41.
42.
Способы определения рН43.
Индикаторы(органические кислоты иоснования)
44.
45.
Диссоциация кислот(по Аррениусу)Диссоциация
46.
Константа диссоциации кислот Ка47.
Константа диссоциация оснований Кb48.
Сильные и слабые кислоты49.
рН растворов сильных кислот50.
рН растворов сильных оснований51.
рН растворов слабых оснований52.
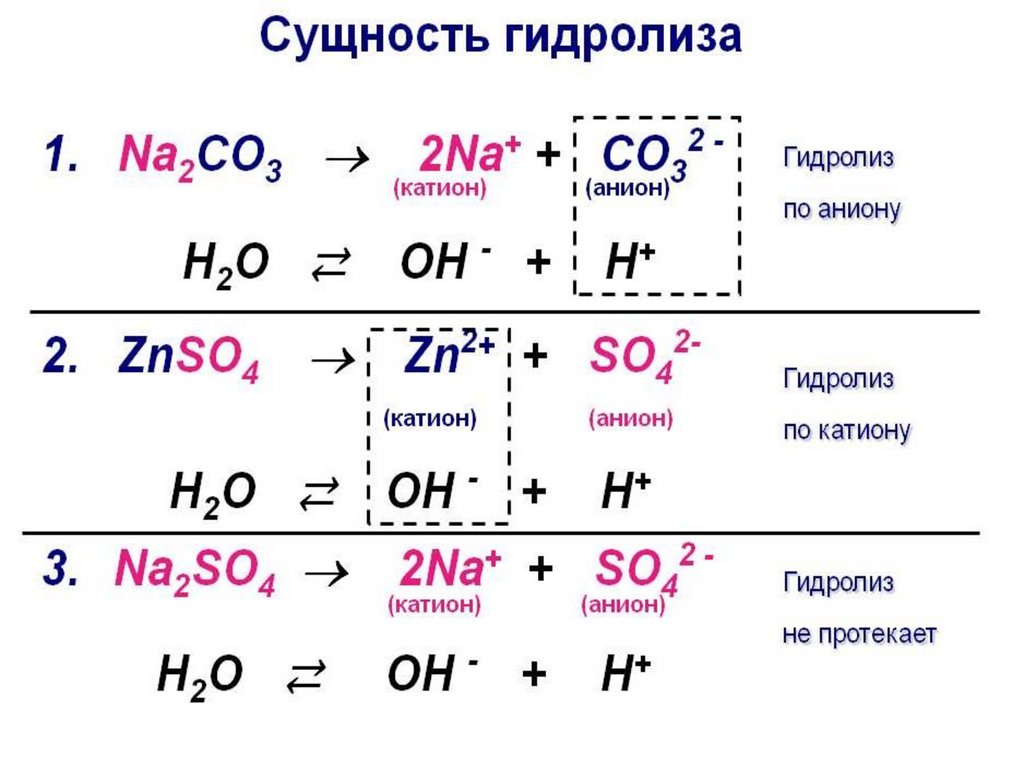
Гидролиз солей• Гидролиз солей – это реакции ионного
обмена между солями и водой.
• Гидролиз солей – это реакция
взаимодействия ионов слабого
электролита, входящего в состав соли, с
водой, в результате которой получается
слабый электролит.
• Гидролиз соли – это слабое кислотноосновное взаимодействие ионов соли с
водой, приводящее к разрушению не
только соли, но и воды
53.
Виды гидролиза• Различают 4 варианта гидролиза солей:
• Соль образована сильным основанием и сильной кислотой.
Такая соль гидролизу практически не подвергается.
• Если соль образована катионом сильного основания и
анионом слабой кислоты, то происходит гидролиз по аниону.
• Если соль образована катионом слабого основания и анионом
сильной кислоты, то гидролиз идет по катиону.
• Соль, образованная катионом слабого основания и анионом
слабой кислоты, подвергается гидролизу и по катиону, и по
аниону.
• Гидролиз солей, образованных очень слабыми кислотой и
основанием, является практически необратимым.
54.
55.
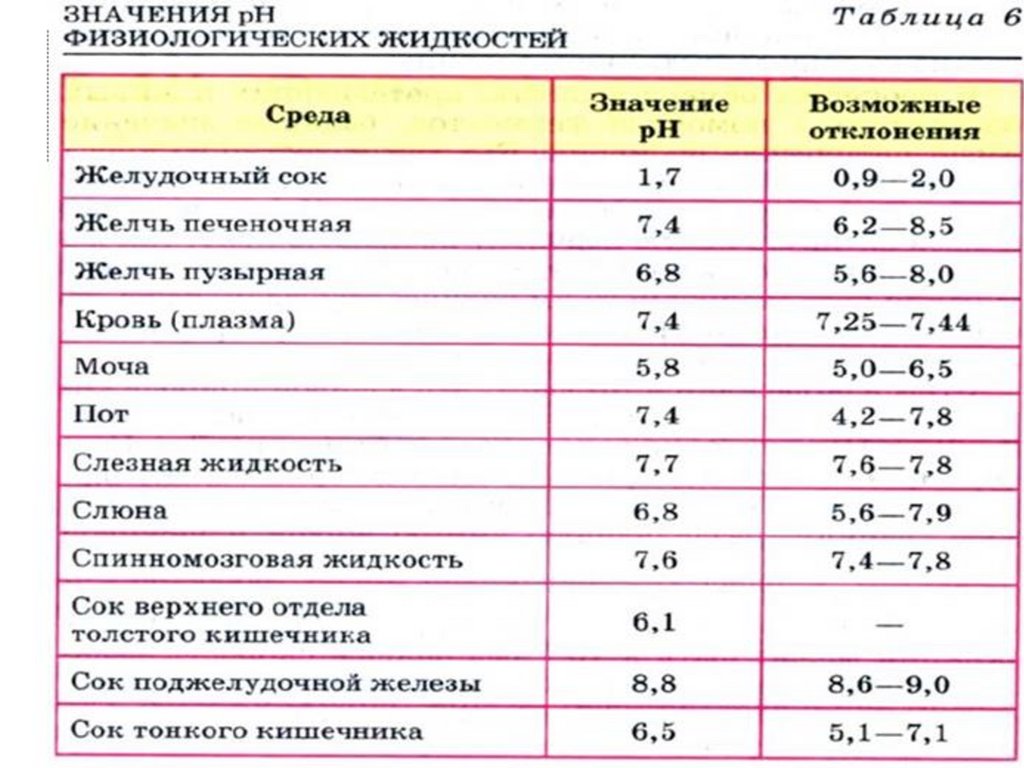
Расчёт рН растворов солей56.
57.
Протолитическая теория кислот иоснований Брёнстеда-Лоури
58.
Отличия в теориях диссоциации ипротолитической
59.
60.
Контрольный вопрос• 1.





















































 chemistry
chemistry