Similar presentations:
Органічні речовини. Алкани. Хімічні властивості алканів. 10 клас
1.
Органічні речовини.Алкани. 10 клас.
Хімічні властивості алканів.
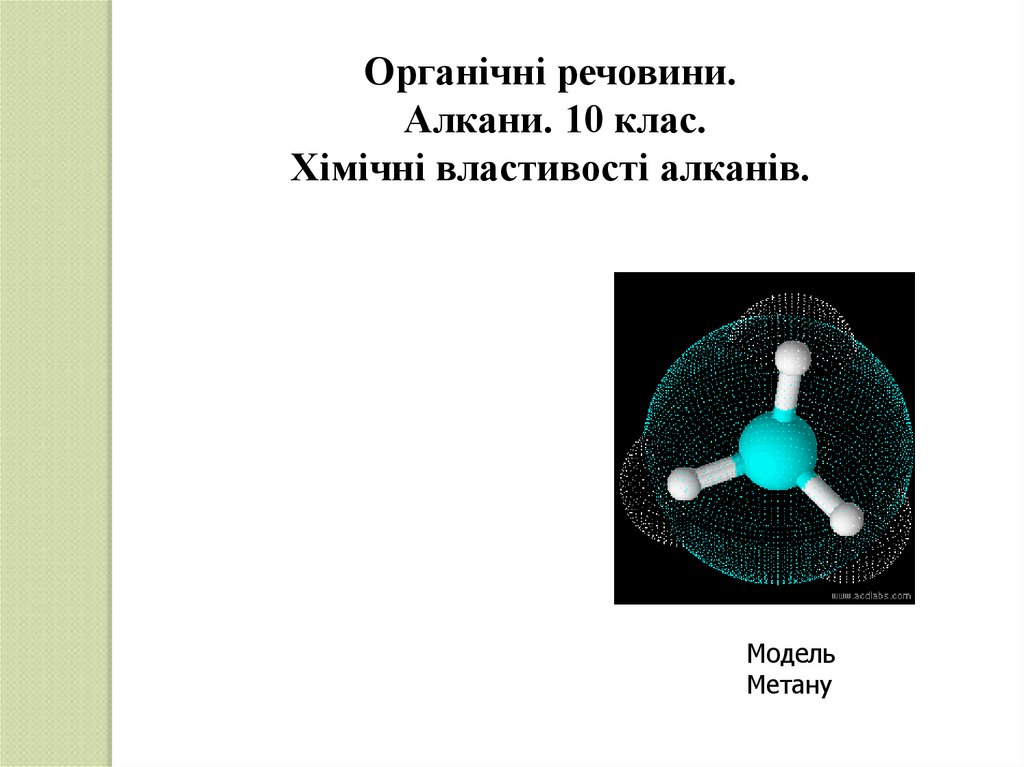
Модель
Метану
2. Добування алканів
Промислові методи:1. З природнього газу, з нафти.
2. Гідрування алкенів.
C2H4 + H2 -> C2H6
Лабораторні методи:
1. Гідроліз карбіда алюмінія.
Al4C3 + 12H2O -> 4Al(OH)3 + 3CH4
2. Реакція Вюрца ( збільшення карбонового ланцюга вдвічі)
2CH3Cl + 2Na -> CH3 – CH3 + 2NaCl
3. Декарбоксілірування солей карбонових кислот
( реакція Дюма)
CH3COONa + NaOH -> CH4 + Na2CO3
3. Хімічні властивості алканів
Ми всі з вами свідки багатьох випадків реакцій саме серед алканів,часом ми не звертаємо уваги на ці явища, коли клацаємо
запальничку, або запалюємо на кухні газ… , коли авто рухається
завдяки газу чи бензину…
4. Хімічні властивості алканів
1. Реакція горіння, або повного окиснення:СН4+2О2 = СО2 + 2Н2О+ 880 кДж енергії!
Метан – цінний вид палива, але і небезпечний в суміші з киснем 1:2,
або повітрям 1:10
Так само реакція повного окиснення характерна для інших алканів.
В робочому зошиті запишіть загальне рівняння реакції горіння:
2 СnH2n+2 + (3n+1) O2 = n CO2 + (n-1) H2O
Спираючись на цей алгоритм, запишіть рівняння реакції повного
окиснення пропану та бутану, що горить в запальничці і ще, складіть
рівняння реакції для горіння етану.
5.
При нестачі киснювідбувається неповне
окиснення, внаслідок чого
утворюється чадний газ:
СН4+2О2 = СО + 2Н2О
Суміш СН4 і О2 дуже
вибухонебезпечна.
Спричинює аварії в шахтах,
може статися вибух в
приміщенні. Саме тому,
щоб своєчасно встановити
виток газу, до побутового
газу
додають метилмеркаптан –
речовину з характерним
неприємним запахом.
6. Хімічні властивості алканів
Горіння вищіх алканівАлкани з великим числом атомів Карбону при горінні можуть
утворювати вуглець.
Побутові свічки, що складаються із суміші твердих вищіх алканів, при
горінні утворюють полум’ я, що утворює кіптяву. Кіптява – це
частинки сажі
( вуглецю), які не встигають згоріти.
Приклад: 2С20H42 + 21O2 -> 40C + 42H2O
7.
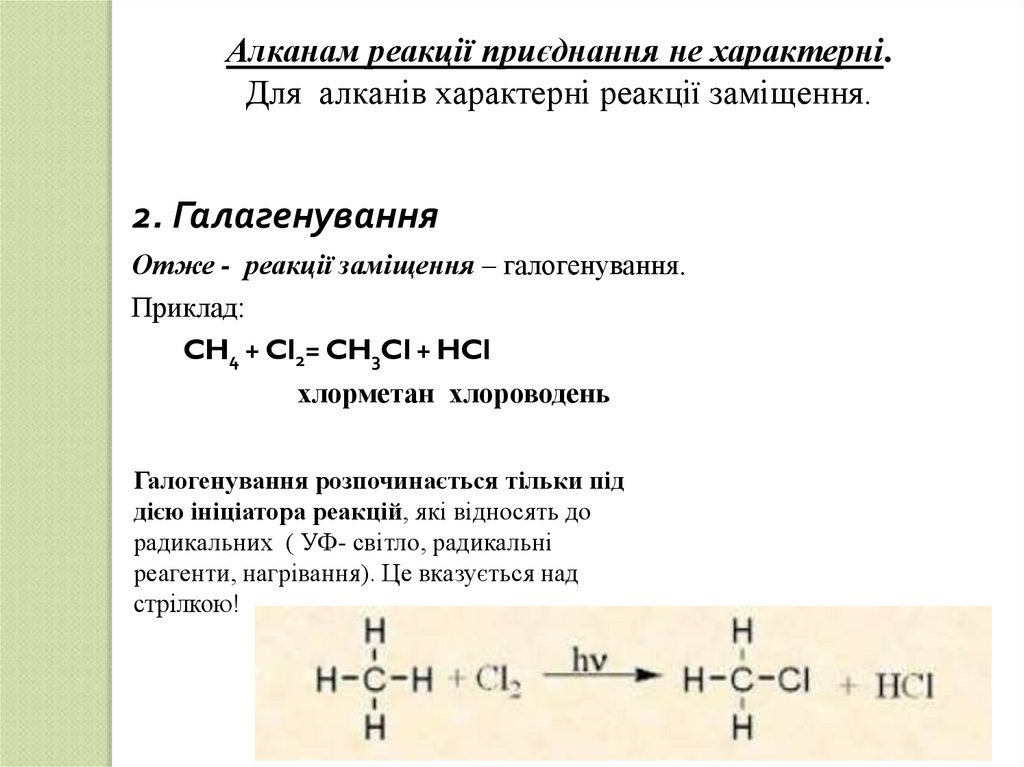
Алканам реакції приєднання не характерні.Для алканів характерні реакції заміщення.
2. Галагенування
Отже - реакції заміщення – галогенування.
Приклад:
CH4 + Cl2= CH3Cl + HCl
хлорметан хлороводень
Галогенування розпочинається тільки під
дією ініціатора реакцій, які відносять до
радикальних ( УФ- світло, радикальні
реагенти, нагрівання). Це вказується над
стрілкою!
8.
3.Термічний розклад алканів.Термічний розклад алканів залежить від температури
нагрівання.
Значення температури вказується над стрілкою!
t = 5000 С відбувається руйнування зв’язків між атомами Карбону,
що веде до утворення вуглеводнів з меншою молекулярною масою
– термічний крекінг
(детально ви його розглядати будете при вивченні теми «Нафта»)
С4Н10 = С2Н6 + С2Н4
t = 1000 С відбувається повний розпад вуглеводнів до простих
речовин
CH4 = С + 2Н2 або: С2Н 6 → 2С + 3Н2
t = 1500 С - з метану та етану можна отримати ацетилен
CH4 = С2Н2 + 3 Н2
9.
4. Ізомерізація.Під впливом температури та за наявністю каталізатора алкани
нормальної будови перетворюються на алкани з розгалудженим
ланцюжком, відбувається ізомеризація - перебудова карбонового
скелета з утворенням алканів розгалуженої будови.
Приклади:
10.
Цікаво про алкани.1. До складу феромонів тварин входять деякі вищі алкани. Запах
феромонів приваблює комах або їх відлякує. Наприклад, феромон
тривоги в мурашок-древоточців містить насичений вуглеводень
декан. Вуглеводи С16-С36, які є в поверхневому шарі кутикул
рослин, запобігають їхньому висиханню. У ході еволюції насичені
вуглеводні, які виробляють квітки орхідеї роду Оphrys (О.
sphegodes), набули нової функції - приваблювання комах.
2.
На поверхні фруктів воскоподібна плівка містить гомологи
метану.
3.
Парафін ( С18 – С35) – використовується в медицині
(парафінотерапія)
4.
Вазелінова олія (до С25) - у медицині, парфумерії, косметології
5.
Вазелін (до С25) - у медицині для виготовлення мазей
6.
Спрей-заморозку «Doc Sprt» використовують для швидкого
охолодження шкіри і м’язів при вивихах і розтягненнях. Містить
зріджені пропан і бутан (раніше С2Н5Сl – токсичний)
7.
Спрей «Дин фріз» - зовнішній засіб для лікування болю в
м’язах, попереку, ревматичного болю, болю від забиття, судом,
розтягнення зв’язок. Головна його складова – С5Н12 (на шкірі
випаровується, поглинаючи тепло, охолоджує ділянку шкіри.)
11.
Закріплення і узагальнення знань:1. Виберіть реакції, характерні для алканів:
А. Повне окиснення;
Б. Приєднання брому;
В. Заміщення за участю хлору;
Г. Термічний розклад.
2. Здійснити перетворення:( дом. завд. )
С → СН4 → СН3Cl → C2H6 → C2H5Br









 chemistry
chemistry








