Similar presentations:
«Медициналық химия» пәні «Жалпы медицина» мамандығы
1.
Жетекші қосылыстың бағытталғанқұрылымдық модификациясының
химиялық әдістері
«Медициналық химия» пәні
«Жалпы медицина» мамандығы
2.
Лекцияның жоспары• Негізгі түсініктер, дәрі дайындаудың негізгі
кезеңдері
• Биологиялық белсенді заттарды анықтау
• Препараттардың химиялық синтезі
• Биотехнологиялық әдістер
3.
Дәрілік затты жасау кезеңдеріЖаңа дәрілік препарат алу үшін кететін шығын: 5 – 15 жыл уақыт, 1 млн. $ - 1 млрд $
4.
Негізгі терминдер• Қосылыс-лидер - қажетті, қызықты қасиеттері болатын, бірақ тиімді
белсенділік көрсетпейтін химиялық қосылыс. Ол – болашақ жаңа дәрінің
құрылымдық прототипі. Осыдан, дәрі дайындау сатысындағы
міндеттердің біріне оның прототипін анықтау жатады (егер кездейсоқ
ашылмаса).
• Дәрілік субстанция – өсімдік, жануар, микроб және синтетикалық текті,
фармакологиялық белсенділік көрсететін және дәрілік препараттар
өндіру және дайындауға арналған зат.
• Дәрілік препарат – дерттердің профилактикасы, диагностикасы және емі
үшін дәрілік форма (таблеткалар, капсулалар, ерітінділер, жақпа майлар
және т.б.) түрінде қолданылатын синтетикалық және табиғи текті зат
немесе заттардың қоспасы.
5.
Дәрілік препараттарды дайындаудың негізгі кезеңдері• Биологиялық белсенді субстанция жасау (өсімдік немесе
жануар ұлпаларының экстрактлері, биотехнологиялық
немесе химиялық синтез, табиғи минералдарды пайдалану)
• Фармакологиялық зерттеулер (фармакодинамикалық,
фармакокинетикалық және токсикологиялық);
• Мемлекеттік тіркеу мен клиникаға дейінгі және клиникалық
зерттеулерді жүргізу үшін сынама партиясын шығару;
• Клиникаға дейінгі зерттеулер туралы құжаттардың
экспертизасы (ҚР ДМ Фармакологиялық комитеті жүргізеді);
• Медициналық практикаға енгізу (өндіруді және емдеу
мекемелерінде қолдануды ұйымдастыру).
6.
Биологиялық белсенді заттарды (дәрілік субстанцияларды)анықтау
• Бионысананы анықтау.
• Препараттарды дәрілік өсімдік шикізатынан бөлу.
• Препараттардың химиялық синтезі.
• Биотехнологиялық әдістер (жасушалық және гендік
инженерия)
7.
Бионысананы анықтау• Қосылыс-лидерді іздеу үшін, оның бионысанасын, яғни
болашақ дәрі адам ағзасында байланысып, әсер ететін
макромолекуланы білу керек. Көптеген жағдайларда
мұндай нысанаға белок (рецептор немесе фермент)
жатады, бірақ бұл ДНК молекуласы және басқа
маңызды биомолекулалар болуы мүмкін.
• Лидерді іздеу стратегиясы оның бионысанасы туралы
белгілі
мәліметтерге,
сол
сияқты
онымен
байланысатын белгілі болған лигандлардың құрылымы
(бұл лиганд мүмкін, мысалы, ағзада пайда болатын
шығар) туралы деректерге байланысты болады.
8.
Препараттарды дәрілік өсімдік шикізатынан бөлу• Өсімдіктерден;
• Жануар ұлпаларынан;
• Минералдық шикізаттардан.
9.
Химиялық синтез• Бүгінгі күні органикалық химия үшін ең күрделі міндет – заттардың
емес, қасиеттердің синтезі. Химик-ғалымдардың көбісі заттардың
қасиеттерін болжауға тырысуда, бірақ бұл міндет күрделі, себебі
химиктердің, биологтар мен медиктердің тілдері бір-біріне ұқсамайды.
• Мысалы, медикке қан қысымын төмендететін препарат керек, ал
биохимиктің ұсынысы бойынша, белсенділігінің жойылуы қан
қысымының
төмендеуіне
әкелетін
ангиотензинконвертирлеуші
ферменттің ингибиторы анықталу керек. Химиктер құрылымдық
формулаларды пайдаланады, сондықтан мұндай міндет олар үшін
түсініксіз. Осыған байланысты қажетті қосылыстың нақты құрылымын,
тіпті класын да болжай алмайды. Мұндай дәрілік заттың туындауы
мүмкін болу үшін, биохимиялық (немесе фармакологиялық) ақпаратты
құрылымдық формулалар тілінде сөйлету қажет. Осы үшін қажетті
дәнекердің ролін соңғы он жылдықтарда пайда болған органикалық
химияның туындысы – „медициналық химия“ (medicinal chemistry,
ағылшынша medicine – дәрі) атқарады.
10.
Рационалдық драг-дизайн• Осылайша, медициналық химияның негізгі міндеті –
рационалдық драг-дизайн (ағыл. drug – дәрі) деп аталатын
физиологиялық белсенділігі алдын-ала болжанған
қосылыстар алу. Бұл процесс қалай жүреді?
• Дәрілердің рационалдық дизайны бойынша стратегия
шартты түрде үш сатыға бөлінеді:
1. Қосылыс-лидерлерді іздестіру немесе «конструкциялау»
(құрау)
2. Қосылыс-лидерді оптимизациялау
3. Дәрілер дайындау
11.
1.1. Бионысана мен лигандныңқұрылымдары белгісіз
• Егер зерттеушіге бәрі – бионысананың құрылымы да,
лигандның құрылымы да белгісіз болса, қосылыс-лидерді
іздеу үшін комбинаторлық химия (қосылыстар кітапханасын
синтездеу және оларды тестлеу) әдісі қолданылады. Іс
жүзінде, бұл сол бұрынғы әдіс, тек қана жаңа
технологиялық,
машиналық
деңгейде
орындалады.
Химиктер мыңдаған заттарды параллель синтездейді және
оларды
қазіргі
роботты
техниканы
пайдаланып,
бионысаналарға тестлейді.
12.
1.2. Бионысананың құрылымы белгілі• Егер нысананың құрылымы белгілі, ал лигандның құрылымы белгісіз
болса, de novo дизайн деп аталатын әдістеме қолданылады.
• Молекула-нысананың дәрімен байланысатын бөлігінің компьютерлік
кеңістік моделі жасалады. Содан соң осы бөлік компьютерде әртүрлі
молекулалармен – лидерге кандидаттармен (процедура «докинг» деп
аталады) сәйкестендіріледі.
• Гипотетикалық лидерге қойылатын талаптар: 1.) молекула өлшемінің
бөліктің өлшемімен сәйкестігі жақсы болу керек; 2.) молекулалардың
нысана бөлігіндегі өзара байланысын (сутегілік байланыс,
электростатикалық тартылыс, липофильдік әрекеттесу және т.б.)
жоғарылату. Нәтижесінде нысанаға сәйкес келетін белгілі өлшемді
және геометриялық құрылым жасауға болады.
• Модельденген қосылыс синтезделеді, белсенділігі сынақталады және
мүмкін болса, қосылыс-лидер ретінде алынады.
13.
1.3. Лигандның құрылымы белгілі• Лигандның құрылымы белгілі, ал нысана белгісіз болған
жағдайда лидер ретінде лиганд алынады.
• Әрине, егер бионысананың да, оған әсер ететін лигандның
да құрылымдары белгілі болса, жағдай жеңілдеген болар
еді. Зерттеуші алдын-ала заттардың қандай класына докинг
жасау керегін білген болар еді және іс жүзінде лигандның
құрылымын нысананың бөлігіне модифицирлеуші еді.
• Мұндай әдіс құрылымды-негізделген дизайн деп аталады.
14.
Қосылыс-лидер ретінде белгілі дәрініпайдалану
• Әрине, бұл жағдайда генерацияланатын құрылымдар, ережеге сай,
өздерінің прототиптеріне ұқсас (терапиялық көшірмелер). Бірақ бұл
амалдың, оның қолданылуын түсініктейтін арнайыланған аспектлері
бар. Мысалы, егер қосылыс-лидер әжептәуір қосалқы әсер жасайтын
белгілі дәрі болса, осы «негізгіемес» қасиет күшейтілетін болады.
Мысалы, ХХ ғасырдың 80-жылдарында антиадренергиялық
препараттардың
(β-адреноблокаторлар),
мысалы
атенолол,
гипотензивтік әсер жасайтыны белгілі болды. Сондықтан ұқсас
құрылым антигипертензивтік, бірақ β-блокаторлық белсенділік
көрсетпейтін препараттар алу үшін қосылыс-лидер ретінде
пайдаланылды. Нәтижесінде кромакалим – калий арналарын
белсенділендіруге (антигипертензивтік зат ретіндегі белсенділігі) ғана
қатысатын бірінші қосылыс алынды.
15.
Қосылыс-лидерді іздеудің эмпириялық жолы(тәжірибеге негізделген)
1. Кездейсоқ ашылулар
• Мысалы, алифатикалық спирттердің азот қышқылымен
түзетін көптеген эфирлерінің синтезіне әкелген
нитроглицерин және оның негізінде көптеген аналогтары
мен туындылары синтезделген пенициллин.
16.
2. Скрининг• Негізі, бастапқы ізденіс әртүрлі заттарды белсенділік бойынша жүйелік
тестлеумен («скрининг») байланысты. Жүйелік скринингтің екі түрі
белгілі:
а) қосылыстардың әжептәуір үлкен тобын бір биологиялық тестде
зерттеу;
б) құрылымдары керемет бірнеше қосылысты көптеген биологиялық
тестлерде зерттеу. Олар, негізі, органикалық қосылыстардың
потенциалдық үлкен жинағының толық тексерісін қатты шектейтін
қымбат және қиын әдістер.
• Скрининг барысында кейде «нысанаға тигізу» түсінігін сипаттайтын hitcompound – физиологиялық белсенділік көрсететін қосылысты
анықтау термині қолданылады. Содан соң құрылымдары ұқсас
қосылыстарға тестлеу жүргізіледі және соның ішінен қосылыс-лидер
таңдалады.
17.
Скрининг (жалғасы)• Жалпы, қосылыс-лидерді органикалық синтезбен ғана емес,
оны табиғи қосылыстардан да бөліп алуға болады.
Қосылыс-лидерлерді жүйелік скрининг әдісімен іздеу
барысында «халық медицинасының» мәлімет көздеріне
жүгіну сирек емес. Басқаша айтқанда, биологиялық
қасиеттер бойынша тестлеу үшін қажетті молекулалардың
шығу көзі ретінде химиялық синтездің өнімдері де,
молекулалары өте ерекше және күрделі құрылымды болып
келген табиғи қосылыстар да қолданылуы мүмкін.
• Табиғи қосылыстардың жүйелік скринингінің көмегімен
анықталған қосылыс-лидердің мысалына қатерлі ісікке
қарсы әсерлі зат – таксол жатады.
18.
Жалпылама («through put») скринингКомпьютерлік және роботтытехниканың дамуына байланысты жалпылама
скрининг туындады. Жалпылама скрининг – бірнеше жүздеген, тіпті
мыңдаған қосылыстардың 30-50 биологиялық тестлердегі бір мезгілдік
автоматталған және миниатюрленген сараптамасы in vitro .
Жалпылама скрининг әдісі, ережеге сай, радиоактивті атомдармен
таңбаланған лигандларды алмастыруға және ферменттерді ингибирлеуге
арналған тестлер үшін қолданылады. Жалпылама скрининг әдістерінің
дамуы органикалық синтездегі жаңа бағытты – «комбинаторлық
кітапханалар» синтезін туындатты. Соңғысы ұқсас реагенттер сериясын
пайдаланып, бір типті әдіспен алынған және құрамы реттелетін
қосылыстардың үлкен (көбіне өте үлкен) санының қоспасы. Бұл қоспа
жалпылыма скринингтеледі, содан соң қоспаның биологиялық белсенділік
көрсеткен құрылымдарының идентификациясы жүргізіледі.
• Жалпылама скрининг әдісінің табысына қандағы холестериннің мөлшерін
төмендететін препараттардың жаңаша легінің қосылыс-лидері болған
ловастатиннің алынуы жатады.
19.
Таксол20.
Бағытталған синтезЭнантиомерлер синтезі (хиральдық ауысу)
• Продәрілер
(pro-drug) жасау – сипатты физиологиялық
белсенділігі болмайтын, бірақ адам ағзасында дәріге айналуға
қабылетті болатын қосылыстар жасау. Бұл ферменттік немесе
химиялық (белокты катализаторсыз) реакцияның нәтижесінде
орындалады.
Продәрі алу үшін, негізі, физиологиялық белсенді қосылыстағы
реакцияға қабылетті белгілі топ, осы байланыс ағзада
ыдырайтындай болып модифицирленеді. Мысалы, продәрілердің
көмегімен дәрінің әсерін ұзартуға, оның судағы ерігіштігін
күшейтуге және тіпті оның дәмін өзгертуге болады.
21.
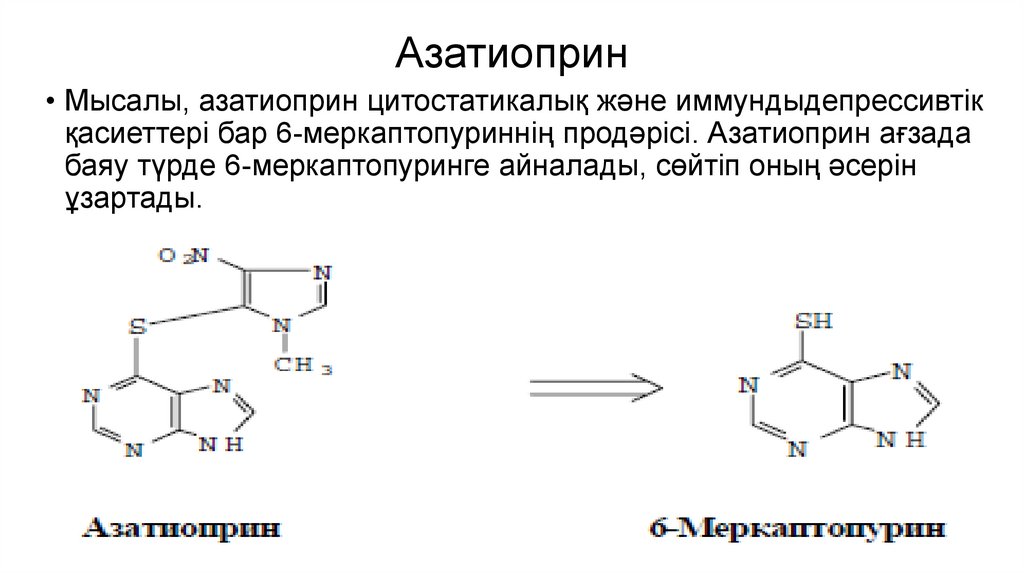
Азатиоприн• Мысалы, азатиоприн цитостатикалық және иммундыдепрессивтік
қасиеттері бар 6-меркаптопуриннің продәрісі. Азатиоприн ағзада
баяу түрде 6-меркаптопуринге айналады, сөйтіп оның әсерін
ұзартады.
22.
Жұмсақ және қосарланған дәрілер• «Жұмсақ дәрілер» (soft drugs) жасау – фармакологиялық әсері
белгілі бір жерде локализацияланған (оларың басқа жерлерде
таралуы деструкцияға және инактивацияға әкеледі) қосылыстар алу.
Бұл стратегиялық амал, мысалы, глаукомаға қарсы дәрі алу
барысында қолданылды.
• «Қосарланған дәрілер» (twin drugs) жасау – ковалентті түрде бір
молекулаға (бұл бір тұздың молекуласындағы екі дәрінің
комбинациясын жоққа шығаратын анықтама) біріктірілген екі
фармакофорлық топтан тұратын физиологиялық белсенді қосылыстар
алу.
Мысалы, ұқсас қосарланған дәріге екі бірдей құраушының
комбинациясы болатын, белсенділігі оның молекуласын құраушы
нитрендипиннің (кальций арналарының антагонисті) белсенділігінен
жуық шамамен 10 есе артық болып келетін BDHP симметриялық
молекуласы жатады.
23.
24.
Ұқсас емес қосарланған дәрілерҚосарланған дәрілер ұқсас та болмауы мүмкін (құраушылар
ретінде әртүрлі құрылымдар қолданылады). Мысалы, құрамында
молекуланың бірнеше функционалдық маңызды бөліктері
болатын күрделі «бинарлық» құрылымдарды конструкциялау
мүмкіншілігі. Бұл жерде сан-алуан комбинациялар жасауға
болады.
• Мысалы, егер дәрілік препаратты ағзада ыдырататын фермент
белгілі болса, онда құрылымының құрамында осы дәрінің
фрагменті де, аталған ферментті ингибирлейтін молекуланың да
фрагменті болатын бинарлық молекуланың құрылуы мүмкін.
Осы молекуланың ағзада ыдырауы барысында, ферменттің
ингибирленуі нәтижесінде аталған препараттың әсері ұзарады.
25.
Биоизостериялық алмастыру• Бұл кезеңнің маңызды әдісі – изостериялық немесе биоизостериялық
алмастыру. „Изостерлер“ термині ХХ ғасырдың басында енгізілді (И.
Ленгмюр): „Құрамындағы атомдардың сандары бірдей және
электрондардың сандары мен орналасуы бірдей молекулалар немесе
иондар “.
• Соған сәйкес конструкцияланатын дәрідегі изостериялық алмастыру
деген атомның немесе топтың өлшемі немесе валенттілігі бойынша
ұқсасқа алмастырылуы. Егер алмастыру барысында физиологиялық
белсенділік сақталатын болса, алмастыру „биоизостериялық“ деп
аталады.
• Бір қызықтысы, „биоизостер“ термині мүлдем «ұқсамайтын»
топшаларға алмастыру жолымен алынатын, бірақ биологиялық
қасиеттері сақталатын қосылыстарға да қатысты.
• Зерттеушілердің биоизостериялық алмастырудың көмегімен, мысалы,
белсенді қосылыстың уыттылығын азайтуға, ағзаның ферменттік
жүйелерінің әсеріне тұрақтылықты жоғарылатуға мүмкіндігі бар, т.б.
26.
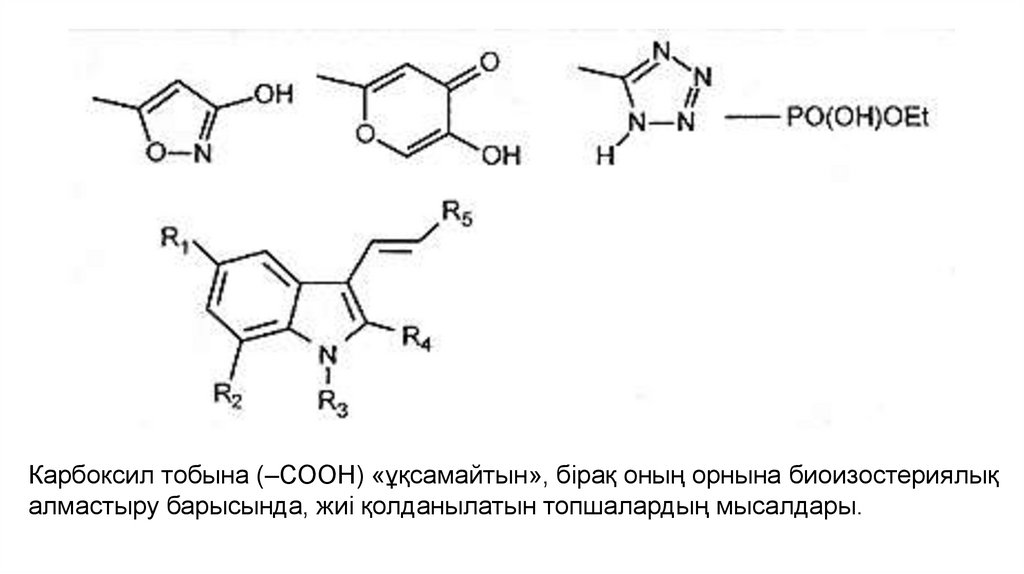
Карбоксил тобына (–СООН) «ұқсамайтын», бірақ оның орнына биоизостериялықалмастыру барысында, жиі қолданылатын топшалардың мысалдары.
27.
ПептидомиметиктерМысалы, біз жасайтын дәрі табиғи лигандсы пептид
болып келген нысанаға әсер етуі керек. Бұл пептидті
қосылыс-лидер ретінде алуға болады, бірақ оның негізінде
пептидомиметик – осы нысанамен әрекеттесуге қабылетті,
бірақ құрамында пептидтіемес құрылымдық элементтер
болатын қосылыс дайындау керек. Оның себебі мынада:
пептидтерді дәрі ретінде пайдалану қолайсыз, себебі суда
нашар ериді, ағзаның ферменттерімен жеңіл ыдырайды.
Жақсы пептидомиметиктердің мұндай кемшіліктері
болмайды.
28.
Биопрепараттар жасау – жанды ағзаларға бағытты әсерету, сол сияқты дерттің профилактикасы мен емі үшін
қолданылатын биологиялық текті препараттардың жалпы
аты.
Дәрі–клондар (me-too) жасау. Дженериктер (generics) –
патенттік қорғаныс мерзімі аяқталған және көптеген
өндірушілер шығаратын дәрілер.
29.
Биотехнологиялық әдістер (жасушалық және гендікинженерия)
Жасушалық инженерия әдістері жаңа типтегі
жасушаларды құрастыруға бағытталған. Оларды әртүрлі
жасушалардың жекеленген фрагменттерінен тіршілікке
қабылетті жасушаларды дайындау үшін пайдалануға
болады.
Гендік инженерия өзгеретін немесе генетикалық
модифицирленген ағзалардың немесе «трансгендік» деп
аталатын өсімдіктер мен жануарлардың тапсырыс
бойынша (қажетті) сапасын алуға мүмкіндік береді.
30.
ОптимизацияҚосылыс-лидер табылған соң, дәріні құраудың екінші кезеңі –
оптимизация басталады. Қосылыс-лидер қажетті белсенділік,
селективтілік,
керекті
еріткіштердегі
ерігіштік,
уытсыздық
көрсететіндей болып өзгеруі керек. Әрине, ол үшін оның құрылымын
өзгерту қажет.
Химиктер практикада қосылыс-лидердің құрылымдық аналогтарын
синтездейді және белгілі физиологиялық белсенділікке тестлейді. Бұл
сатыдағы негізгі мәселе сол, теориялық тұрғыдан, мүмкін деген
аналогтардың саны өте үлкен. Олай болса, рационалдық амалды
пайдаланып, қандай аналогтарды синтездеу керектігін болжау керек.
Ол үшін тағы да компьютерлік модельдеуді, яғни белсенділігі белгілі
қосылыс-лидердің аздаған аналогтарының докингін пайдалануға
болады. Оның көмегімен, нысанамен байланысу үшін маңызды
химиялық топтардың бір-біріне қатысты қалай орналасқанын түсінуге
болады, яғни синтезделетін аналогтардың саны қысқартылады.
31.
Дәрілер дайындауДәрілік қосылыс жасаудың соңғы сатысы – оны дайындау. Тиімді
лидер клиникада қолданылу үшін қолайлы болуы және қажетті
фармакокинетикалық және фармакодинамикалық сипаттамаларға
ие болуы керек. Бұл сатыда аяқталады:
1. Препараттың дәрілік формаларын дайындау;
2. Инновациялық дәрілік формаларды дайындау;
3. Препараттың дәрілік формасының биоқолжетімділігін зерттеу;
4. Препараттың фармакопеялық мақаласын
және препарат
стандартының фармакопеялық мақаласын дайындау.
32.
Клиникаға дейінгі және клиникалық зерттеулер1. Дәрілік препаратты зерттеудің биоэтикалық экспертизасы:
• Клиникаға дейінгі зерттеулердің халықаралық стандартқа
негізделген құқықтық және этикалық бақылауын жүргізу;
• Жануарлардың жағдайы және қоректенуі;
• Мейірімділік шаралары;
• Жануарларды өлтіру шарттары (наркоз жасалу керек);
• Зерттеу хаттамасының биоэтика бойынша комиссиямен
келісімі.
33.
2. Дәрілік препараттарды токсикологиялық зертханада зерттеу• Өткір уыттылықты анықтау;
• Созылмалы уыттылықты зерттеу;
• Ерлердің және әйелдердің жыныстық жасушалар өндіретін
мүшелеріне (гонадтар) әсерін анықтау.
• Трансплаценталық әсерлерді айқындау (эмбриоуыттылық,
фетоуыттылық);
• Мутагендік қасиеттерді зерттеу;
• Аллергенділікті және жергілікті тітіркендіргіш әсерді анықтау;
• Канцерогендік қасиеттерді тексеру.
34.
Дәрілік препараттарды клиникалық зерттеу шарттары• Науқастардың бақылау тобын таңдау.
• Науқастарды зерттеу топтары бойынша рандомизациялау.
• «Еселенген көрінбейтін әдісті» және плацебо пайдалану.
• Зерттеу критерийлері нақты болу керек.
• Әсер сандық бағалануы керек.
• Эталондық препаратпен салыстырылуы керек.
• Этикалық қағидалар сақталуы керек (науқастың келісімі).
35.
Дәрілік препараттарды клиникалық зерттеу фазалары1. Сау еріктілерге жүргізіледі (тиімді дозаларды анықтау,
фармакокинетика зерттеледі)
2. Кішірек топтарда (9-дан 100-200 науқасқа дейін) жүргізіледі.
Плацебо – бақыланатын, рандомизирленген зерттеулер.
3. Науқастардың үлкен тобына (бірнеше мың) белгілі
препараттармен салыстырмалы түрде жүргізілетін
рандомизирленген зерттеулер.
4. Тіркелгеннен кейінгі клиникалық зерттеулер. Рандомизация,
бақылау. Фармакоэкономикалық зерттеулер.
36.
Қорытынды• Әрине, заттардың фармакокинетикалық қасиеттерін жақсартуға
бағытталған әрбір құрылымдық модификация, жаңа химиялық
қосылыстың алынуына әкеледі. Ал оның белсенділігі төмен болуы
мүмкін немесе ол басқа белсенділік көрсетуі мүмкін. Сондықтан
дәрілерді дайындауға арналған зерттеулер, көбінесе, QSAR және
компьютерлік модельдеу қолданылатын оптимизациялау сатысынан
бөлінбейді. Қазіргі кездегі дәрілер жасаудың жалпы стратегиясы
осындай.
• Әрине, қазіргі кезде жаңа әдістер пайда болғанымен, дәстүрлі іздену
әдістері
жойылмайды.
Бірақ
рационалдық
драг-дизайнның
интеллектуалдық
бейнесі,
сол
сияқты
нәтижесінде
жаңа
бионысаналар белгілі болып жатқан, молекулалық биологияның
табыстары, дүние жүзілік химик-органиктер қоғамының басым бөлігін
қасиеттері алдын-ала болжанған құрылымдардың синтезімен
шұғылдануға міндеттеді.


































 medicine
medicine chemistry
chemistry








