Similar presentations:
Гидролиз солей. Конкурсная работа
1. Гидролиз солей
Конкурсная работа2. Тема. Гидролиз солей
Цель: дать понятие о сущности реакций гидролиза.Рассмотреть гидролиз солей, условия протекания
гидролиза; раскрыть роль гидролиза в биологических и
обменных процессах; научить составлять ионные
уравнения гидролиза; закрепить знания пользоваться
таблицей растворимости для прогнозирования возможных
химических реакций; совершенствование химического
языка учащихся.
2
3. Содержание
Данные экспериментаТеоретические основы
Типы солей
Типы гидролиза
Проверка знаний
3
4. Эксперимент
Изменение окраски лакмусав растворах солей
Что наблюдаете?
В чем причина изменения
окраски индикатора?
NaCl
К2CO3
ZnSO4
4
5. Теоретические основы
Вода – слабый электролитН2О ⇄ Н+ + ОН[Н+ ] = [ОН- ] – среда нейтральная, рН = 7
[Н+ ] > [ОН- ] – среда кислая,
рН < 7
[Н+ ] < [ОН- ] – среда щелочная, рН > 7
Почему в водных растворах солей
появляются избытки свободных
ионов Н+ или ОН- ?
5
6. Теоретические основы
- +Диссоциация солей
-
+
-
+
-
+
+
- +
+
- +
-
- +
+
В гидратированных ионах возможно
Ионвзаимодействие
– дипольное взаимодействие,
соли
Ориентация «ионы –ионов
диполи
воды»
образование
гидратированных
ионов
со своей гидратной
оболочкой
6
7. Теоретические основы
Определениеот греческих
слов водой»
– «разложение
Гидролиз солей – это взаимодействие ионов
соли с водой с образованием
малодиссоциирующего вещества
(слабого электролита)
7
8. Типы солей
Соль= основание
+ кислота
Любую
соль можно
представить
как
продукт
взаимодействия
Сила
Основания
Кислоты
Cоли
электролита
основания с кислотой
Na
Cl
NaOH
HCl
С
С+С
(сильные)
Сл
(слабые)
KKOH
Ba(OH)2
HNO3
H2SO4
NH4 OH
Zn(OH)
Zn
2
Al(OH)3
H2S
H2CO3
CH3COO
COOH
С + Сл
Сл + С
Сл + Сл
8
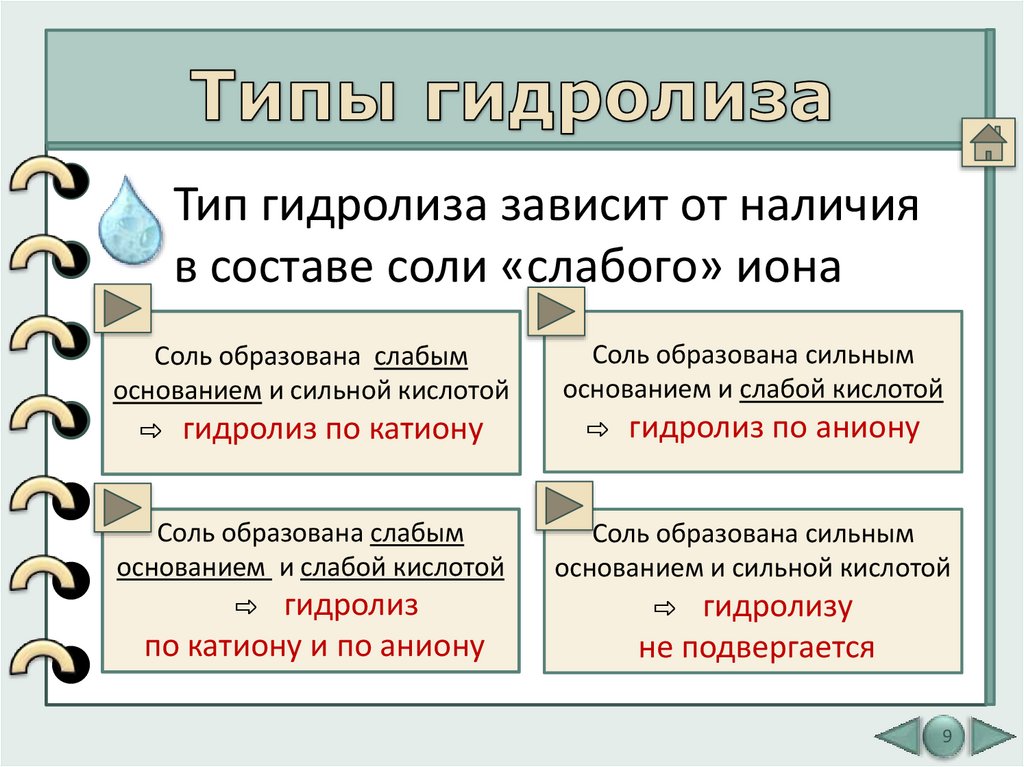
9. Типы гидролиза
Тип гидролиза зависит от наличияв составе соли «слабого» иона
Соль образована слабым
основанием и сильной кислотой
⇨ гидролиз по катиону
Соль образована сильным
основанием и слабой кислотой
⇨ гидролиз по аниону
Соль образована слабым
основанием и слабой кислотой
⇨ гидролиз
Соль образована сильным
основанием и сильной кислотой
⇨ гидролизу
по катиону и по аниону
не подвергается
9
10. Гидролиз по аниону
3. 6.Определить
4.
Написать
Написать
Соли,
молекулярное
возможность
сокращенное
образованные
образования
уравнение
ионное
2. Написать
5.1.
Определить
Определить
уравнения
среду
состав
диссоциации
раствора
соли
уравнение
сильным
слабого основанием
электролита
между
гидролиза
слабым
иислабой
тип
ионом
гидролиза
кислотой
и водой
KOH – сильное основание
К2CO3
H2CO3 – слабая кислота
Слабый электролит ⇨
+
2К2CO3 = 2К + CО3
подвергается
+
Н2О ⇄ ОН + Н
гидролизу по аниону
CО32- + Н+ОН- ⇄ НCО3- + ОН- - 1 ступень
[Н+ ] < [ОН- ] – среда щелочная, рН > 7
лакмус синий
К2CО3 + Н2О ⇄ КНCО3 + КОН
10
11. Гидролиз по катиону
3. 6.Определить
4.
Написать
Соли,
возможность
сокращенное
образованные
образования
ионное
Написать
молекулярное
уравнение
2. Написать
5.1.
Определить
Определить
уравнения
среду
состав
диссоциации
раствора
соли
уравнение
слабым
слабогооснованием
электролита
между
слабым
и сильной
и тип
ионом
гидролиза
кислотой
и водой
гидролиза
Zn(OH)2 – слабое основание
ZnSO4
H2SO4 – сильная кислота
Слабый электролит ⇨
2+
2ZnSO4 = Zn + SO4
подвергается
+
Н2О ⇄ ОН + Н
гидролизу по катиону
Zn2+ + Н+ОН- ⇄ ZnOH+ + Н+ - 1 ступень
[Н+ ] > [ОН- ] – среда кислая, рН < 7
лакмус красный
2ZnSO4 + 2Н2О ⇄ (ZnOH)2SO4 + H2SO4
11
12. По катиону и аниону
3.5.Определить4. Написать
Соли,возможность
сокращенное
образованные
образования
ионное
Определить
среду
раствора,
сравнив
2. Написать
1. Определить
уравнения
состав
диссоциации
соли
уравнение
слабым
слабогоКоснованием
между
электролита
слабыми
ииислабой
тип
кислотой
и водой
значения
дис
(кислоты)
Кионами
дисгидролиза
(основания)
NH4OH – слабое основание
CH3COONH4
CH3COOH – слабая кислота
Слабые электролиты ⇨
+
CH3COONН4 = NН4 + CH3COO
подвергается
гидролизу по катиону
Н2О ⇄ ОН- + Н+
и по аниону
CH3COO -+NН4+ +Н+ОН- ⇄ CH3COOH + NH4OH
Кдис(CH3COOH) =1,75 · 10-5 < Кдис(NH4OH)= 6,3 · 10-5
⇨ [Н+ ] < [ОН- ] – среда слабощелочная, рН > 7
лакмус синий
12
13. Необратимый гидролиз
КатионыПо таблице растворимости можно
Р
Р
Р
М
М
Н
Н
Н
Н
Н
определить
соли,
которые
Р
Р
Р
Р
Р
Р
Р
Р
Р
Р
Р
«в водной
Р
Р
Рсреде
Р
Р разлагаются»,
Р
Р
Р
Р
Р т.е.
Р
Р
Р
Р
Р
—
—
— —
Н
—
Н
подвергаются
необратимому
Р
Р
Р
Р
М
М
— — М
—
—
гидролизу
Р
Р
Р
Р
М
Р
Р
Р
Р
Р
Р
Анионы
Р
Р
Р
Р
Н
Н
Н
Н
Н
Н
Н
Р
Р
Р
Р
Н
Н
—
—
Н
—
—
Н
—
Р
Р
Н
Н
Н
—
Н
—
—
Р
Р
Р
Р
Р
Р
Р
Р
Р
Р
Р
Al2S3 + 6H2O = 2Al(OH)3 ↓ + 3H2S↑
13
14. Не подвергаются
3. Определитьвозможность
образования
Соли,
образованные
Определить
состав
соли
4.1.Определить
среду
раствора
2. Написать
уравнения
диссоциации
слабогооснованием
электролитаи исильной
тип гидролиза
сильным
кислотой
NaOH – сильное основание
NaCl
HCl – сильная кислота
NaCl = Na+ + ClН2О ⇄ ОН- + Н+
Сильные электролиты ⇨
гидролизу
не подвергается
[Н+ ] = [ОН- ] – среда нейтральная, рН = 7
лакмус цвет не меняет
14
15. Проверка знаний
1.составе
какой
соли
нетподвергается
«слабого»
2.
4.5.Фенолфталеин
Необратимому
Если
3.ВКак
в изменится
пробирку
можно
гидролизу
сокраска
раствором
использовать
лакмуса
хлорида
вдля
Последовательно ответьте на вопросы 1 - 5
иона?
цинка
обнаружения
поместить
растворе
в водном
нитрата
соль:
цинк - растворе
выделится
цинка? соли:
газ:
Вопрос 1
Вопрос 2
Вопрос 3
Вопрос 4
Вопрос 5
1.
A Сульфид
Нитрата
Не изменится
NH
Хлор
4Cl
кальция
хрома
(III)
B Хлорида
Ацетат
Посинеет
Водород
KNO3
кальция
бария
C Сульфата
Бромид
Покраснеет
Na2S
Хлороводород
алюмининия
бария
D Фосфата
Нитрит
Обесцветится
FeSO4
Кислород
натрия
лития
2.
3.
4.
5.
15
16. Домашнее задание
Какую среду будут иметь водные растворы следующихсолей:
1 вариант
а) нитрата цинка
б) сульфата калия
в) сульфида натрия
2 вариант
а) хлорида меди (II)
б) сульфита натрия
в) нитрата бария
Составьте ионное уравнение гидролиза
этих солей.
16
17. Домашнее задание
Подготовить доклад с презентацией натему:
«Значение гидролиза в биологических
обменных
процессах.
Применение
гидролиза в промышленности».
17
















 chemistry
chemistry








