Similar presentations:
Предмет «Химия». Строение веществ. Развитие представлений о строении атома
1.
Предмет «Химия». Строениевеществ.
Развитие представлений о строении
атома.
Периодический закон и
периодическая система химических
элементов.
Свойства атомов и периодическое
изменение свойств химических
элементов.
2.
Зачем нам это нужно?1) Знать практическое значение химии
применительно к специальности.
2) Применять химические знания в
специальных дисциплинах.
3.
Работа по дисциплине1. Изучение теоретического материала на
лекционных и практических занятиях.
2. Применение теоретического материала на
практических и лабораторных занятиях.
3. Выполнение ДЗ и КР (в каждом семестре
по ДВА ДЗ и по одной КР).
4.
• Химия – наука о веществах, их свойствах ипревращениях.
• Каждое вещество обладает определённым
набором химических свойств. Они
определяются участием вещества в
химических реакциях. Химия изучает
законы и принципы, описывающие
превращения, а также представления и
теории, позволяющие дать объяснения
превращениям.
5.
Научные методы, применяемые в химии:• Факты → закономерности, теории
(индукция)
• Теория → применение (дедукция).
Химические свойства веществ отличаются от
физических.
Химические свойства не зависят
от агрегатного состояния, (а физические –
зависят).
6.
Все химические вещества состоят из частиц:простые частицы называются - атомами, а
сложные – молекулами.
атом→ Н2О ←атом
↑
Молекула
7.
Многочисленные химические соединениясостоят из атомов и называются молекулами.
Способность атомов вступать друг с
другом в контакт и образовывать молекулы
обусловлена особенным строением самого
атома.
8.
АТОМАтом – наименьшая химическая частица вещества. При
разрушении он распадается на физические частицы: протон (р+),
нейтрон (no), электрон(е-). Атом электронейтрален.
Определенный вид атомов называется химическим элементом.
Каждый элемент имеет своё название и свой символ.
N - азот
Ag - серебро
Fe - железо
H - водород
O - кислород
C - углерод
Au – золото
Hg – ртуть
и другие.
Атомы элемента должны иметь один и тот же состав – число
протонов, нейтронов, электронов.
9.
Известные и безвестныеученые, занимавшиеся изучением строения
атома
• 1897 год – Дж. Томсон открыл электрон;
• 1900 год – М.Планк высказал предположение, что
вещества поглощают и излучают энергию
порциями (квантами);
• 1904 год – Дж. Томсон модель строения атома: в
положительной сфере вкраплены электроны
(булочка с изюмом);
• 1909 год – Р.Малликен определил заряд
электрона;
10.
• 1910 год – Э.Резерфорд установил строениеатома: в центре атома находится ядро,
окружённое электронами;
• 1910 год – Н.Бор в соответствии с опытами
Э.Резерфорда и предположением М.Планка,
предложил новую модель строения атома
(разрешенные орбиты);
• 1924 год – Луи де Бройль выдвинул
предположение, что электрон характеризуется
корпускулярно-волновым дуализмом;
11.
• 1925 год – П. Паули постулировал принципзапрета;
• 1926 год – Э.Шредингер вывел уравнение,
описывающее поведение электрона в
атоме;
• 1927 год – В.Гейзенберг постулировал
принцип неопределённости.
12.
Косвенные свидетельства сложности строения атомовхимических элементов
Электролитическая диссоциация
Электролиз
Фотоэффект
Естественная радиоактивность (Беккерель, 1896 г, засвечивание
фотопластинки солями урана)
Ионизация газов, спектры испускания атомов
Свечение флуоресцирующих веществ, рентгеновское излучение
Анри Беккерель (1852-1908)
Пьер (1859–1906) и Мария (1867–1934) Кюри
13.
Английский физик Эрнст Резерфорд открыл - и -излучениекороткоживущих изотопов радона и множество других изотопов. Объяснил
радиоактивность тория, открыл и объяснил радио-активное превращение
химических элементов, создал теорию радиоактивного распада, обнаружил
протон. Доказал, что -частица — ядро гелия. Поставив опыт по рассеянию
-частиц на металлической фольге, сделал вывод о существовании в атоме
массивного ядра. Предложил планетарную модель атома. Открыл
образование новых химических элементов при распаде тяжелых
радиоактивных элементов.
Эрнст Резерфорд (1871-1937)
14.
В 1913 г. Роберт Милликен измерил значение заряда электрона e =(4,774 ± 0,009)·10–10 эл. ед. Полученное значение продержалось более 70
лет. Лишь недавно с помощью новейшей высокочувствительной
аппаратуры определили новое значение заряда электрона е = 4,80298·10–10
эл. ед.
Генри Мозли установил зависимость между частотой спектральных
линий рентгеновского излучения и атомным номером элемента. Это
открытие позволило установить зависимость между порядковым номером
элемента и зарядом его ядра.
Роберт Милликен (1868-1953)
Генри Мозли (1887-1915)
15.
В 1913 г. Нильс Бор опубликовал серию статей«О строении атомов и молекул», открывших
путь к атомной квантовой механике.
16.
Попытки детально изучить излучение раскалённоготела привели к открытию спектров излучения.
Максом Планком было показано, что энергия
излучения испускается порциями (квантами)
Е = hν = hc/λ,
h = 6,626.10-27 эрг.с - постоянная Планка.
Было установлено два вида спектров:
сплошные - тепловые
линейчатые - набор линий, уникальный
для любого элемента. Этот спектр возникает в
результате процессов внутри атома.
Следовательно, атом должен иметь структуру!
Причем, электрон – мобильная частица, способная
уходить из атома возвращаться обратно.
17.
Итоги изучения спектров атомовПоявились постулаты Бора.
I
В атоме существуют орбиты, вращаясь по
которым е- не излучает и не поглощает
энергию.
II
Излучение происходит только при
перескоке е- с одной орбиты на другую.
hν = ∆E – формула Эйнштейна
∆E – энергия, которая тратится на отрыв
электрона и на его разгон. Или:
∆E = Е2 – Е1
18.
Классическая модель строения атома
В 1913 году Нильс Бор предложил квантовую модель строения
атома. В атоме Бора электроны вращаются вокруг ядра по
кольцевым орбитам. Основное отличие модели Бора от
предыдущих моделей в двух постулатах.
Квантовые постулаты Бора
Атомная система может находиться только в некоторых
стационарных состояниях, в которых энергия электрона остается
постоянной (не происходит излучения).
При переходе электрона из состояния Еm в состояние Еn
излучается или поглощается квант, частота которого
определяется уравнением Е = h , где h – постоянная Планка,
равная 6,62.10 34 Дж.с.
Таким образом, движение электрона в атоме нельзя описать
законами классической механики. Кроме того, электроны наряду
со свойствами материальных частиц проявляют волновые
свойства, что подтверждают опыты по дифракции электронов при
прохождении через кристаллы.
19.
20.
Планетарная модель атома21.
22.
Двойственность свойств частицФранцузский ученый Луи де Бройль
(1892—1987), развивая представления о
двойственной корпускулярно-волновой
природе света, выдвинул в 1923 году
гипотезу об ее универсальности.
23.
Принцип неопределённостиСогласно де Бройлю, с каждым
микрообъектом связываются, с одной
стороны, корпускулярные
характеристики — энергия E и импульс P, а
с другой стороны — волновые
характеристики — частота и длина волны
.
24.
Уравнение Шрёдингераd ψ d ψ d ψ 8π m
(
EU
)
ψ
0
2
2
2
dx
dy
dz
h
2
2
2
2
Уравнение описывает движение микрочастиц, проявляющих волновые
свойства, которое связало энергию, координаты и волновую функцию ,
квадрат которой пропорционален вероятности нахождения электрона в
некотором объеме пространства, окружающего точку с координатами x, y и z.
25.
Квантовые числа, характеризующиеэлектроны в атоме
• Главное квантовое число (n) – характеризует энергию электрона в
атоме, принимает значения 1, 2, 3 … . Используются буквенные
символы K, L, M, N и т. д.
Орбитальное квантовое число (l) характеризует орбитальный
момент количества движения электрона в атоме (форму орбита-ли),
принимает значения 0, 1, 2 … (n-1), всего n значений для дан-ного n.
Используются буквенные символы s, p, d, f, g.
Магнитное квантовое число (ml) характеризует расположение
орбитали в пространстве, принимает значения –l …0 …+l, всего 2l+1
значений для данного l.
Спиновое квантовое число (ms) характеризует собственный
магнитный момент электрона, принимает значения ½.
26.
Квантовые числаn – главное квантовое число, имеющее числовые значения от 1 до ∞.
Характеризует энергию квантовой орбиты, удалённость от ядра, размер атома
или орбитали, указывает на номер периода в таблице элементов.
l - орбитальное квантовое число, имеющее числовые значения от 0 до (n-1).
Характеризует энергию квантового подуровня, форму пространства
(орбитали), занимаемого электроном. Вместо числовых значений обычно
используются соответствующие буквенные обозначения, которыми
обозначались линии спектров:
0–s
1 -p
2 - d 3 - f и др.
ml - магнитное квантовое число, имеющее числовые значения от (-1) до (+1).
Характеризует энергию ориентации орбитали в пространстве около ядра,
указывает на количество (2 l + 1) орбиталей одной формы и одного размера
ms (s) – спиновое квантовое число (спин электрона), имеющее числовые
значения (-1/2) и (+ 1/2) или соответствующие графические обозначения (↑)
и (↓). Характеризует собственный момент вращения электрона:
(↑) - по часовой стрелке, или (↓) - против часовой стрелки.
27.
28.
Электронные орбитали29.
30.
Планетарная модель атома:Чем дальше от ядра, тем
меньше становится разница
между уровнями и
подуровнями!!!!!!!
Проскок электрона!
31.
Электронная структура атомаПринцип наименьшей энергии!
Принцип Паули!
Правило Гунда (Хунда)!
Правила КЛЕЧКОВСКОГО!
32.
Принцип наименьшей энергииЭлектроны в основном состоянии заполняют
орбитали в порядке повышения уровня
энергии орбиталей.
33.
Принцип ПаулиВ атоме не может быть двух электронов ,
обладающих одинаковым набором
квантовых чисел.
То есть, на каждой орбитали может
находиться не более ДВУХ электронов,
характеризующихся противоположными
(антипараллельными) спинами.
34.
Принцип Паули35.
Правило ГундаЗаполнение орбиталей одного подуровня в
основном состоянии начинается
одиночными электронами с одинаковым
значением спинового квантового числа.
36.
Правило Гунда37.
Правила Клечковского1) Возрастание энергии уровней и,
соответственно, заполнение орбиталей
происходит в порядке возрастания суммы
квантовых чисел n+l.
2) Если сумма n+l имеет одинаковое значение
при различных слагаемых, то заполнение
орбиталей происходит в порядке возрастания
n.
38.
Правило Клечковского (2)39.
Правила КлечковскогоДля второго правила возможны исключения
для d и f подуровней с наполовину или
полностью заполненными подуровнями –
ПРОСКОК электрона!!!
40.
Электронная формуламногоэлектронного атома
41.
№ Символn
l
ms
s
n+l
Электронная конфигурация
73
Ta
5
2
0
+½
7
1s22s22p63s23p64s23d104p65s24d105p66s24f145d3
74
W
5
2
+1
+½
7
1s22s22p63s23p64s23d104p65s24d105p66s24f145d4
75
Re
5
2
+2
+½
7
1s22s22p63s23p64s23d104p65s24d105p66s24f145d5
76
Os
5
2
-2
-½
7
1s22s22p63s23p64s23d104p65s24d105p66s24f145d6
77
Ir
5
2
-1
-½
7
1s22s22p63s23p64s23d104p65s24d105p66s24f145d7
78
Pt
5
2
0
-½
7
1s22s22p63s23p64s23d104p65s24d105p66s24f145d8
79
Au
5
2
+1
-½
7
1s22s22p63s23p64s23d104p65s24d105p66s24f145d9
80
Hg
5
2
+2
-½
7
1s22s22p63s23p64s23d104p65s24d105p66s24f145d10
41
42.
Валентные электроны43.
Свойства атомовТак как электронное строение атомов
меняется периодически, то соответственно
периодически меняются свойства атомов:
- размер (радиус);
- энергия (потенциал) ионизации;
- энергия сродства к электрону;
- электроотрицательность;
- металличность (неметалличность);
- окислительно-восстановительные свойства.
44.
4445.
Энергия ионизации - это энергия, которую нужно затратить,чтобы удалить из атома электрон.
Если удалять не один электрон, а несколько,
то делать это придётся постепенно. Тогда для
удаления каждого следующего электрона
потребуется своё энергетическое усилие,
более мощное, чем предыдущее.
Удалять непарные электроны легче, чем
разрушать пару.
46.
4647.
Энергия сродства к электрону - это энергия, которая выделяется приприсоединении электрона к атому с
образованием аниона.
48.
Зависимость сродства к электрону атомаот атомного номера элемента
48
49.
Электроотрицательность - это способность атома прочно удерживатьсвои электроны и, по возможности,
присоединить к себе чужие.
Благодаря электроотрицательности
можем оценить степень окисления (то есть
условный заряд, возникающий при
частичном перетягивании одним из атомов
валентных электронов другого атома)
атомов в их соединениях друг с другом.
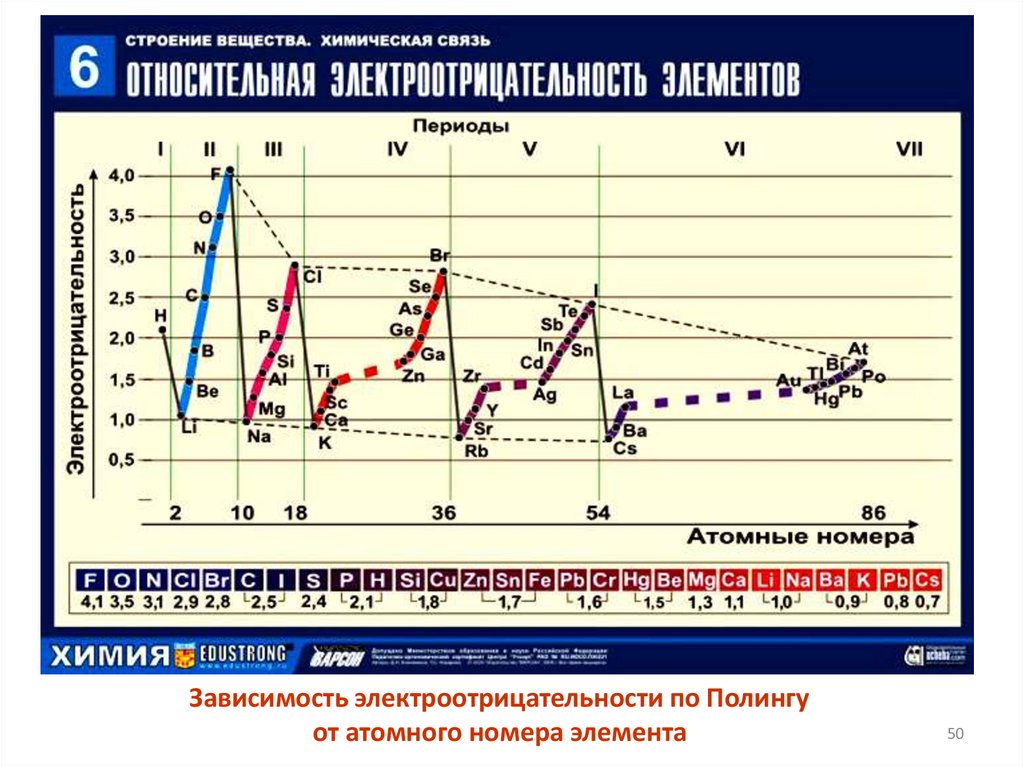
50.
Зависимость электроотрицательности по Полингуот атомного номера элемента
50
51.
Свойства атома-nē
катион (+n)
+nē
анион (-n)
Атом
52.
Валентность (ковалентность) –свойство атомов одного элемента
присоединять к себе какое-либо число
атомов другого элемента. Валентность
бывает по водороду, кислороду,
положительная или отрицательная (степень
окисления), высшая (максимальная или
характеристичная, равная номеру группы в
таблице элементов). Обычно валентность
оценивают по числу непарных электронов в
атоме.
53.
В 1829 году немецкий химик Иоганн Вольфганг Деберейнер предпринялпервую попытку систематизации химических элементов. Он заметил, что
некоторые сходные по своим свойствам элементы можно объединить по
три в группы, которые он назвал триадами
Li Ca P S Cl
Na Sr As Se Br
K Ba Sb Te I
Атомная масса среднего элемента триады близка к полусумме
(среднему арифметическому) атомных масс двух крайних элементов
триады.
53
54.
Джон Ньюлендс сделал попытку сопоставить химические свойства элементов с ихатомными массами. Расположив элементы в порядке возрастания атомных масс,
Ньюлендс заметил, что сходство в свойствах проявляется между каждым восьмым
элементом. Найденную закономерность Ньюлендс назвал законом октав по
аналогии с семью интервалами музыкальной гаммы.
54
55.
Периодический закон Д. И. МенделееваПериодический закон Д. И. Менделеева — фундаментальный закон,
устанавливающий периодическое изменение свойств химических
элементов в зависимости от зарядов ядер их атомов. Открыт в марте 1869
года при сопоставлении свойств известных в то время элементов и величин
атомных масс. Термин «периодический закон» Д. И. Менделеев впервые
употребил в ноябре 1870 года, а в октябре 1871 года дал формулировку
Периодического закона: «свойства простых тел, а также формы и свойства
соединений элементов, а потому и свойства образуе-мых ими простых и
сложных тел, находятся в периодической зависимости от их атомного
веса». Графическим (табличным) выражением периодического закона
является разработанная Менделеевым периодическая система элементов.
Современная формулировка Периодического закона: «свой-ства
простых веществ, а также формы и свойства соединений элементов
находятся в периодической зависимости от зарядов ядер атомов
элементов».
55
56.
В рамках квантовой теории атомабыло доказано, что, по мере
возрастания Z (заряд ядра),
периодически повторяется
строение внешних электронных
оболочек атомов, что
непосредственно и обусловливает
специфику химических свойств
элементов.
57.
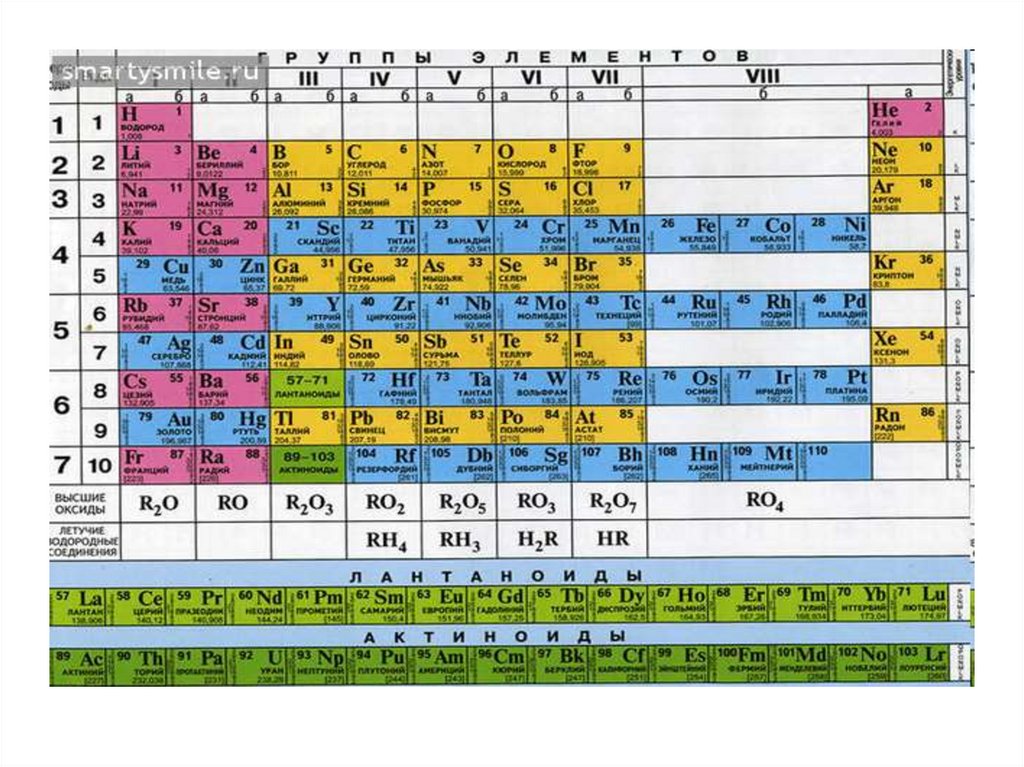
Рассмотрим Периодическуюсистему элементов.
Современная периодическая система
элементов охватывает более 110
химических элементов;
из них все трансурановые
(Z = 93-110), а также элементы с Z = 43
(Tc), 61 (Pm), 85 (At) и 87 (Fr) получены
искусственно.
58.
59.
60.
http://www.ptable.com/ - динамическая ПСЭ61.
Фундаментальнымпринципом построения
периодической системы
является
разделение всех
химических элементов на
группы и периоды.
62.
Периодическая системаэлементов состоит из
8 групп и
7 периодов (седьмой пока не
завершен).
63.
Периодом называется совокупностьэлементов, начинающаяся
щелочным металлом и
заканчивающаяся инертным
газом (особый случай - первый
период); каждый период содержит
строго определённое число
элементов.
64.
Классическая редакция Периодическойсистемы элементов короткой формы была
отменена IUPAC в 1989 году.
Взамен была принята Периодическая система
элементов длинной формы. Где все периоды
отображены горизонтальными строками. 6-ой и 7ой периоды расчленены на 2 части. Причём,
вторые части, содержащие по 14 f-элементов и по
1 d-элементу вынесены из периодов в подвал
таблицы.
































































 chemistry
chemistry








