Similar presentations:
Молекулярная физика
1. Молекулярная физика
ГПОУ ТО "НТК"
Преподаватель физики:
Бондарчук Т.В.
2.
Молекулярная физика – раздел физики, вкотором изучаются физические свойства тел в
различных агрегатных состояниях на основе
рассмотрения их молекулярного строения,
силы взаимодействия между частицами,
образующими тела и характеры теплового
движения этих частиц.
3.
Все состоит из атомов…Вещи отличаются друг от
друга атомами, из
которых состоят, их
порядком и
положением…
Греческий ученый Демокрит
(460 — 370 г.г. до н.э.)
4.
Молекулярная кинетическаятеория (МКТ) - учение, которое
объясняет строение и свойства тел
движением и взаимодействием
частиц, из которых состоят тела.
5. Основные положения МКТ и их опытное обоснование
6. 1. Вещество состоит из частиц (молекул, атомов, ионов), разделенных промежутками.
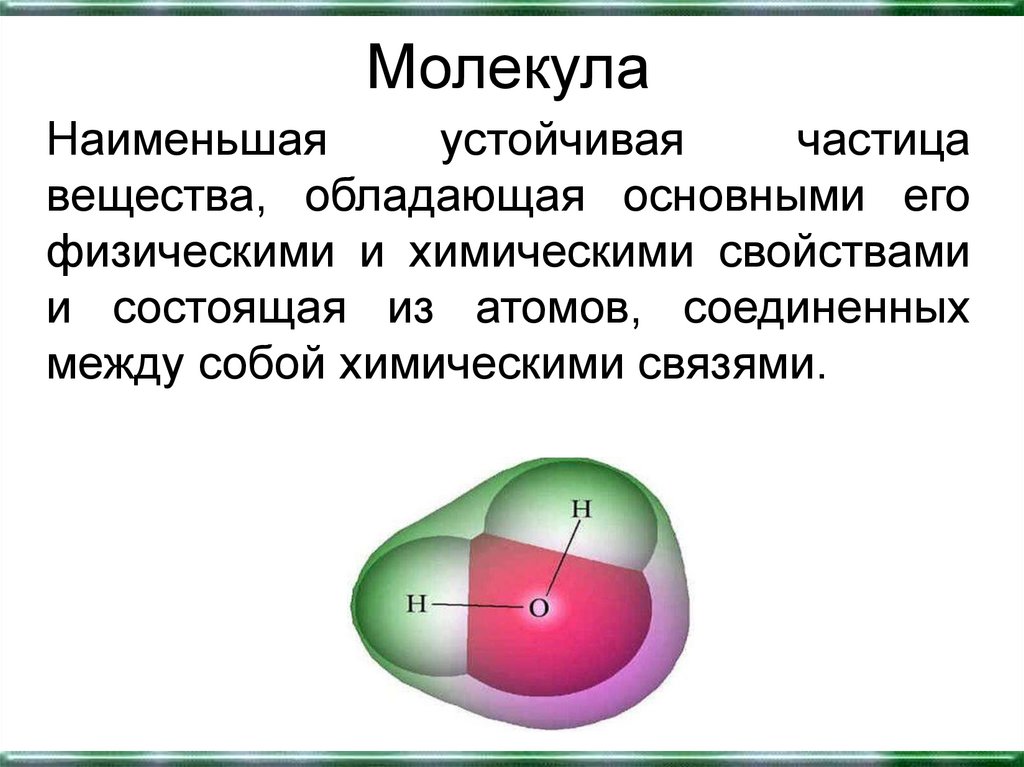
7. Молекула
Наименьшаяустойчивая
частица
вещества, обладающая основными его
физическими и химическими свойствами
и состоящая из атомов, соединенных
между собой химическими связями.
8. Атом
Наименьшаячастица
химического
элемента, являющаяся носителем его
свойств.
9. Опытные обоснования
Дробление веществ
Испарение
Расширение и сжатие при изменении
температуры или деформации
10. Опытные обоснования
Фотографии отдельных больших молекул
Определение параметров молекул (d, m, v...)
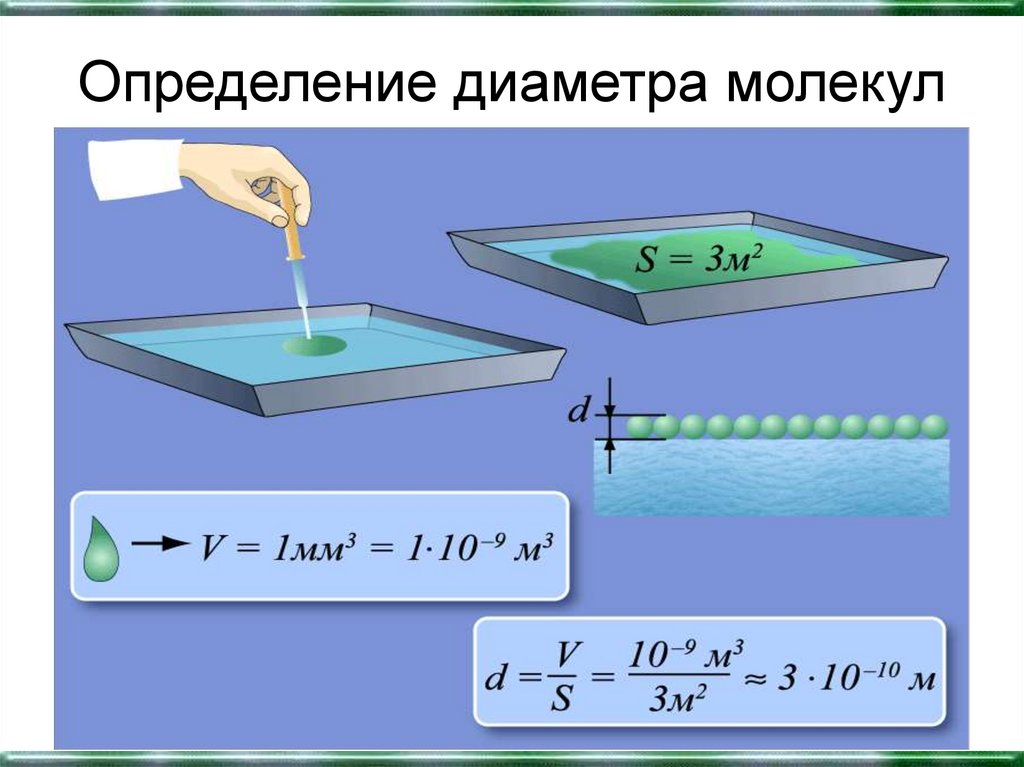
11. Определение диаметра молекул
12. Физические величины, характеризующие молекулы:
Относительная молекулярная
масса
Количество вещества
Молярная масса
13. 1. Относительная молекулярная масса
Относительноймолекулярной (или
атомной) массой вещества
Мr называют отношение
массы молекулы (или
атома) mo данного
вещества к 1/12 массы
атома углерода moc:
Относительные молекулярные
массы определяют по таблице
Менделеева.
Например:
Мr(CO2) = 12 + 2 ∙ 16 = 44
mo
Mr
1
moc
12
Мr(Н2О) = 2 ∙ 1 + 16 = 18
14. 2. Количество вещества
Количество вещества– это физическая
величина равная
отношению числа
молекул N в данном
теле к постоянной
Авогадро NА, т.е. к
числу молекул в 1 моль
вещества:
N
.
NA
Единица количества
вещества – 1 моль.
Один моль – это количество
вещества, в котором
содержится столько же
молекул или атомов,
сколько атомов содержится
в 12 г углерода.
Постоянная Авогадро – число
атомов в 1 моль вещества
или в 12 г углерода:
NA ≈ 6 ∙ 1023 моль-1
15. 3. Молярная масса
Молярная масса М –это масса вещества,
взятого в количестве 1
моль.
Молярная масса равна
произведению массы
молекулы на
постоянную Авогадро:
М mo N A.
Единица измерения
молярной массы в “СИ” –
кг/моль.
Связь молярной массы с
молекулярной:
М = 10-3 Мr кг/моль
Например:
М(CO2) = 44∙10-3 кг/моль.
М(Н2О) = 18 ∙10-3 кг/моль.
16. Другие формулы
m m0 N V
m
Количество вещества:
M
m
Число молекул:
N N A N A
M
Масса вещества:
m
Плотность:
nm0
V
N
Концентрация: n
V M
m0
Масса молекулы:
NA
17. 2. Частицы находятся в непрерывном хаотическом движении
18. Опытные обоснования
19. Броуновское движение
1827 г. - английский
ботаник Р. Броун,
рассматривая в
микроскоп, заметил,
что взвешенные в
воде частицы
цветочной пыльцы
непрерывно и
хаотично движутся.
20.
1905-1906 г. Эйнштейн создал
теорию
броуновского
движения
21.
1908 -1913 г. Ж. Перрен
экспериментально
проверил теорию.
Ж. Перрен —
нобелевский
лауреат по физике
22.
Броуновское движение — это тепловоедвижение взвешенных в жидкости (или газе)
частиц.
23. Причина броуновского движения
На рисунке изображена модельброуновского движения.
Множеством мелких шариков
обозначены молекулы воды, а
большим шаром – частица
пыльцы. Количество ударов
молекул о частицу слева и
справа, сверху и снизу,
спереди и сзади не всегда
одинаково. Под действием
"перевеса"
ударов с какой-нибудь одной
стороны частица будет
перескакивать с места на
24. Диффузия
Диффузией называют взаимноепроникновение частиц одного вещества в
другое, обусловленное движением молекул.
25.
При проведении опыта с водой и краскойзамечено, что в теплой комнате диффузия
протекает значительно быстрее. Например,
на солнечном подоконнике диффузия
завершается примерно на неделю раньше.
26.
Причина диффузии – это самостоятельное
движение частиц вещества.
Ускорение диффузии можно объяснить тем,
что повышение температуры тела приводит к
увеличению скорости движения его частиц.
При любой температуре наблюдается
самостоятельное движение частиц всех
веществ – твердых, жидких и газообразных.
27. Определение скоростей молекул
В начале 20 века
немецкий физик
Отто Штерн
выполнил первые
измерения
скоростей молекул.
28. Установка для проведения опытов по измерению скоростей молекул
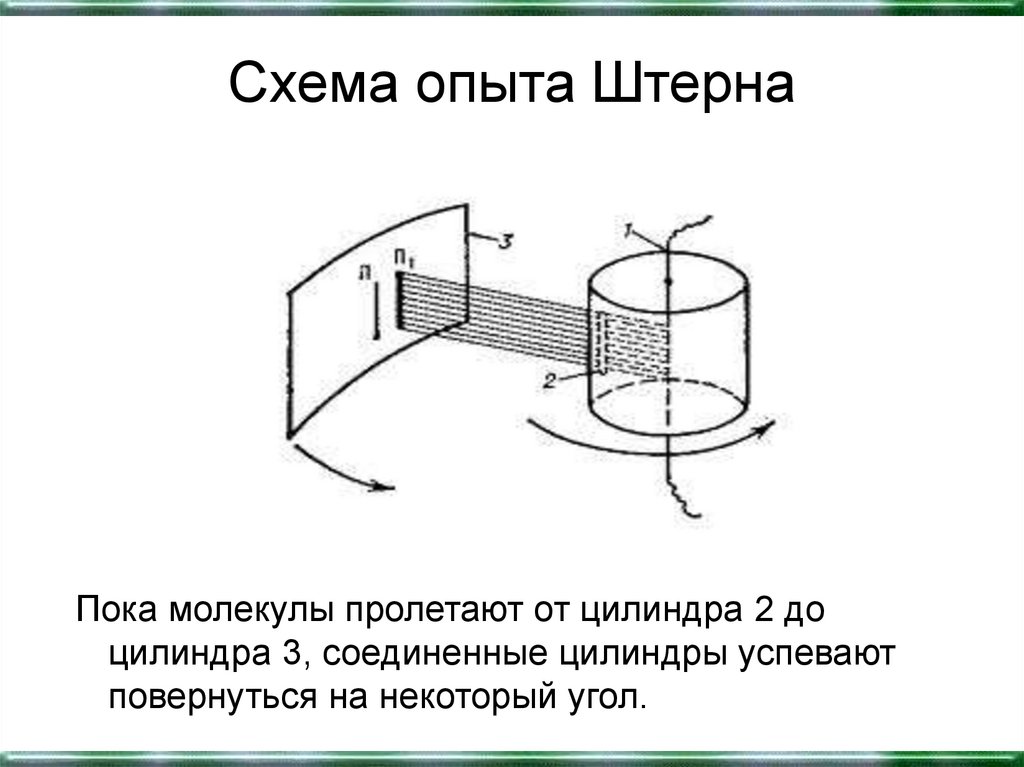
29. Схема опыта Штерна
Пока молекулы пролетают от цилиндра 2 доцилиндра 3, соединенные цилиндры успевают
повернуться на некоторый угол.
30. 3. Частицы взаимодействуют друг с другом
31. Опытные обоснования
32. Опыт с цилиндрами
Возьмем два свинцовых цилиндрика. Ножом илилезвием зачистим их торцы до блеска и плотно
прижмем друг к другу. Мы обнаружим, что
цилиндрики "сцепятся". Сила их сцепления
настолько велика, что при удачном проведении
опыта цилиндрики выдерживают тяжесть гири в 5
кг.
33. Из опыта следует вывод:
частицы веществ способныпритягиваться друг к другу.
Однако это притяжение возникает лишь
тогда, когда поверхности тел очень гладкие
(для этого и понадобилась зачистка
лезвием) и, кроме того, плотно прижаты друг
к другу.
34. Опыт с резиновым ластиком
Чтобы сдавить резиновый ластик, требуется
значительная сила! Ластик гораздо легче
изогнуть, чем сдавить.
35. Из опыта следует вывод:
частицы веществ способныотталкиваться друг от друга.
Жидкие, а особенно твердые тела очень
трудно сжать.
Притяжение или отталкивание частиц
веществ возникает лишь в том случае, если
они находятся в непосредственной близости.
36. Природа взаимодействия молекул
Взаимодействие молекул имеет
электрическую природу.
Молекулы в целом электрически
нейтральны.
Распределение положительных и
отрицательных электрических зарядов в них
таково, что на расстояниях, чуть больших
размеров самих частиц, они
притягиваются. На расстояниях, меньших
размеров частиц, они отталкиваются.
37. Решите задачи.
1.Какова молярная масса серной кислоты (Н2SO4)? этилового
спирта (С2Н5ОН)?
2.
Сколько молекул в двух молях воды?
3.
Чему равно количество вещества в литре воды?
4.
Какова масса 4 моль кислорода (О2)?
5.
Сколько молекул содержится в 1 кг водорода (Н2)?
6.
7.
8.
Рассчитайте массу молекулы кислорода.
Какое количество вещества содержится в алюминиевой
отливке массой 5,4 кг?
Сколько молекул содержится в 5 м3 олова? Плотность
олова 7300 кг/м3.


































 physics
physics








