Similar presentations:
Классификация и номенклатура неорганических веществ
1.
Классификация иноменклатура неорганических
веществ
Басова Инна Николаевна,
учитель химии и биологии
высшей квалификационной категории,
МБОУ «Средняя общеобразовательная
школа № 48 имени Р.М.Каменева»
Курск 2023
2.
Цель урока: обобщить сведения о классификациивеществ, составе основных классов сложных
неорганических веществ, закрепить знания, умения и
навыки классифицировать неорганические вещества.
Задачи:
применение обобщения знаний, умений и навыков в
новых условиях – создание проблемной ситуации;
уметь
устанавливать существенные признаки,
являющиеся основой различных классификаций;
уметь устанавливать причинно-следственные связи
между «составом», «химическими свойствами»,
«классом вещества».
3.
1.2.
3.
4.
5.
6.
7.
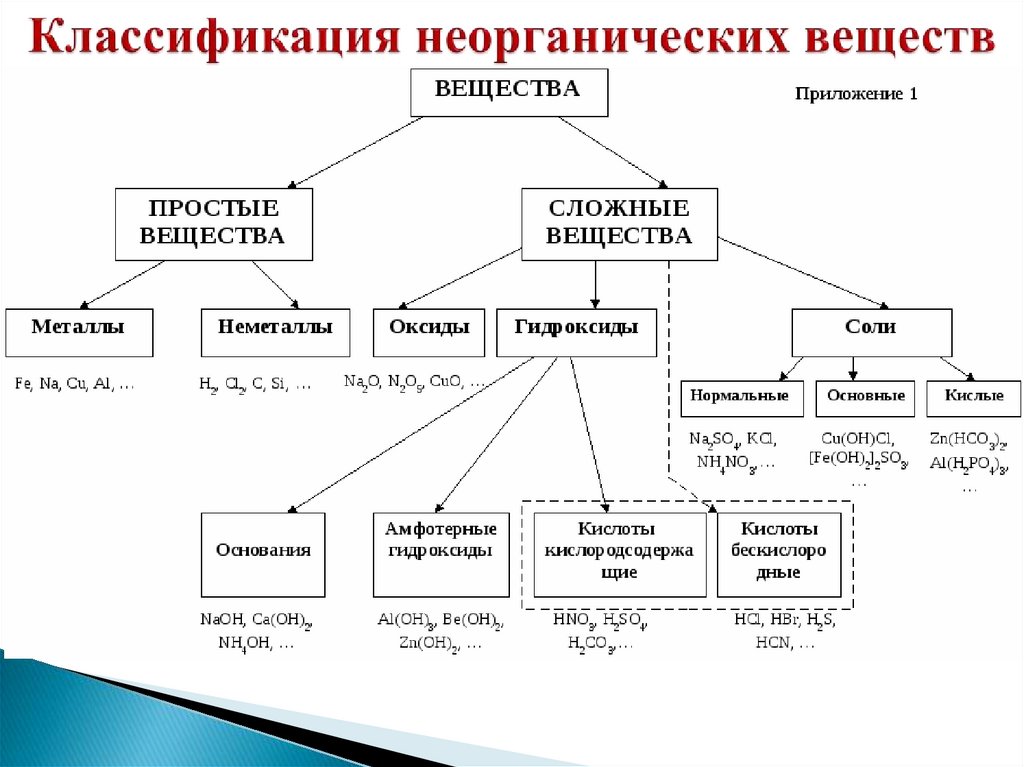
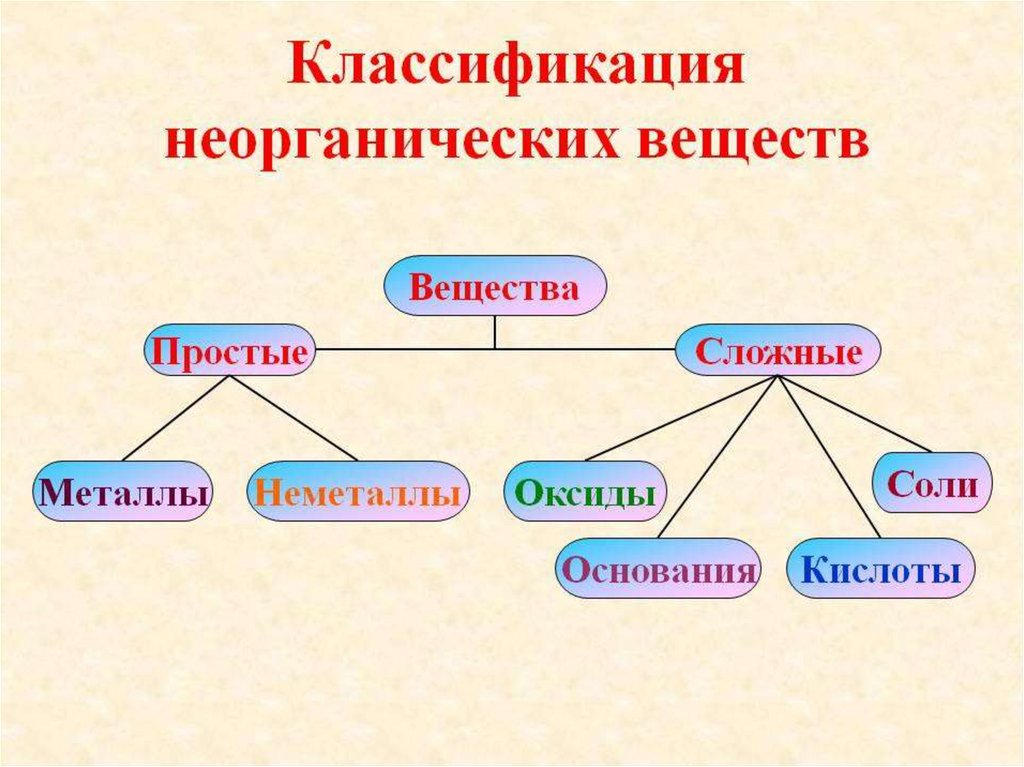
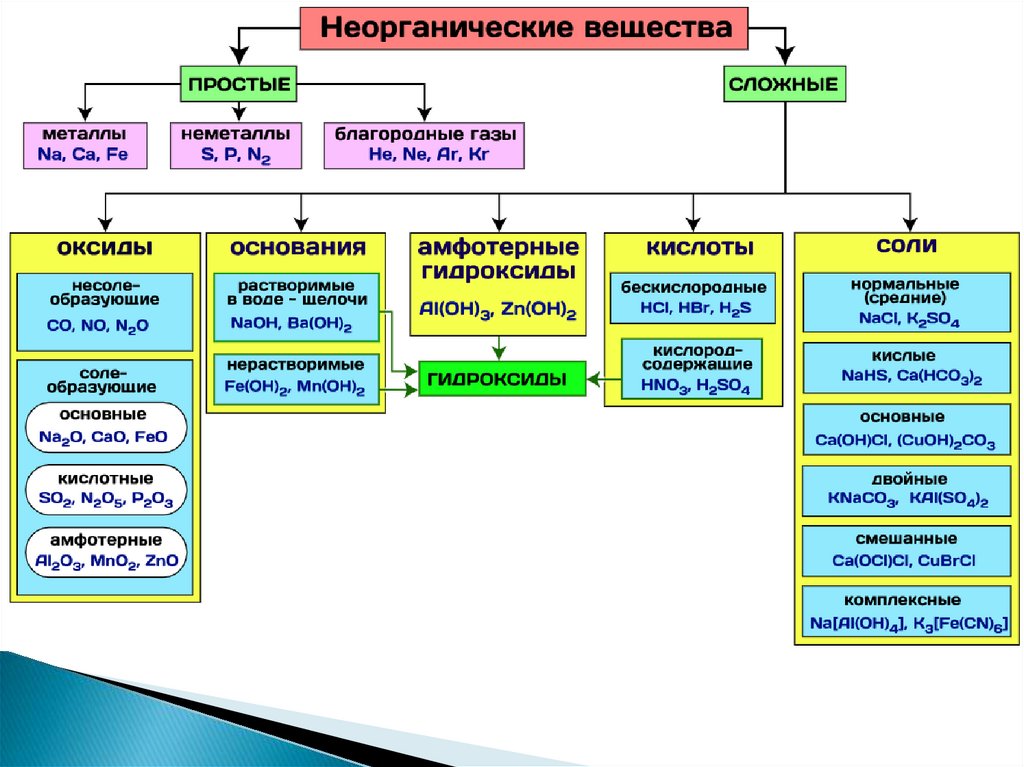
Классификация неорганических веществ.
Металлы и неметаллы.
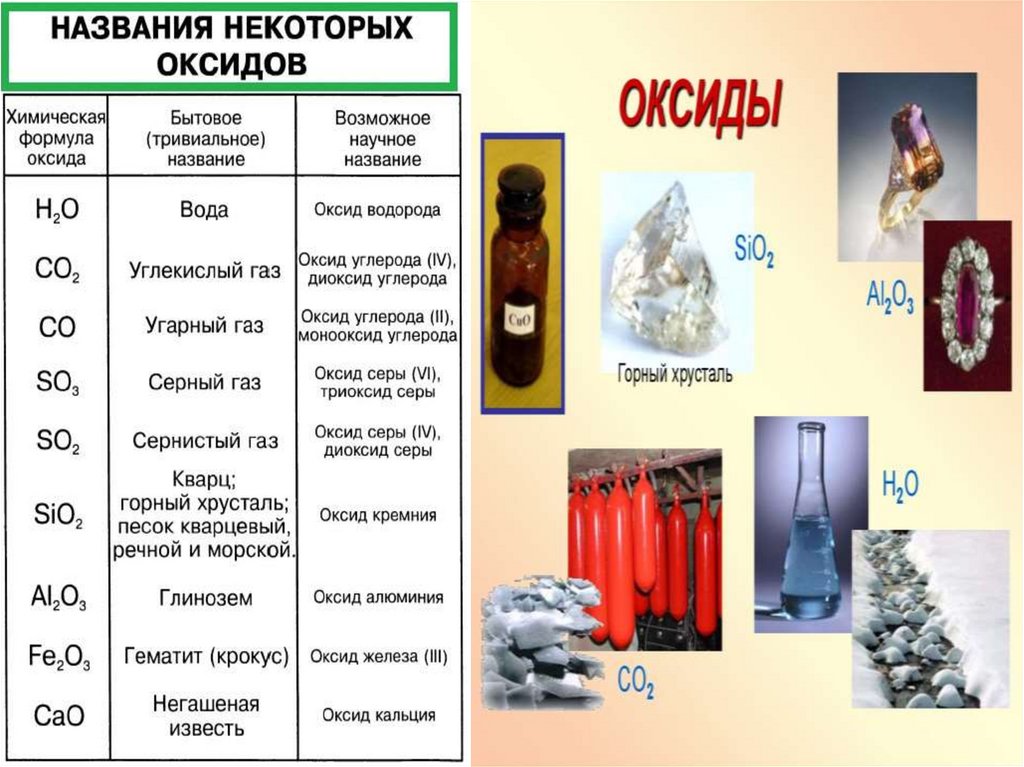
Оксиды. Их классификация и номенклатура.
Основания и их классификация.
Кислоты и их классификация.
Соли. Классификация солей. Номенклатура
солей.
Бытовые названия некоторых солей
4.
5.
Металлы – простые вещества, в которыхатомы связаны между собой
металлической связью.
Неметаллы – простые вещества, в
которых атомы связаны между собой
ковалентными (или
межмолекулярными) связями.
6.
По химическим свойствам среди металловвыделяют группу так называемых
амфотерных металлов.
Это название отражает способность этих
металлов, их оксидов и гидроксидов
реагировать как с кислотами, так и со
щелочами.
Цинк, алюминий, хром, марганец, железо.
7.
8.
9.
10.
11.
12.
13.
14.
15.
Основным оксидам соответствуютоснования
Амфотерным оксидам – амфотерные
гидроксиды
Кислотным оксидам –
кислородсодержащие кислоты.
16.
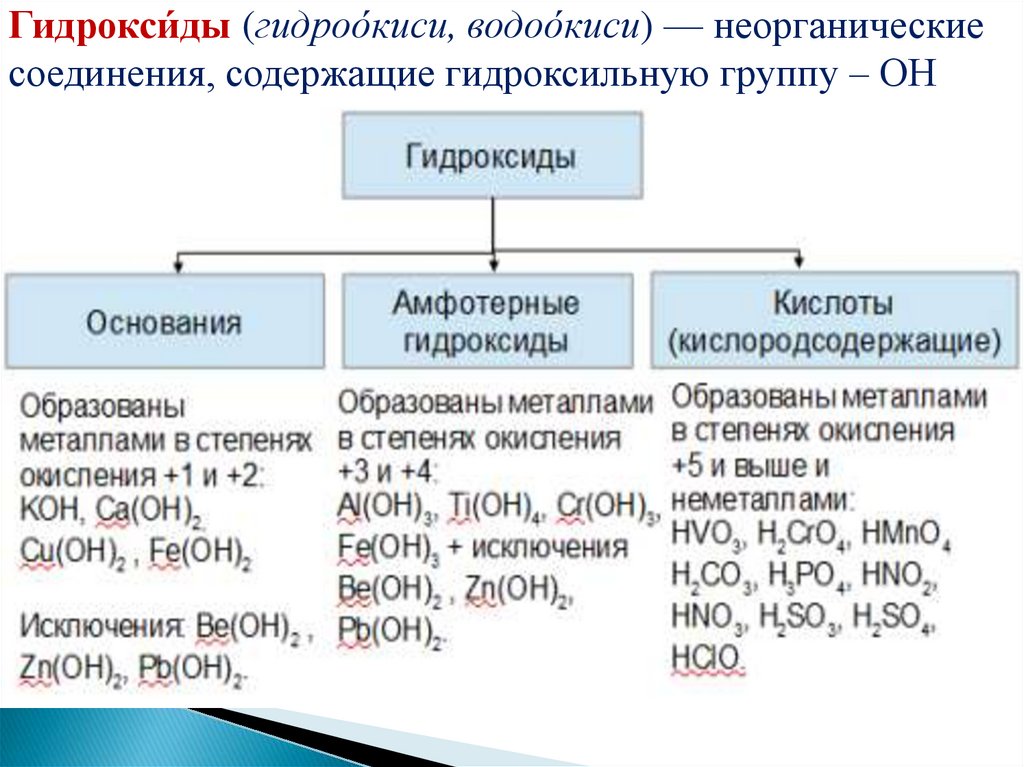
Гидроксиды – соединения, в составкоторых входит группа Э–О-Н.
И основания, и кислородсодержащие
кислоты, и амфотерные гидроксиды
– относятся к ГИДРОКСИДАМ!
17.
Гидрокси́ды (гидроо́киси, водоо́киси) — неорганическиесоединения, содержащие гидроксильную группу – ОН
18.
Основания – сложные вещества, молекулыкоторых состоят из атомов металлов и
гидроксо-групп – ОН ,
Общая формула Ме(ОН)n,
n- число гидроксо-групп.
По современной номенклатуре их принято
называть гидроксидами элементов с
указанием степени окисления:
NaOH – гидроксид натрия,
КОН – гидроксид калия,
Сu(OH)2 – гидроксид меди (II).
19.
20.
НерастворимыеРастворимые (Щелочи)
1) гидроксиды металлов первой
Все остальные
группы главной подгруппы: LiOH,
гидроксиды
NaOH, KOH, RbOH, CsOH
металлов.
2) гидроксиды металлов второй
группы главной подгруппы, начиная
с кальция:
Ca(OH)2, Sr(OH)2, Ba(OH)2
21.
Кислоты – сложные вещества,содержащие в своем составе ионы
оксония Н+ или при
взаимодействии с водой
образующие в качестве катионов
только эти ионы.
Общая формула: Н кислотный остаток
22.
Кислородсодержащие кислоты1) высшие кислоты
H2SO4 – серная кислота
HNO3 – азотная кислота
H3PO4 – фосфорная кислота
H2CO3 – угольная кислота
H2SiO3 – кремниевая кислота
2) кислоты с меньшей степенью
окисления неметалла
H2SO3 – сернистая кислота
HNO2 – азотистая кислота
Бескислородные кислоты
HF – фтороводородная кислота
(плавиковая)
HCl – хлороводородная кислота
(соляная кислота)
HBr – бромоводородная кислота
HI – иодоводородная кислота
H2S – сероводородная кислота
23.
ОдноосновныеДвухосновные
HNO3 азотная
H2SO4 серная
HF фтороводородная
H2SO3 сернистая
HCl хлороводородная H2S сероводородная
HBr бромоводородная H2CO3 угольная
HI иодоводородная
H2SiO3 кремниевая
Трехосновные
H3PO4 фосфорная
24.
Сильные кислотыHI - иодоводородная
HBr -бромоводородная
HCl -хлороводородная
H2SO4 -серная
HNO3 -азотная
HClO4 -хлорная
Слабые кислоты
HF – фтороводородная
H3PO4 – фосфорная
HNO2 – азотистая (неустойчивая)
H2SO3 – сернистая (неустойчивая)
H2CO3 – угольная (неустойчивая)
H2S↑- сероводородная
H2SiO3↓- кремниевая
СН3СООН - уксусная
25.
Соли – это сложные вещества, состоящиеиз одного (нескольких) атомов металла
(или более сложных катионных групп,
например, аммонийных групп NН4+) и
одного (или нескольких) кислотных
остатков.
Общая формула: Ме кислотный остаток
26.
СОЛИСредние
Кислые
Основные
Двойные
Продукт
Продукт
Продукт Содержат два
полного
непол-ного непол-ного разных
замещения замещения заме-щения металла и
атомов
атомов
ОН-групп один
водорода в водоро-да в
на
кислотный
кислоте на кислоте на кислотный остаток
металл
металл
остаток
AlCl3
КHSO4
FeOHCl
Хлорид Гидросульфа Хлорид
алюминия
т калия
гидроксоже
леза (II)
Смешанные
Комплексные
Содержат один
Содержат
металл и два
комплексный
кислотных
катион или анион
остатка
– атом металла,
связанный с
несколькими
лигандами.
KAl(SO4)2
CaClBr
K2[Zn(OH)4]
Сульфат
алюминиякалия
Хлоридбромид
кальция
Тетрагидроксоцин
кат калия
27.
В названиях солей используются латинскиеназвания образующих кислоты неметаллов
Элемент Латинское название
Корень
Н
гидрогениум
ГИДР-
С
карбоникум
КАРБ-
N
нитрогениум
НИТР-
S
сульфур
СУЛЬФ-
28.
Соль какой кислотыАзотная HNO3
Кислотный Название солей
Примеры
остаток
NO3нитраты
Ca(NO3)2 нитрат кальция
SiO32-
силикаты
Na2SiO3 силикат натрия
Угольная H2CO3
CO32-
карбонаты
Na2CO3 карбонат натрия
Фосфорная H3PO4
PO43-
фосфаты
AlPO4 фосфат алюминия
Серная H2SO4
SO42-
сульфаты
PbSO4 сульфат свинца
Бромоводородная HBr
Br-
бромиды
NaBr бромид натрия
Иодоводородная HI
I-
иодиды
KI иодид калия
Сероводородная H2S
S2-
сульфиды
FeS сульфид железа (II)
Соляная HCl
(хлороводородная)
Cl-
хлориды
NH4Cl хлорид аммония
Фтороводородная HF
F-
фториды
CaF2 фторид кальция
Более Cернистая кислота H2SO3
низкая
степ.
Азотистая HNO2
ок.
SO32-
сульфиты
К2SO3 сульфит калия
NO2-
нитриты
КNO2 нитрит калия
Бескислородные
кислоты
Высшие кислоты
Кремниевая H2SiO3
29.
Кислые соли, помимо ионов металла икислотного остатка, содержат ионы
водорода. Названия кислых солей
содержат приставку "гидро":
NaHCO3 – гидрокарбонат натрия,
K2HPO4 – гидрофосфат калия,
KH2PO4 – дигидрофосфат калия.
30.
Основные соли, помимо ионов металла икислотного остатка, содержат
гидроксильные группы.
Основные соли образуются при неполной
нейтрализации основания. Названия
основных солей образуют с помощью
приставки "гидроксо":
Mg(OH)Cl - гидроксохлорид магния
(основная соль)
31.
Двойные соли – имеют два разныхкатиона металла или аммония.
В названии их перечисляют через дефис:
(NH4)Fe(SO4)2 – сульфат железа (III)аммония.
32.
Смешанные соли – имеют два разныханиона кислотных остатков. В названии
их называют через дефис:
СаOCl2 или CaCl(OCl) - хлоридгипохлорит кальция (традиционное
название хлорная известь).
33.
Комплексные соли – содержат сложныйкомплексный анион (или реже катион),
состоящий из металлакомплексообразователя и нескольких
лигандов (отрицательно заряженные ионы
или молекулы аммиака или воды).
Пример:
K[Al(OH)4] – тетрагидроксоалюминат калия
K4[Fe(CN)6] – гексацианоферрат калия
[Cu(NH3)4]Cl2 – хлорид тетраамминмеди (II)
34.
СольМеждународное название
Традиционное название
NaHCO3
Гидрокарбонат натрия
Сода питьевая
Na2CO3
Карбонат натрия
Сода кальцинированная
K2CO3
Карбонат калия
Поташ
Na2SO4
Сульфат натрия
Глауберова соль
KClO3
Хлорат калия
Бертолетова соль
Ca3(PO4)2
Фосфат кальция
Фосфорит
СаСО3
Карбонат кальция
Известняк
CuSO4∙5H2O
Пентагидрат сульфата меди
Медный купорос
Na2CO3∙10Н2О
Декагидрат карбоната
натрия
Сода кристаллическая
35.
Планирование к учебнику «Химия», 8, 9класс, Габриелян О.С. Единая коллекция
цифровых образовательных ресурсов































 chemistry
chemistry








