Similar presentations:
Растворы. Способы выражения концентрации и техника приготовления. Аналитические концентрации растворов
1.
Как ваше настроение?2.
3.
ПМ .01 Выполнение организационно-технологических и базовыхлабораторных процедур при выполнении различных видов
лабораторных исследований.
МДК01.02 Организационно-технологические основы деятельности
лаборатории медицинской организации
Растворы . Способы выражения
концентрации и техника приготовления.
Аналитические концентрации растворов.
Преподаватель : Духовских Юлия Сергеевна
4.
МДК01.02 Организационнотехнологические основы деятельностилаборатории медицинской организации
Тема: Растворы . Способы выражения концентрации и
техника приготовления. Аналитические концентрации
растворов.
Цель :иметь представление о способах выражения
концентрации растворов по точной и
приблизительной навеске ,технике приготовления
5.
Тема: Растворы . Способы выражения и техника приготовления. Аналитическиеконцентрации растворов.
Общие правила приготовления растворов:
1. Каждый раствор состоит из нескольких компонентов, которые
необходимо либо взвесить,либо отмерить
Для взвешивания используют аналитические весы
6.
Тема: Способы выражения и техника приготовления. Аналитическиеконцентрации растворов.
Общие правила приготовления растворов:
1. Каждый раствор состоит из нескольких компонентов, которые
необходимо либо взвесить,либо отмерить
Для измерения объема пользуются мерной посудой
.
у
7.
Тема: Способы выражения и техника приготовления. Аналитические концентрациирастворов.
Общие правила приготовления растворов:
2. Независимо от того ,какие (по точности) приготовляют
растворы,применять следует только чистые растворители.
!дистилированная вода
!деминирализованна вода
8.
Тема: Способы выражения и техника приготовления. Аналитические концентрациирастворов.
Общие правила приготовления растворов:
3. Предварительно подготавливают соответствующие
емкости,посуду,в которой будут готовить и хранить получаемый
раствор
9.
Тема: Способы выражения и техника приготовления. Аналитическиеконцентрации растворов.
Общие правила приготовления растворов:
4. Подлежащие растворению твердые вещества ,особенно
труднорастворимые ,рекомендуется измельчать ,так как
растворение крупных кристаллов и комков происходит очень
медленно
10.
Тема: Способы выражения и техника приготовления. Аналитические концентрациирастворов.
Общие правила приготовления растворов:
5. Применение для приготовления растворов горячей воды при
точных растворах НЕ рекомендуется
Хотя нагревание и ускоряет процесс растворения .оно приводит к
изменению концентрации за счет испарения и неточностям в
измерении объемов.
11.
Тема: Способы выражения и техника приготовления. Аналитические концентрациирастворов.
Общие правила приготовления растворов:
6.
12.
Тема: Способы выражения и техника приготовления. Аналитические концентрациирастворов.
Общие правила приготовления растворов:
7. Концентрированные растворы едких щелочей не
рекомендуется хранить; их готовят непосредственно
перед употреблением.
8. Если необходимо приготовить насыщенный раствор
вещества, растворимость которого в воде
известна,вещество добавляют небольшими порциями
,каждый раз добиваясь полного растворения,до тех пор
,пока последняя порция уже не будет растворятся
13.
Тема: Способы выражения и техника приготовления. Аналитические концентрациирастворов.
Общие правила приготовления растворов:
9 Подлежащие хранению растворы необходимо сразу после
приготовления перелить в плотно закрывающиеся сосуды и
снабдить этикетками с указанием названия и формулы
растворенного вещества, концентрации раствора и даты его
приготовления.
14.
.Растворы . Способы выражения концентрации и техника приготовления. Аналитические
концентрации растворов.
Концентрацией раствора называется масса растворенного вещества,
содержащаяся в определенной массе или объеме раствора или растворителя.
Численное выражение состава растворов: массовая доля растворенного вещества,
молярная концентрация, молярная концентрация эквивалента, моляльная
концентрация, мольная доля.
К техническим способам выражения концентрации растворов, относят:
1. массовая процентная концентрация
2. объемная процентная концентрация
3. массо-объемная процентная концентрация
К аналитическим способам выражения концентрации растворов относят :
1. молярная концентрация
2. молярная концентрация эквивалента или нормальная концентрация
3. массовая конценртация ,титр раствора
15.
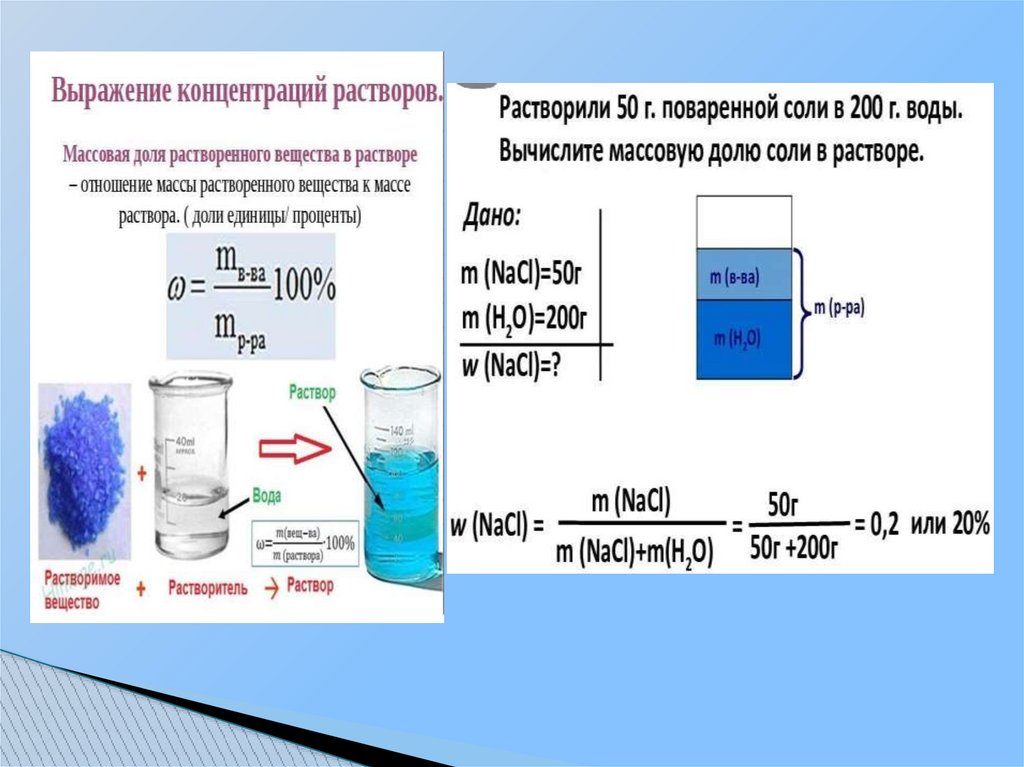
10.1. Способы выражения концентрации растворовМассовой долей W называют отношение массы растворенного вещества к массе
раствора.
W = mраст.в-ва/mраствора * 100%
Если это отношение выражено в процентах, то называется процентной концентрацией
(С%). Выражается числом граммов растворенного вещества, содержащихся в 100 г раствора.
Например, 20%-й раствор соли – это раствор, в 100 г которого содержится 20 г соли и 80 г
воды.
Молярная концентрация, CM выражается числом молей растворенного вещества,
содержащихся в 1 л раствора. Раствор, содержащий 1 моль растворенного вещества в 1 л
называется
одномолярным
(1М);
0,1
моль-децимолярным
(0,1М);
0,01 моль - сантимолярным (0,01М).
СМ = n/V = mр.в-ва/ M * V (моль/л), где m – масса растворенного вещества, г; M –
молярная масса растворенного вещества, г/моль; V – объем раствора, л.
Плотность раствора выражает отношение массы раствора к его объему. Зависит от
концентрации
ρ = mр-ра/ V (г/мл, г/см3).
16.
Молярная концентрация эквивалента, C(1/z) выражается числом моль-эквивалентоврастворенного вещества, содержащихся в 1 л раствора.
С(1/z) = m *z/M * V, где z – фактор эквивалентности.
Моляльная концентрация, Cm выражается числом молей растворенного вещества,
содержащееся в 1 кг (1000 г) растворителя.
Сm = mр.в-ва /M*mраств-теля =n/mраств-теля (моль/кг). mраств-теля в кг
Мольная доля вещества в смеси (Ni) определяется отношением числа молей данного
вещества к сумме числа молей всех веществ, находящихся в смеси или растворе.
Ni = ni/∑ni Например, смешаны три компонента А, В, С в количестве na, nb, nc молей.
Тогда мольная доля каждого из них будет:
Na = na/na+nb+nc
Nb =
nb/na+nb+nc и т.д. Сумма мольных долей всех компонентов равна 1.
Титр раствора (Т) выражает массу растворенного вещества, содержащееся в 1 мл
раствора
Т = m/V (г/мл, г/см3). m в г, V в мл
17.
18.
Тема: Способы выражения и техника приготовления. Аналитические концентрациирастворов.
ПРИГОТОВЛЕНИЕ СТАНДАРТНОГО РАСТВОРА ПО ТОЧНОЙ НАВЕСКЕ
В титриметрическом анализе растворы с точно известной концентрацией называют
рабочими, или стандартными.
Их можно приготовить несколькими способами:
по стандарт-титру (фиксаналу)
по точной навеске исходного вещества
по приблизительной навеске вещества с последующим определением точной
концентрации (стандартизацией) приготовленного раствора по соответствующему
стандартному раствору
19.
Тема: Способы выражения и техника приготовления. Аналитические концентрациирастворов.
ПРИГОТОВЛЕНИЕ СТАНДАРТНОГО РАСТВОРА ПО ТОЧНОЙ НАВЕСКЕ
Первичные стандарты должны удовлетворять следующим требованиям:
строгое соответствие состава химической формуле
постоянство химического состава во времени
химическая и физическая устойчивость
химическая чистота
по возможности высокая молекулярная масса
доступность
20.
Тема: Способы выражения и техника приготовления. Аналитические концентрациирастворов.
ПРИГОТОВЛЕНИЕ СТАНДАРТНОГО РАСТВОРА ПО ТОЧНОЙ НАВЕСКЕ
Стандартные растворы таких веществ приготавливают растворением точной навески
в воде и разбавлением полученного раствора до требуемого объема.
21.
Тема: Способы выражения и техника приготовления. Аналитические концентрациирастворов.
ПРИГОТОВЛЕНИЕ СТАНДАРТНОГО РАСТВОРА ПО ТОЧНОЙ НАВЕСКЕ
1. Зная концентрацию (С, моль-экв/л) и объем (V, мл) раствора, который необходимо
приготовить, рассчитывают массу (m, г) химически чистого соединения с точностью
до 4 знака после запятой.
2. Рассчитанную массу взвешивают в контейнере на аналитических весах.
3. Содержимое контейнера количественно переносят в мерную колбу, тщательно
вымывают струей воды из промывалки.
4. Вещество в колбе растворяют, заполнив ее на ½ или ¾ водой.
5. Колбу закрывают пробкой и раствор хорошо перемешивают.
6. Доводят объем раствора до метки с помощью капельной пипетки.
Внимание! Если стандартным веществом является кристаллогидрат, то при расчете
массы необходимо учитывать молярную массу воды.
22.
Тема: Способы выражения и техника приготовления. Аналитические концентрациирастворов.
Пример 1. Рассчитать, массу навески Na2B4O7·10 H2O, необходимую для
приготовления 100 мл 0.1 моль-экв/л раствора.
Решение:




























 chemistry
chemistry








