Similar presentations:
Введение в биохимию. Структура и функции белков. Ферменты
1.
ФГБОУ ВО АГМУ Минздрава РоссииКафедра Общей и биологической химии, клинической
лабораторной диагностики
Введение в биохимию.
Структура и функции белков.
Ферменты
Лектор: доцент Дегтярева Юлия
Владимировна
2.
Биохимия – наука, изучающаявещества, входящие в состав живых
организмов, их превращения, а также
взаимосвязь этих превращений с
деятельностью органов и тканей.
Термин «биохимия» ввел в 1903
году немецкий биохимик Карл
Нейберг (1877-1956 гг.).
3.
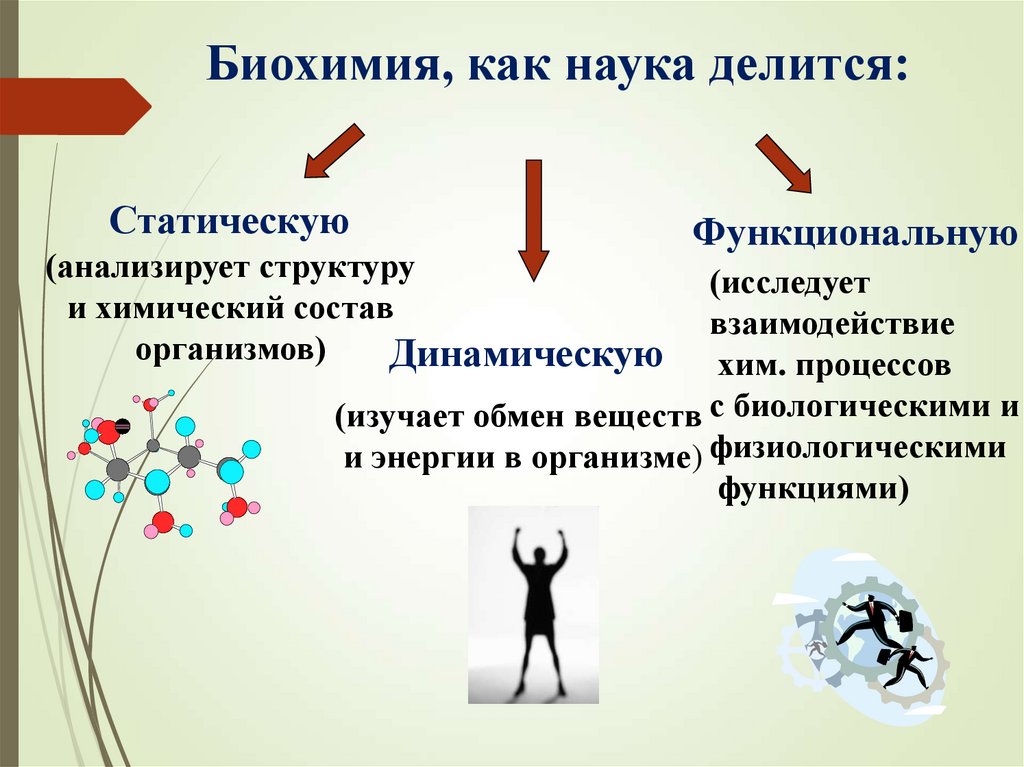
Биохимия, как наука делится:Статическую
(анализирует структуру
и химический состав
организмов)
Динамическую
Функциональную
(исследует
взаимодействие
хим. процессов
(изучает обмен веществ с биологическими и
и энергии в организме) физиологическими
функциями)
4.
По объектам исследования, биохимияделится:
Биохимию человека и животных
Биохимию растений
Биохимию микроорганизмов
Биохимию вирусов
5.
Структура и функции белков6.
Белки – природные высокомолекулярныеполимеры, состоящие из остатков αаминокарбоновых кислот, связанных
амидной (пептидной) связью.
Характерны неразветвленные пептидные
связи.
Высокая молекулярная масса (количество
аминокислотных остатков в белках 50 –
1000).
Количество
белков
(несколько
миллиардов различных белков).
7.
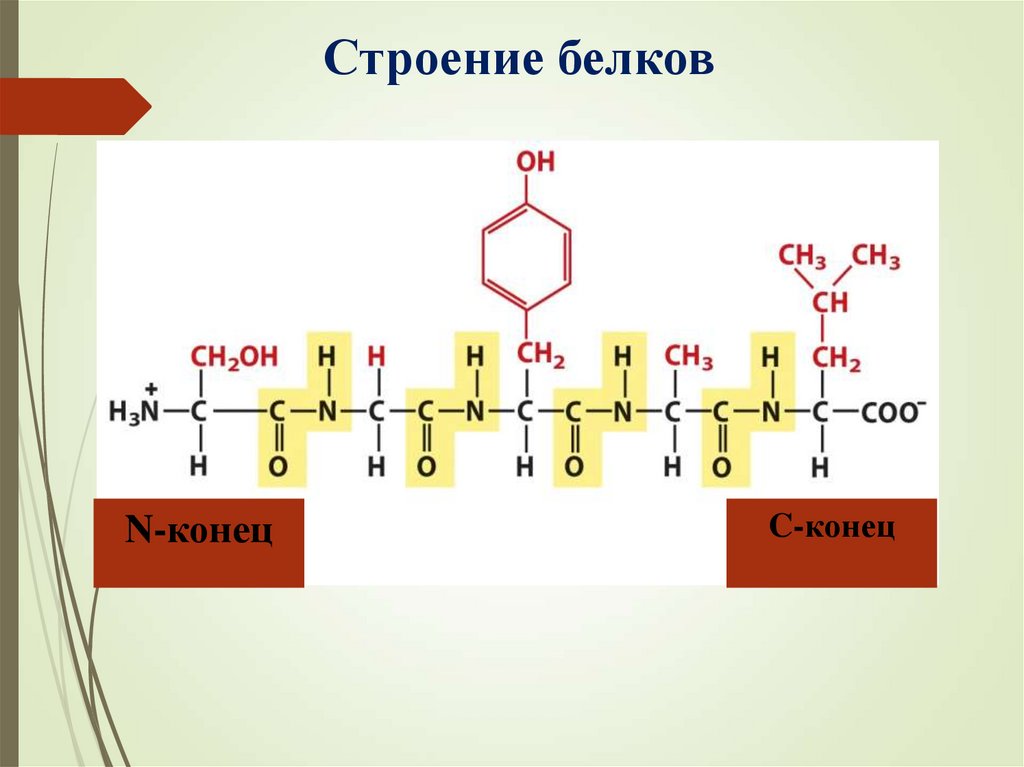
Строение белковN-конец
C-конец
8.
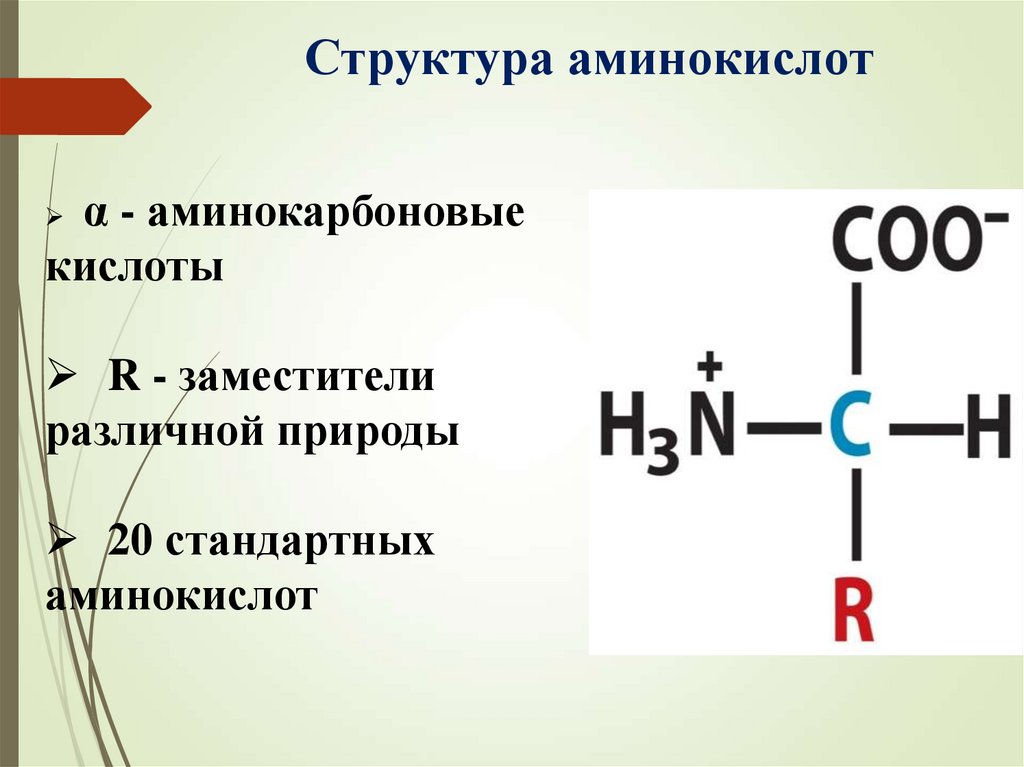
Структура аминокислотα - аминокарбоновые
кислоты
R - заместители
различной природы
20 стандартных
аминокислот
9.
Классификация аминокислотПо химической структуре
По отношению к воде (гидрофильные и
гидрофобные)
По кислотно-основным свойствам
Кислые
Основные
Нейтральные
По пищевой ценности
Заменимые (синтезируются в организме)
Незаменимые (должны поступать извне)
10.
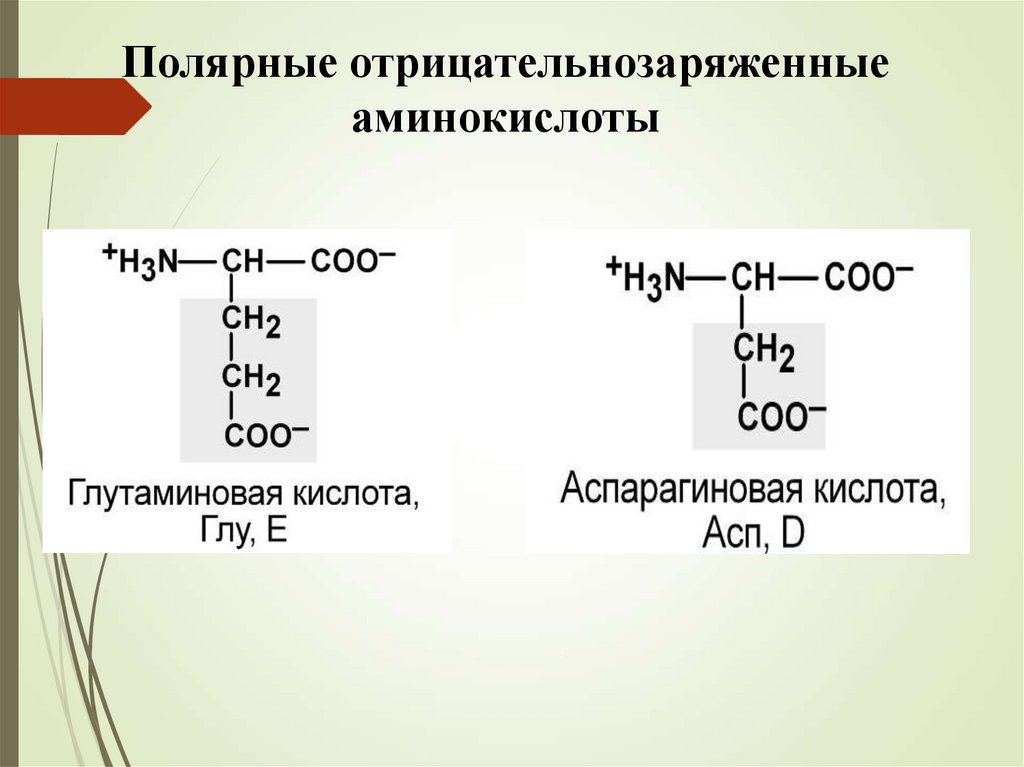
Полярные незаряженные аминокислоты11.
Полярные отрицательнозаряженныеаминокислоты
12.
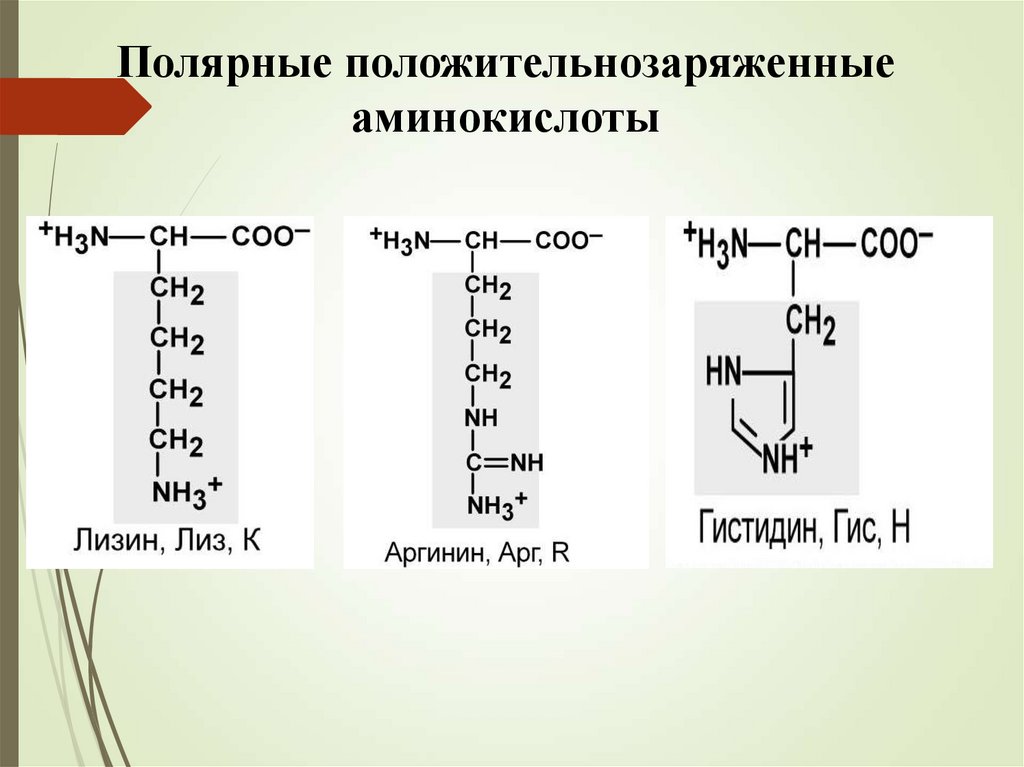
Полярные положительнозаряженныеаминокислоты
13.
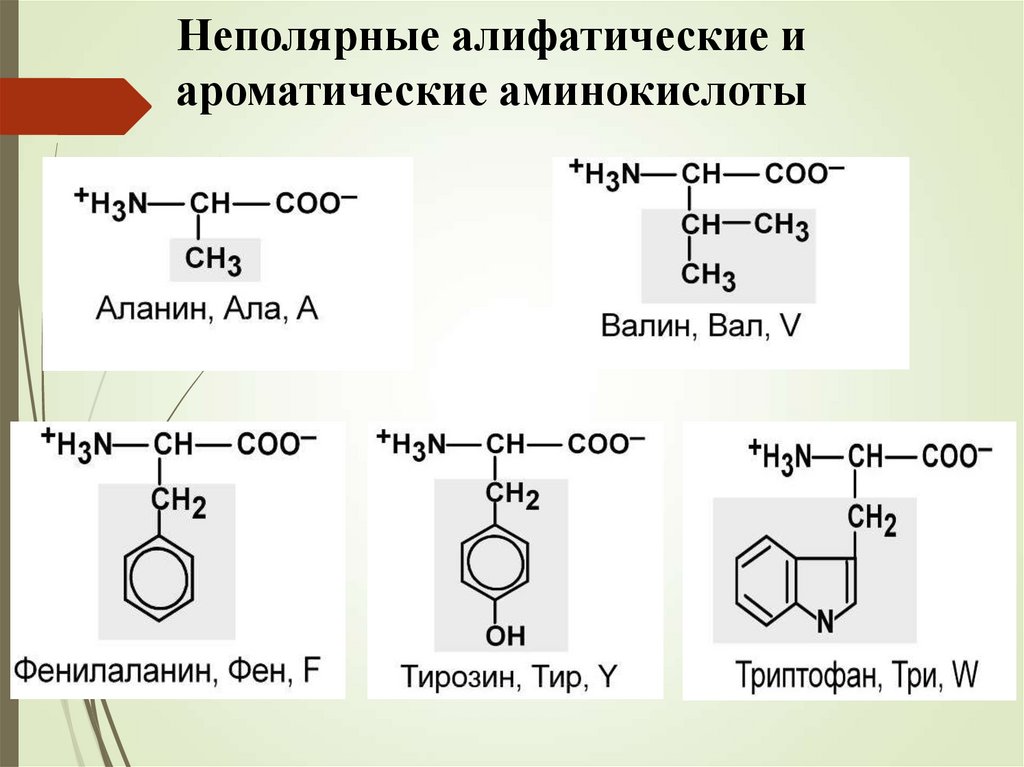
Неполярные алифатические иароматические аминокислоты
14.
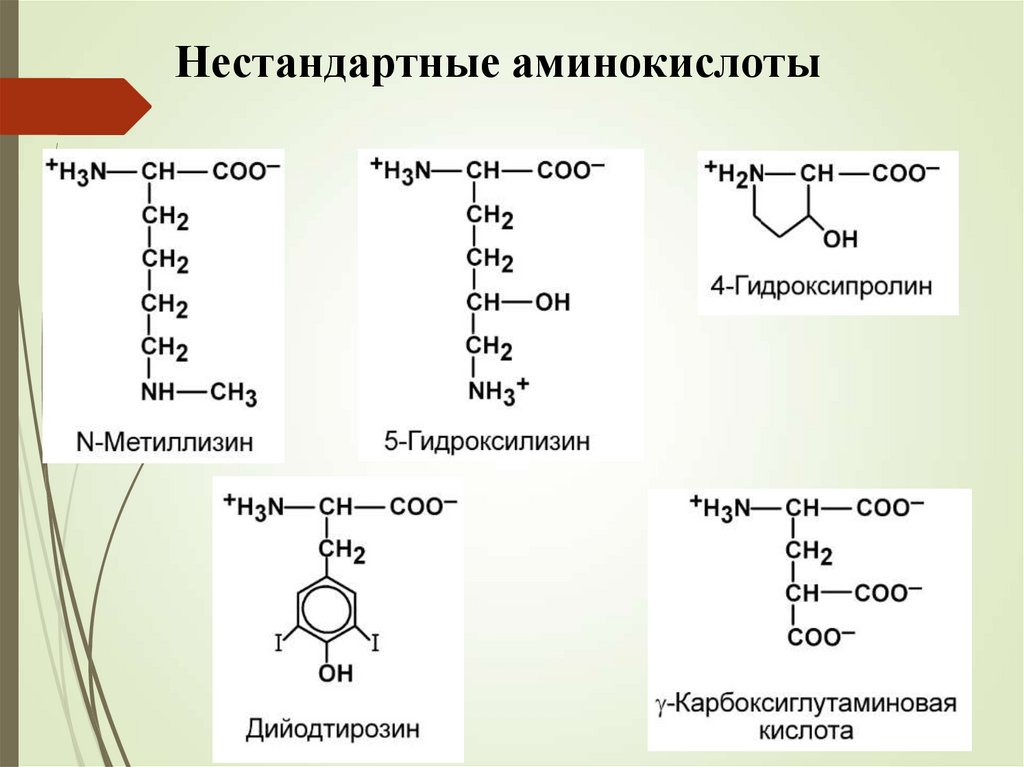
Нестандартные аминокислоты15.
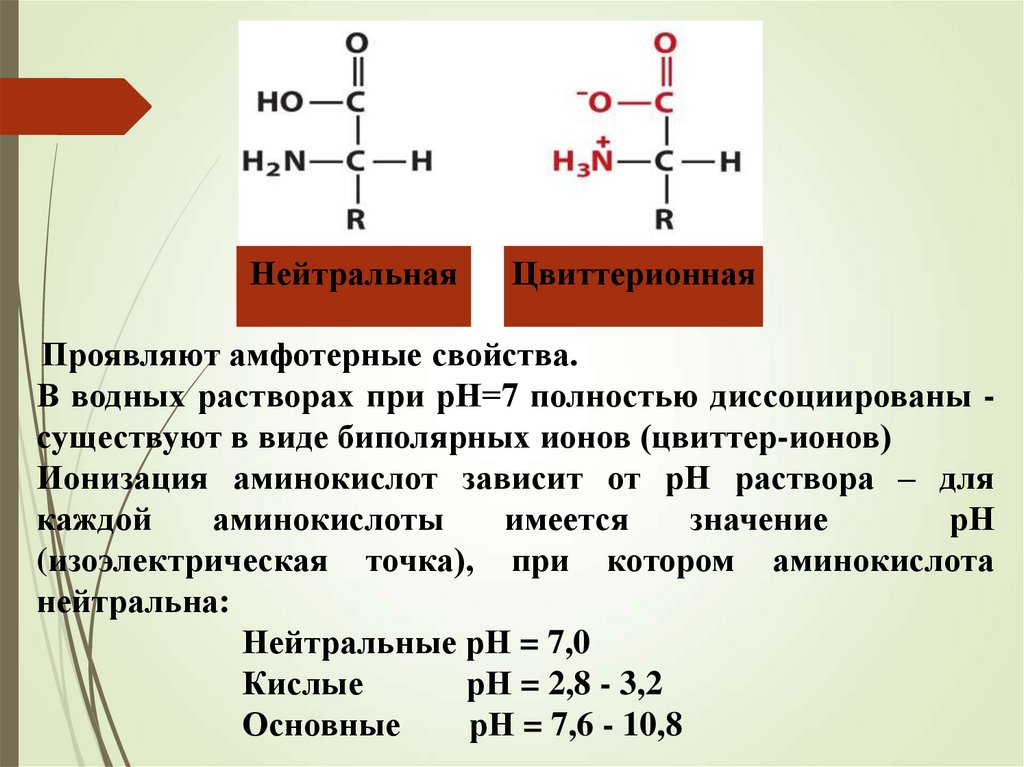
Кислотно-основные свойствааминокислот
16.
НейтральнаяЦвиттерионная
Проявляют амфотерные свойства.
В водных растворах при рН=7 полностью диссоциированы существуют в виде биполярных ионов (цвиттер-ионов)
Ионизация аминокислот зависит от рН раствора – для
каждой
аминокислоты
имеется
значение
рН
(изоэлектрическая точка), при котором аминокислота
нейтральна:
Нейтральные рН = 7,0
Кислые
рН = 2,8 - 3,2
Основные
рН = 7,6 - 10,8
17.
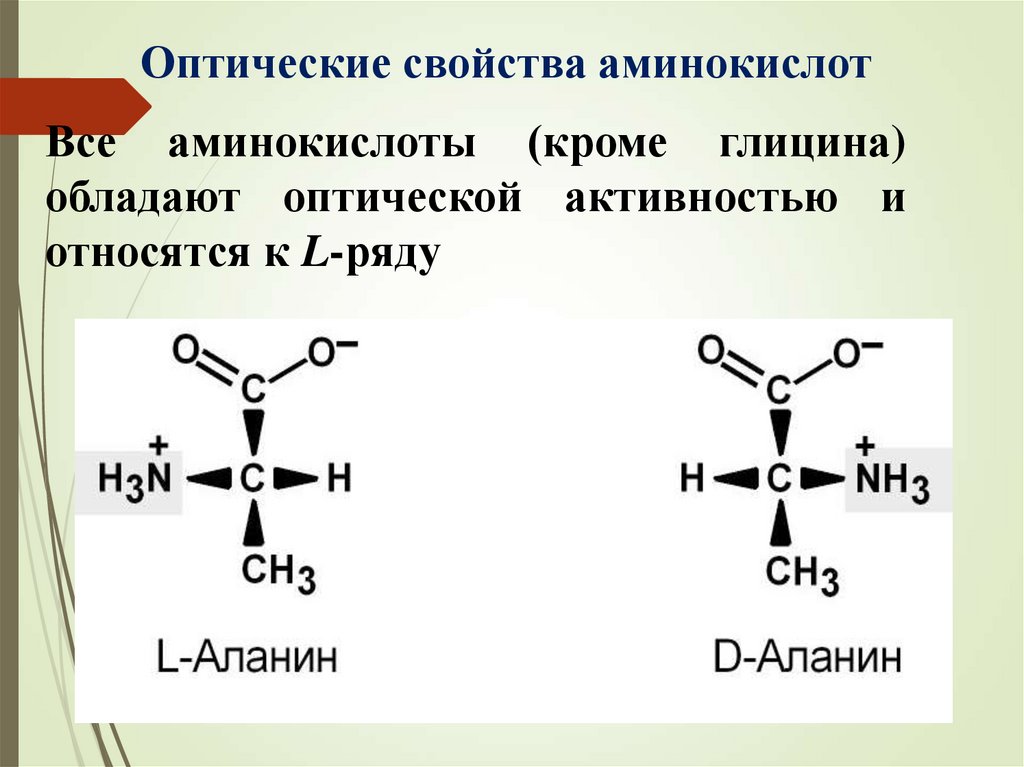
Оптические свойства аминокислотВсе аминокислоты (кроме глицина)
обладают оптической активностью и
относятся к L-ряду
L-Аланин
D-Аланин
18.
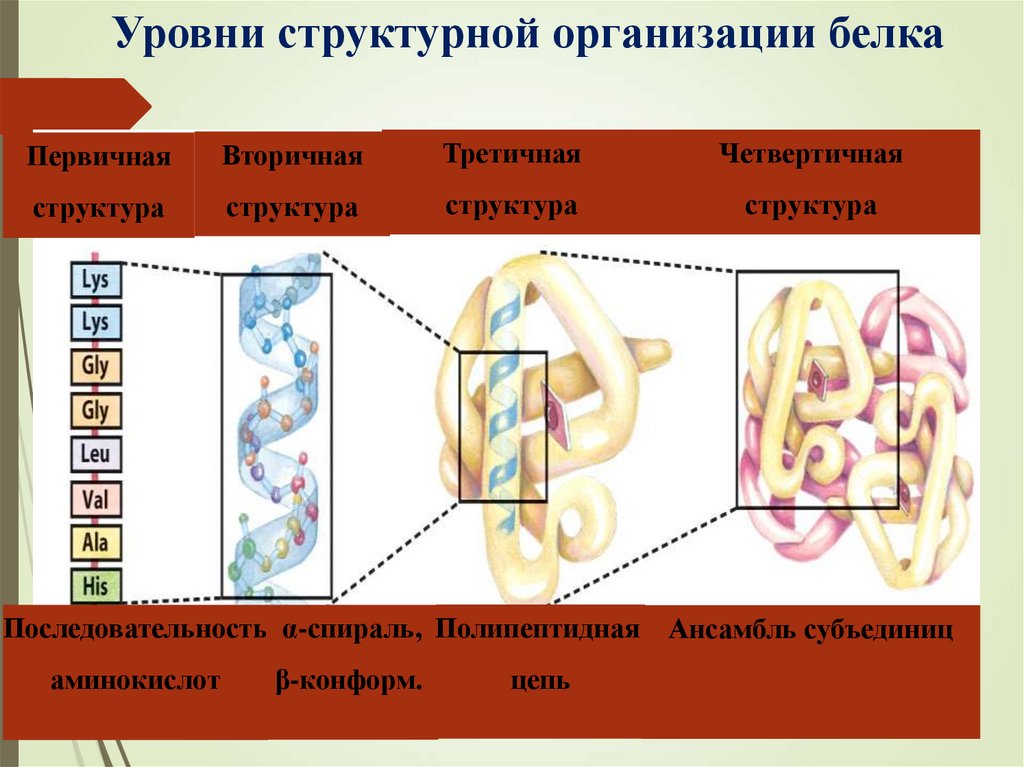
Уровни структурной организации белкаПервичная
Вторичная
Третичная
Четвертичная
структура
структура
структура
структура
Последовательность α-спираль, Полипептидная Ансамбль субъединиц
аминокислот
β-конформ.
цепь
19.
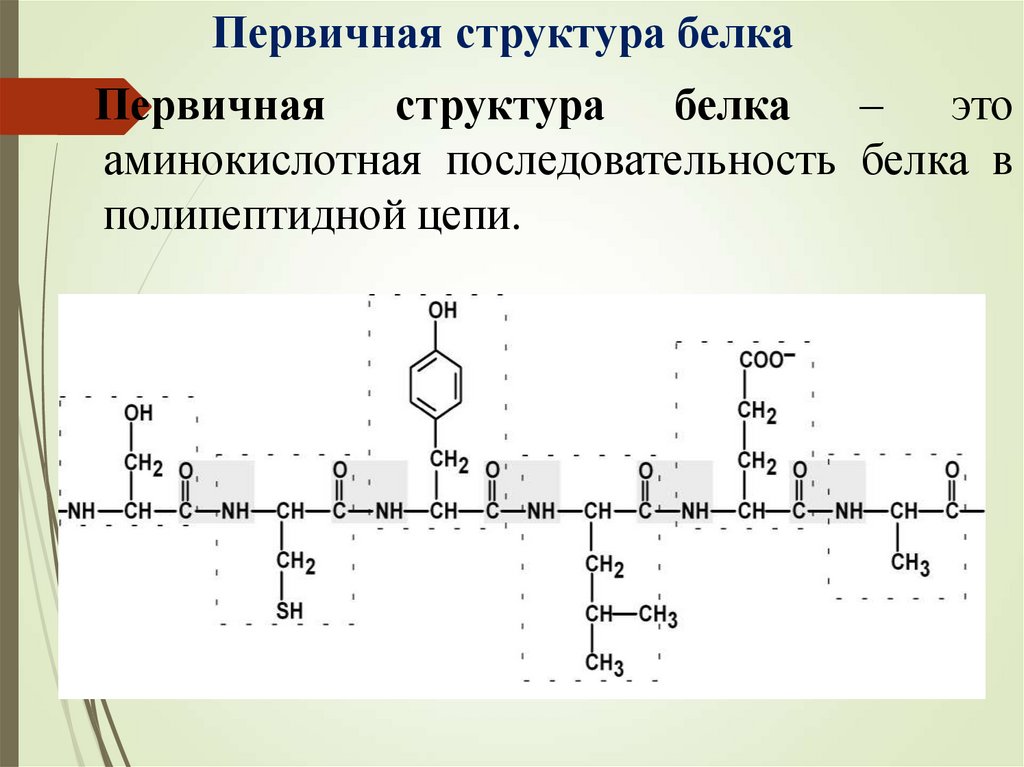
Первичная структура белкаПервичная
структура
белка
–
это
аминокислотная последовательность белка в
полипептидной цепи.
20.
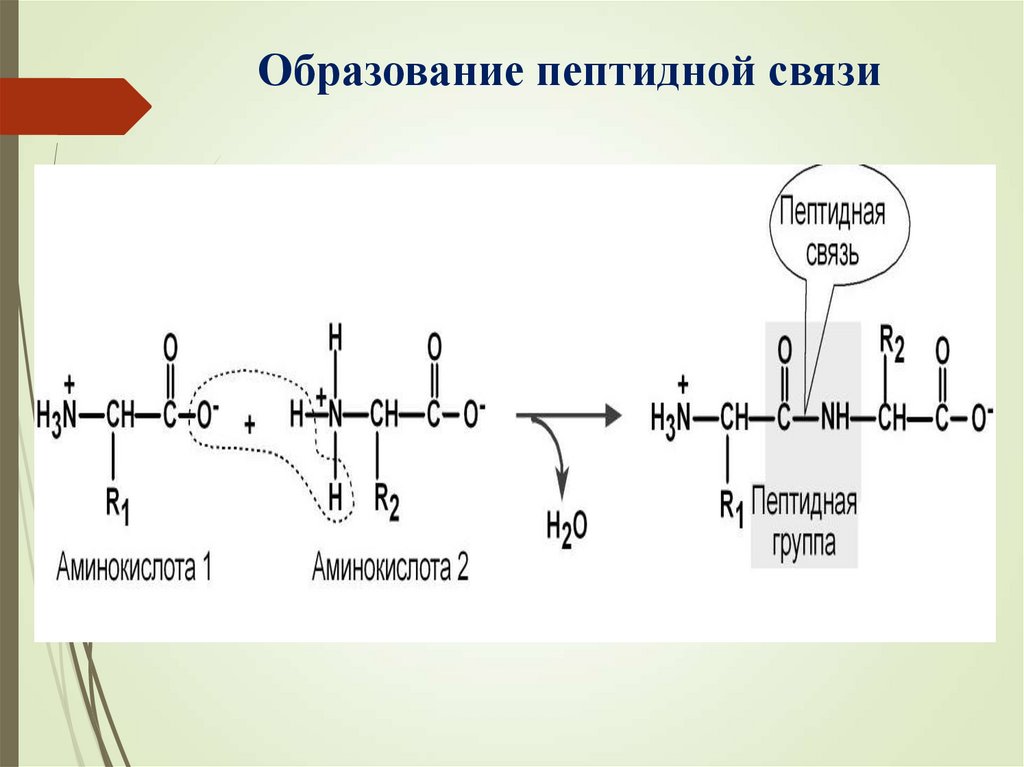
Образование пептидной связи21.
Вторичная структура белкаВторичная структура белка – упорядоченные
структуры
полипептидных
цепей,
стабилизированные
водородными
связями
между пептидными -СО- и NH-группами.
Типы вторичных структур:
α-спираль
β-складчатая структура
Неупорядоченный клубок
22.
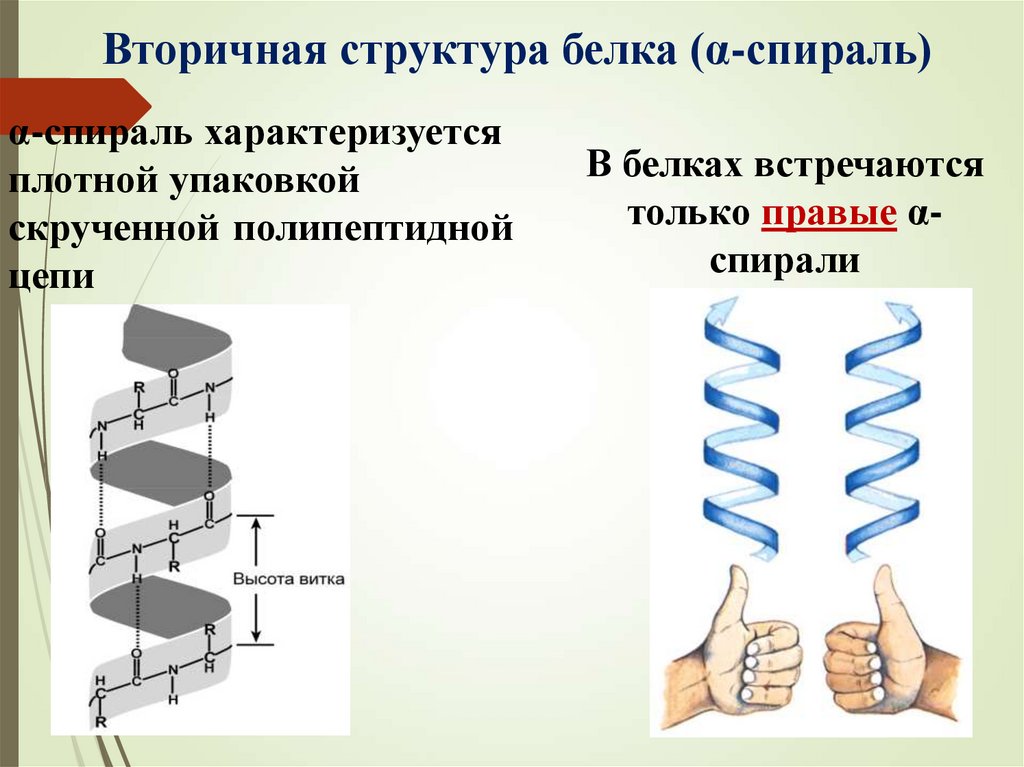
Вторичная структура белка (α-спираль)α-спираль характеризуется
плотной упаковкой
скрученной полипептидной
цепи
В белках встречаются
только правые αспирали
23.
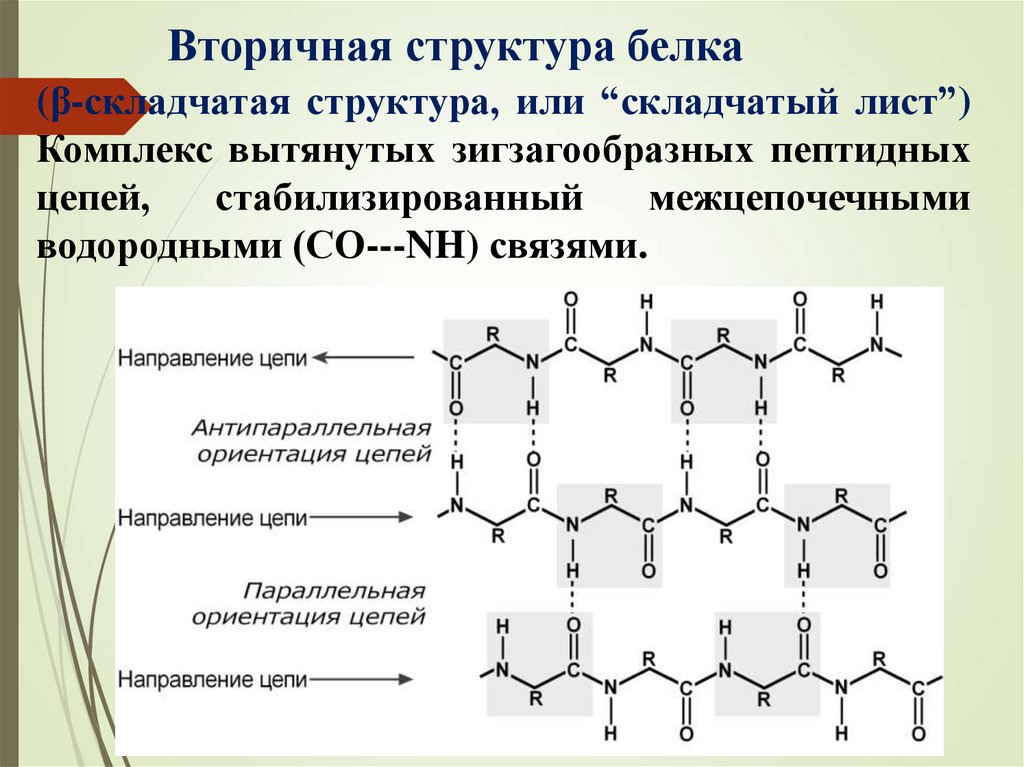
Вторичная структура белка(β-складчатая структура, или “складчатый лист”)
Комплекс вытянутых зигзагообразных пептидных
цепей,
стабилизированный
межцепочечными
водородными (СО---NH) связями.
24.
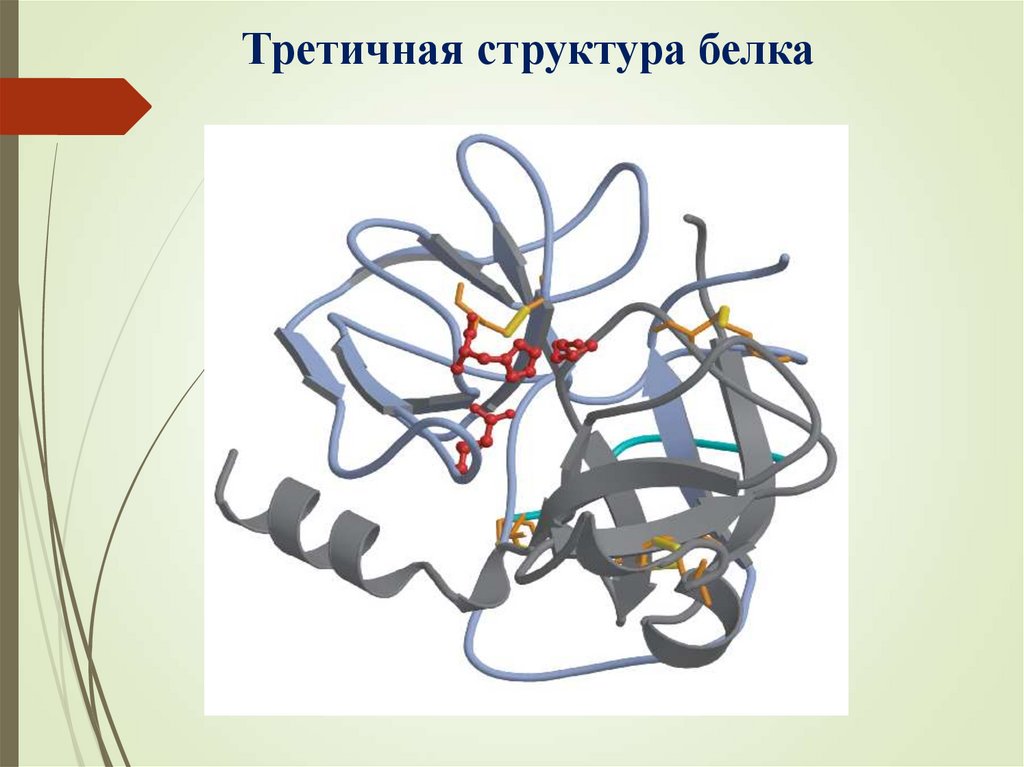
Третичная структура белка25.
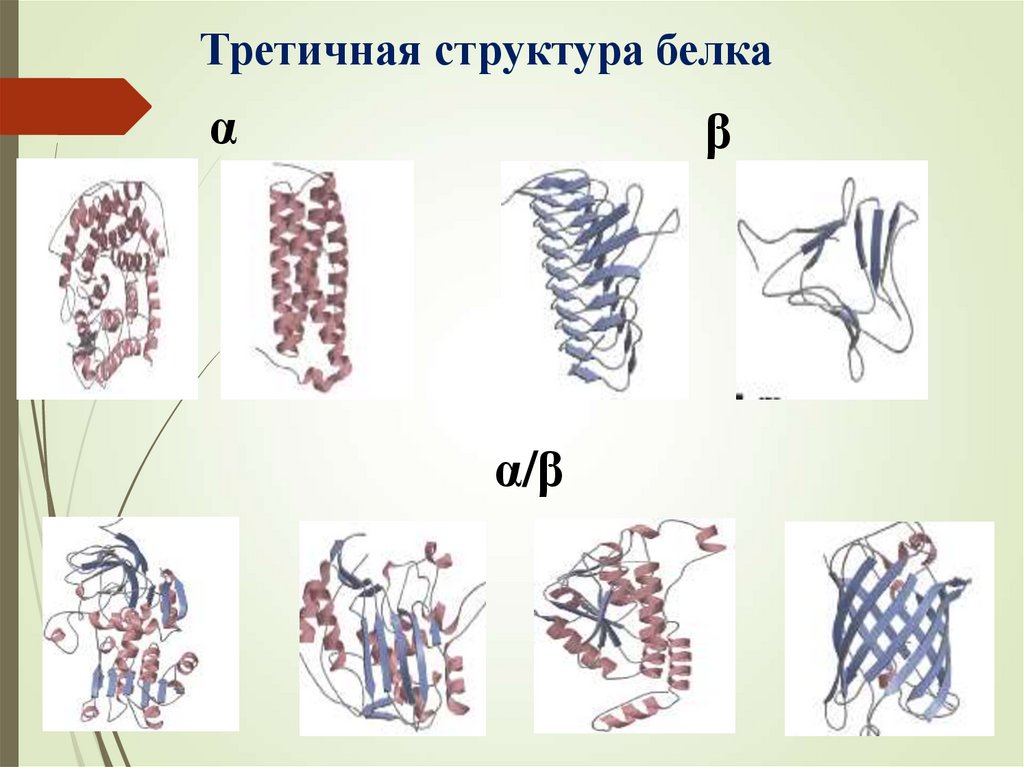
Третичная структура белкаα
β
α/β
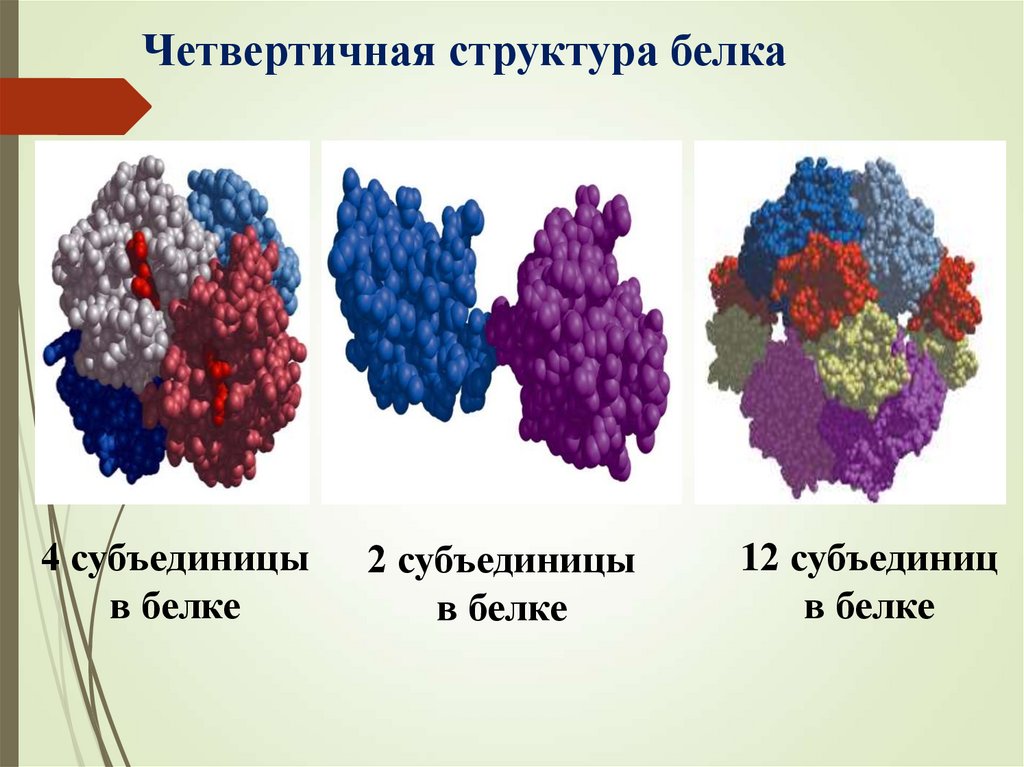
26.
Четвертичная структура белка4 субъединицы
в белке
2 субъединицы
в белке
12 субъединиц
в белке
27.
Стадии образования нативнойконформации белка (Фолдинг белков)
Образование пространственной структуры
белка – процесс сложный и многостадийный.
В итоге формируется третичная структура
белка (нативная конформация белка).
Белки–шапероны (белки «теплового шока») –
это белки, которые помогают полипептиду
принять правильную пространственную
структуру.
28.
Глобулярные и фибриллярные белкиБелки образуют при свертывании:
Компактные структуры сферической формы
(глобулы) - Глобулярные белки
Вытянутые волокна - Фибриллярные белки
Миоглобин кита (синим цветом)
- гидрофобные остатки
аминокислот, красным цветом –
остаток гема)
Волокна
коллагена
29.
Глобулярные белкиСвойства глобулярных белков:
Водорастворимые и амфифильные (мембранные)
белки.
Гидрофобные R - группы скрыты внутри глобулы
и защищены от взаимодействия с Н2О, а
гидрофильные R - группы находятся на
поверхности глобулы в гидратированном
состоянии.
Фибриллярные белки
Представляют собой вытянутые и складчатые
структуры
Выполняют в клетках и тканях структурную
функцию
Нерастворимые в воде (α-кератин, β-кератин,
коллаген, эластин)
30.
Методы выделения и очистки белковЭкстракция белков водными или
водно-солевыми растворами
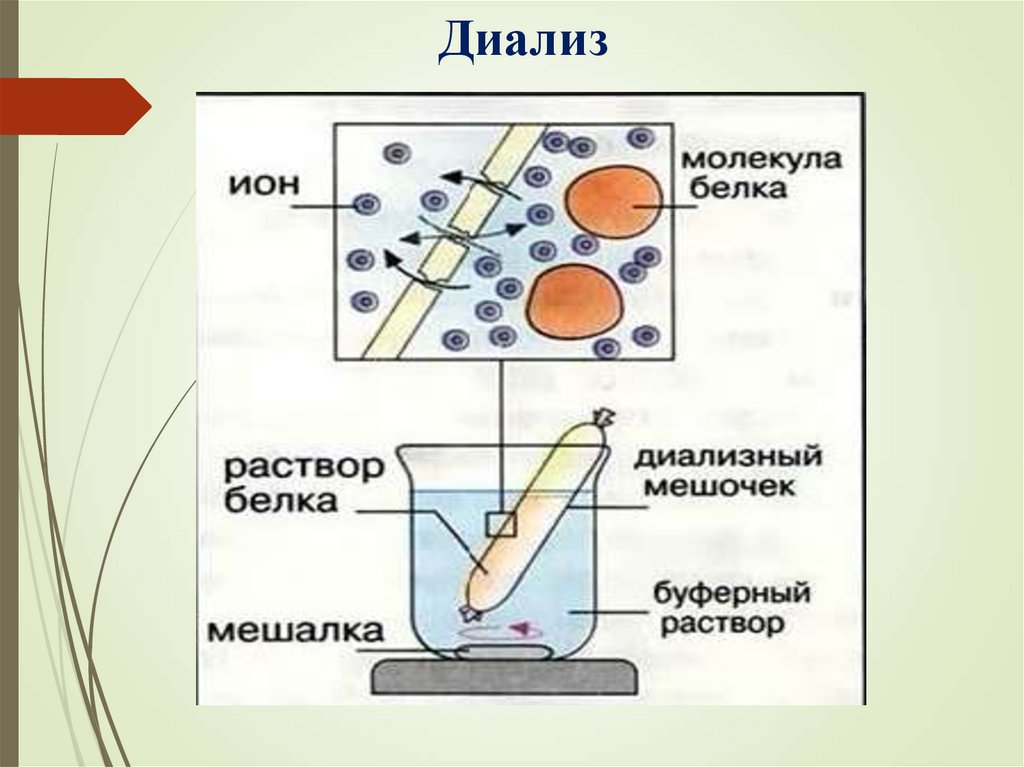
Диализ
Высаливание
Электрофорез
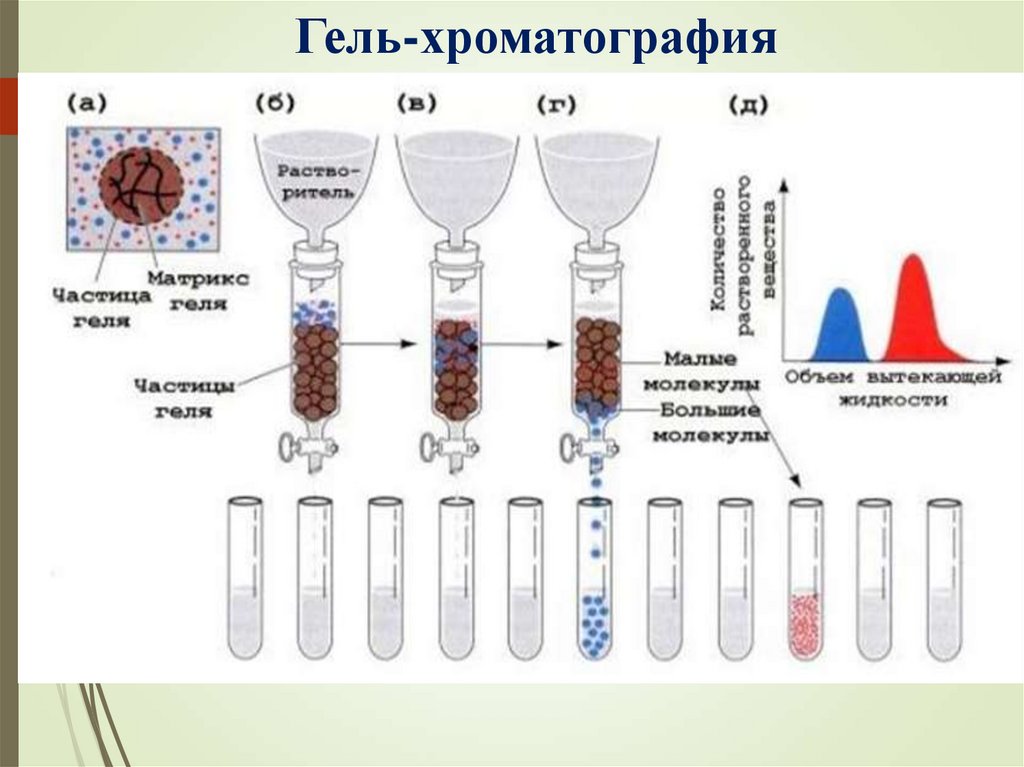
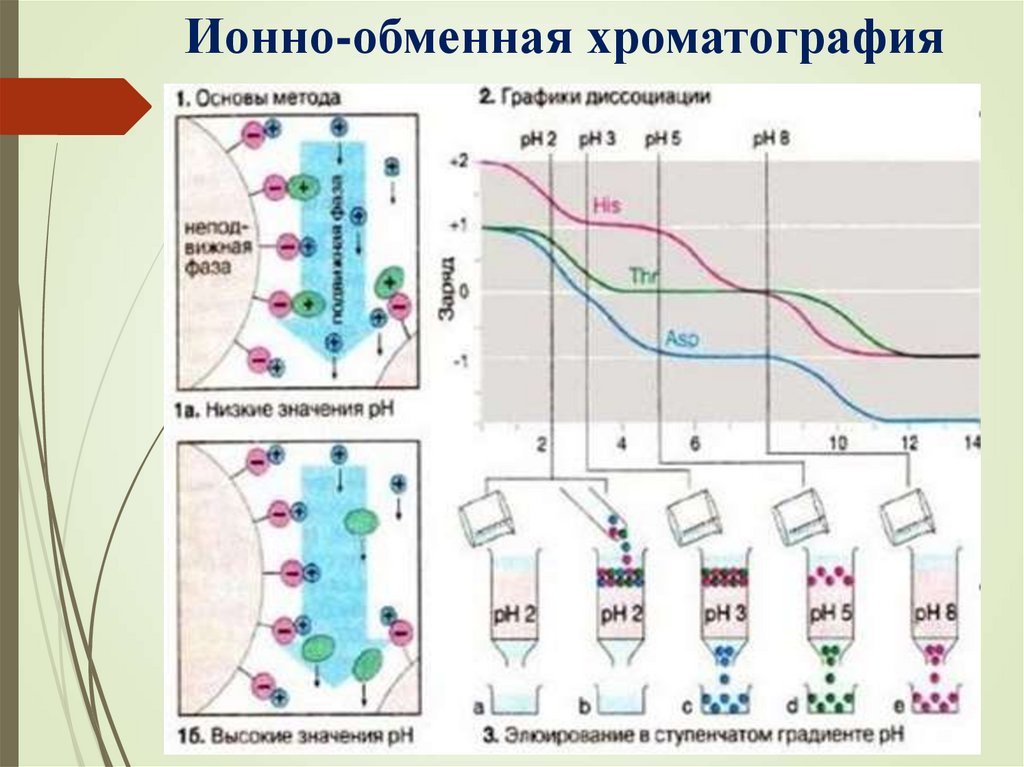
Хроматография: аффинная, гельхроматография, ионно-обменная
Ультрацентрифугирование
31.
Гель-хроматография32.
Ионно-обменная хроматография33.
Диализ34.
Денатурация и ренатурация белкаДенатурация – это структурные изменения в
молекуле белка (без разрыва ковалентных
связей), которые приводят к потере его
биологической активности.
Денатурацию белков вызывают нагревание,
изменение
рН,
обработка
детергентами,
органическими растворителями и др.
Денатурация белка – обратимая и необратимая.
Ренатурация (ренативация) – восстановление
белка до третичной структуры и его
биологической активности.
35.
Функции белков36.
СтруктурнаяСтруктурные
белки
составляют
«остов» многих тканей
и органов.
Являются фибриллярными белками.
Коллаген (кости, хрящи, кожа,
сухожилия)
α- и β-Кератины (волосы)
Эластин (связки, стенки сосудов и
др.)
Протеогликаны (клеточные стенки,
межклеточный матрикс)
37.
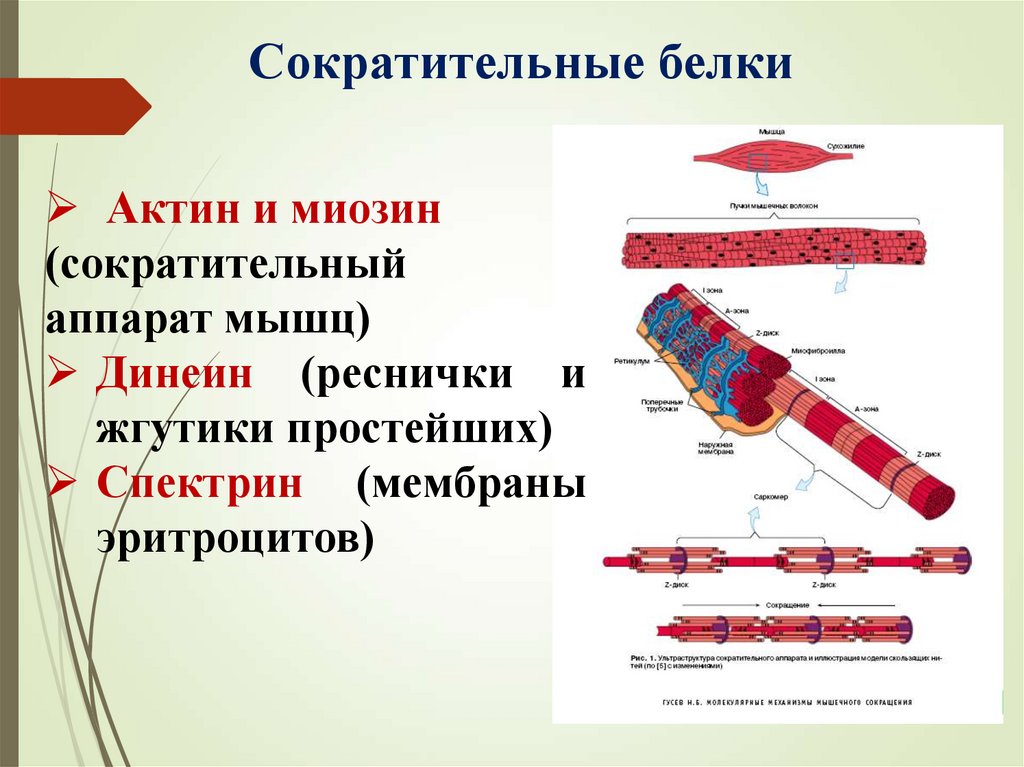
Сократительные белкиАктин и миозин
(сократительный
аппарат мышц)
Динеин (реснички и
жгутики простейших)
Спектрин (мембраны
эритроцитов)
38.
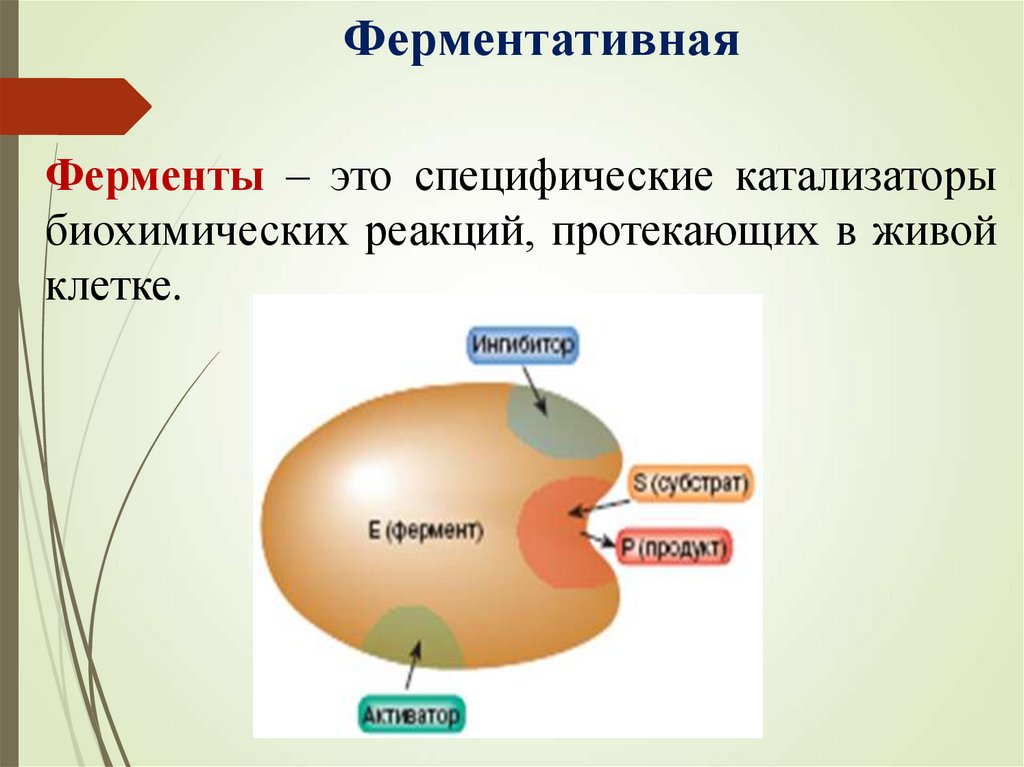
ФерментативнаяФерменты – это специфические катализаторы
биохимических реакций, протекающих в живой
клетке.
39.
ТранспортнаяГемоглобин
тканям).
(транспорт О2
от легких к
Миоглобин (транспорт О2
ткани).
в мышечной
Цитохром С (транспорт
дыхательной цепи).
электронов
Сывороточный
альбумин
жирных кислот в крови).
в
(транспорт
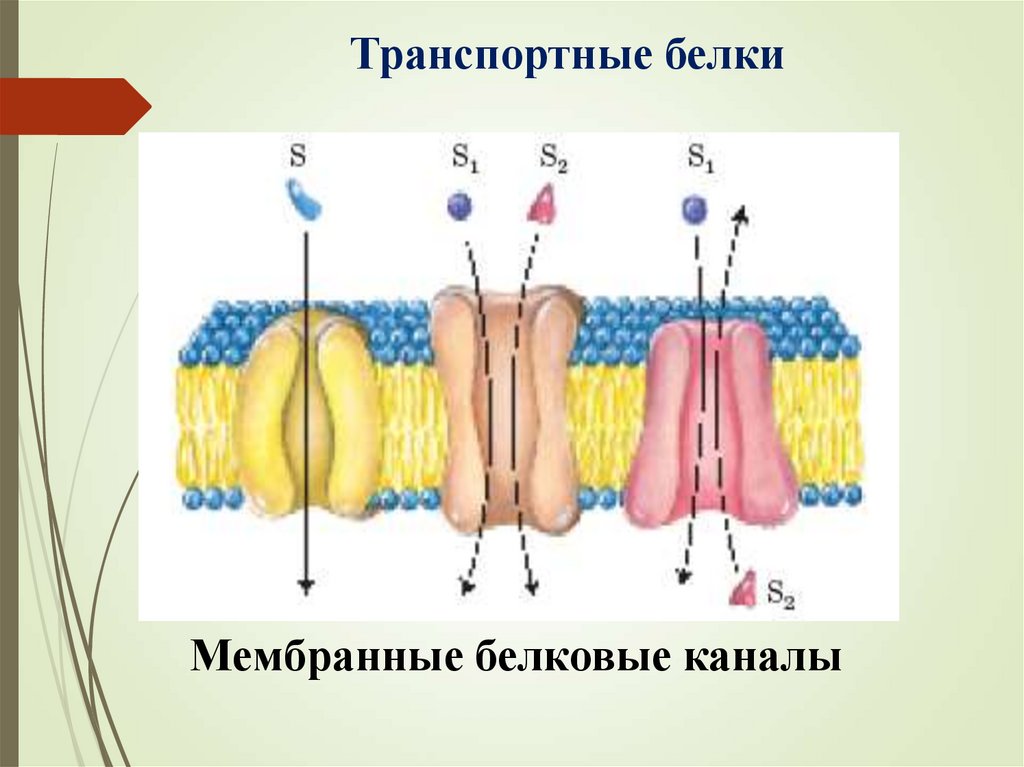
Мембранные белки (транспорт веществ и
ионов через биологические мембраны).
40.
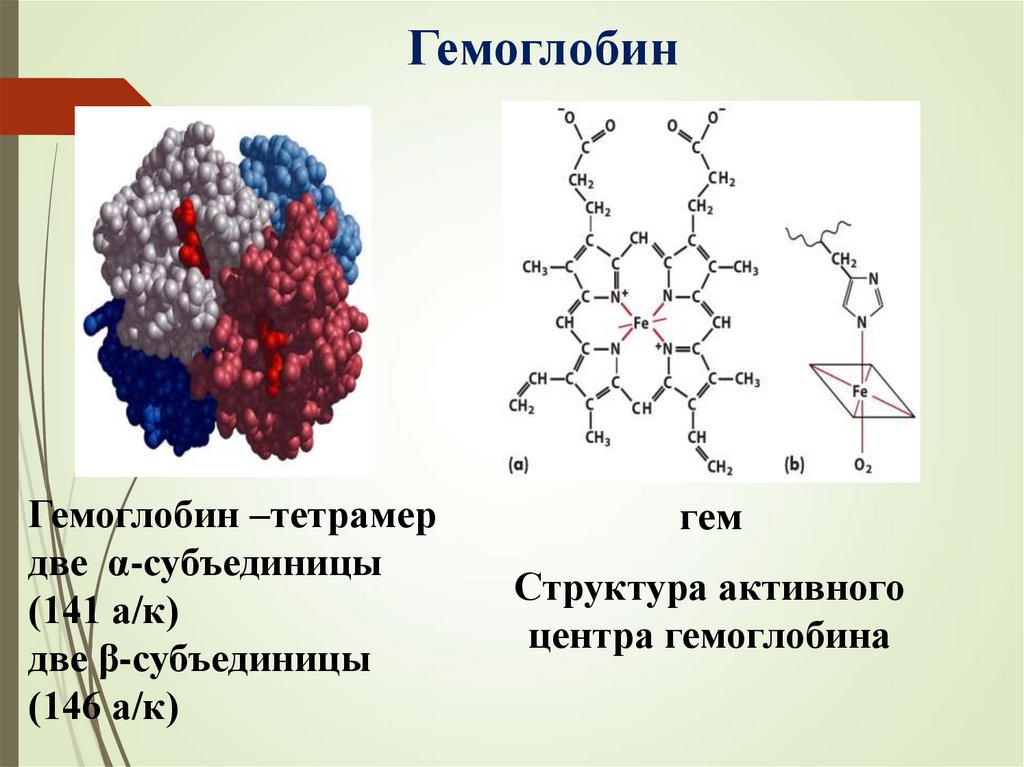
ГемоглобинГемоглобин –тетрамер
две α-субъединицы
(141 а/к)
две β-субъединицы
(146 а/к)
гем
Структура активного
центра гемоглобина
41.
Транспортные белкиМембранные белковые каналы
42.
ПитательнаяПищевые белки
Казеин молока
Альбумин яичный
Глиадин пшеницы
Зеин ржи
Запасные белки
Ферритин (“депо”
железа в селезенке)
43.
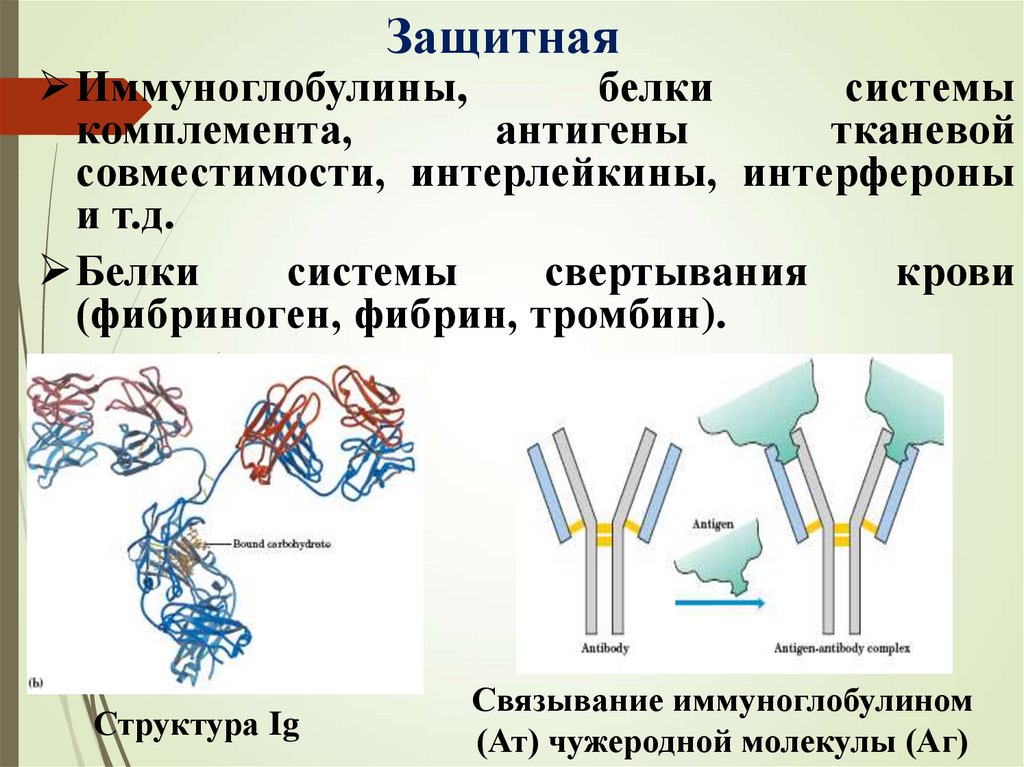
ЗащитнаяИммуноглобулины,
белки
системы
комплемента,
антигены
тканевой
совместимости, интерлейкины, интерфероны
и т.д.
Белки
системы
свертывания
крови
(фибриноген, фибрин, тромбин).
Структура Ig
Связывание иммуноглобулином
(Ат) чужеродной молекулы (Аг)
44.
РегуляторнаяГормоны – биологически активные регуляторы,
вырабатываются в эндокринных железах и
разносятся по кровяному руслу к клеткаммишеням.
Существует 3 класса гормонов – пептиднобелковые,
стероидные,
производные
аминокислот (например, адреналин).
Белковые гормоны – все гормоны гипоталамуса,
некоторые
гормоны
гипофиза
и
др.
(соматотропин,
тиротропин,
гонадотропин,
пролактин, инсулин, паратропин).
45.
РецепторнаяРодопсин зрительного аппарата (восприятие и
преобразование световых сигналов).
Бактериородопсин галофильных бактерий.
Мембранные белки - рецепторы различных
гормонов (передают сигнал от гормона внутрь
клетки и обеспечивают запуск механизма
клеточного ответа).
Рецепторы клеточной поверхности эритроцитов,
лимфоцитов, макрофагов (выработка
организмом иммунного ответа).
Рецепторы нейропептидов головного мозга
(регуляция поведения и высшей нервной
деятельности).




















 biology
biology








