Similar presentations:
Окислительно-восстановительные реакции
1. Окислительно-восстановительные реакции
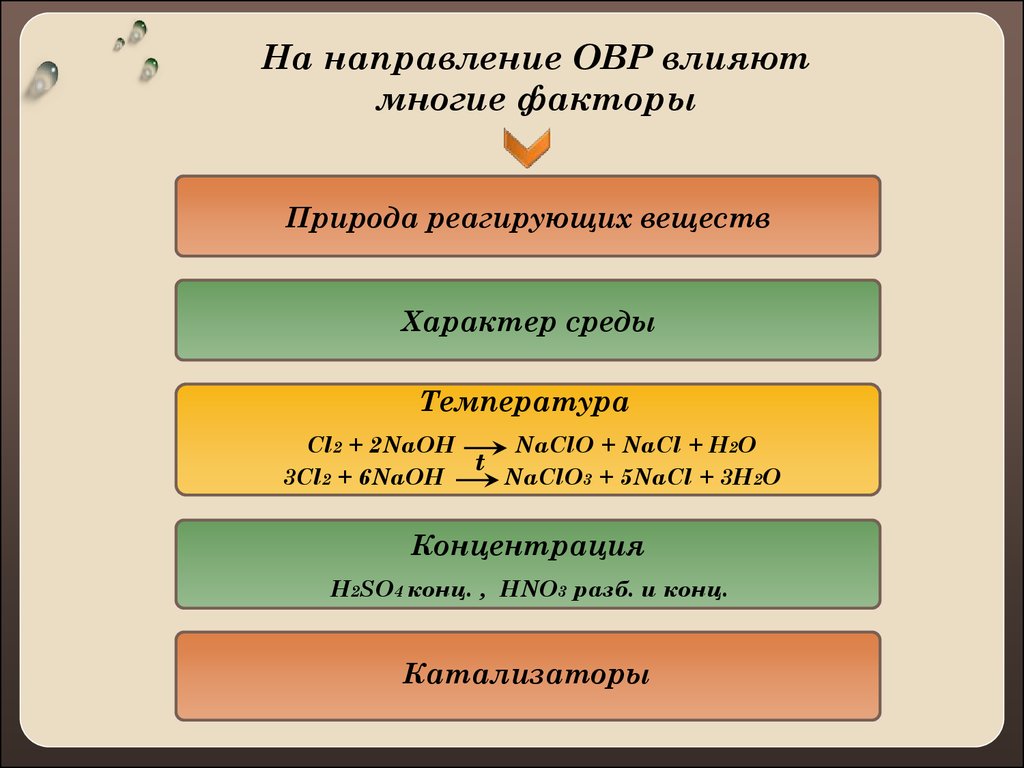
2. На направление ОВР влияют многие факторы
Природа реагирующих веществХарактер среды
Температура
Cl2 + 2NaOH
NaClO + NaCl + H2O
t
3Cl2 + 6NaOH
NaClO3 + 5NaCl + 3H2O
Концентрация
H2SO4 конц. , HNO3 разб. и конц.
Катализаторы
3.
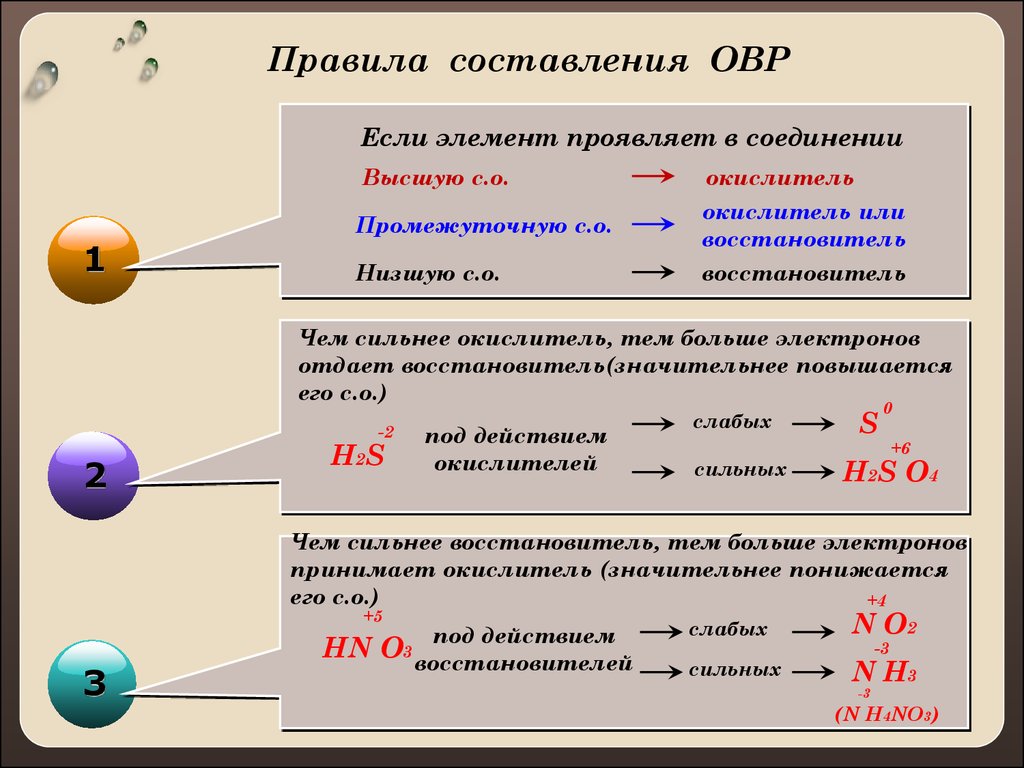
Правила составления ОВРЕсли элемент проявляет в соединении
Высшую с.о.
1
окислитель
Промежуточную с.о.
окислитель или
восстановитель
Низшую с.о.
восстановитель
Чем сильнее окислитель, тем больше электронов
отдает восстановитель(значительнее повышается
его с.о.)
-2
2
H2S
под действием
окислителей
слабых
сильных
S
0
+6
H2S O4
Чем сильнее восстановитель, тем больше электронов
принимает окислитель (значительнее понижается
его с.о.)
+4
+5
3
HN
под действием
O3 восстановителей
слабых
N O2
сильных
N H3
-3
-3
(N H4NO3)
4.
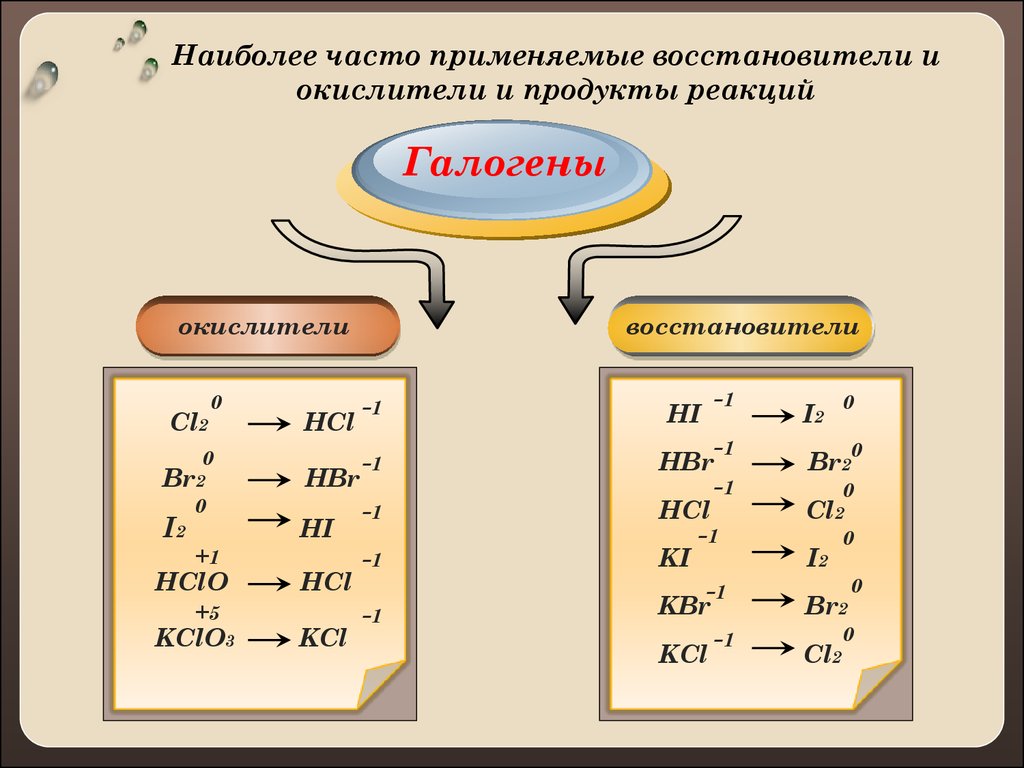
Наиболее часто применяемые восстановители иокислители и продукты реакций
Галогены
окислители
Cl2
0
0
Br2
I2
0
+1
HClO
+5
KClO3
HCl
HBr
HI
HCl
KCl
восстановители
-1
HI
-1
HBr
-1
-1
-1
-1
-1
-1
HCl
-1
KI
-1
KBr
-1
KCl
I2
0
0
Br2
0
Cl2
I2
0
Br2
Cl2
0
0
5.
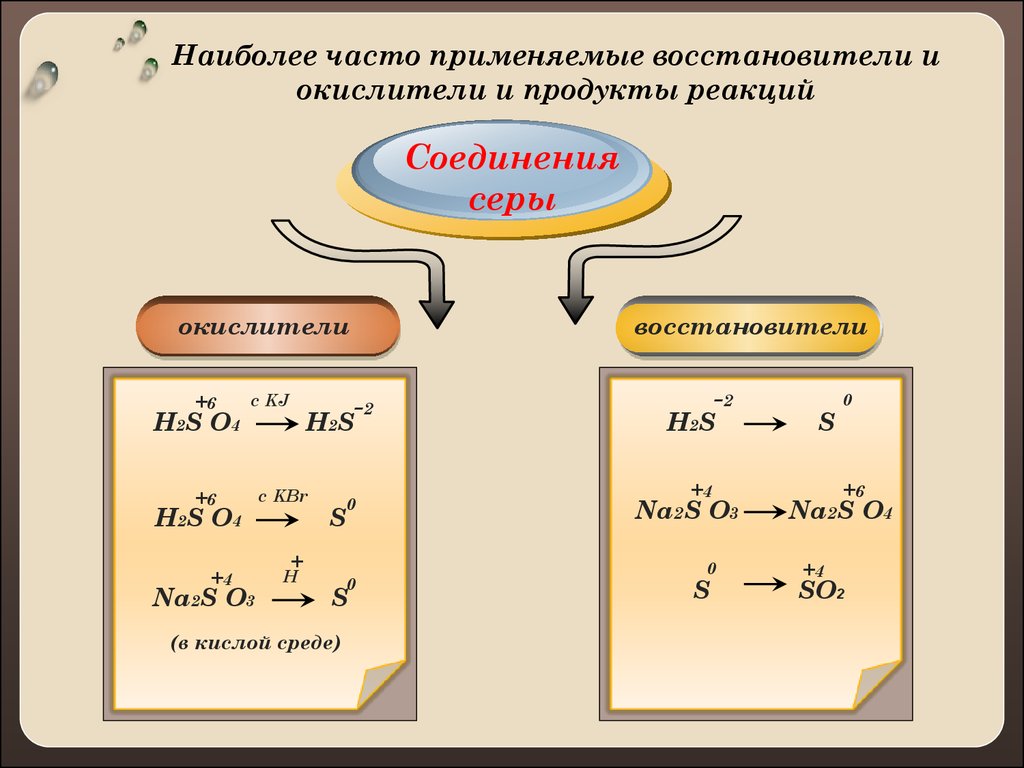
Наиболее часто применяемые восстановители иокислители и продукты реакций
Соединения
серы
окислители
+6
H 2S O 4
с KJ
+6
H2S O4
+4
Na2S O3
H 2S
с KBr
S
восстановители
-2
0
+
H
0
S
(в кислой среде)
-2
H 2S
+4
Na2S O3
0
S
S
0
+6
Na2S O4
+4
SO2
6.
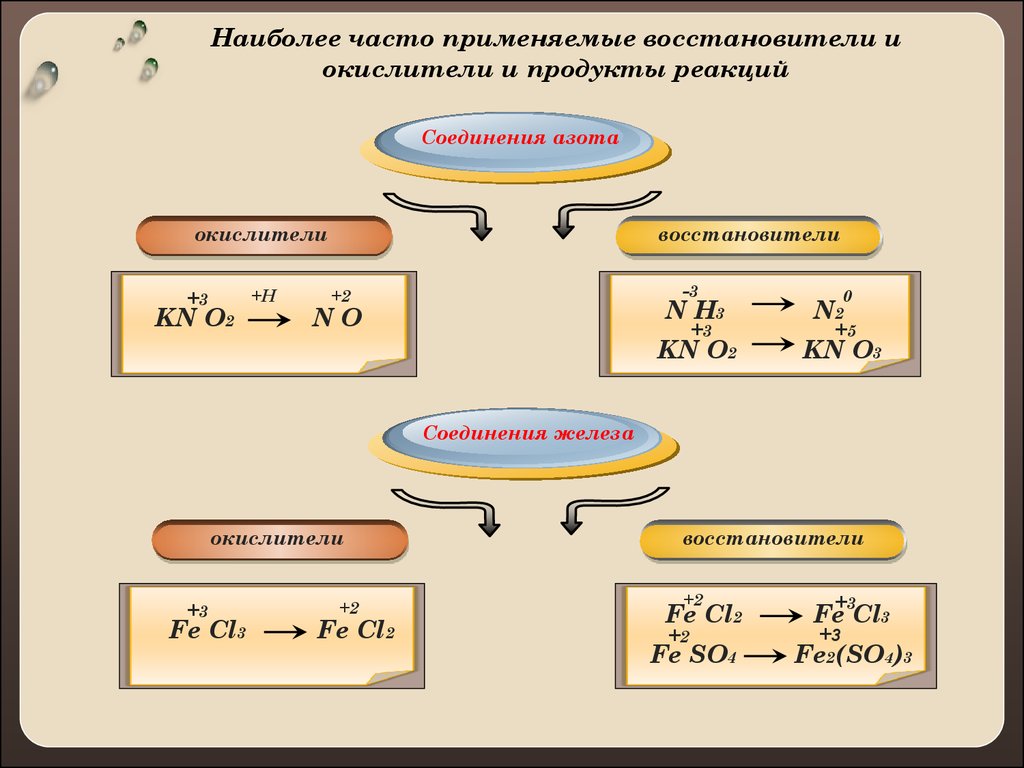
Наиболее часто применяемые восстановители иокислители и продукты реакций
Соединения азота
окислители
+3
KN O2
+H
восстановители
-3
+2
N H3
NO
+3
KN O2
0
N2
+5
KN O3
Соединения железа
окислители
+3
Fe Cl3
+2
Fe Cl2
восстановители
+2
Fe Cl2
+2
Fe SO4
+3
Fe Cl3
+3
Fe2(SO4)3
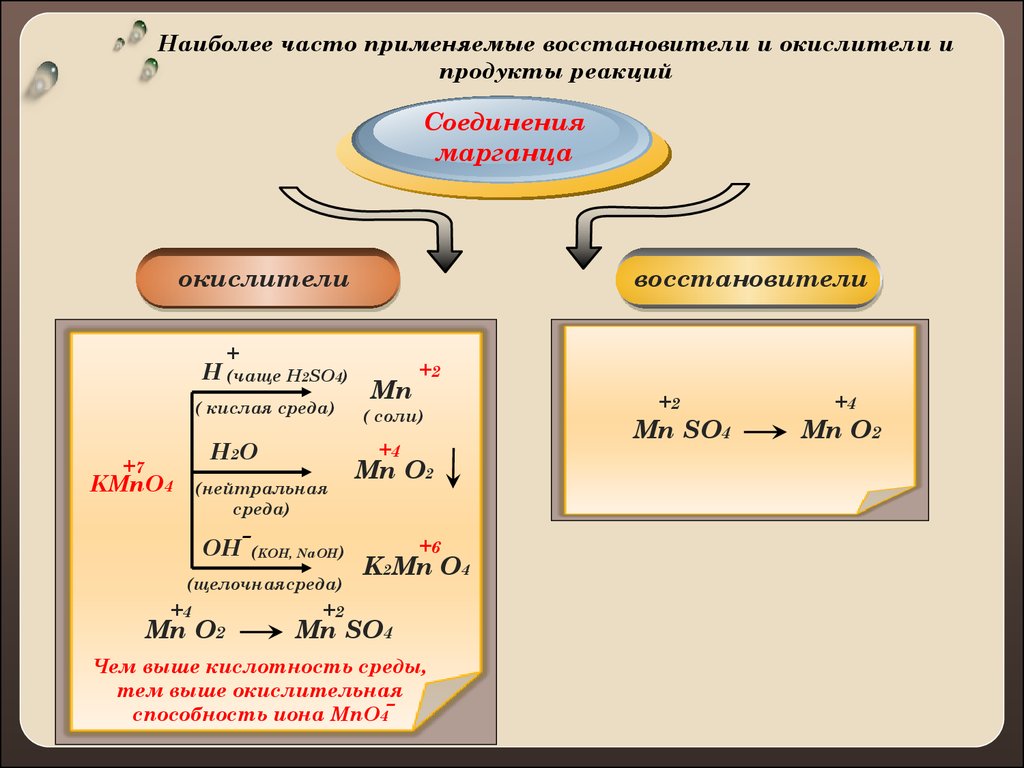
7.
Наиболее часто применяемые восстановители и окислители ипродукты реакций
Соединения
марганца
окислители
восстановители
+
H (чаще H2SO4)
( кислая среда)
+7
(нейтральная
среда)
OH
Mn O2
Mn O2
-
(KOH, NaOH)
(щелочнаясреда)
+4
( соли)
+4
H2 O
KMnO4
Mn
+2
+6
K2Mn O4
+2
Mn SO4
Чем выше кислотность среды,
тем выше окислительная
способность иона MnO4
+2
Mn SO4
+4
Mn O2
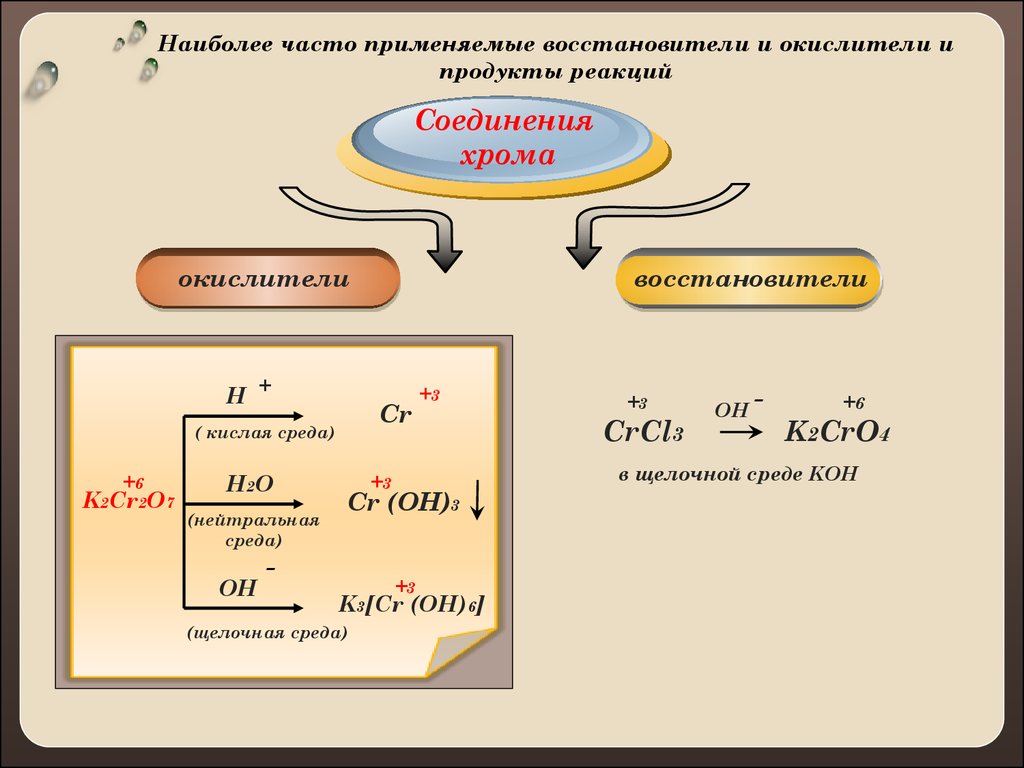
8.
Наиболее часто применяемые восстановители и окислители ипродукты реакций
Соединения
хрома
окислители
H +
Cr
( кислая среда)
+6
K2Cr2O7
H2 O
(нейтральная
среда)
OH
восстановители
+3
Cr (OH)3
+3
K3[Cr (OH)6]
(щелочная среда)
CrCl3
OH
-
+6
K2CrO4
в щелочной среде KOH
+3
-
+3
9.
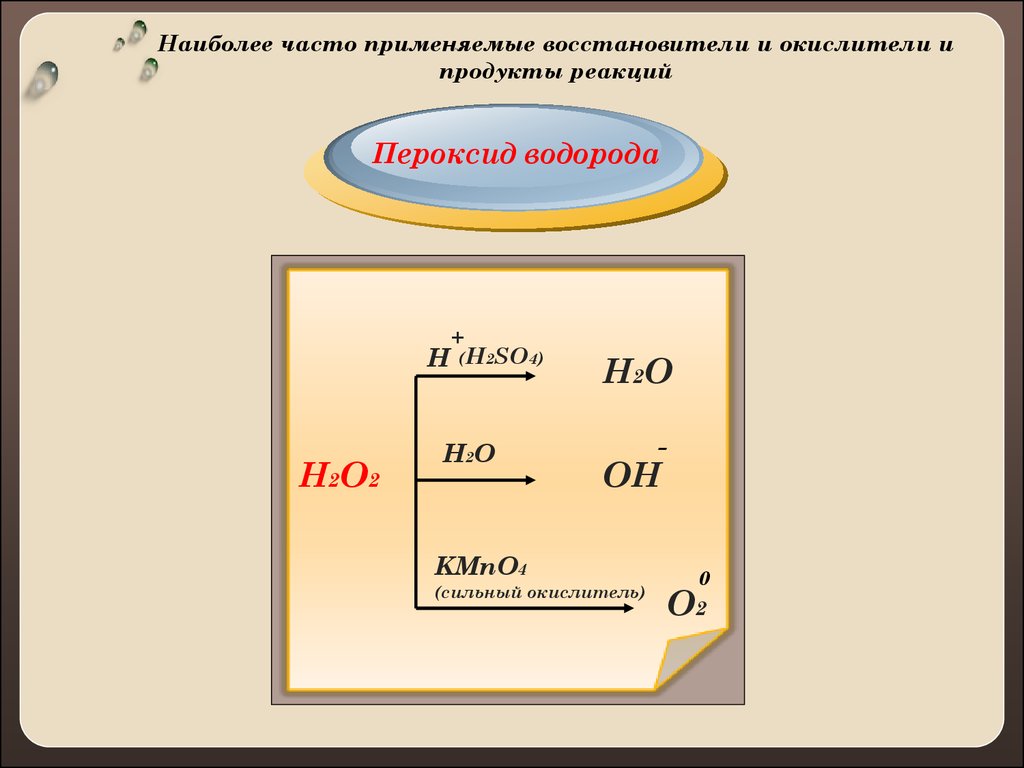
Наиболее часто применяемые восстановители и окислители ипродукты реакций
Пероксид водорода
+
H (H2SO4)
H2O2
H2 O
H2O
-
OH
KMnO4
(сильный окислитель)
0
O2
10.
В кислой среде+4
+7
+6
5Na2SO3 + 2 KMnO4 + 3H2SO4
+7 +5e-
Mn
-
+4
Mn
-1
5 Na2SO4 + 2MnSO4 + K2SO4 + 3 H2O
5
+6
-2e
S
+2
2
S
10
2
- окислитель
5
- восстановитель
+7
+2
10 KI + 2 KMnO4 + 8 H2SO4
2I
-1
+7
Mn
-
-2e
+5e-
0
I2
+2
Mn
+2
2 MnSO4 + 5 I2 + 6K2SO4 + 8 H2O
2
5
0
10
5
- восстановитель
2
- окислитель
11.
В кислой среде-1
+7
+2
2 KMnO4 +16 HCl
+7 +5e-
Mn
-1
2Cl
+3
-2e
2MnCl2 + 2 KCl + 5 Cl2 + 8 H2O
Mn
+2
0
Cl2
5
2
10
+6
N
-2e-
+6 +3e-. 2
2Cr
N
+5
+3
2Cr
2
- окислитель
5
- восстановитель
+5
3 KNO2 + K2Cr2O7 + 4 H2SO4
+3
0
+3
3KNO3 + Cr2(SO4)3 + K2SO4 + 4 H2O
2
6
3
6
1
- восстановитель
- окислитель
12.
В нейтральной среде+7
+4
+4
2 KMnO4 + 3 K2SO3 + H2O
+7 +3e+4
Mn
-
+4
-2e
S
S
+6
+7
6
2
-2
Mn
-2
-2e
3
0
2
+6
2
- окислитель
3
- восстановитель
0
2MnO2 + 2 KOH +3 S+ 2 H2O
Mn
S
2
+4
2 KMnO4 + 3 H2S
+7 +3e+4
S
2 MnO2 + 3 K2SO4 + 2 KOH
3
Mn
2
6
3
-2
2Cr
S
-2
+3e .2
-2e
+3
2Cr
6
0
2
S
- окислитель
- восстановитель
+3
K2Cr O7 + 3 H2S + H2O
+6
+6
2Cr(OH)3
6
0
+ 3 S+ 2KOH
1
- окислитель
3
- восстановитель
13.
В щелочной среде- +3
+7
+6
2 KMnO4 + KNO2 + 2 KOH
+7 +1e-
Mn
+3
N
+6
K2Cr2O7
-
-2e
Mn
N
+6
+5
1
2
2
2K2MnO4 + KNO3 + H2O
2
- окислитель
1
- восстановитель
-2
+ 4KOH+ 3 (NH4)2 S + H2O
+6
2Cr
S
+6e-
-2 -2e-
+3
2Cr
S
0
6
2
6
+5
+3
0
2K3[Cr(OH)6] + 3 S + 6 NH3
1
- окислитель
3
- восстановитель






 chemistry
chemistry








