Similar presentations:
Многообразие неорганических веществ. Соли
1.
ЗАНИМАТЕЛЬНАЯХИМИЯ
ТЕМА: МНОГООБРАЗИЕ НЕОРГАНИЧЕСКИХ
ВЕЩЕСТВ. СОЛИ.
Центр дополнительного образования «Дом научной коллаборации
им. П.К. Анохина»
при ФГБОУ ВО «ПИМУ» Минздрава России
2.
ЗАНИМАТЕЛЬНАЯХИМИЯ
ПРОВЕРКА ДОМАШНЕГО ЗАДАНИЯ
3.
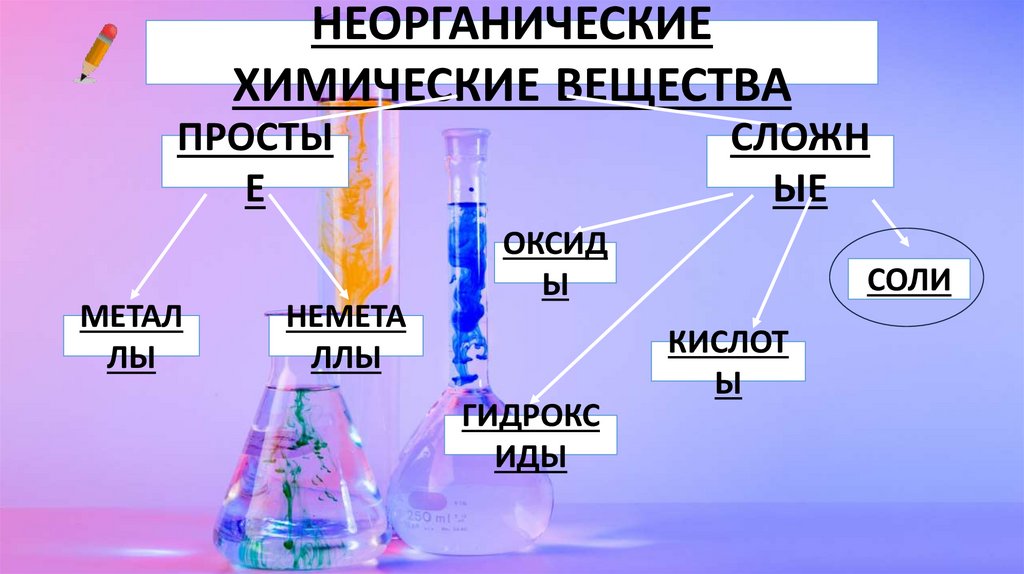
НЕОРГАНИЧЕСКИЕХИМИЧЕСКИЕ ВЕЩЕСТВА
ПРОСТЫ
Е
МЕТАЛ
ЛЫ
НЕМЕТА
ЛЛЫ
СЛОЖН
ЫЕ
ОКСИД
Ы
ГИДРОКС
ИДЫ
СОЛИ
КИСЛОТ
Ы
4.
ХИМИЧЕСКИЕ ВЕЩЕСТВА:КИСЛОТЫ
КИСЛОТЫ – ЭТО СЛОЖНЫЕ
ХИМИЧЕСКИЕ ВЕЩЕСТВА,
СОСТОЯЩИЕ ИЗ ОДНОГО
ИЛИ НЕСКОЛЬКИХ АТОМОВ
ВОДОРОДА, СПОСОБНЫХ
ЗАМЕЩАТЬСЯ АТОМАМИ
МЕТАЛЛА, И КИСЛОТНЫХ
ОСТАТКОВ.
5.
ХИМИЧЕСКИЕ ВЕЩЕСТВА:СОЛИ
СОЛИ – ЭТО СЛОЖНЫЕ
ХИМИЧЕСКИЕ ВЕЩЕСТВА,
СОСТОЯЩИЕ ИЗ КАТИОНА
(МЕТАЛЛА) И АНИОНА
(КИСЛОТНОГО ОСТАТКА).
6.
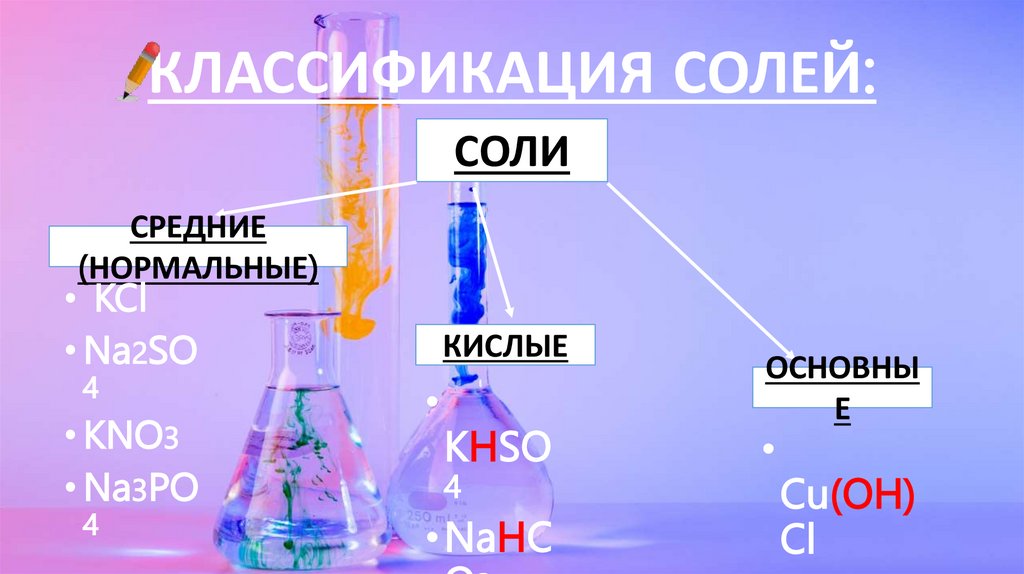
КЛАССИФИКАЦИЯ СОЛЕЙ:СОЛИ
СРЕДНИЕ
(НОРМАЛЬНЫЕ)
• KCl
• Na2SO
4
• KNO3
• Na3PO
4
КИСЛЫЕ
KHSO
4
• NaHC
ОСНОВНЫ
Е
Cu(OH)
Cl
7.
СРЕДНИЕ(НОРМАЛЬНЫЕ)
СОЛИ
Это соли, в которых атомы
водорода в кислоте полностью
замещены
атомами
металлов:
2NaOH + H2SO4 → Na2SO4
КИСЛЫЕ СОЛИ
Это продукт неполного замещения
атомов водорода атомами
металлов
в
кислоте:
NaOH + H2CO3 → NaHCO3
+ 2H2O
+ H 2O
Это продукт неполного замещения
ОСНОВНЫЕ СОЛИ гидроксогрупп основания
кислотным
остатком:
Al(OH)3 + HNO3 →
Al(OH)2NO3 + H2O
8.
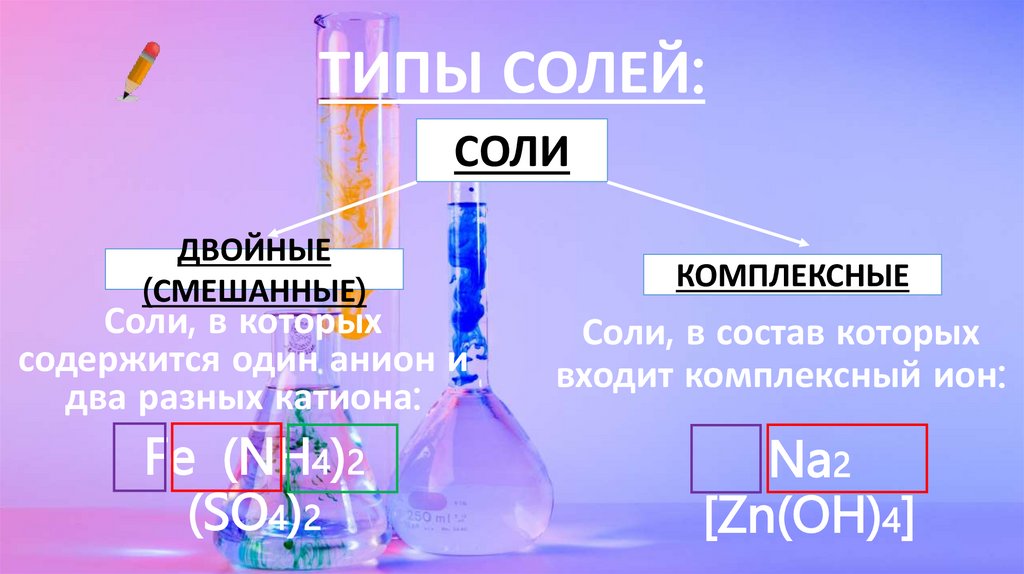
ТИПЫ СОЛЕЙ:СОЛИ
ДВОЙНЫЕ
(СМЕШАННЫЕ)
Соли, в которых
содержится один анион и
два разных катиона:
Fe (NH4)2
(SO4)2
КОМПЛЕКСНЫЕ
Соли, в состав которых
входит комплексный ион:
Na2
[Zn(OH)4]
9.
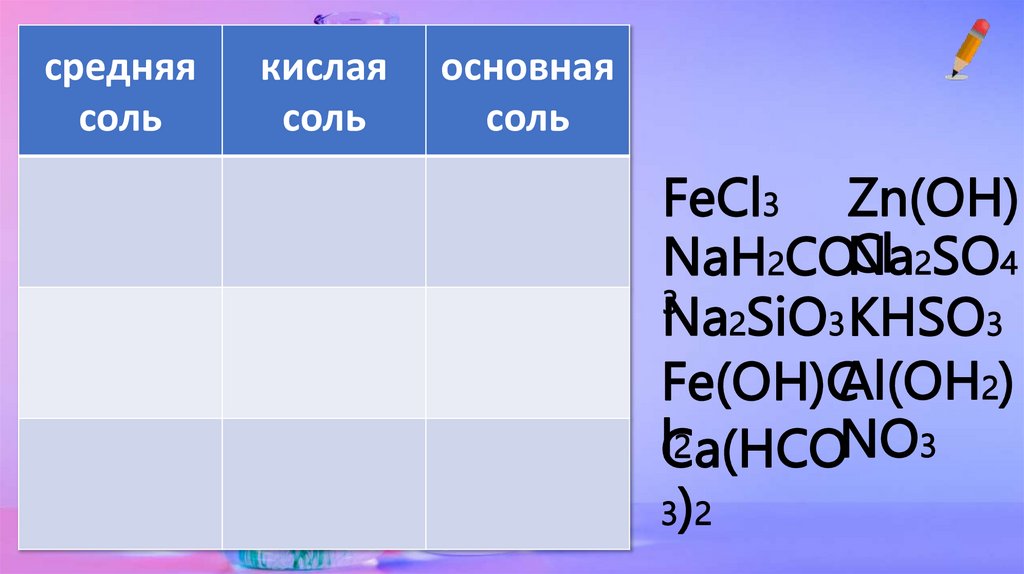
средняясоль
кислая
соль
основная
соль
FeCl3 Zn(OH)
Cl 2SO4
NaH2CONa
3
Na2SiO3 KHSO3
Fe(OH)CAl(OH2)
NO3
lCa(HCO
2
3)2
10.
КАК ДАТЬ НАЗВАНИЯ СОЛЯМ?В ЗАВИСИМОСТИ ОТ КИСЛОТНОГО ОСТАТКА:
2• O – оксид (пример: CuO – оксид меди);
• OH – гидроксид (прим.: NaOH – гидроксид
натрия);
• F – фторид (прим.: NaF – фторид натрия);
3• PO4 – фосфат (прим.: Na3PO4 – фосфат
• Cl – хлорид (прим.: CrCl3 – хлорид хрома);
натрия);
• Br – бромид (прим.: KBr – бромид калия);
2
CO
3
– карбонат (прим.: Na2CO3 – карб
• I – йодид (прим.: KI – йодид калия);натрия).
2• SO3 – сульфит (прим.: Na2SO3 – сульфит
натрия);
2• SO4 – сульфат (прим.: Na2SO4 – сульфат
натрия);
• NO2 – нитрит (прим.: Ba(NO2)2 – нитрит
11.
2+ПОПРОБУЕМ ВМЕСТЕ!
-
бария
Ba Clхлорид
2
2+
2Ca CO3 карбонат
2+
2железа
кальция
Fe2+ SOсульфат
4
нитрат
свинца
Pb (NO3)2
2+
магния
Mg3 3-(POфосфат
4)2
12.
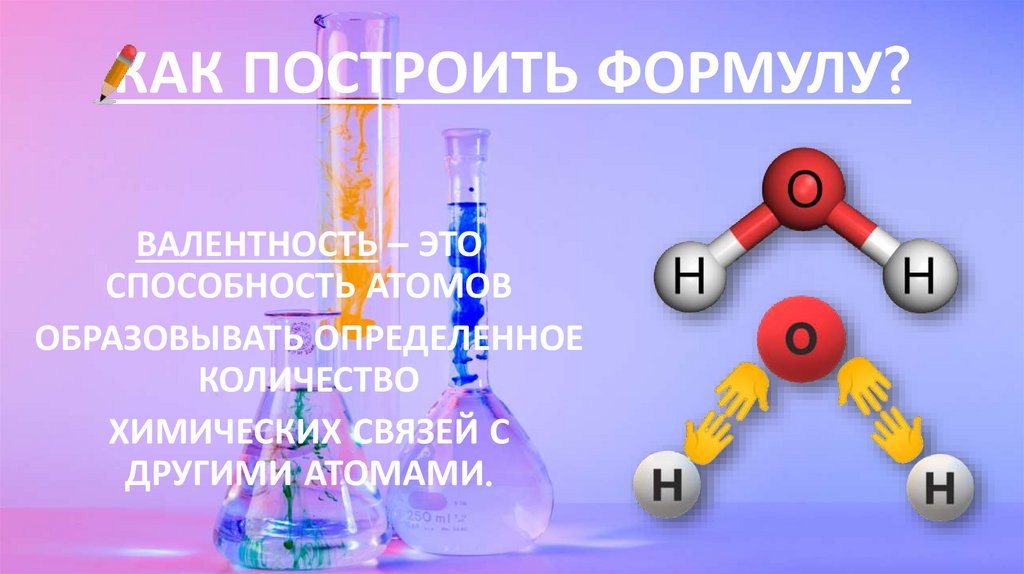
КАК ПОСТРОИТЬ ФОРМУЛУ?ВАЛЕНТНОСТЬ – ЭТО
СПОСОБНОСТЬ АТОМОВ
ОБРАЗОВЫВАТЬ ОПРЕДЕЛЕННОЕ
КОЛИЧЕСТВО
ХИМИЧЕСКИХ СВЯЗЕЙ С
ДРУГИМИ АТОМАМИ.
13.
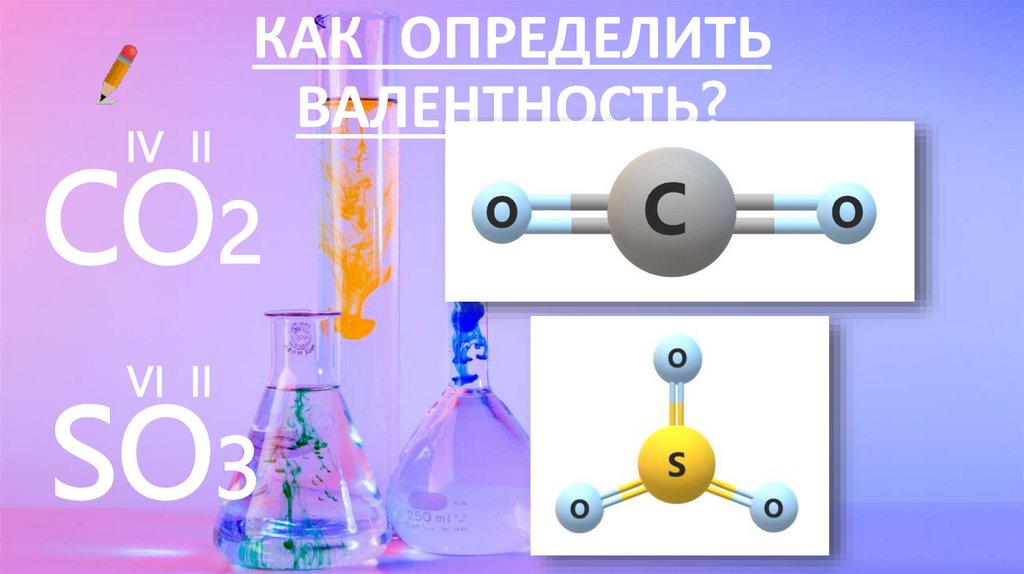
IV IIКАК ОПРЕДЕЛИТЬ
ВАЛЕНТНОСТЬ?
CO2
VI II
SO3
14.
15.
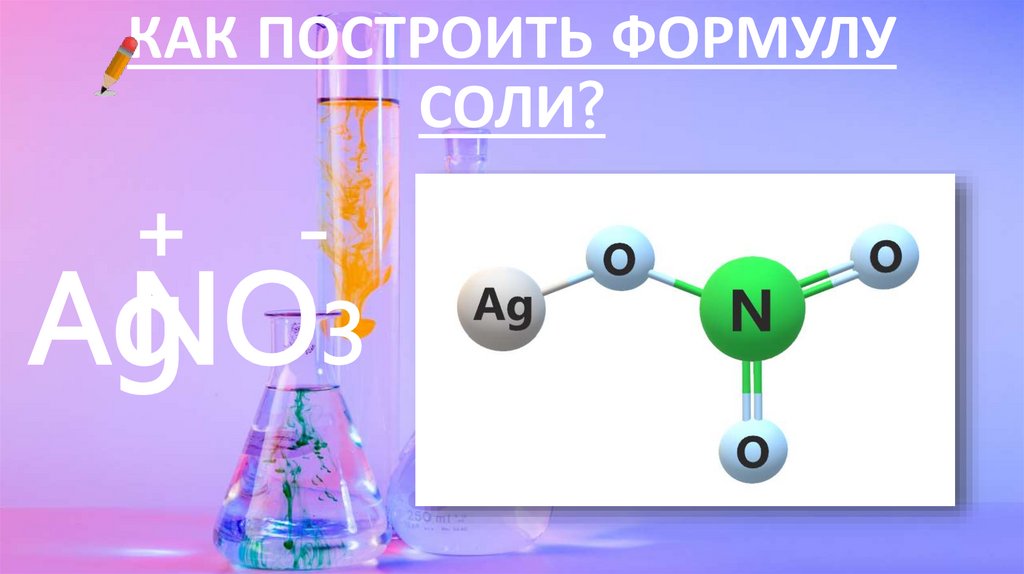
КАК ПОСТРОИТЬ ФОРМУЛУСОЛИ?
+
AgNO3
16.
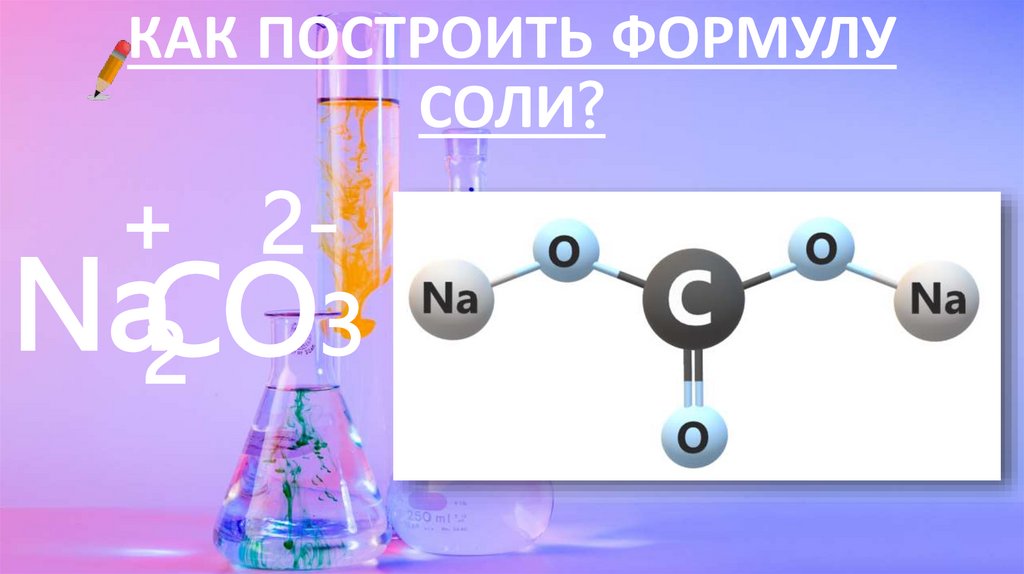
КАК ПОСТРОИТЬ ФОРМУЛУСОЛИ?
+ 2Na2CO3
17.
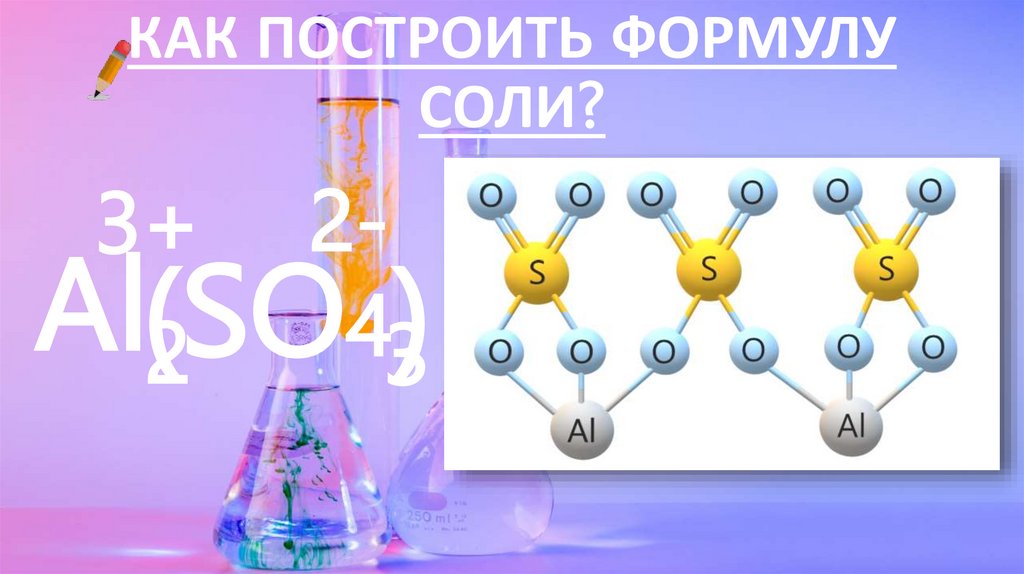
КАК ПОСТРОИТЬ ФОРМУЛУСОЛИ?
2Al(2SO43)
3+
18.
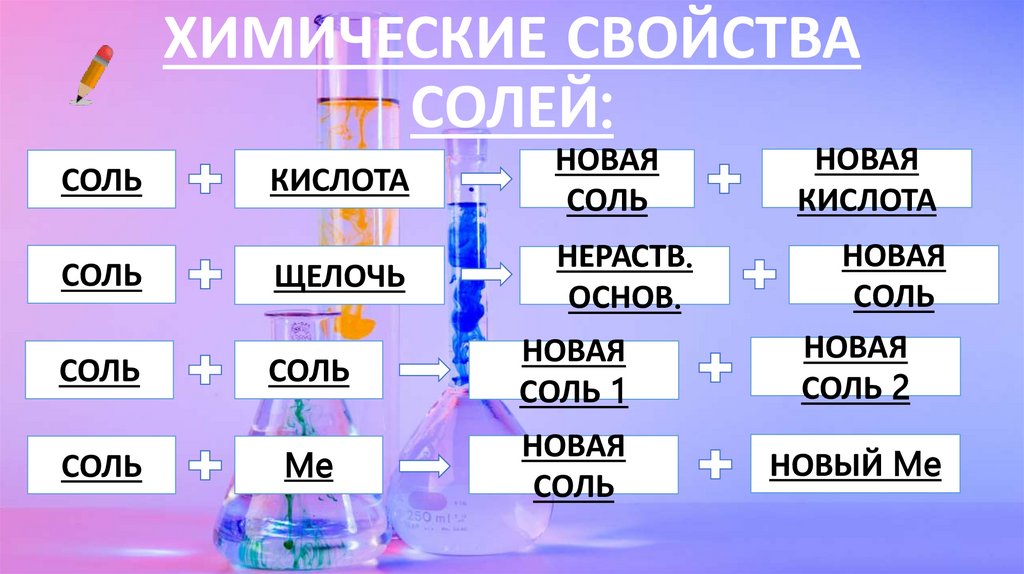
ХИМИЧЕСКИЕ СВОЙСТВАСОЛЕЙ:
СОЛЬ
СОЛЬ
СОЛЬ
СОЛЬ
КИСЛОТА
НОВАЯ
СОЛЬ
НОВАЯ
КИСЛОТА
ЩЕЛОЧЬ
НЕРАСТВ.
ОСНОВ.
НОВАЯ
СОЛЬ
НОВАЯ
СОЛЬ 2
СОЛЬ
НОВАЯ
СОЛЬ 1
Me
НОВАЯ
СОЛЬ
НОВЫЙ Me
19.
ДОМАШНЕЕ ЗАДАНИЕ1. Составить формулы для следующих солей и
расставить заряды:
хлорид калия; сульфат меди; нитрат магния;
фосфат кальция.
2. Дать названия следующим веществам:
CuCl2; Ca(OH)2; Ba(NO3)2; MgSO4; Zn3(PO4)2.
2. Составить структурные формулы следующих
веществ и
20.
ПРАКТИКА21.
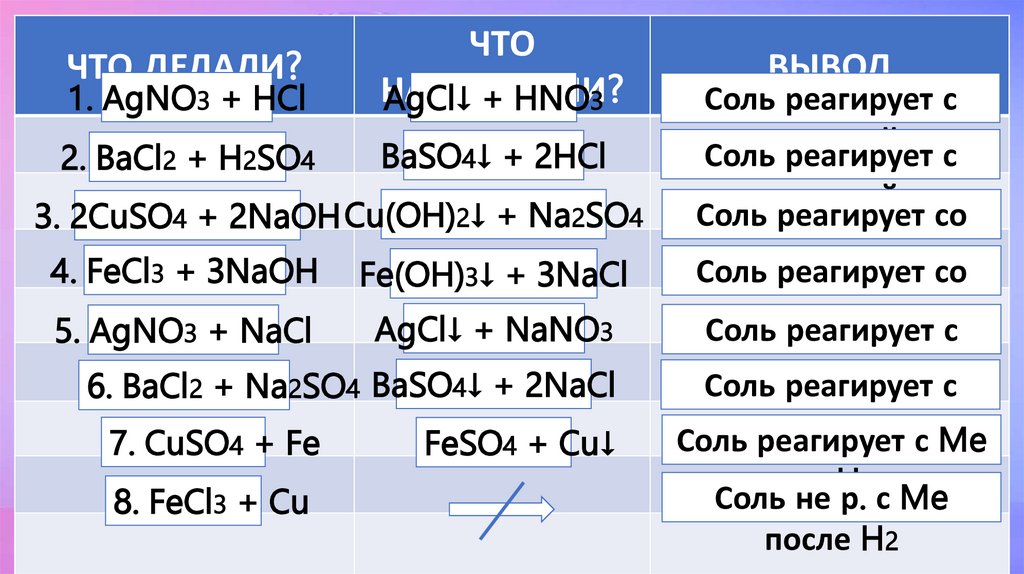
ЧТО ДЕЛАЛИ?1. AgNO3 + HCl
ЧТО
НАБЛЮДАЛИ?
AgCl↓ + HNO3
2. BaCl2 + H2SO4
BaSO4↓ + 2HCl
3. 2CuSO4 + 2NaOH Cu(OH)2↓ + Na2SO4
4. FeCl3 + 3NaOH
5. AgNO3 + NaCl
Fe(OH)3↓ + 3NaCl
AgCl↓ + NaNO3
6. BaCl2 + Na2SO4 BaSO4↓ + 2NaCl
7. CuSO4 + Fe
8. FeCl3 + Cu
FeSO4 + Cu↓
ВЫВОД
Соль реагирует с
кислотой
Соль реагирует с
кислотой
Соль реагирует со
щелочью
Соль реагирует со
щелочью
Соль реагирует с
солью
Соль реагирует
с
солью с Me
Соль реагирует
до
H
2
Соль не р. с Me
после H2
22.
СПАСИБО ЗАВНИМАНИЕ!










 chemistry
chemistry








