Similar presentations:
Белки. Биохимия
1.
БиохимияКафедра «Биотехнология и технология продуктов
биоорганического синтеза»
Доцент, к.б.н. Суслянок Георгий Михайлович
2.
Предмет и задачи курсабиохимии
Биохимия изучает структурные и функциональные основы живой
материи.
Уровни структурной организации
живой природы
Атом → Молекула → Макромолекула → Вирус → Клетка →
→ Ткань → Орган → Организм → Популяция → Биоценоз →
→ Биосфера
Биохимия изучает вещества, слагающие живую природу, их
строение, свойства, а также превращения этих веществ в
процессах жизнедеятельности организмов.
Объект исследований в биохимии — живые организмы, а методы
исследований — химические. Поэтому биохимию часто называют
химией жизни.
3.
Признаки живой материи1) Биологический обмен веществ (метаболизм):
Ассимиляция (анаболизм) — это реакции образования из простых
веществ более сложных, идут с затратой энергии;
Диссимиляция (катаболизм) — это процессы распада сложных веществ
на более простые, идут с выделением энергии.
2) Высокий уровень структурной организации (клеточное строение).
3) Способность извлекать энергию из окружающей среды (биоэнергетика).
4) Асимметрия биологического синтеза.
5) Способность к самовоспроизведению.
Жизнь есть триединый поток вещества, энергии и информации.
4.
БелкиБиологические функции белков
Структурная (формируют каркасы внутриклеточных органелл и внеклеточных
структур, т.е. являются строительным материалом живой природы; коллаген и
эластин — основа соединительной и костной ткани высших животных и человека,
кератины — основа роговых производных эпидермиса кожи);
Каталитическая (обеспечивается белками — ферментами, которые ускоряют
биохимические реакции, обеспечивая необходимые скорости протекания обменных
процессов);
Транспортная (гемоглобин крови транспортирует кислород от лёгких к тканям и СО2
в обратном направлении, миоглобин транспортирует кислород к митохондриям
внутри клеток красных мышц);
Регуляторная (гормон инсулин регулирует уровень глюкозы в крови);
Защитная (иммуноглобулины (антитела), интерфероны вырабатываются при
попадании в организм чужеродных частиц, фибриноген способствует остановке
кровотечений);
Рецепторная (родопсин — белок, участвующий в зрительном акте);
5.
Биологические функции белков(продолжение)
Сократительная (белки мышц — миозин и актин — обеспечивают мышечное
сокращение и расслабление);
Запасающая (яичный альбумин, глиадин пшеницы, зеин кукурузы, казеин
молока и др. являются резервными белками, предназначенными для
питания развивающихся клеток);
Инертные белки (белки волос, ногтей, шерсти, когтей, рогов, копыт,
перьев, клювов, панцирей, игл и т.п., а также фиброин шелка, паутины);
Токсичные белки (яды змей, скорпионов, грибов, растений,
микроорганизмов).
Общая характеристика белков
Белки — высокомолекулярные соединения, масса которых составляет от 6000
до 1 000 000 Да.
Белки коагулируют при нагревании, осаждаются белковыми осадителями,
дают цветные реакции, при полном гидролизе распадаются до аминокислот.
Белки — это высокомолекулярные полимеры аминокислот.
6.
АминокислотыВ природе обнаружено около 200 аминокислот, однако из них в построении
белков участвует 20, которые называют протеиногенными. Остальные
аминокислоты называют непротеиногенными.
Общая формула протеиногенных аминокислот
Все 20 протеиногенных аминокислот являются L-α-аминокислотами и все они имеют
генетический код (шифр).
7.
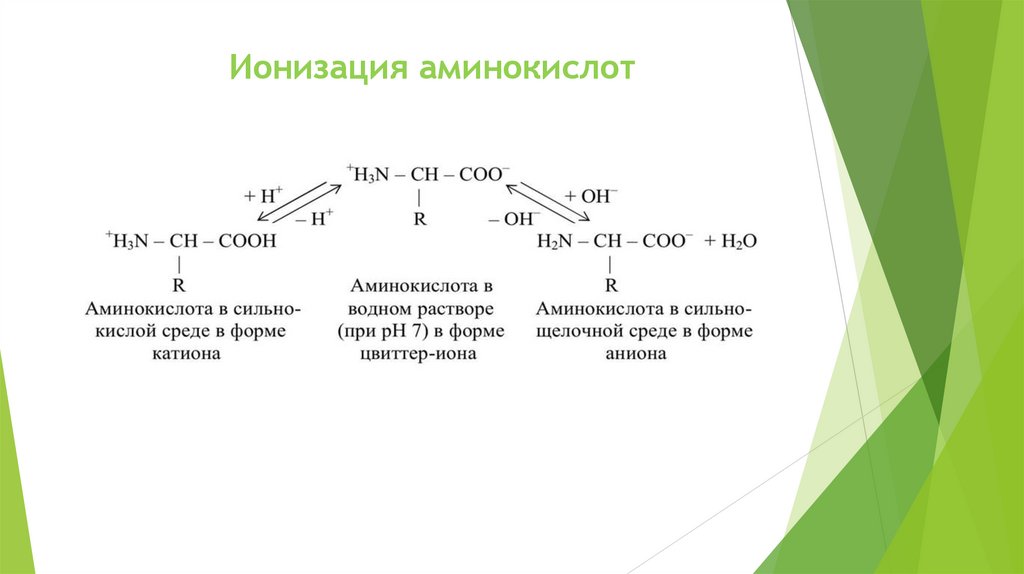
Ионизация аминокислот8.
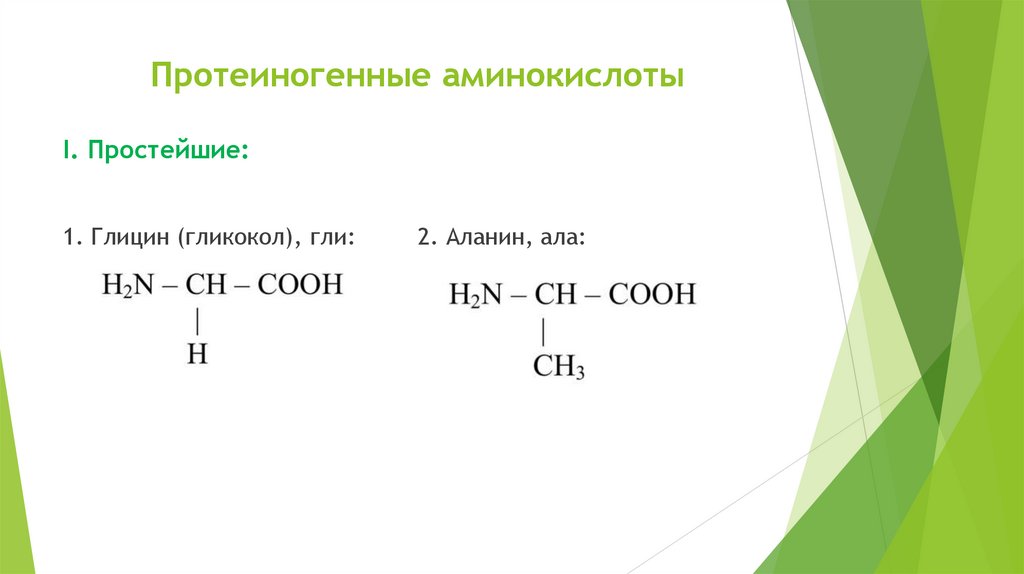
Протеиногенные аминокислотыI. Простейшие:
1. Глицин (гликокол), гли:
2. Аланин, ала:
9.
Протеиногенные аминокислоты(продолжение)
II. Гидроксиаминокислоты:
3. Серин, сер:
4. Треонин, тре:
10.
Протеиногенные аминокислоты(продолжение)
III. Серосодержащие аминокислоты:
5. Цистеин, цис:
6. Метионин, мет:
11.
Образование цистина —пример биологического окисления
Два цистеина могут взаимодействовать друг с другом с образованием цистина:
Упрощенная запись этой реакции:
12.
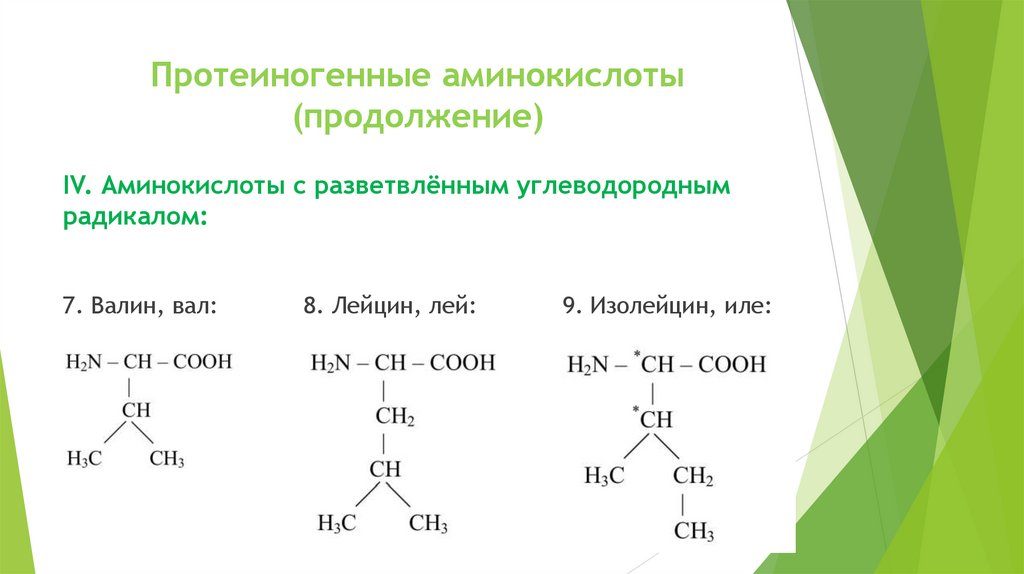
Протеиногенные аминокислоты(продолжение)
IV. Аминокислоты с разветвлённым углеводородным
радикалом:
7. Валин, вал:
8. Лейцин, лей:
9. Изолейцин, иле:
13.
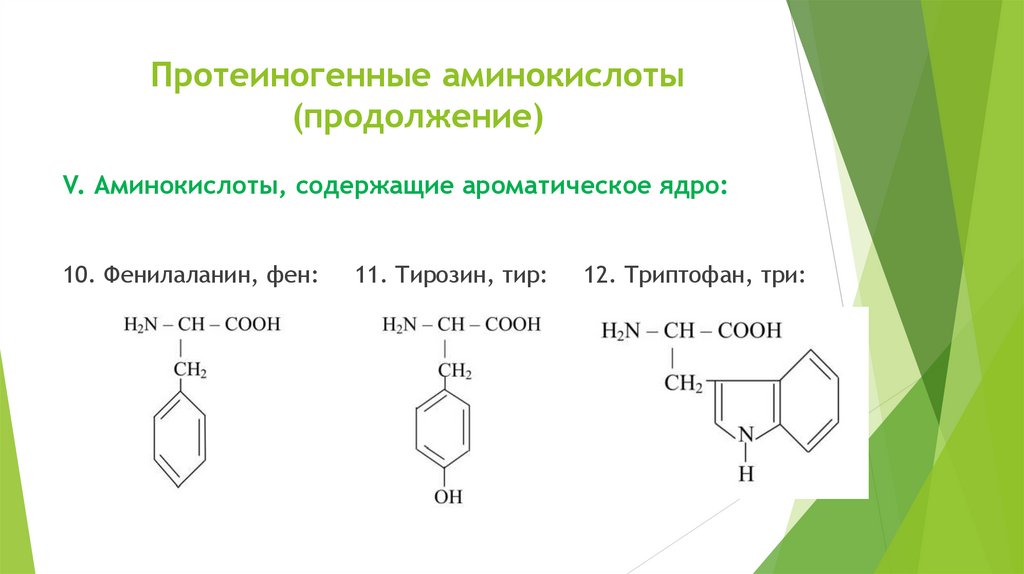
Протеиногенные аминокислоты(продолжение)
V. Аминокислоты, содержащие ароматическое ядро:
10. Фенилаланин, фен:
11. Тирозин, тир:
12. Триптофан, три:
14.
Протеиногенные аминокислоты(продолжение)
VI. Кислые аминокислоты:
13. Аспарагиновая кислота, асп:
14. Глутаминовая кислота, глу:
15.
Протеиногенные аминокислоты(продолжение)
VII. Амиды кислых аминокислот:
15. Аспарагин, асн:
16. Глутамин, глн:
16.
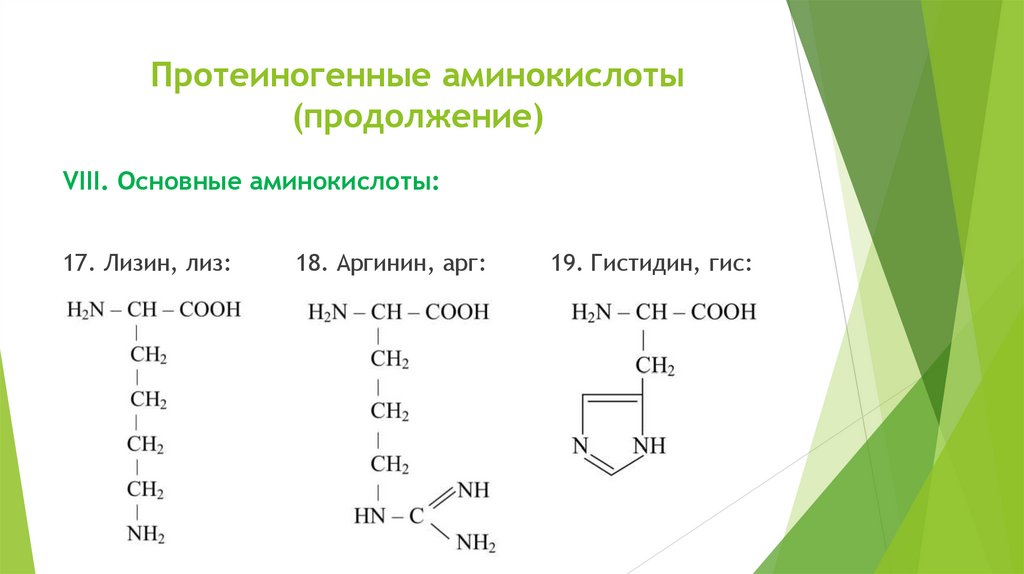
Протеиногенные аминокислоты(продолжение)
VIII. Основные аминокислоты:
17. Лизин, лиз:
18. Аргинин, арг:
19. Гистидин, гис:
17.
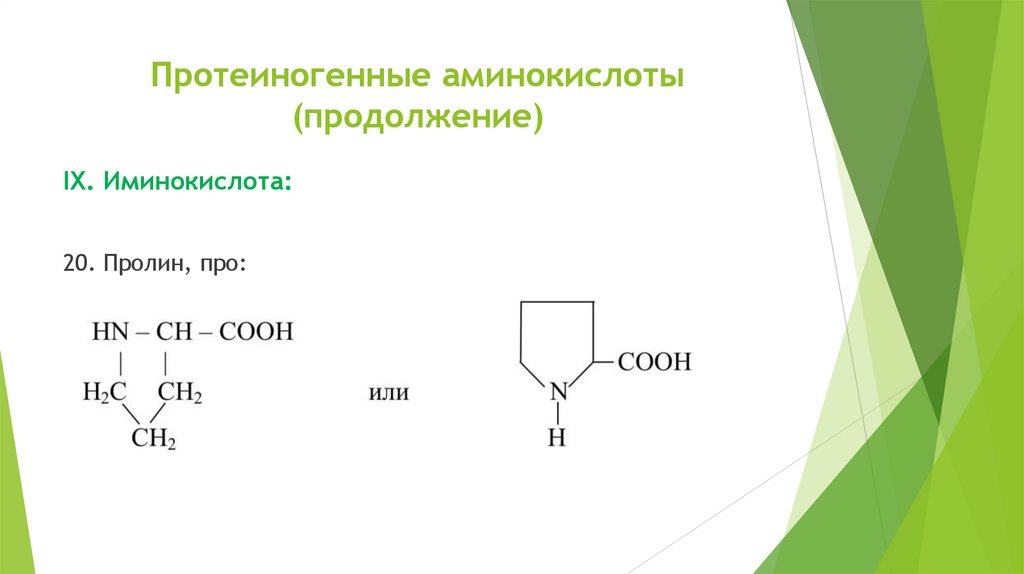
Протеиногенные аминокислоты(продолжение)
IХ. Иминокислота:
20. Пролин, про:
18.
Физико-химическая классификацияаминокислот
По радикалам аминокислоты делятся на 2 группы:
Гидрофильные (серин, треонин, тирозин, цистеин,
аспарагин, глутамин, лизин, аргинин, гистидин,
аспарагиновая и глутаминовая кислоты);
Гидрофобные (аланин, валин, лейцин, изолейцин,
фенилаланин, триптофан, пролин и метионин).
19.
Некоторые функции аминокислот1) Структурные элементы:
↓
Витамин В3
↓
Углеводы Кофермент А Жиры
2) Радиопротекторы: цистеин.
3) Нейромедиаторы:
4) Образование меланинов: окисление тирозина.
5) Образование меланоидинов: продукты сахароаминных реакций.
6) Вкусовые продукты: глутамат натрия.
20.
Пищевая ценность белковПервичный синтез аминокислот протекает только в растениях. Животные и человек
используют готовые аминокислоты либо синтезируют их путём перестройки
аминокислот (вторичный синтез).
Протеиногенные аминокислоты делятся на:
Незаменимые (валин, лейцин, изолейцин, фенилаланин, триптофан, треонин,
метионин, лизин). Они не синтезируются человеком и животными и обязательно
должны поступать с пищей.
Заменимые (глицин, аланин, серин, цистеин, тирозин, пролин, гистидин,
аргинин, аспарагиновая кислота, глутаминовая кислота, аспарагин, глутамин).
Они могут синтезироваться человеком и животными.
Цистеин и тирозин относят к условно заменимым аминокислотам, т.е. к заменимым
аминокислотам при условии достаточного поступления с пищей метионина и
фенилаланина (цистеин синтезируется из метионина, а тирозин — из фенилаланина).
Аргинин и гистидин — частично заменимые аминокислоты. Они синтезируются в
организме человека в недостаточном количестве.
21.
Нарушения обмена аминокислотПри некоторых, чаще всего врожденных, заболеваниях перечень незаменимых
аминокислот может расширяться. Например, в организме людей, страдающих
фенилкетонурией, реакция превращения фенилаланина в тирозин не
протекает. Заболевание проявляется в нарушении развития мозга у
новорожденных и, как следствие, умственной отсталости. Для таких людей
тирозин является незаменимой аминокислотой, и продукты с высоким
содержанием фенилаланина из их рациона следует исключить.
Отсутствие в рационе хотя бы одной из незаменимых аминокислот приводит к
нарушению обмена веществ, лимитированию роста и развития организма.
При недостатке аминокислот в пище возможны атрофия мышц у животных,
падёж скота, снижение яйценоскости.
В организме человека нарушается равновесие между процессами биосинтеза и
распада, клетки голодают, нарушается умственное развитие, снижается
способность к обучаемости у детей, нарушается развитие органов и тканей
плода. Это серьёзная социальная проблема.
22.
Трофическая цепьБелки в питании человека
Роль белков в питании человека: они являются источниками аминокислот.
Суточная норма потребления белков для населения Земли — 70–80 г, для России — 100 г.
Или 1,0-1,5 г на 1 кг массы тела, для детей — 1,5-4,0 г.
80 % потребляемого белка — растительные белки, 20 % — животные белки. Идеальным считается
соотношение: 45 % растительных белков и 55 % животных белков.
Для биосинтеза 1 г животных белков нужно потребить 6-8 г растительных белков.
23.
Полноценные и неполноценные белкиБелки, содержащие все восемь незаменимых аминокислот в
требуемом количестве и соотношении для питания человека
называют полноценными.
Если хотя бы одна из восьми незаменимых аминокислот в белке
отсутствует или содержится в крайне малом количестве, то такой
белок считается неполноценным в пищевом отношении.
Как правило, животные белки являются полноценными, растительные белки —
неполноценные.
Наиболее полноценными являются белки куриного яйца, молока.
Повышенное содержание белка имеется в твороге, мясе, рыбе, из растений —
в бобовых (соя, фасоль, горох, чечевица).
Белки картофеля являются исключением: они полноценные. Но содержание
белков в картофеле — всего 2 %.
24.
Аминокислотный скор белковДля характеристики пищевой ценности белка чаще всего пользуются
специальным показателем — аминокислотным скором (от англ. “score” —
счёт), который рассчитывается по формуле:
где Х — количество миллиграммов аминокислоты, содержащееся в 1 г
исследуемого белка;
А — количество миллиграммов этой же аминокислоты, содержащееся в 1 г
эталонного белка.
Эталонный белок — теоретический идеальный белок, в котором все
незаменимые аминокислоты присутствуют в оптимальном количестве и
соотношении для питания человека.
25.
Лимитирующие аминокислотыАминокислота, имеющая наименьший скор, называется лимитирующей. Она
лимитирует (ограничивает) усвоение всего белка.
Самой дефицитной аминокислотой является лизин. Например, в белках зерна
пшеницы её скор составляет 56 %.
Решение проблемы дефицита белков в питании и
обогащения белков лимитирующими аминокислотами:
1)
2)
3)
4)
5)
У злаковых мало лизина и триптофана, но достаточно серосодержащих
аминокислот, у бобовых — наоборот. В составе рациона питания следует
комбинировать бобовые и злаковые.
Выведение сортов с высоким содержанием незаменимых аминокислот.
Повышение продуктивности животноводства и растениеводства.
Индустриальное производство белков: производство кормовых дрожжей,
приготовление белково-витаминных концентратов, выделение белков из
непищевого сырья растительного происхождения.
Совершенствование технологии хранения и переработки пищевого сырья с
целью минимизации потерь белков.
26.
Образование пептидовПептиды — это низкомолекулярные полимеры аминокислот с
молекулярной массой до 6 000 Да.
Группа -CO-NH- называется пептидной группой, а связь между атомами
углерода и азота в пептидной группе — пептидной связью.
Пептидная связь — ковалентная. Она очень прочная, относится к сильным
взаимодействиям.
27.
ГлутатионГлутатион — трипептид, состоящий из остатков трёх аминокислот:
глутаминовой кислоты, цистеина и глицина.
Реакцию взаимопревращений двух форм глутатиона можно записать так:
Глутатион содержится во всех живых организмах. Он присутствует в
дрожжах, зародыше зерна пшеницы, крови человека и животных и др.
Основными биологическими функциями глутатиона являются регуляция
окислительно-восстановительных процессов в клетках, а также
каталитической активности ряда ферментов.
28.
Функции пептидов– регуляция пищеварения (гастрин, секретин);
- регуляция мышечных сокращений (анзерин, карнозин);
- гормоны (окситоцин, вазопрессин, глюкагон);
- нейропептиды (пептиды поведения, памяти, сна);
- яды (аманитин бледной поганки, фаллоидин мухомора, апамин пчёл,
конотоксин морских моллюсков)
- антибиотики (грамицидин S).
29.
Структурная организациябелковой молекулы
Белки представляют собой полипептиды, молекулярная масса
которых составляет 6 000-1 000 000 Да и более. Таким образом, они
являются высокомолекулярными соединениями, состоящими из
большого числа аминокислотных остатков.
В отличие от низкомолекулярных пептидов, белки обладают хорошо
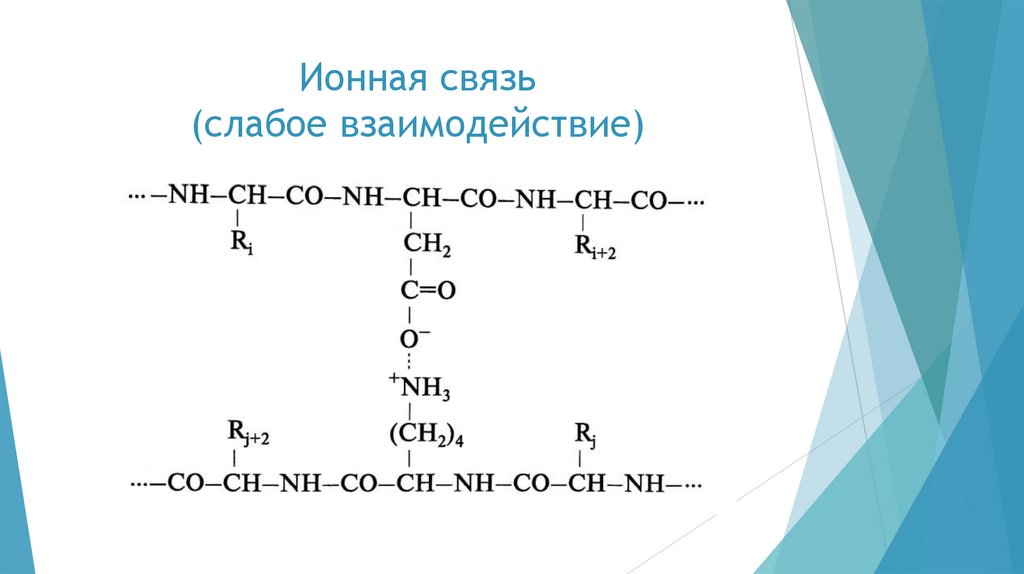
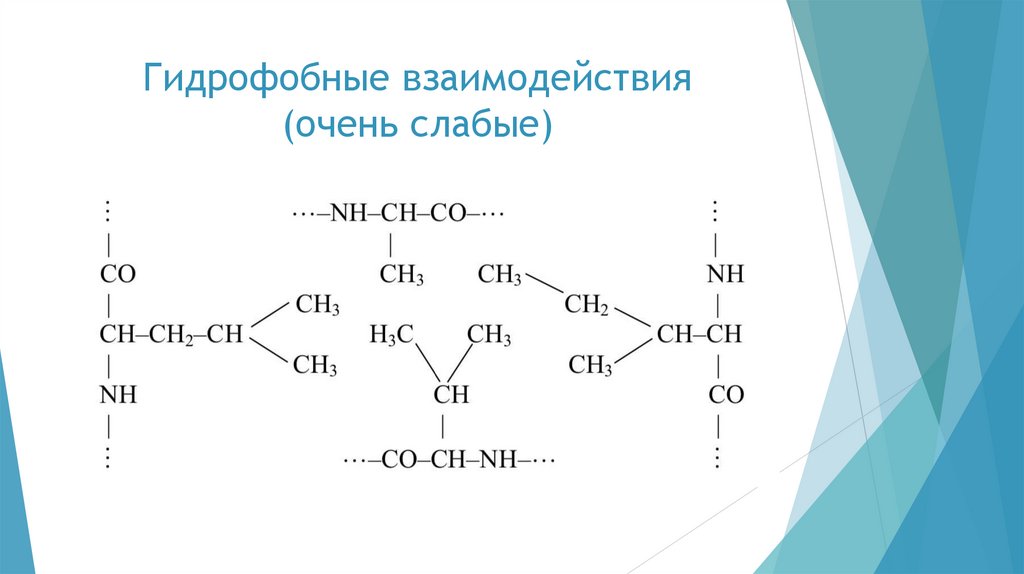
развитой трёхмерной пространственной структурой, которая
стабилизируется различного рода взаимодействиями — сильными и
слабыми.
Различают четыре уровня структурной организации белковых
молекул: первичную, вторичную, третичную и четвертичную
структуры.
30.
Первичная структура белкаПервичная структура белка представляет собой последовательность
аминокислотных остатков, соединённых друг с другом пептидными связями в
полипептидную цепочку.
Первичная структура белка прочная, так как основу её построения
составляют ковалентные по характеру пептидные связи, представляющие
собой сильные взаимодействия.
31.
Первичная структура белка(продолжение)
Соединяясь между собой в различной последовательности,
протеиногенные аминокислоты образуют изомеры.
Из трёх аминокислот можно построить 6 трипептидов (3! = 6).
Из четырёх аминокислот — 24 тетрапептида (4! = 24).
Из пяти — 120 пентапептидов (5! = 120).
Из 20 ≈ 2·1018 полипептидов.
При этом каждая аминокислота участвует в построении данных
полипептидных цепочек только один раз.
32.
Наименования аминокислотных остатковНазвания полипептидов образуются путём последовательного перечисления
тривиальных названий всех аминокислотных остатков, начиная с N-конца,
с заменой их окончаний на «-ил». Окончание С-концевой аминокислоты
не меняется.
Глицин → глицил,
Аланин → аланил,
Серин → серил,
Треонин → треонил,
Цистеин → цистеинил,
Метионин → метионил,
Валин → валил,
Лейцин → лейцил,
Изолейцин → изолейцил,
Фенилаланин → фенилаланил,
Тирозин → тирозил,
Триптофан → триптофанил
(триптофил),
Пролин → пролил,
Гистидин → гистидил,
Лизин → лизил,
Аргинин → аргинил,
Аспарагин → аспарагинил,
Глутамин → глутаминил,
Аспарагиновая кислота → аспарагил
(аспартил),
Глутаминовая кислота → глутамил.
33.
Первичная структура белка(продолжение)
Аминокислоты — азбука белка.
Минимальная масса белка 6 000 Да. Средняя молекулярная масса
протеиногенной аминокислоты 120 Да. Следовательно, в белке
содержится как минимум 50 аминокислотных остатков
(6 000 Да / 120 Да = 50 АК).
Последовательность аминокислотных остатков обуславливает
разнообразие белковых молекул.
Первичная структура уникальна для каждого белка. Она определяет
все биологические особенности, специфичность белковых молекул.
Первичная структура белка задана генетически.
34.
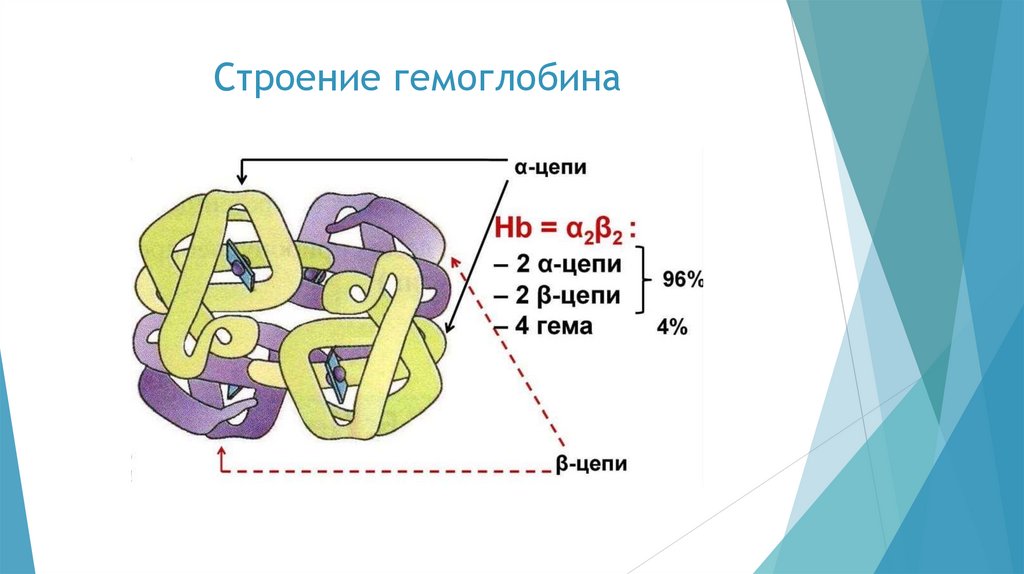
Серповидноклеточная анемияБолезни, связанные с нарушениями первичной структуры белка, получили
название молекулярных.
Одной из молекулярных болезней является серповидноклеточная анемия,
причина которой кроется в ничтожном нарушении первичной структуры
гемоглобина. Если у здоровых людей полипептидная цепочка в молекуле
гемоглобина, состоящая из 146 аминокислотных остатков, начинается с такой
последовательности аминокислотных остатков:
Вал-Гис-Лей-Тре-Про-Глу-Глу-Лиз-Сер-···,
то у людей с врождённой аномалией структуры
она начинается иначе:
гемоглобина
Вал-Гис-Лей-Тре-Про-Вал-Глу-Лиз-Сер-···
Аномальный гемоглобин хуже транспортирует кислород, в результате чего
больные постоянно испытывают кислородное голодание. Заболевание
проявляется в замедлении развития, общей слабости организма, сокращении
продолжительности жизни.
35.
Расшифровкапервичной структуры белка
Расшифровав первичную структуру инсулина, Ф. Сэнгер впервые
подтвердил полипептидную теорию строения белковой молекулы
Э.Г. Фишера и доказал, что белки — это химические соединения,
обладающие строго определённой структурой, которую можно
изобразить в виде химической формулы, показывающей порядок
соединения аминокислотных остатков в полипептидной цепочке.
36.
ИнсулинПервичная структура молекулы бычьего инсулина:
37.
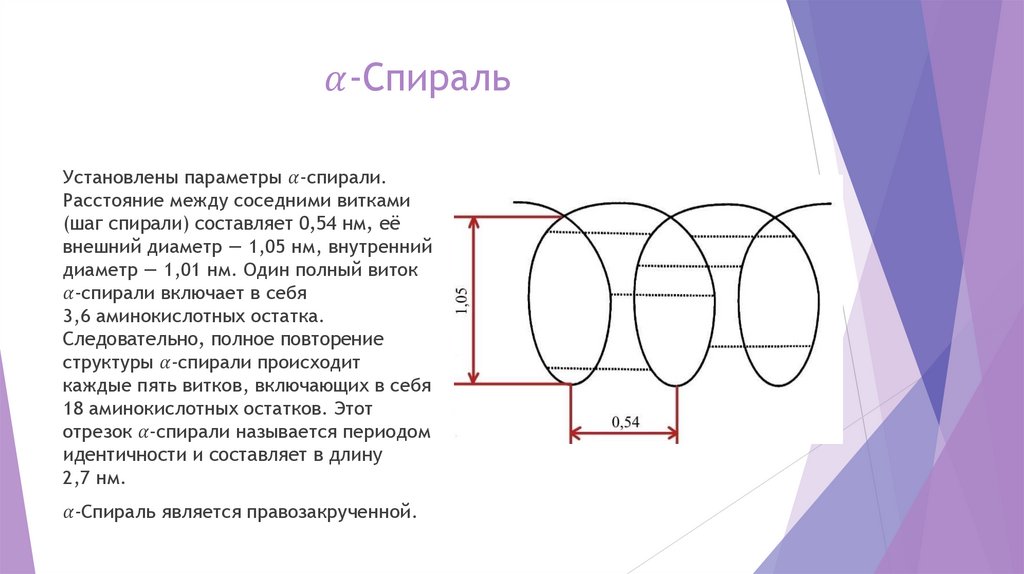
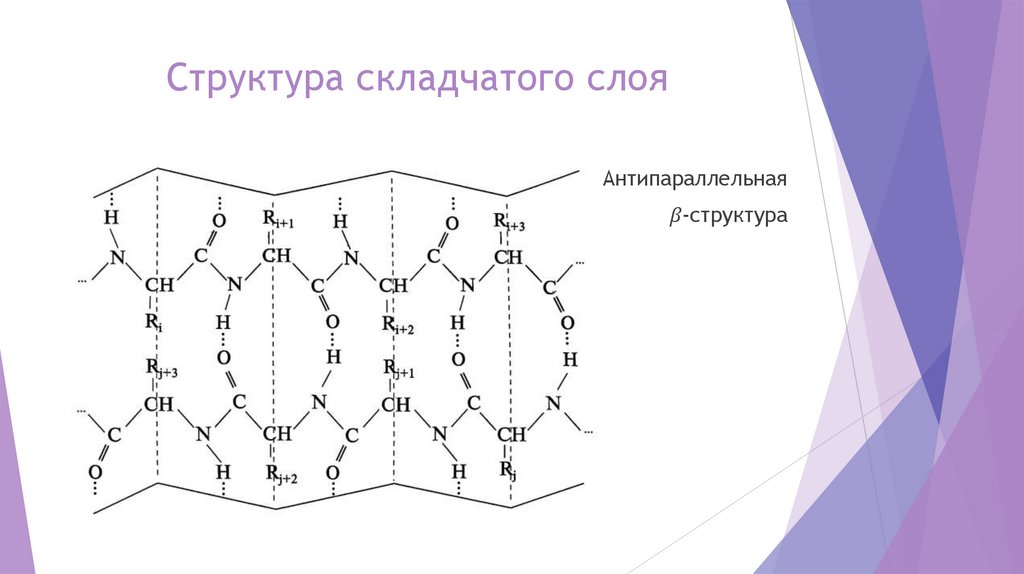
Вторичная структура белкаВторичная структура белка представляет собой сочетание упорядоченных и
аморфных участков полипептидной цепи.
Длина пептидной связи близка к длине двойной связи и составляет 0,1325 нм.
Поэтому свободное вращение атомов углерода и азота вокруг пептидной связи
затруднено, и повороты в полипептидной цепи могут совершаться только по
связям, примыкающим к

























































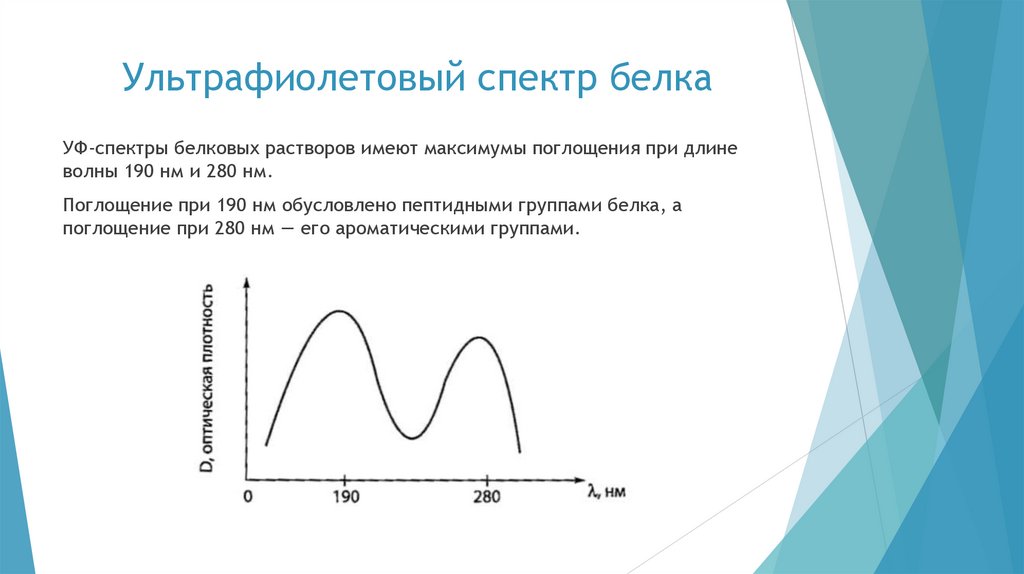




 chemistry
chemistry








