Similar presentations:
Электрический ток в электролитах (билет 22.2)
1. Билет 22, вопрос 2 ЭЛЕКТРИЧЕСКИЙ ТОК В ЭЛЕКТРОЛИТАХ
2. Электролиты – это вещества с ионной проводимостью. Могут быть как жидкими, так и твёрдыми. Растворы электролитов часто также
называют электролитами. Это– растворы солей, кислот,
щелочей
3. Электролиз – это выделение на электродах веществ, входящих в состав электролита, при прохождении через электролит
электрического тока4. Если через раствор медного купороса пропустить электрический ток, то ионы чистой меди будут нейтрализоваться на угольном
катоде, а ионы остаткасерной кислоты после
нейтрализации на медном аноде и
образования новых молекул
медного купороса будут уходить в
раствор
5. Само явление электролиза было открыто в 1800 году англ.учёными. У. Никольсоном и А. Карлейлем. Законы электролиза были
установлены в1833 -1834гг. англ.уч. Майклом
Фарадеем. Им также были
введены термины: «катод»,
«анод», «электроды»,
«электролиз», «электролиты»
6. Закон Фарадея для электролиза
7.
8. m= k I t
m= k I t9. Масса вещества, выделившегося на электроде, прямо пропорциональна силе тока и времени прохождения тока через раствор (расплав)
электролита10. m=M / N A q = n e n – валентность хим. элемента q- заряд иона k= M / (e N A n) ( иногда это выражение называют вторым законом
m=M / N Aq=ne
n – валентность хим. элемента
q- заряд иона
k= M / (e N A n)
( иногда это выражение называют вторым
законом Фарадея)
11. F = e N A = 9,65• 10 4 (Кл/моль) F – постоянная Фарадея
F = eN4
A = 9,65• 10
(Кл/моль)
F – постоянная Фарадея
12. Получаем объединённый закон Фарадея m = M q / F n
Получаемобъединённый закон
Фарадея
m=Mq/Fn
13. Электролиз широко применяется в технике: декоративное покрытие металлических изделий тонким слоем другого металла (золочение.
Никелирование идр.), электролитическое
изготовление копий
рельефных предметов, очистка
металлов от примесей










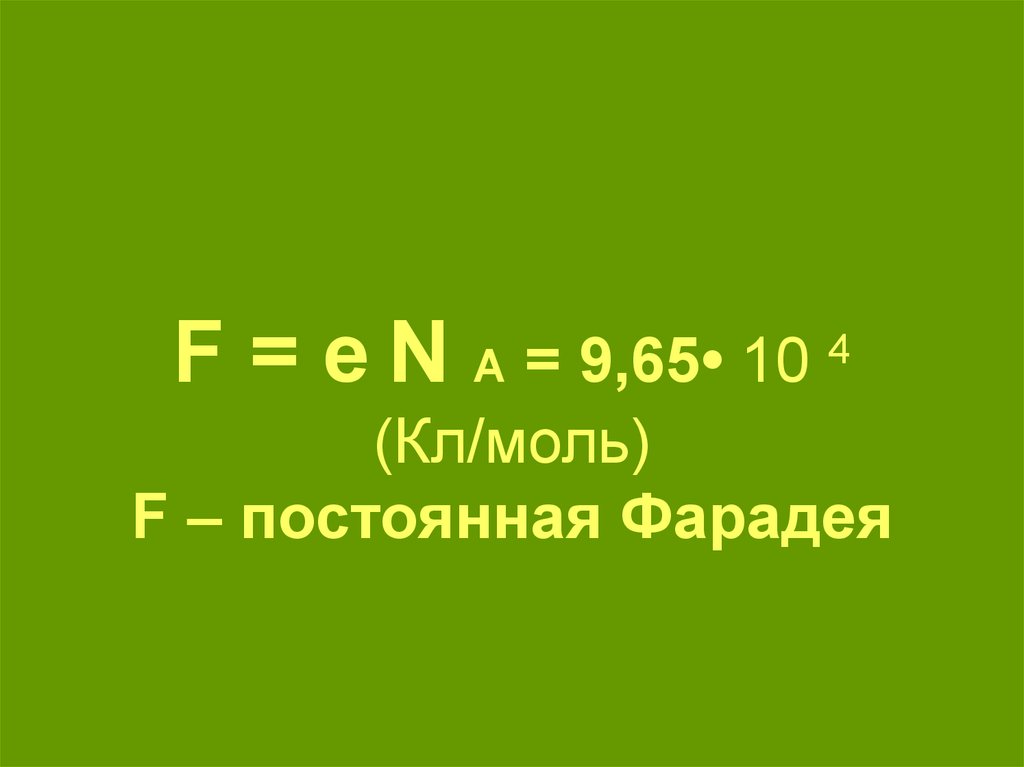


 physics
physics








