Similar presentations:
Электролитическая диссоциация
1. Электролитическая диссоциация
2.
1. В первой половине ХIХ в. М.Фарадейввел понятие об электролитах и
неэлектролитах.
2. В 1887г. С.Аррениус предложил теорию
этектролитической диссоциации.
3. Каблуков И. и Кистяковский В.
объяснили нахождение в растворе
катионов(+) и анионов(-).
3.
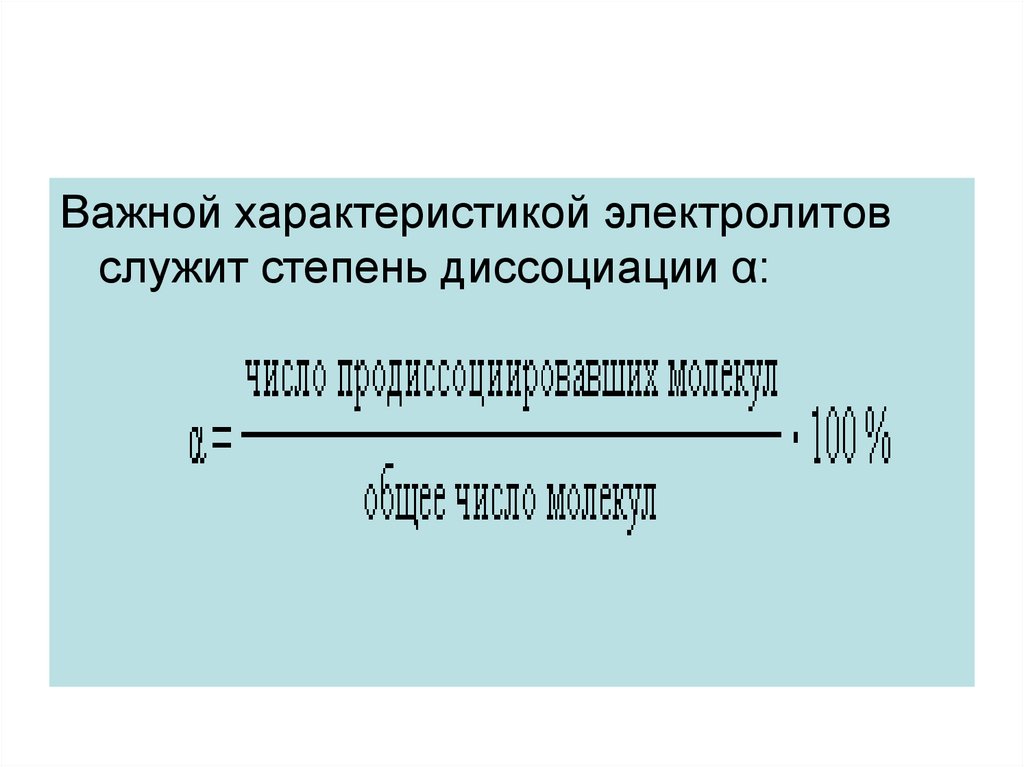
Важной характеристикой электролитовслужит степень диссоциации α:
4. По величине степени диссоциации электролиты делятся на слабые и сильные.
Слабые:Сильные:
HNO3, H2SO4, HCl, HBr, HNO2, HCN, H2SO3,
H2S, HF, H2CO3
HI, HClO4, HMnO4 ,
H2SiO3,
все одноосновные
органические
щелочи, а так же
кислоты, все
основания Ca, Sr, Ba
остальные
основания, вода.
5.
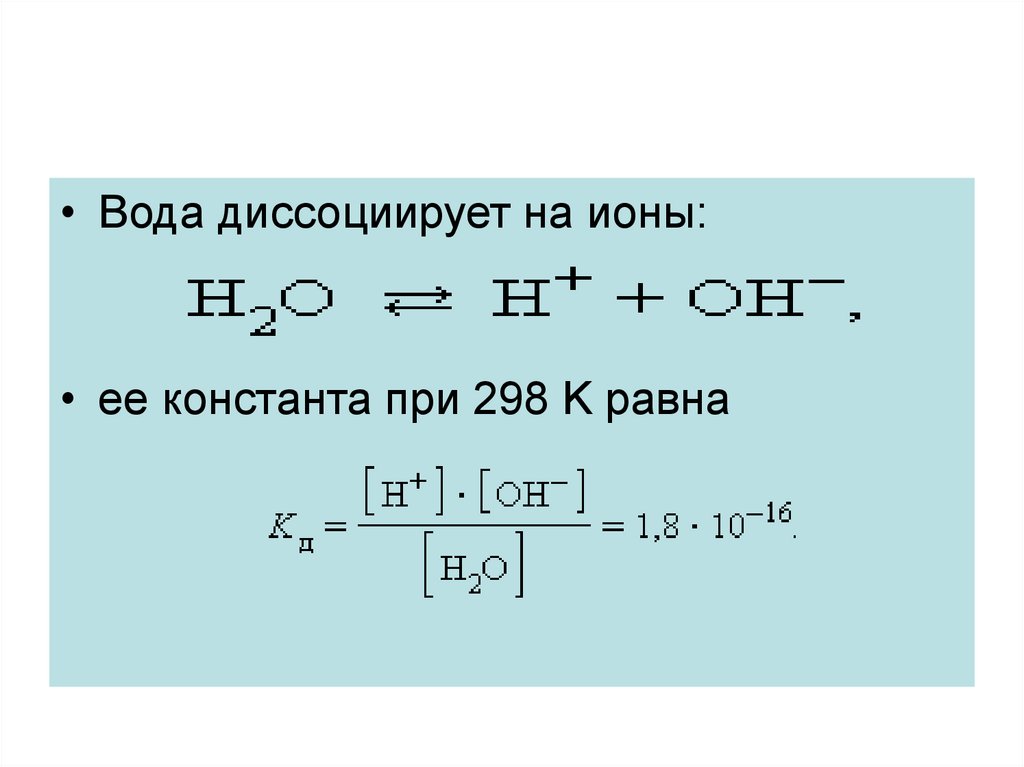
• Вода диссоциирует на ионы:• ее константа при 298 K равна
6.
Таким образом, в пределах 15–25 °Cионное произведение воды Kв = 10–14
7.
Равенство [H+] и [OH–] соответствуетнейтральной среде [H+] = [OH–] = 1 ∙ 10–7
при [H+] > 1 ∙ 10–7 – кислой,
при [H+] < 1 ∙ 10–7 – щелочной.





 chemistry
chemistry








