Similar presentations:
Наглядное пособие «Динамические модели». Кристаллы. Немолекулярные вещества. Простые вещества
1.
Лилия КузнецоваНаглядное пособие
«Динамические модели»
Электронное приложение к учебнику «Химия-8»
© Кузнецова
2005
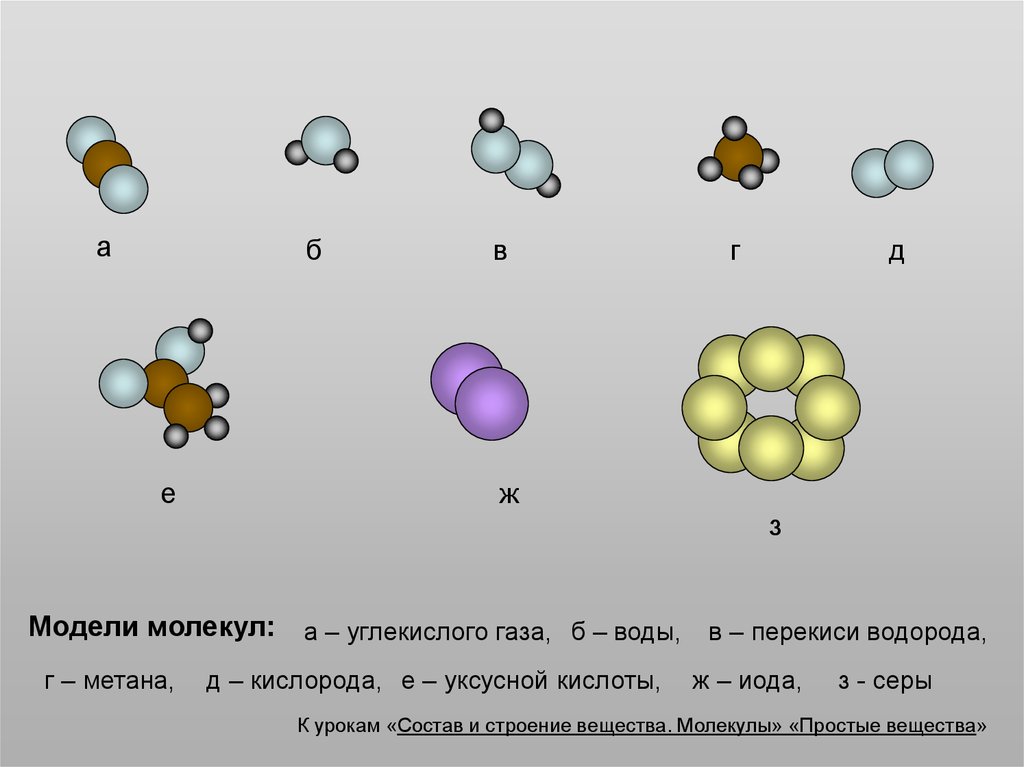
2. а
бе
в
г
д
ж
з
Модели молекул: а – углекислого газа, б – воды, в – перекиси водорода,
г – метана,
д – кислорода, е – уксусной кислоты,
ж – иода,
з - серы
К урокам «Состав и строение вещества. Молекулы» «Простые вещества»
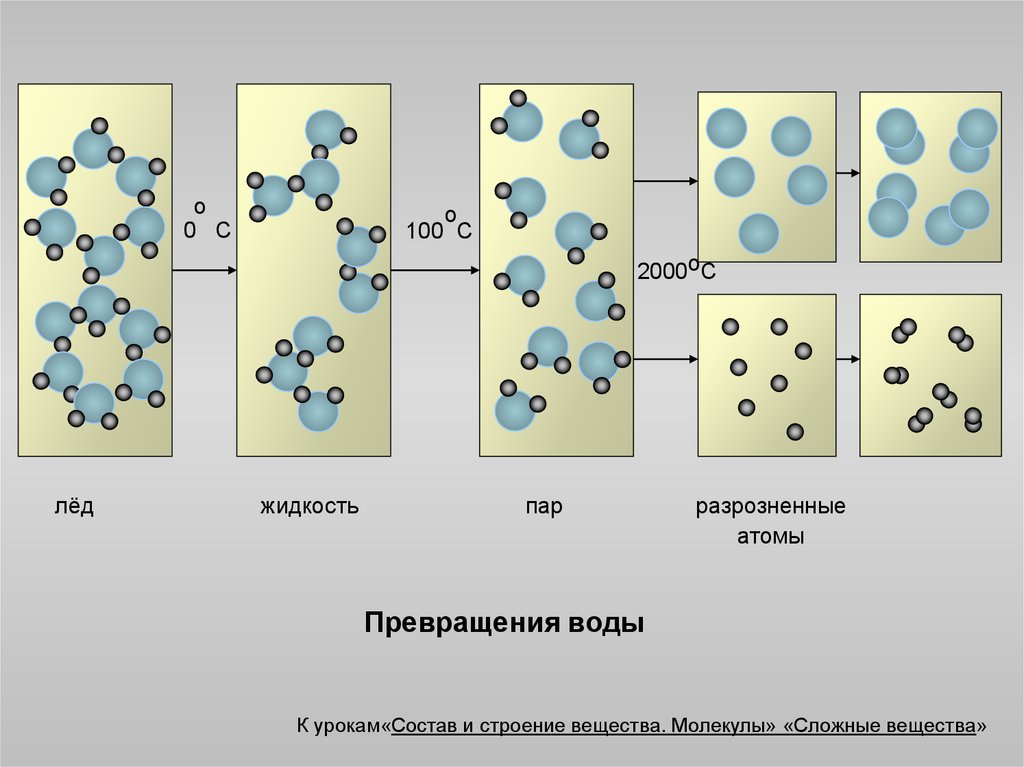
3.
о0 С
о
100 С
2000оС
лёд
жидкость
пар
разрозненные
атомы
Превращения воды
К урокам«Состав и строение вещества. Молекулы» «Сложные вещества»
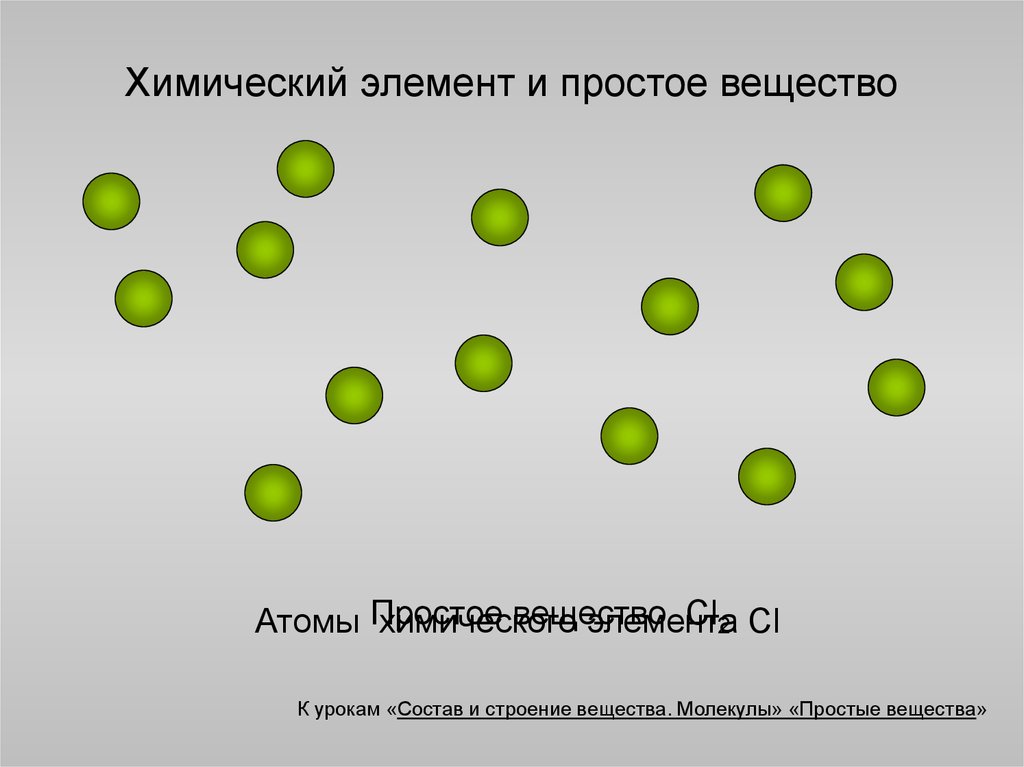
4. Химический элемент и простое вещество
веществоCl2 Cl
Атомы Простое
химического
элемента
К урокам «Состав и строение вещества. Молекулы» «Простые вещества»
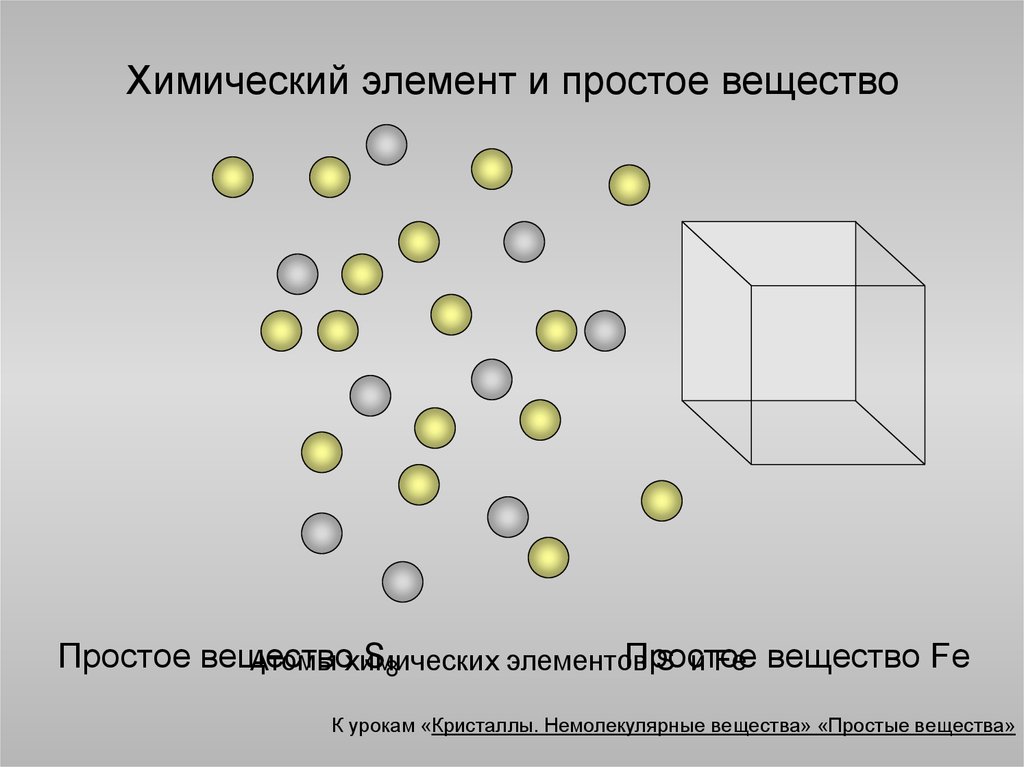
5. Химический элемент и простое вещество
Простое веществоS8
Простое
Атомы химических
элементов
S и Fe вещество Fe
К урокам «Кристаллы. Немолекулярные вещества» «Простые вещества»
6.
ПростоеХимический
вещество
элемент
Al Al
К урокам «Кристаллы. Немолекулярные вещества» «Простые вещества»
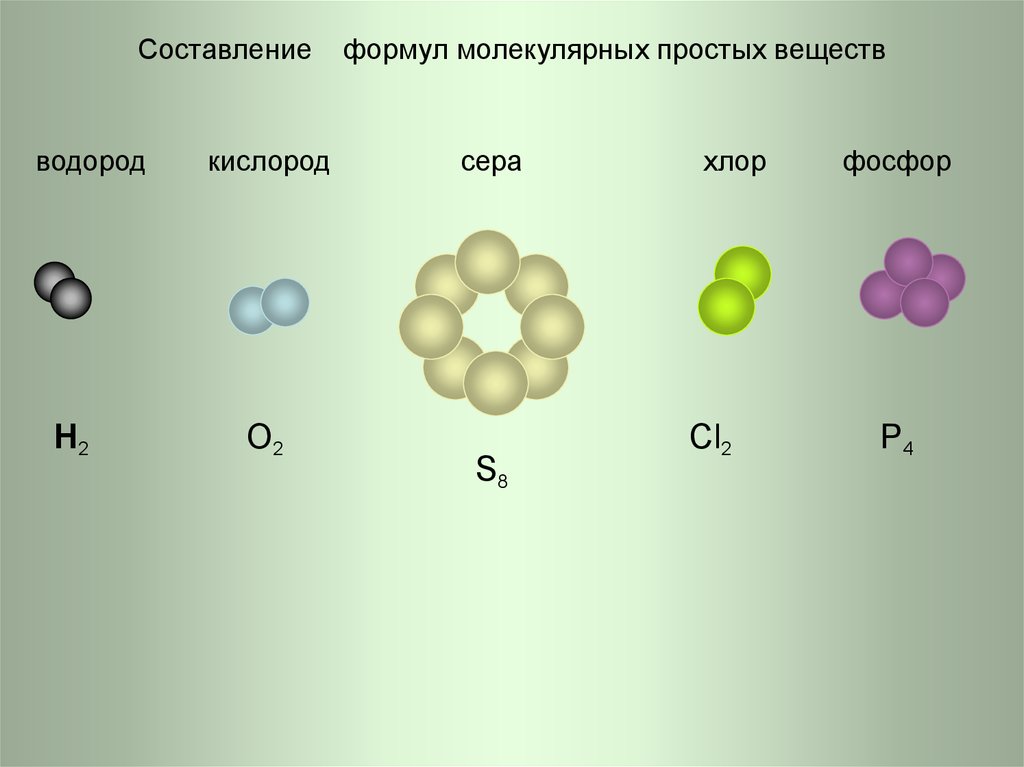
7. Составление формул молекулярных простых веществ
Составлениеводород
H2
кислород
O2
формул молекулярных простых веществ
сера
S8
хлор
Cl2
фосфор
P4
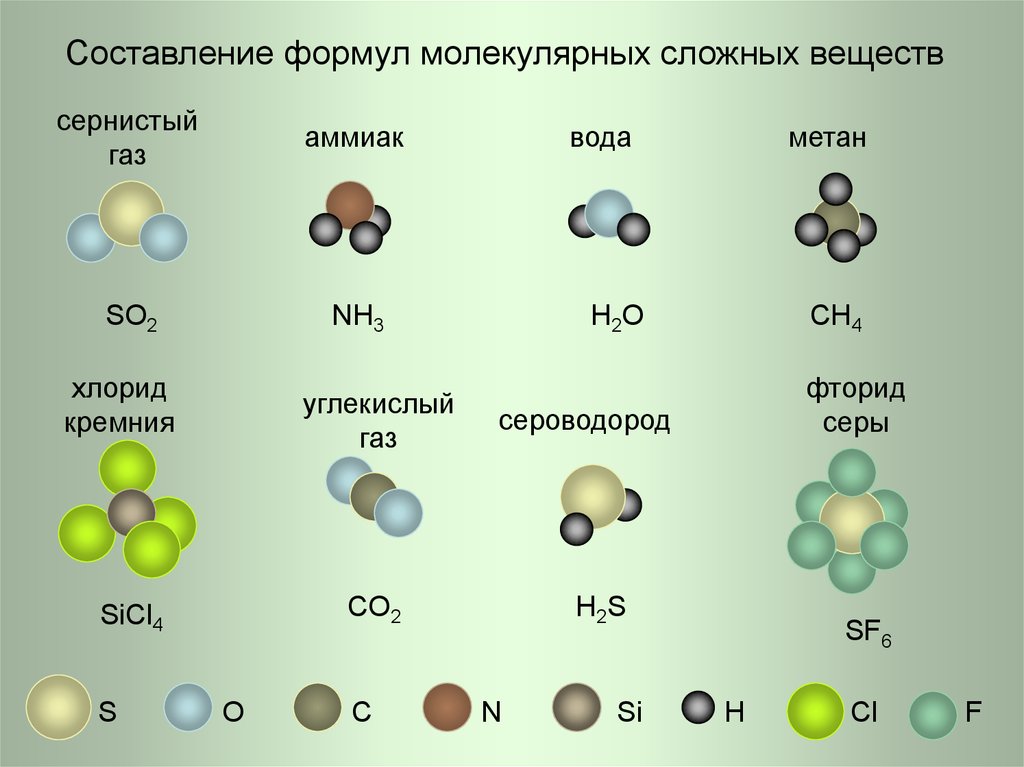
8. Составление формул молекулярных сложных веществ
сернистыйгаз
аммиак
SO2
NH3
хлорид
кремния
углекислый
газ
O
C
метан
H 2O
CH4
фторид
серы
сероводород
CO2
SiCl4
S
вода
H 2S
N
Si
SF6
H
Cl
F
9.
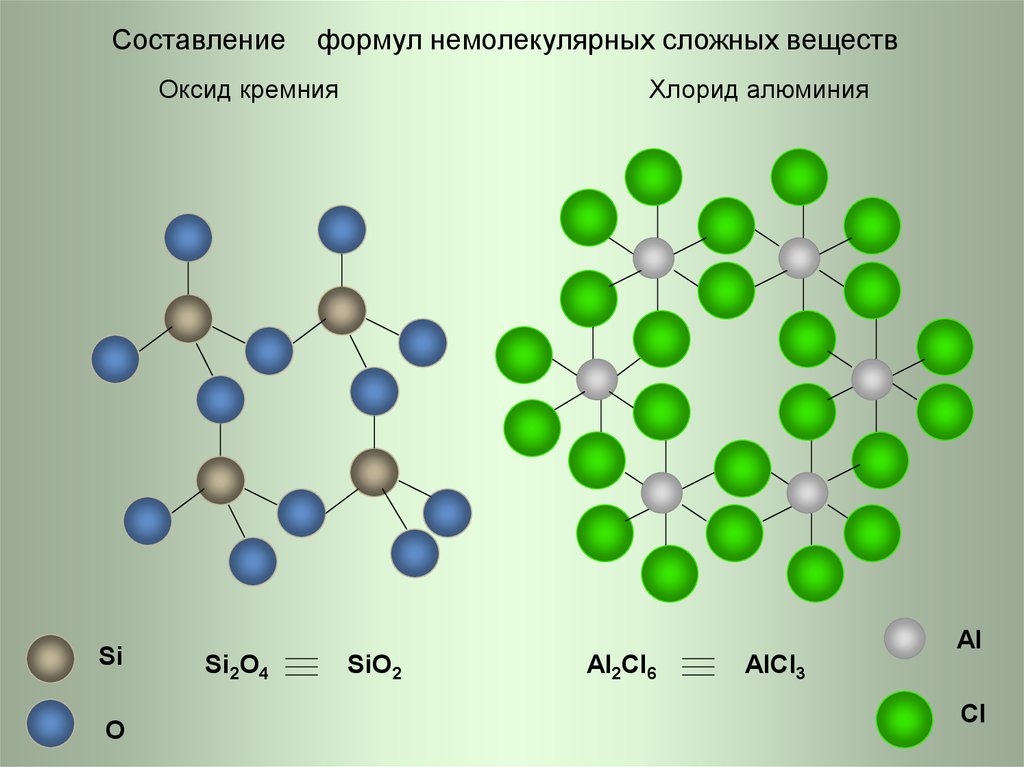
Составлениеформул немолекулярных сложных веществ
Оксид кремния
Si
O
Хлорид алюминия
Al
Si2O4
SiO2
Al2Cl6
AlCl3
Cl
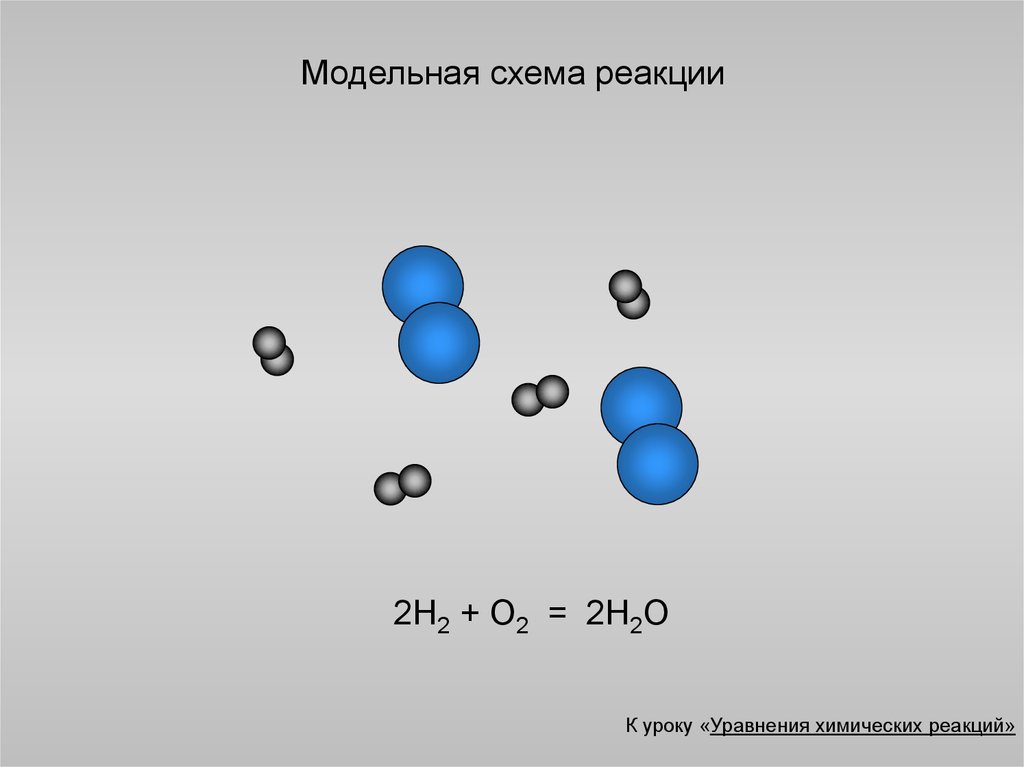
10. Модельная схема реакции
2Н2 + О2 = 2Н2ОК уроку «Уравнения химических реакций»
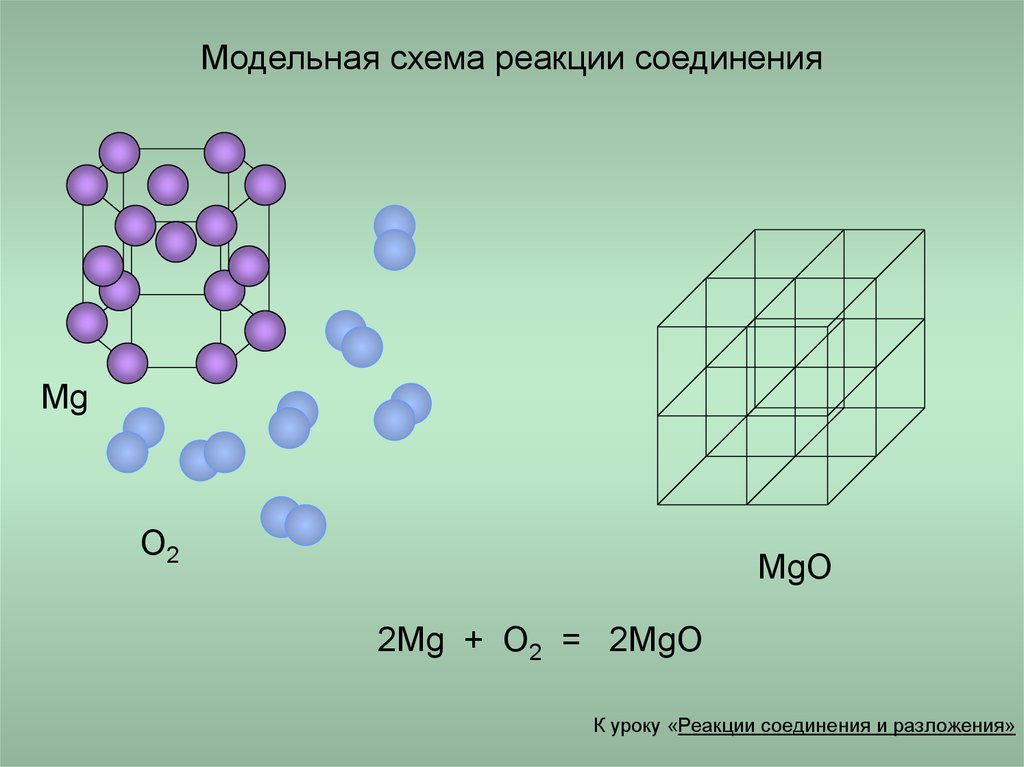
11. Модельная схема реакции соединения
MgO2
MgO
2Mg + O2 = 2MgO
К уроку «Реакции соединения и разложения»
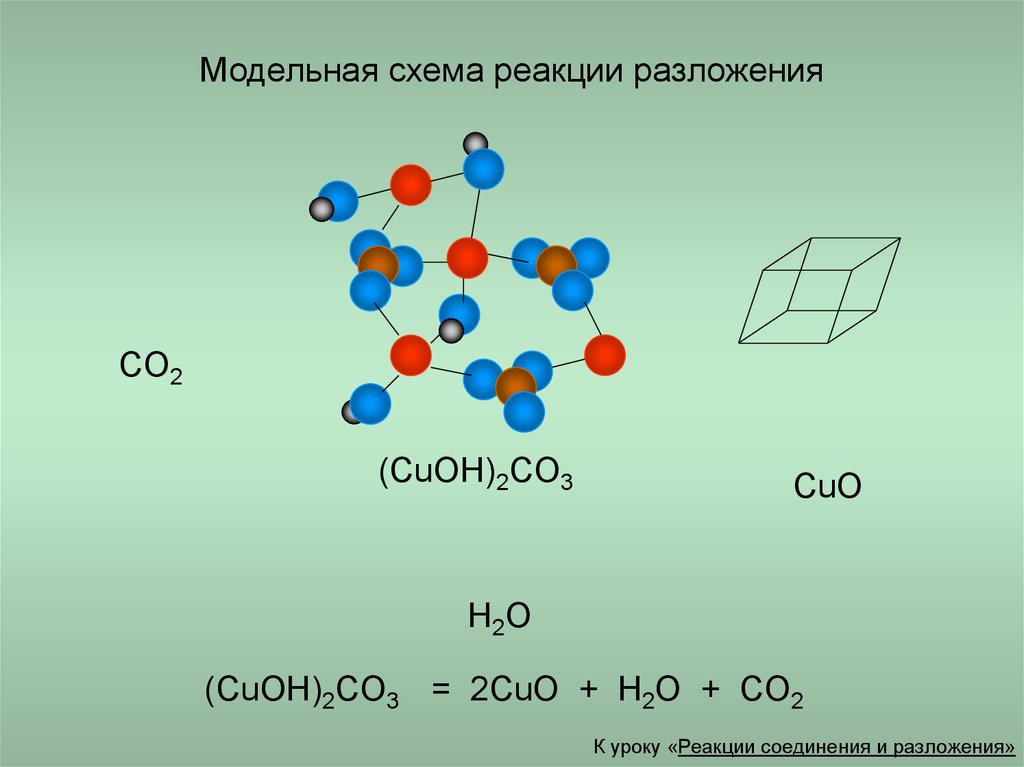
12. Модельная схема реакции разложения
CO2(CuOH)2CO3
CuO
H2O
(CuOH)2CO3 = 2CuO + H2O + CO2
К уроку «Реакции соединения и разложения»
13.
ПериодII
III
Элемент
B
C
N
Si
№ группы
III
IV
V
IV
B2O3
CO2
BO33-
CO3 2-
Формула
оксида
N2O5
SiO2
P
S
V
P2O5
VI
SO3
Cl
VII
Cl2O7
Структура
сложного
аниона
Ф-ла иона
Название
иона
Ф-ла
кислоты
Название
кислоты
-
4-
3-
2-
SO4
-
NO3
SiO4
PO4
ClO4
фосфат
сульфат
хлорат
борат
карбонат
нитрат
силикат
H3BO3
H2CO3
HNO3
H4SiO4
H3PO4
H2SO4
HClO4
азотная
кремни фосфоевая
рная
серная
хлорная
борная
угольная
14.
Взаимодействие оксидовMgO
SO3
+
=
MgSO4
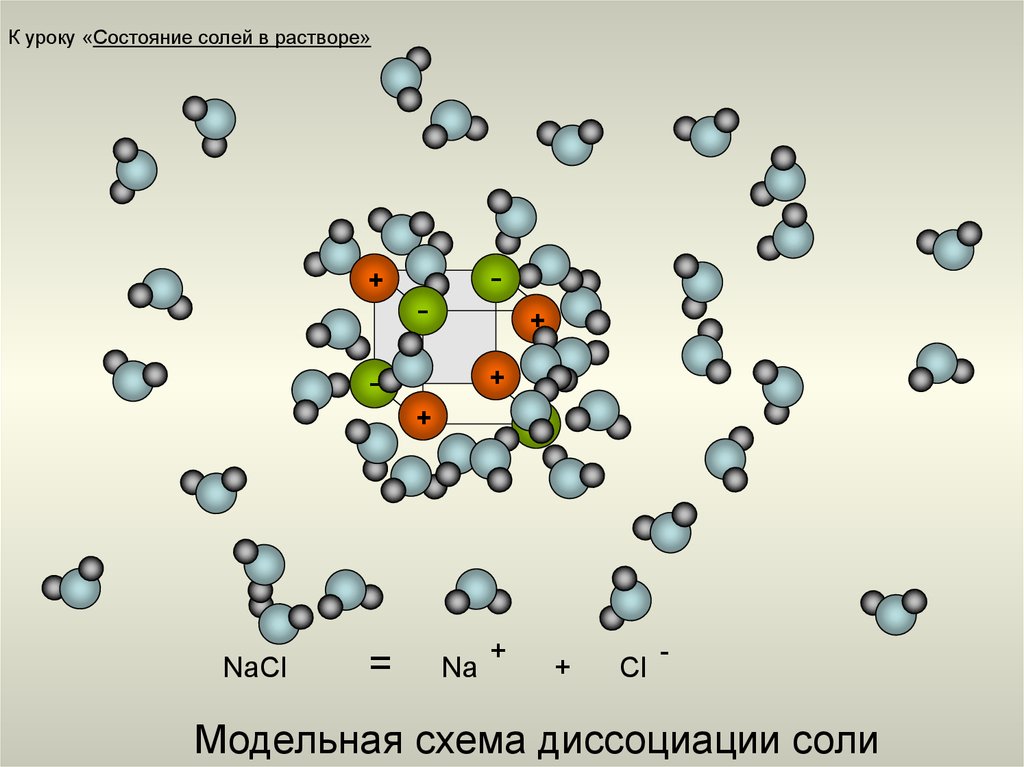
15. Модельная схема диссоциации соли
К уроку «Состояние солей в растворе»-
+
-
+
+
+
NaCl
=
-
Na
+
+
Cl
-
Модельная схема диссоциации соли
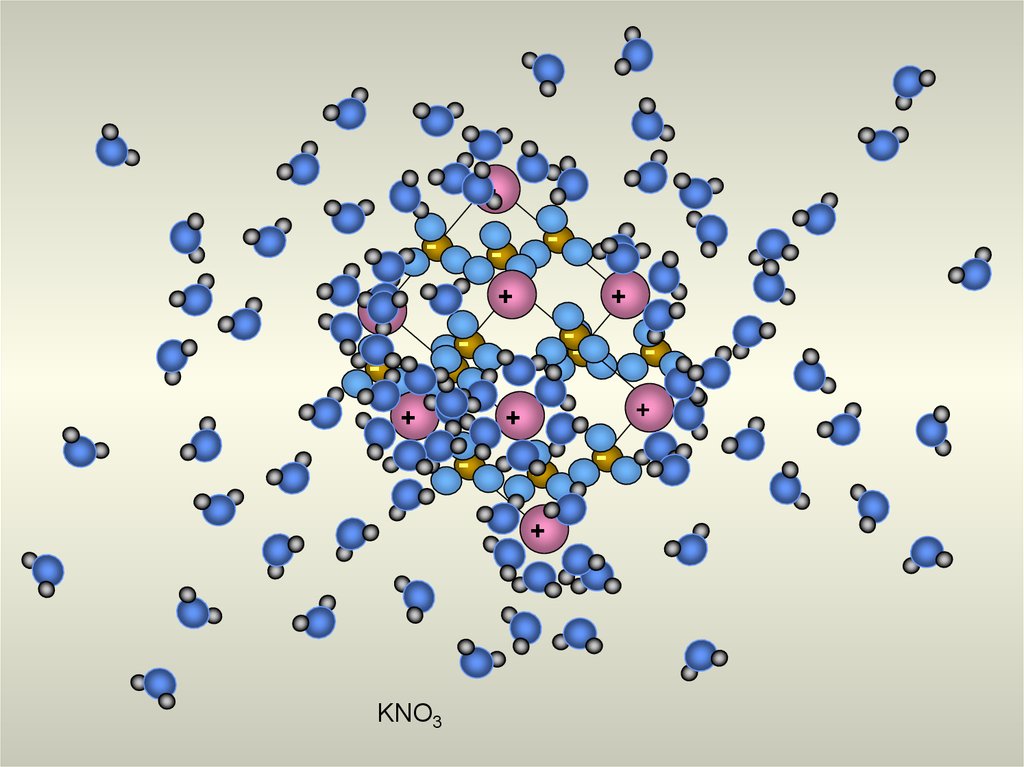
16.
+-
-
+
+
-
-
+
--
-
+
+
+
-
+
KNO3
-
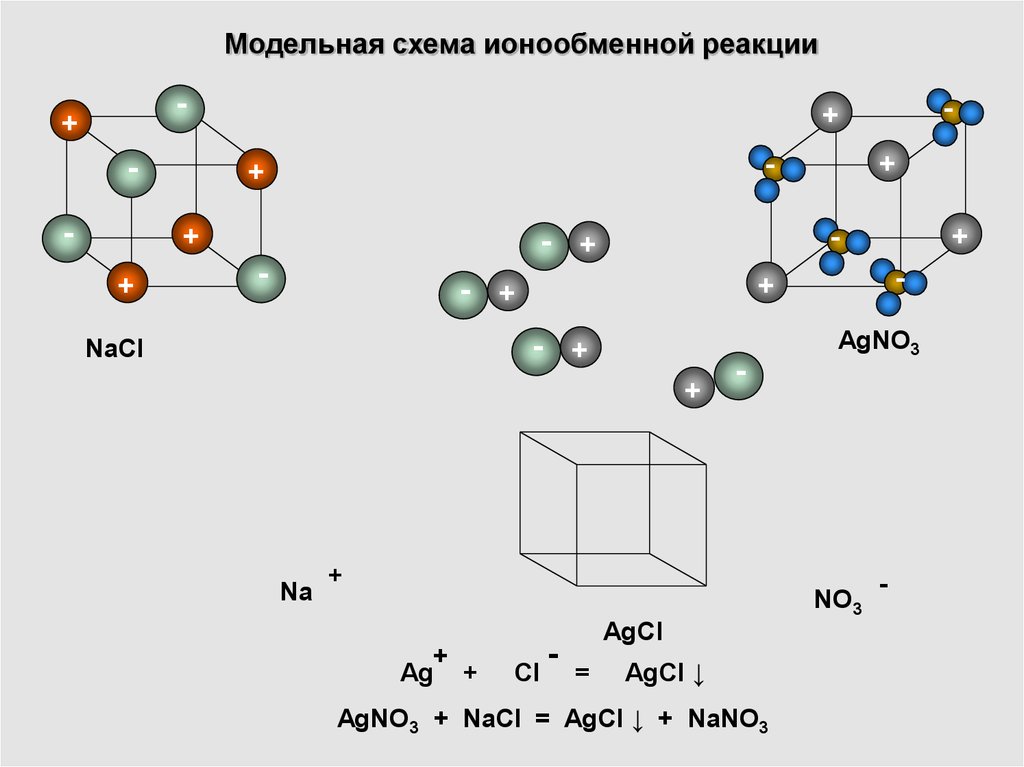
17. Модельная схема ионообменной реакции
-+
-
-
+
+
+
-
+
-
- +
-
- +
+
Na
-
-
AgNO3
+
NO3
+
Ag +
+
+
- +
NaCl
+
Cl
-
AgCl
=
AgCl ↓
AgNO3 + NaCl = AgCl ↓ + NaNO3
-
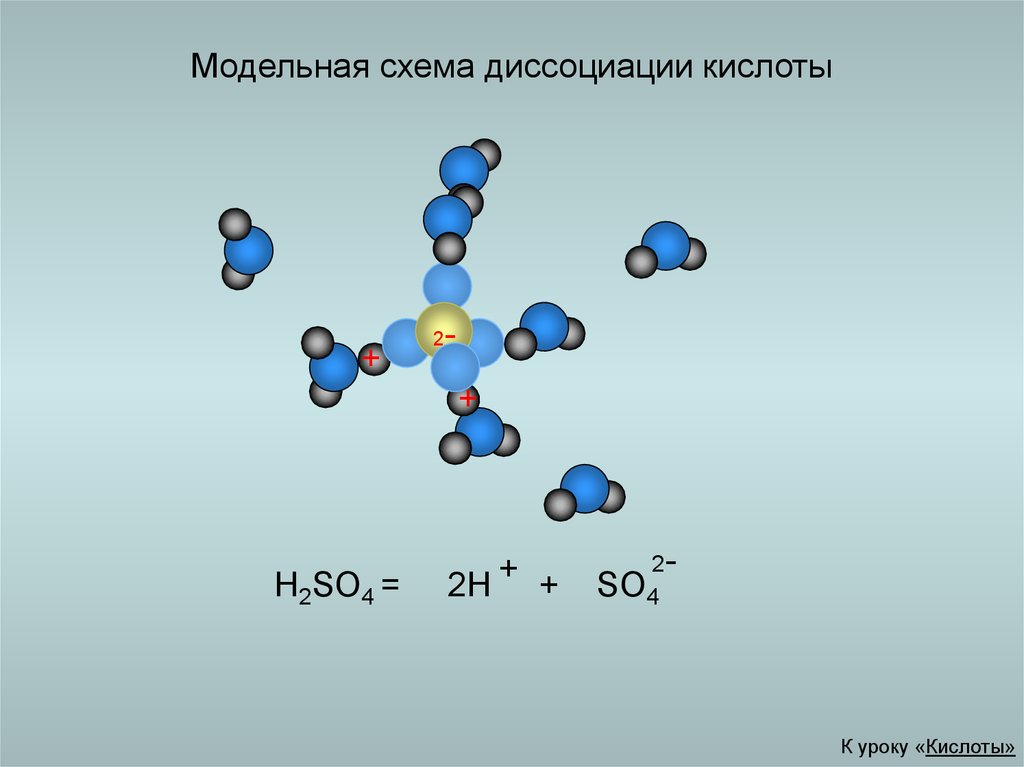
18. Модельная схема диссоциации кислоты
+-
2
+
H2SO4 =
2H + +
2SO4
К уроку «Кислоты»
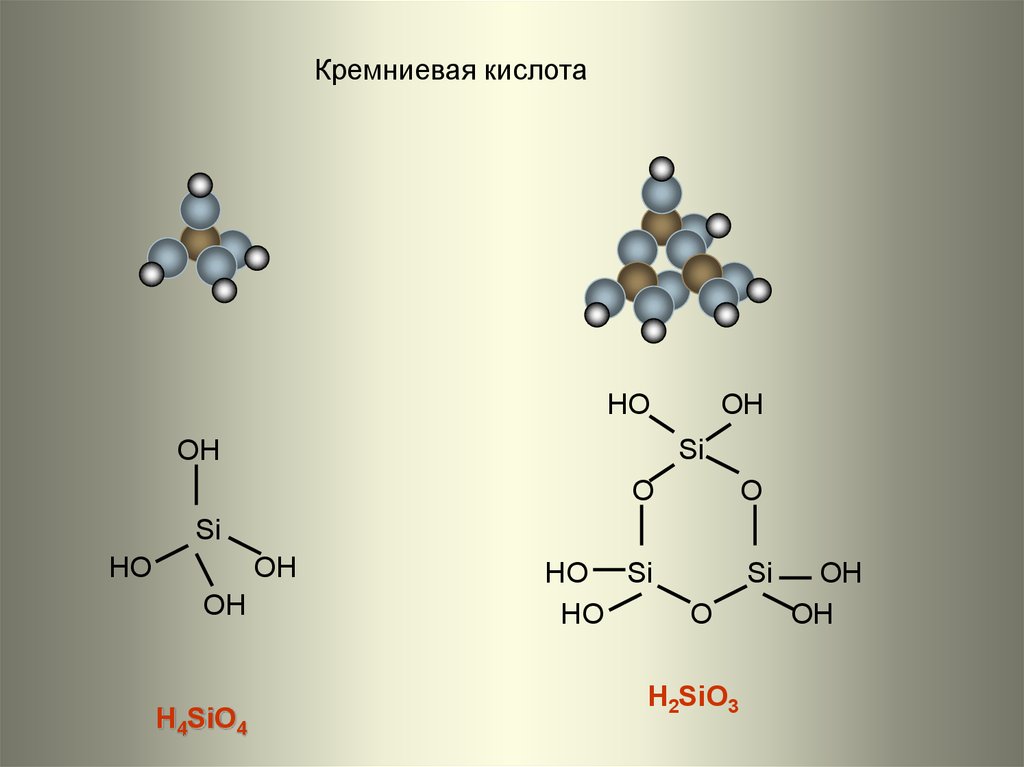
19.
Кремниевая кислотаHO
OH
Si
OH
O
O
Si
HO
OH
OH
H4SiO4
HO Si
HO
Si
O
H2SiO3
OH
OH
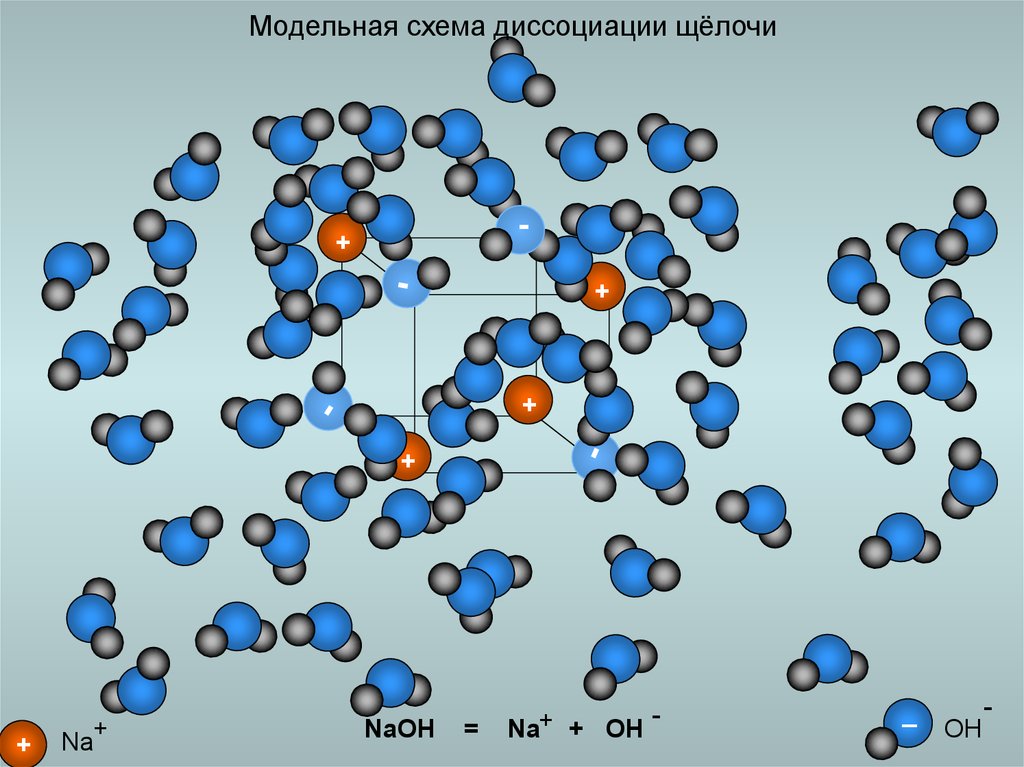
20. Модельная схема диссоциации щёлочи
-+
+
+
+
+
+
Na
NaOH
=
Na+ + OH
_
OH
-
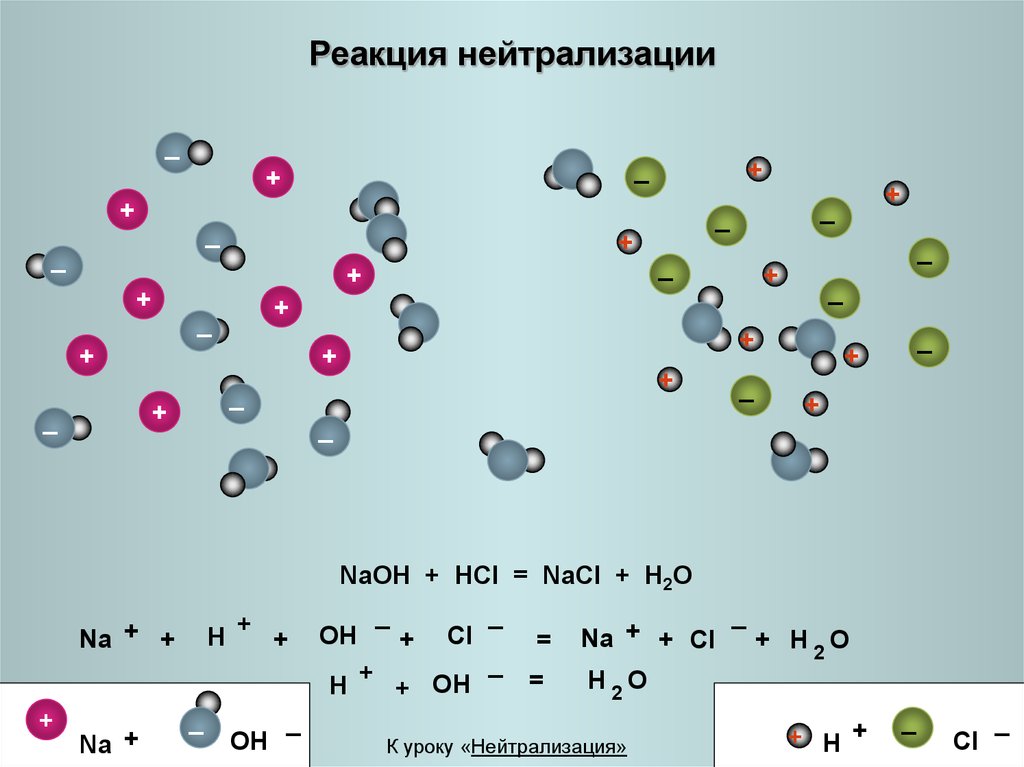
21. Реакция нейтрализации
__
+
_
+
+
_
+
_
_
+
+
_
+
_
+
+
+
+
_
+
+
_
_
_
_
+
_
_
+
+
_
NaOH + HCl = NaCl + H2O
Na + +
H
+
+
OH
H
+
Na +
_
OH
_
_
+
+
Cl
+ OH
_
=
_
=
Na + + Cl
_
+ H2O
H2O
К уроку «Нейтрализация»
+ H +
_
Cl
_
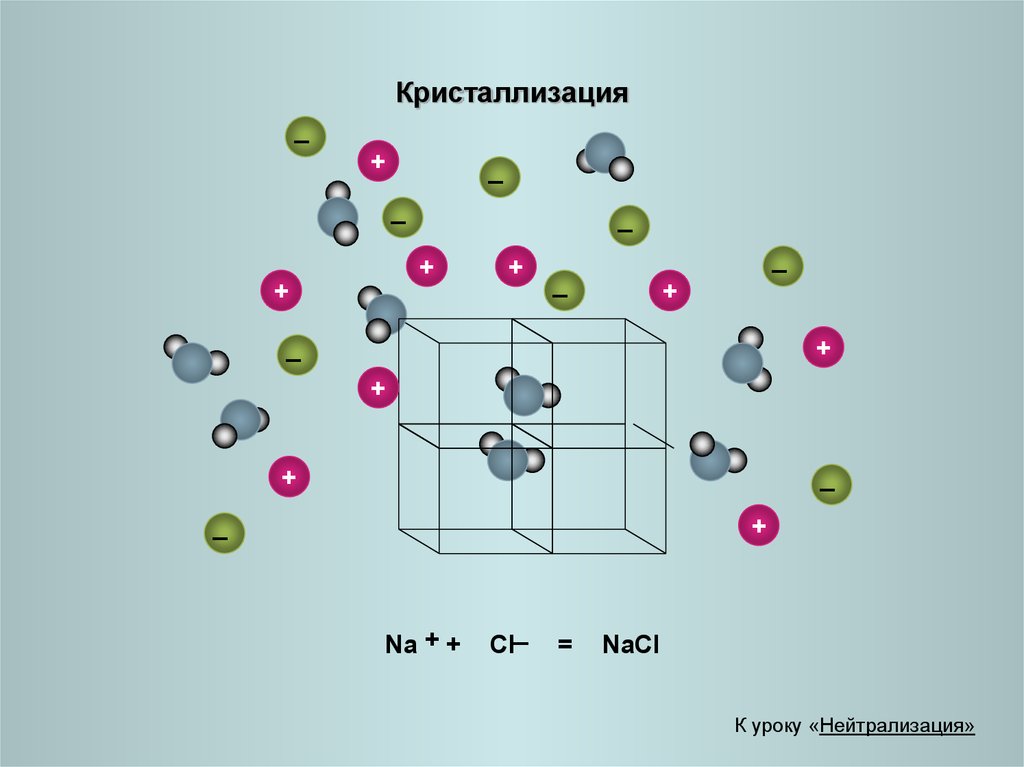
22.
Кристаллизация_
+
_
_
_
+
+
+
_
_
+
_
+
+
+
_
_
+
Na + +
_
Cl
=
NaCl
К уроку «Нейтрализация»
23.
+_
_
+
+
+
_
+
+
_
+
_
_
+
_
+
+
+
+
+
_
+
+
_
_
_
+
+
+
_
+
Cu 2+
+
+
+
OH
_
+
+
_
+
+
_
+
Cu(OH)2 + 2HCl = CuCl
2 + H2 O
Cu(OH)2 + 2H + = Cu 2+ + H2O
_
H
+
Cl
К уроку «Нейтрализация»
_
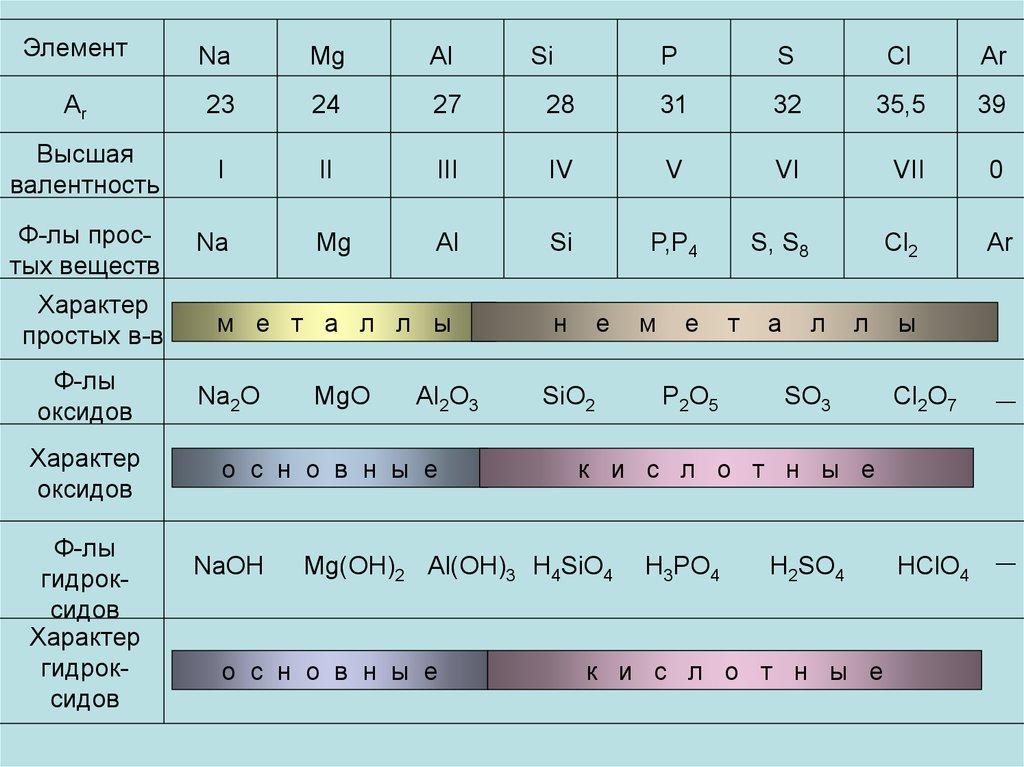
24. Элемент
NaMg
Al
Аr
23
24
27
Высшая
валентность
I
II
Ф-лы простых веществ
Na
Mg
Характер
простых в-в
Ф-лы
оксидов
Характер
оксидов
Ф-лы
гидроксидов
Характер
гидроксидов
P
S
Cl
Ar
28
31
32
35,5
39
III
IV
V
VI
VII
0
Al
Si
P,P4
м е т а л л ы
н
Na2O
MgO
Al2O3
о с н о в н ы е
NaOH
Si
е
SiO2
е
P2O5
т
а
Cl2
л
л
SO3
Ar
ы
Cl2O7
__
HClO4
__
к и с л о т н ы е
Mg(OH)2 Al(OH)3 H4SiO4
о с н о в н ы е
м
S, S8
H3PO4
H2SO4
к и с л о т н ы е
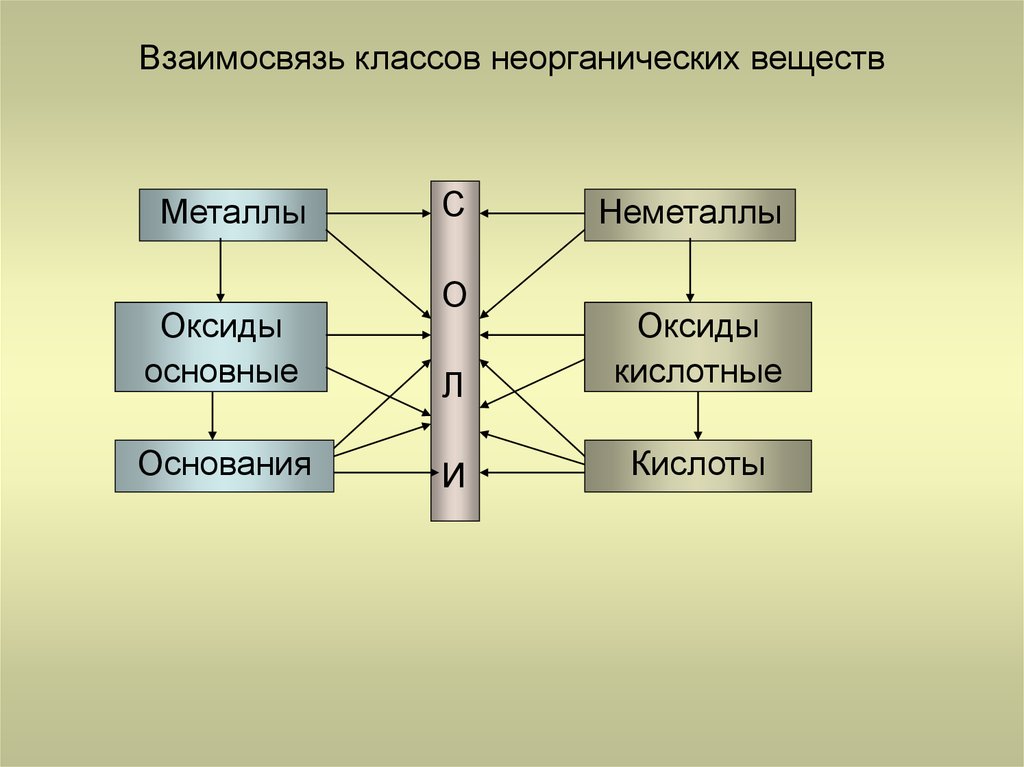
25. Взаимосвязь классов неорганических веществ
МеталлыОксиды
основные
металлов
Основания
С
О
Неметаллы
Л
Оксиды
неметаллов
кислотные
И
Кислоты
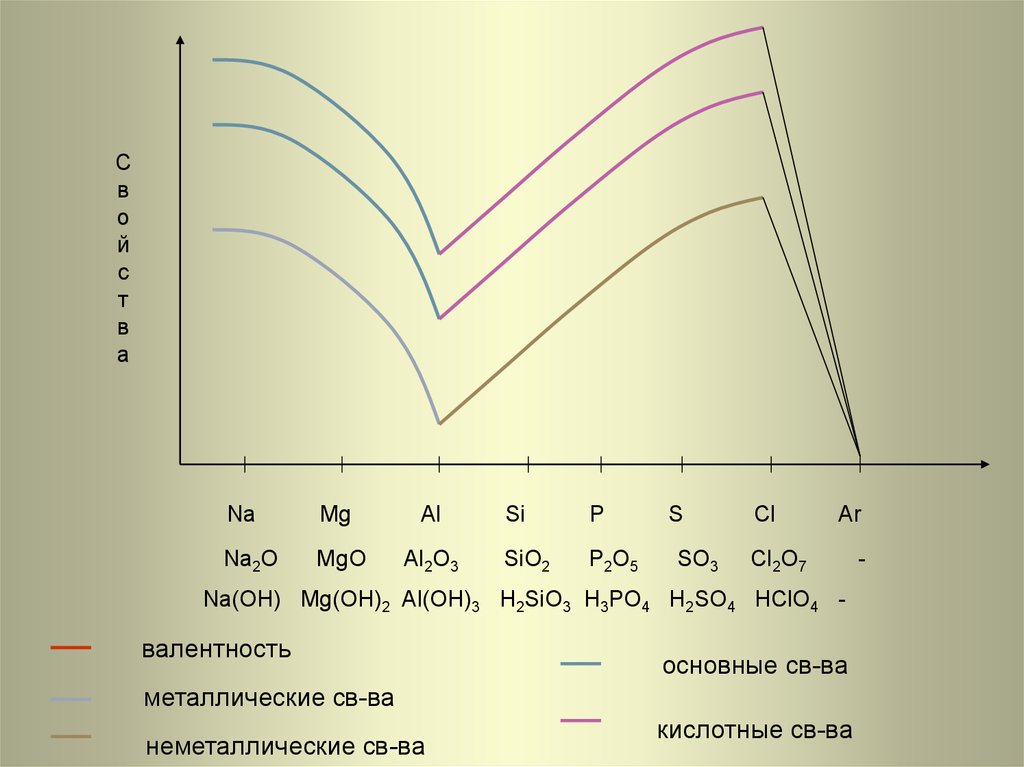
26. Na Mg Al Si P S Cl Ar
Св
о
й
с
т
в
а
Na
Mg
Al
Na2O
MgO
Al2O3
Si
P
SiO2
P2O5
S
SO3
Cl
Ar
Cl2O7
Na(OH) Mg(OH)2 Al(OH)3 H2SiO3 H3PO4 H2SO4 HClO4 -
валентность
основные св-ва
металлические св-ва
неметаллические св-ва
кислотные св-ва
-
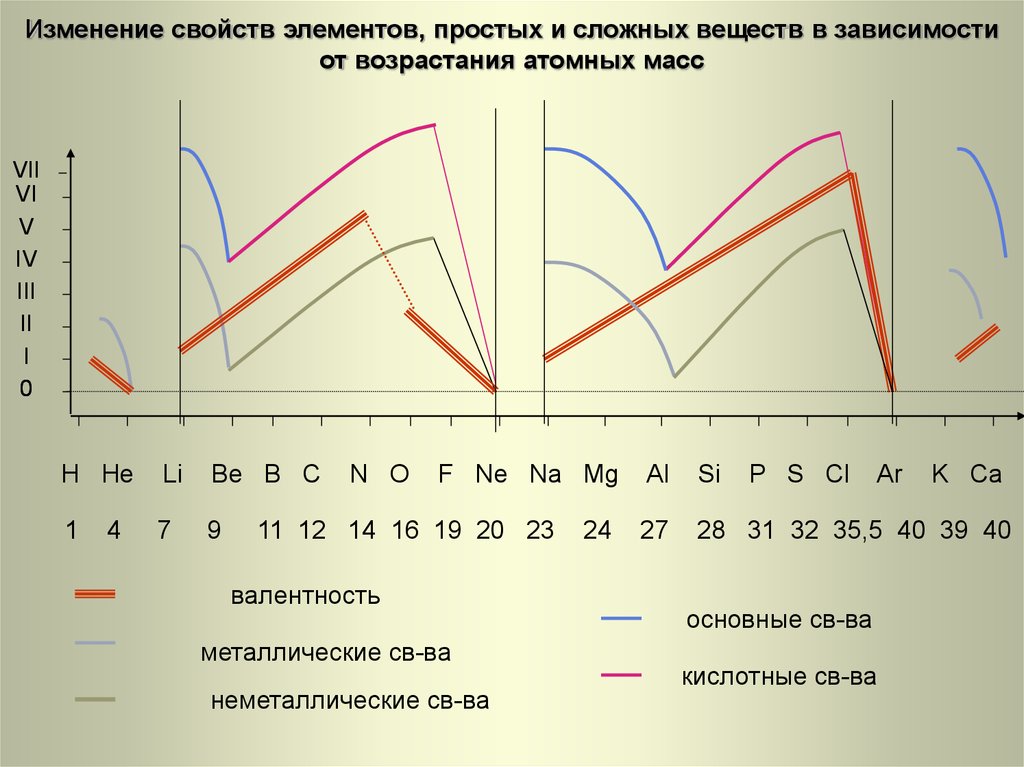
27. H He Li Be B C N O F Ne Na Mg Al Si P S Cl Ar K Ca
Изменение свойств элементов, простых и сложных веществ в зависимостиот возрастания атомных масс
VII
VI
V
IV
III
II
I
0
H He
Li
Be B C
1
7
9
4
N O
F Ne Na Mg
11 12 14 16 19 20 23
валентность
металлические св-ва
неметаллические св-ва
24
Al
Si
P S Cl
Ar
27
28 31 32 35,5 40 39 40
основные св-ва
кислотные св-ва
K Ca





 chemistry
chemistry








