Similar presentations:
Концентрация раствора. Консультация к модулю 2
1.
Консультация к модулю 2.2.
Задание 1(концентрация раствора).Пример.Рассчитайте объем
концентрированной соляной кислоты
(плотность раствора 1,19 г/мл), содержащей
38% НС1, необходимый для приготовления 1 л
2М раствора.
Дано:
Найти:
3.
Решение:Определяем массу растворенного вещества в
растворе 2
4.
Ответ:5.
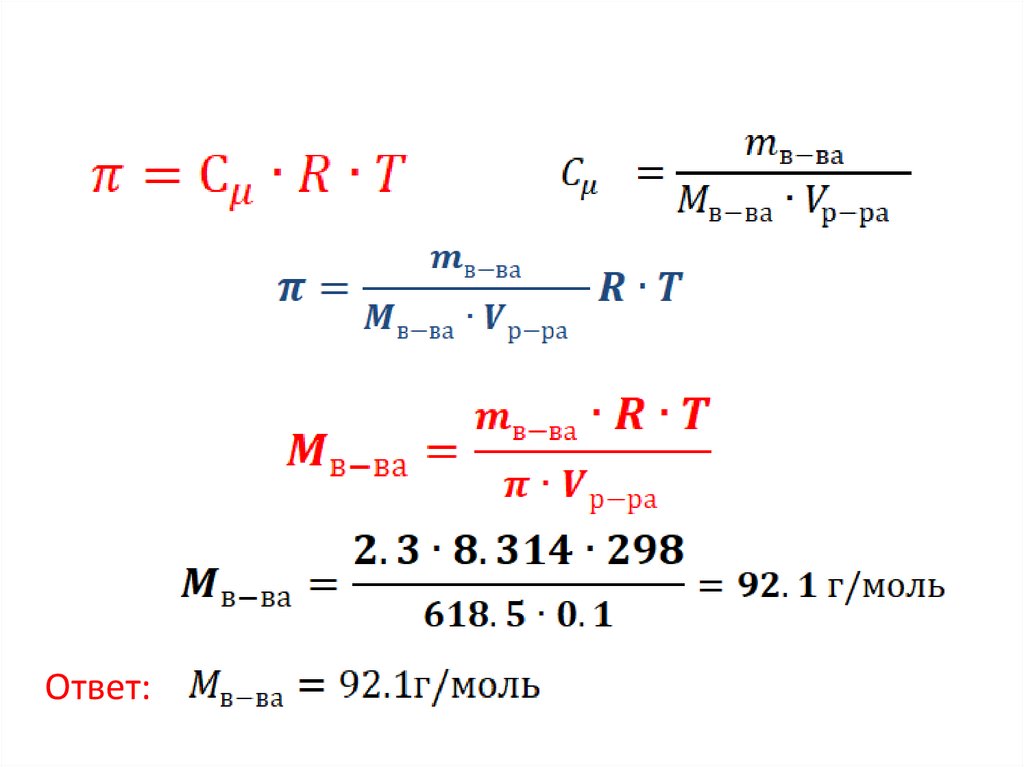
Задание 2. ( осмотическое давление)Пример .Раствор, в 100 мл которого содержится
2,30 г неизвестного вещества, обладает
осмотическим давлением 618,5 кПа при 298 К.
Определите молярную массу растворенного
вещества.
Дано:
T=298
mв-ва=2,3г
Найти:Mв-ва-?
6.
Ответ:7.
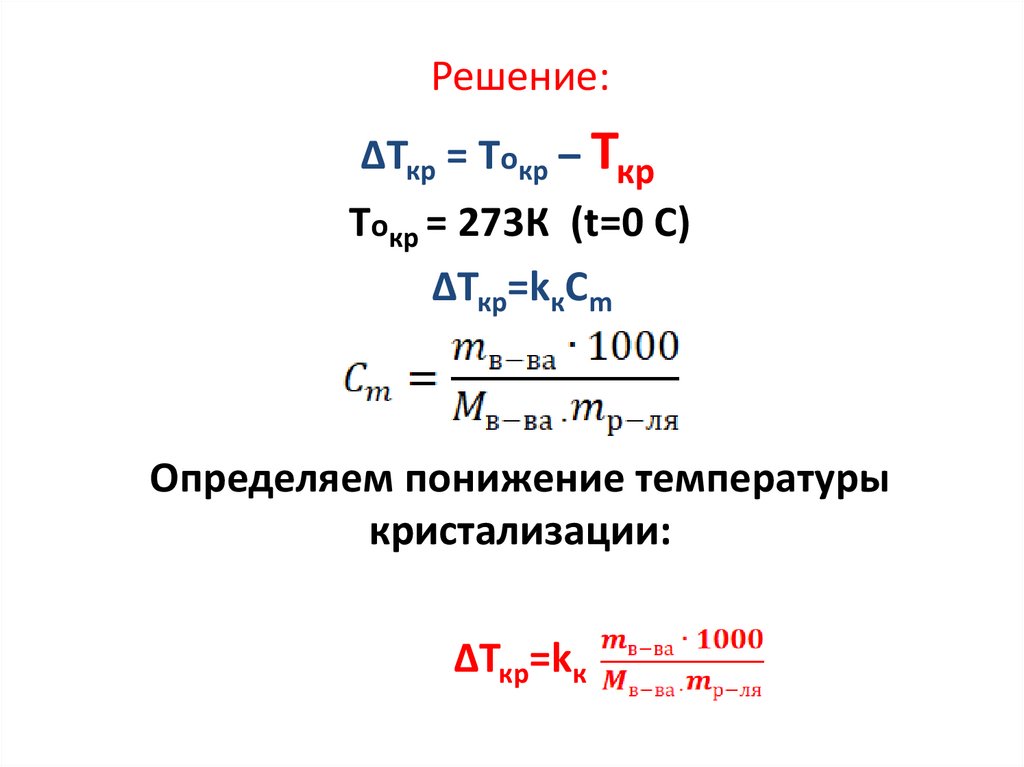
Задание 3. (понижение температурыкристализации)
Пример .Рассчитайте, при какой температуре
будет замерзать водный раствор этилового спирта
С2Н5ОН, если массовая доля спирта в нем равна
25%. Криоскопическая постоянная воды равна
1,85 К∙кг/моль.
Дано:
Найти: Ткр -?
8.
Решение:ΔТкр = Токр – Ткр
Токр = 273К (t=0 C)
ΔТкр=kкСm
Определяем понижение температуры
кристализации:
ΔТкр=kк
9.
Пусть масса раствора равна 100г, тогдаmв-ва=25г
mр-ля=100-25=75г
Определяем температуру замерзания раствора:
ΔТкр = Токр – Ткр
Ткр = Токр – Ткр
Ткр = 273-13,4=259,6K
Ответ: Ткр = 259,6K
10.
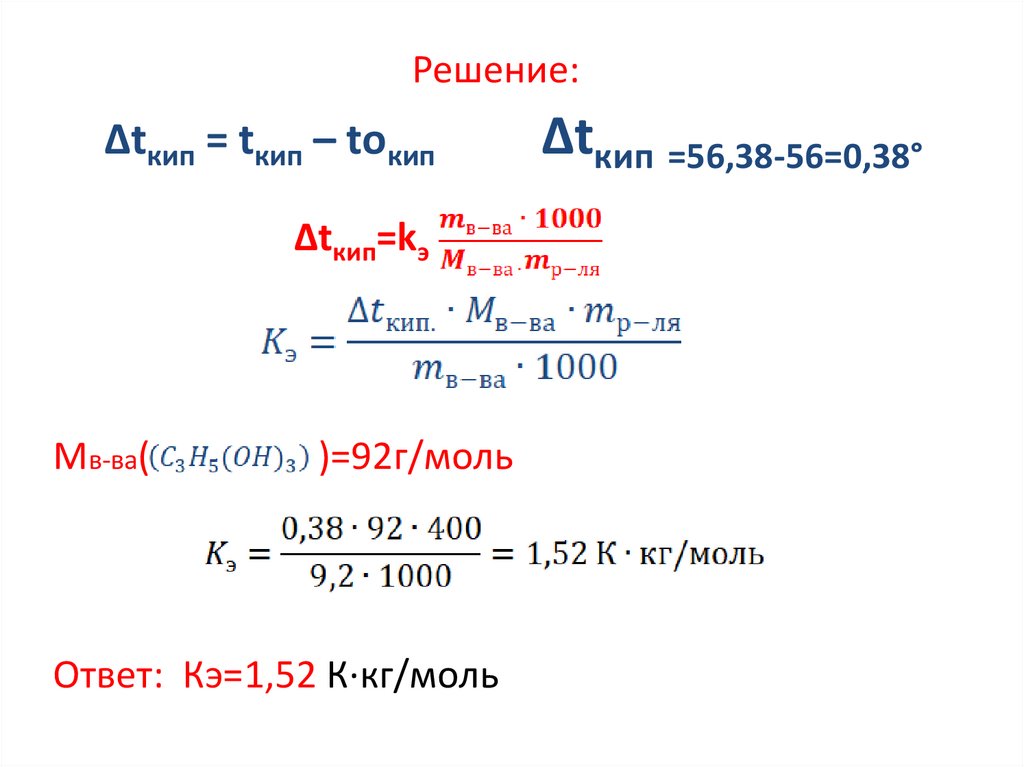
Задание 4 (повышение температуры кипения)Пример . Раствор, состоящий из 9,2 г
глицерина С3Н5(ОН)3 в 400 г ацетона
(СН3)2СО, кипит при температуре 56,38°С,
чистый ацетон кипит при 56,0°С. Определите
эбуллиоскопическую константу ацетона.
Дано:
Найти:- kэ -?
11.
Решение:Δtкип = tкип – tокип
Δtкип=kэ
Мв-ва(
)=92г/моль
Ответ: Кэ=1,52 К∙кг/моль
Δtкип =56,38-56=0,38°
12.
Задание 5. (Электролитическая диссоциация.Ионное равновесие в растворах электролитов)
Пример. Смешивают попарно растворы:
а)
б)
в)
Определите, в каких из приведенных пар
реакции практически идут до конца. Для этих
случаев составьте уравнения реакций в
молекулярно-ионном виде.
13.
Решение:а)
14.
д)Реакция необратима, идет до конца.
15.
e)Реакция необратима, идет до конца
16.
Задание 6. (характеристики слабых электролитов).Пример. Определите концентрацию ионов
и рН
раствора кислоты муравьиной
, для которой
константа электролитической диссоциации
,а степень диссоциации
%.
Дано:
%
Найти:
рН-?
Cm( )-?
17.
Решение:Согласно закону разбавления Оствальда:
18.
Подставим полученные данные в формулу дляопределения pH:
Ответ:
19.
Задание 7. (характеристики сильныхэлектролитов).
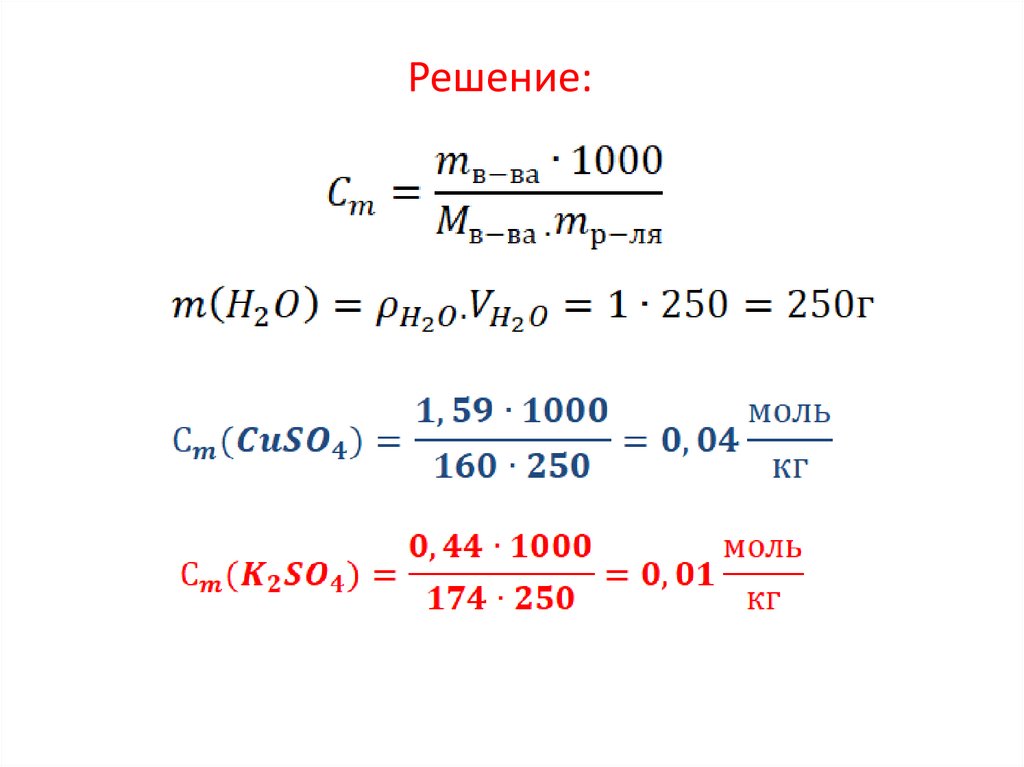
Пример . Вычислите ионную силу раствора,
содержащего 1,59 г меди (2) сульфата и 0,44 г
калия сульфата в 250 мл воды (плотность
воды 1 г/мл).
Дано:
ρ(Н О) = 1 г/мл
Найти: I-?
2
20.
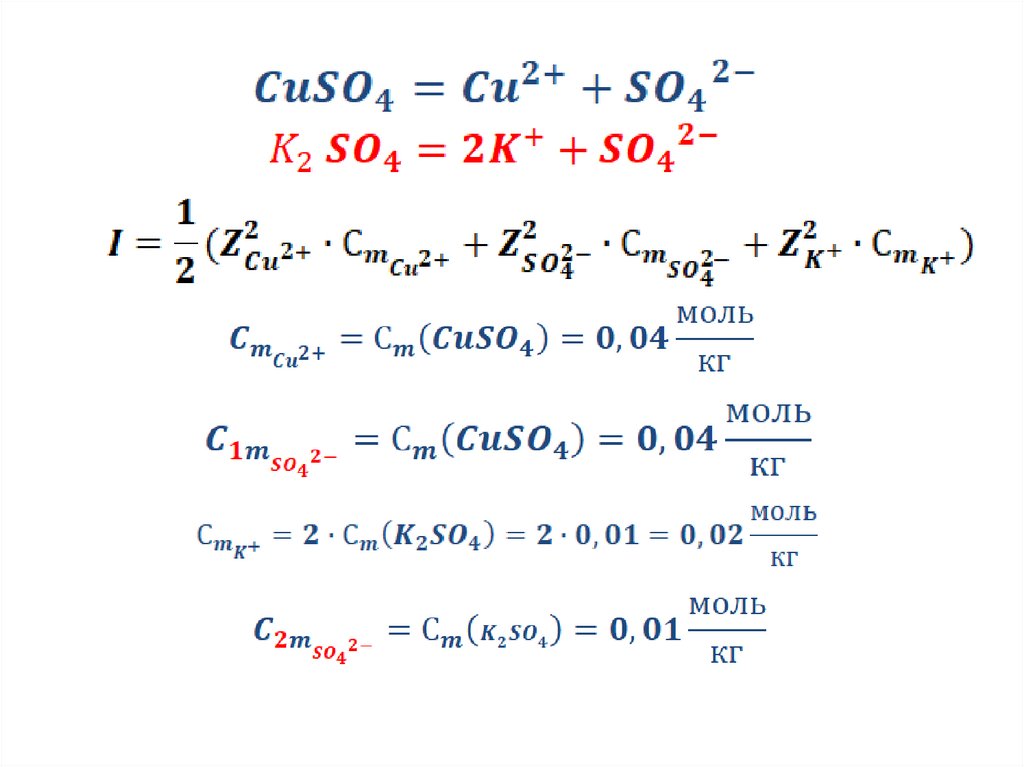
Решение:21.
.22.
Ответ:I=0,1923.
Задание 8. (гидролиз солей).Пример. .Напишите уравнение реакции гидролиза
водного раствора соли NH4CNS, укажите тип
гидролиза, рассчитайте рН раствора соли.
Дано:
NH4CNS
Найти:
рН-?
24.
Решение :NH4CNS образована
NH4OH слабое основание
HCNS слабая кислота
Вывод: среда нейтральная, pH~7, тип
гидролиза кислотно-основный.
25.
.Ответ:
26.
Задание 9. (коллоидные растворы).Пример . Золь получен смешиванием равных объемов
0,008 н. раствора бромида магния
и 0,009 н. раствора
нитрата серебра
. Определите знак заряда гранулы и
тип золя, напишите формулу его мицеллы. Укажите
структурные составляющие золя.
Дано:
Мицелла-?
27.
Решение:Золь гидрофобный
n
n
{[m(AgBr)ꞏ nAg+ ꞏqH2O]n+ ꞏ(n-x)NO3- ꞏpH2O}x++xNO3- ꞏ yH2O
28.
Задание 10. (расставить коэффициенты методомэлектронно-ионного баланса в окислительновосстановительной реакции)
Пример : в кислотной среде (для уравнивания атомов
кислорода в полуреакциях используем только H+ и H2O).
Na2SO3 + K2Cr2O7 + Н2SO4 → Na2SO4 + Cr2(SO4)3 +
K2SO4 + H2O.
2Na+ + SO32– + 2K+ + Cr2O72– + 2H+ + SO42– → 2Na+ +
SO42– + 2Cr3+ + 3SO42– + 2K+ + SO42– + H2O.
SO32–
Cr2O72–
→ SO42–
→ 2Cr3+.
29.
SO32– + Н2ОCr2O72– + 14Н+
→ SO42– + 2Н+
→ 2Cr3+ + 7Н2О.
Вос-ль SO32– + Н2О – 2ē = SO42– + 2Н+
Ок-ль Cr2O72– + 14Н+ + 6ē = 2Cr3+ + 7Н2О
30.
SO32– + Н2О – 2ē = SO42– + 2Н+Cr2O72– + 14Н+ + 6ē = 2Cr3+ + 7Н2О
2 6 3
6
1
3SO32– + 3Н2О + Cr2O72– + 14Н+ = 3SO42– + 6Н+ + 2Cr3+ +
7Н2О.
3SO32– + Cr2O72– + 8Н+ = 3SO42– + 2Cr3+ + 4Н2О
3Na2SO3 + K2Cr2O7 + 4H2SO4=Cr2(SO4)3 + 3Na2SO4 + K2SO4
+ 4H2O.
31.
Пример3: в основной среде (для уравниванияатомов кислорода в полуреакциях используем
только ОH- и H2O).
Fe2O3 + KNO3 + KOH → K2FeO4 + KNO2 + H2O.
32.
33.
.6
Fe2O3 + 3KNO3 + 4KOH = 2K2FeO4 + 3KNO2 + 2H2O.









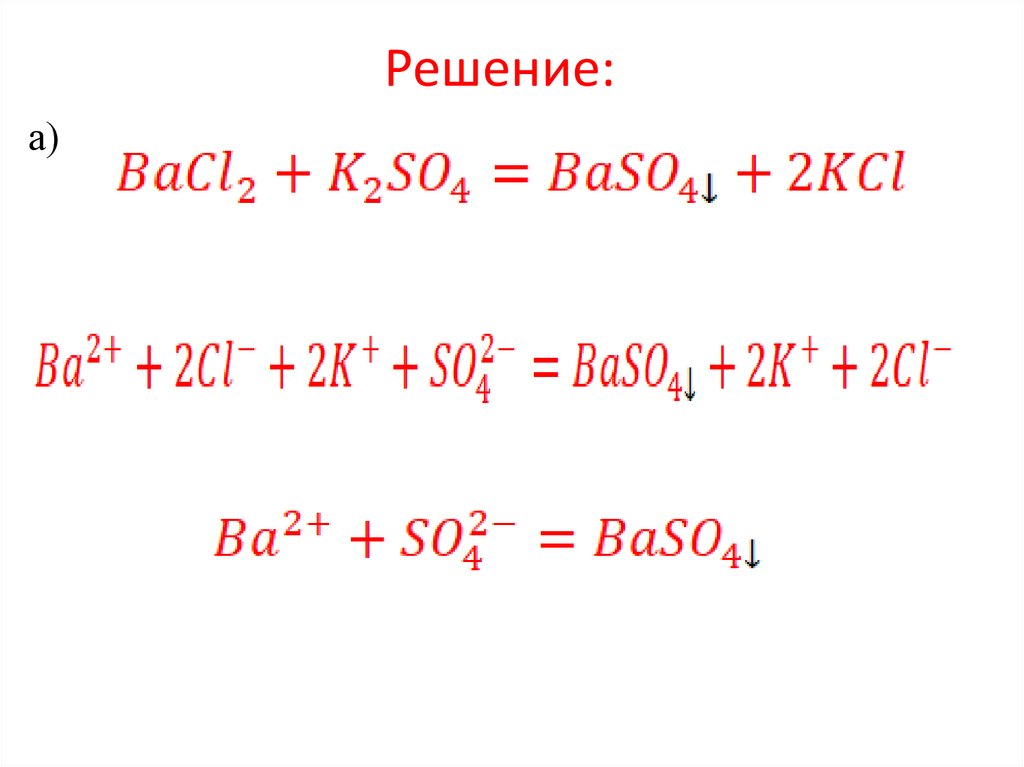
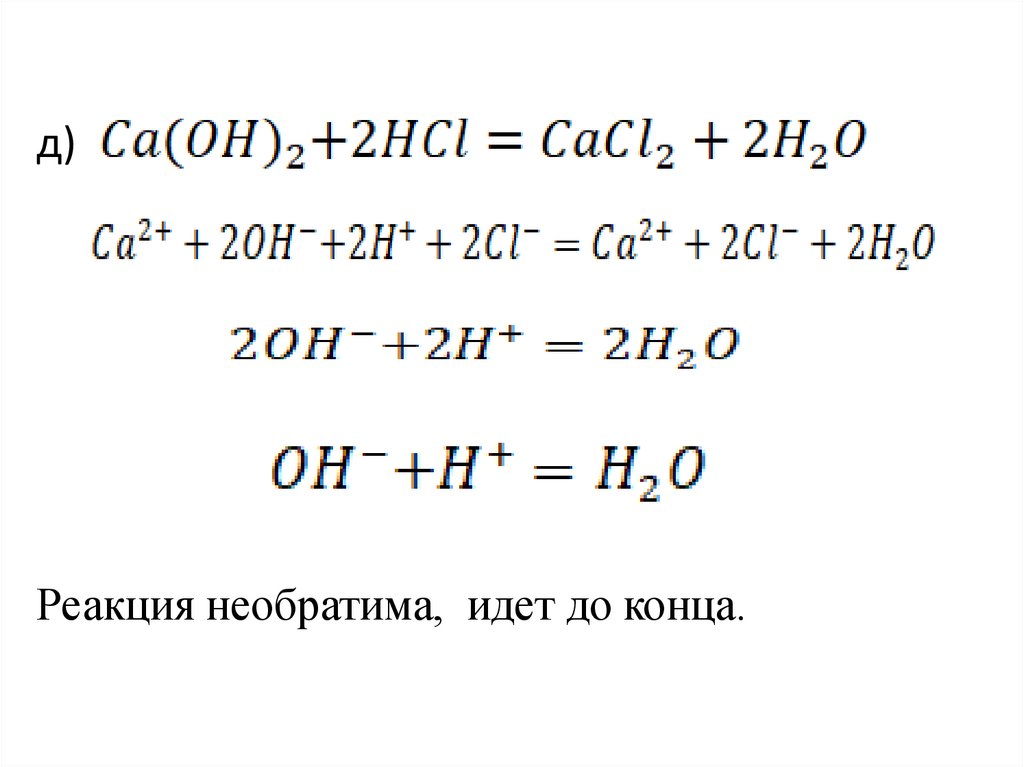
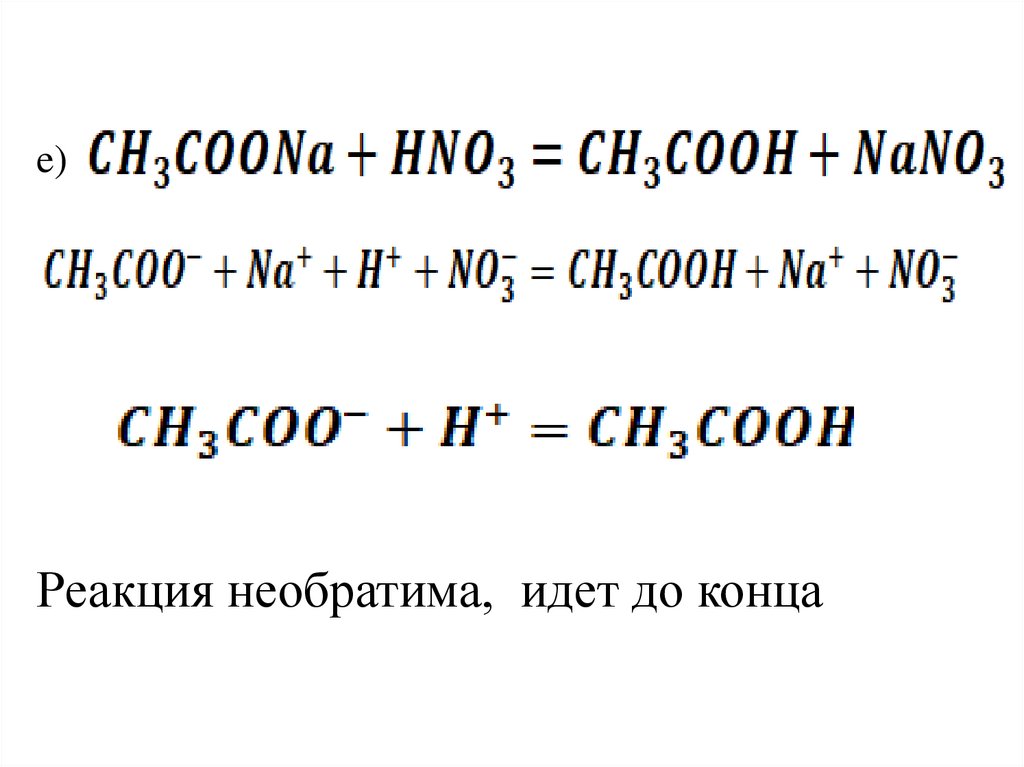











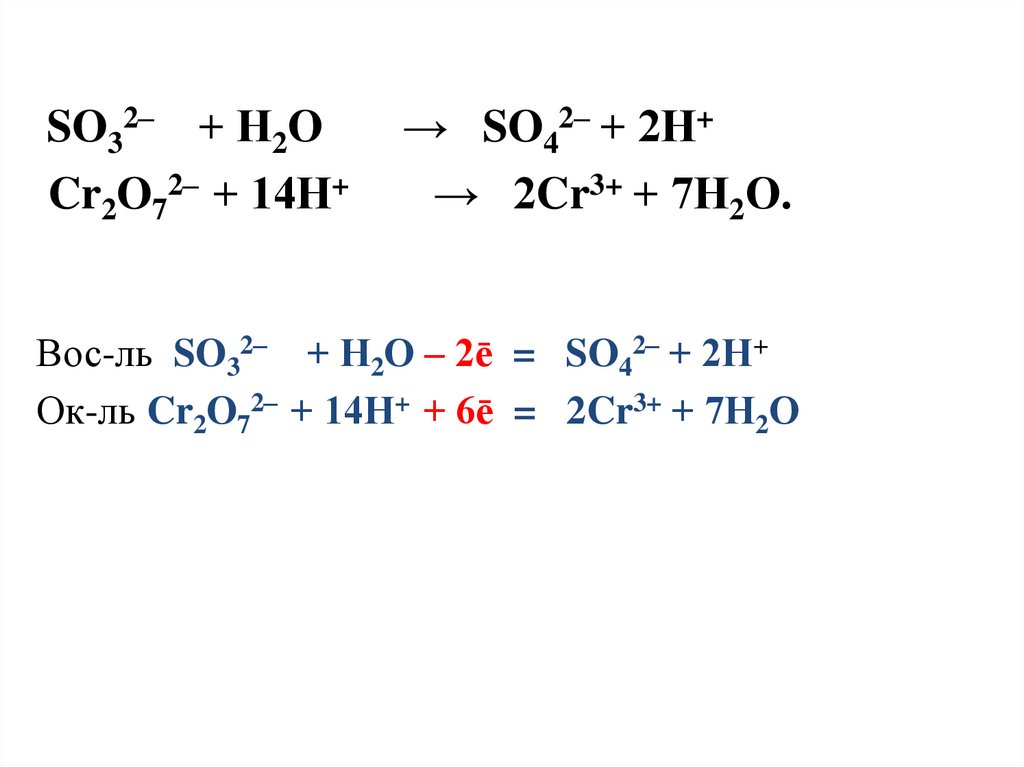
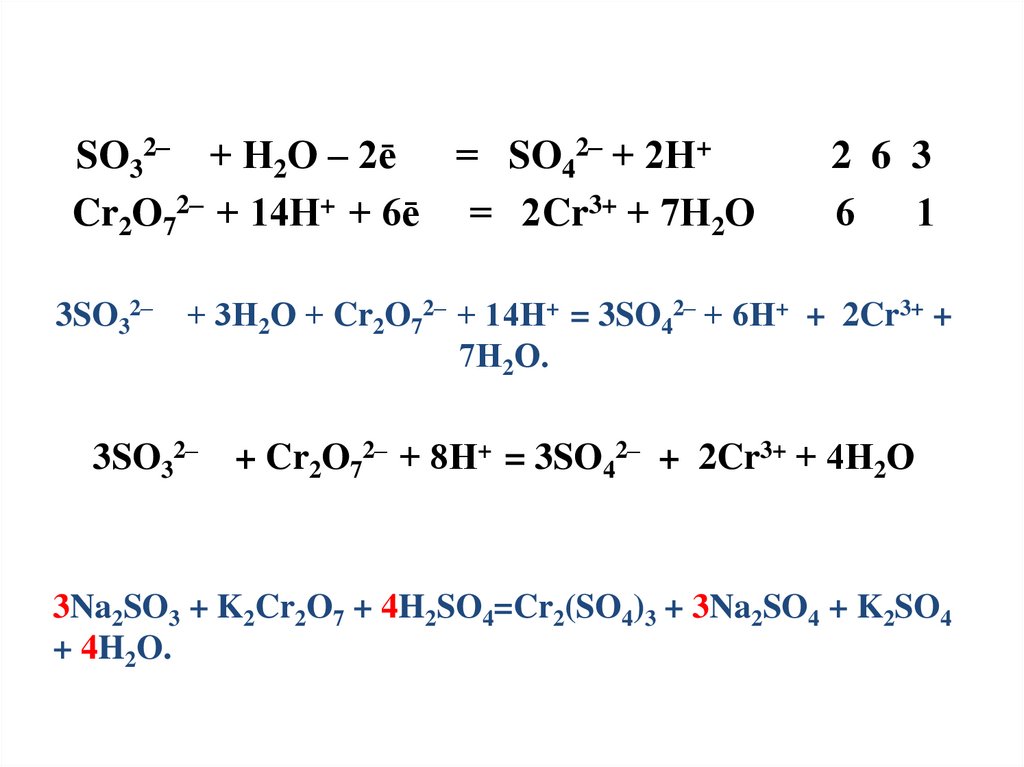

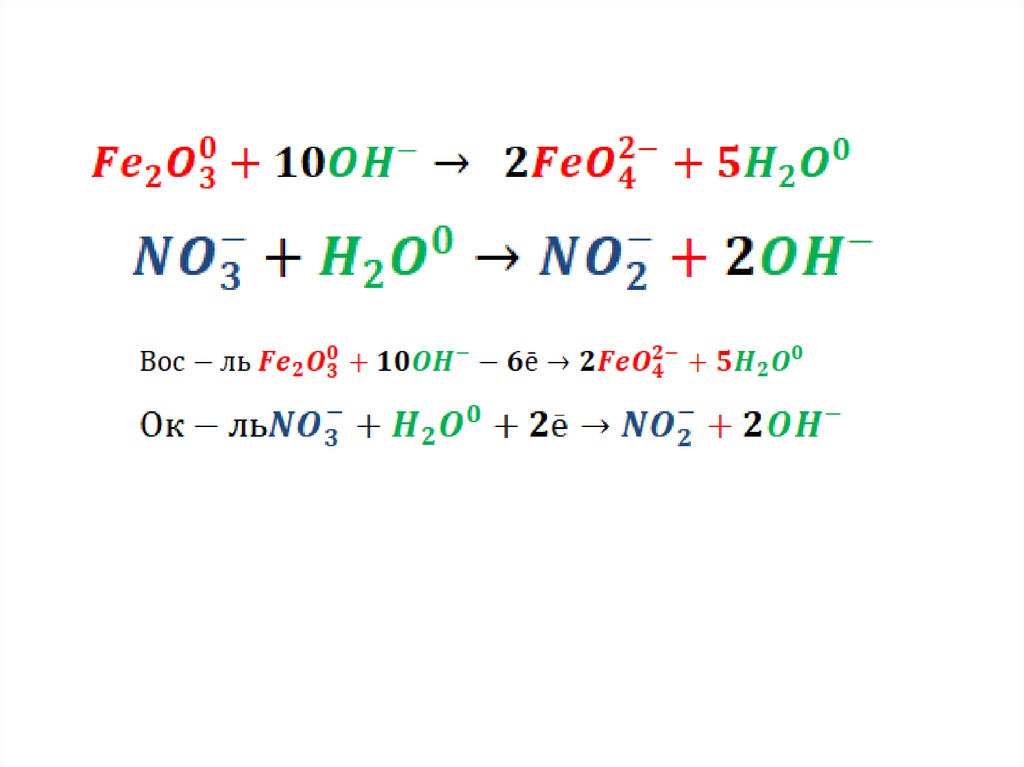
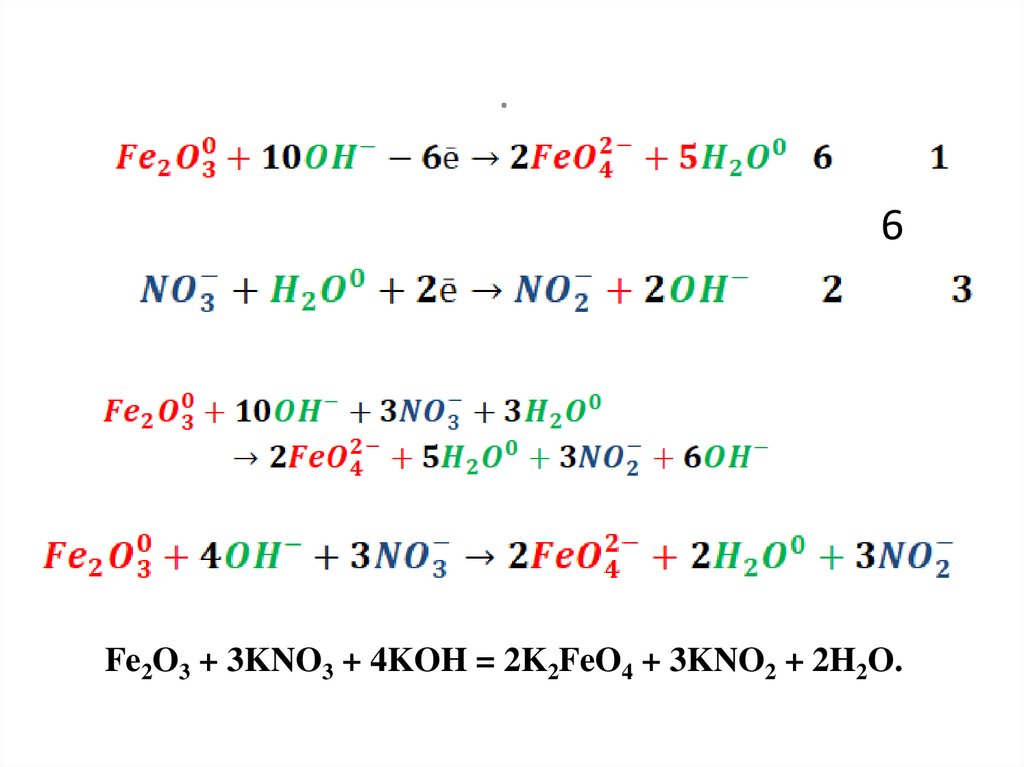










 chemistry
chemistry








