Similar presentations:
Протеомика. Биохимия
1.
ПРОТЕОМИКА2.
Биохимия – наука о молекулярных основах жизниБиохимия изучает различные молекулы, химические
реакции и процессы, протекающие в живых клетках и
организмах.
Главная задача биохимии – установление связи между
молекулярной структурой и биологической функцией
химических компонентов живых организмов.
3.
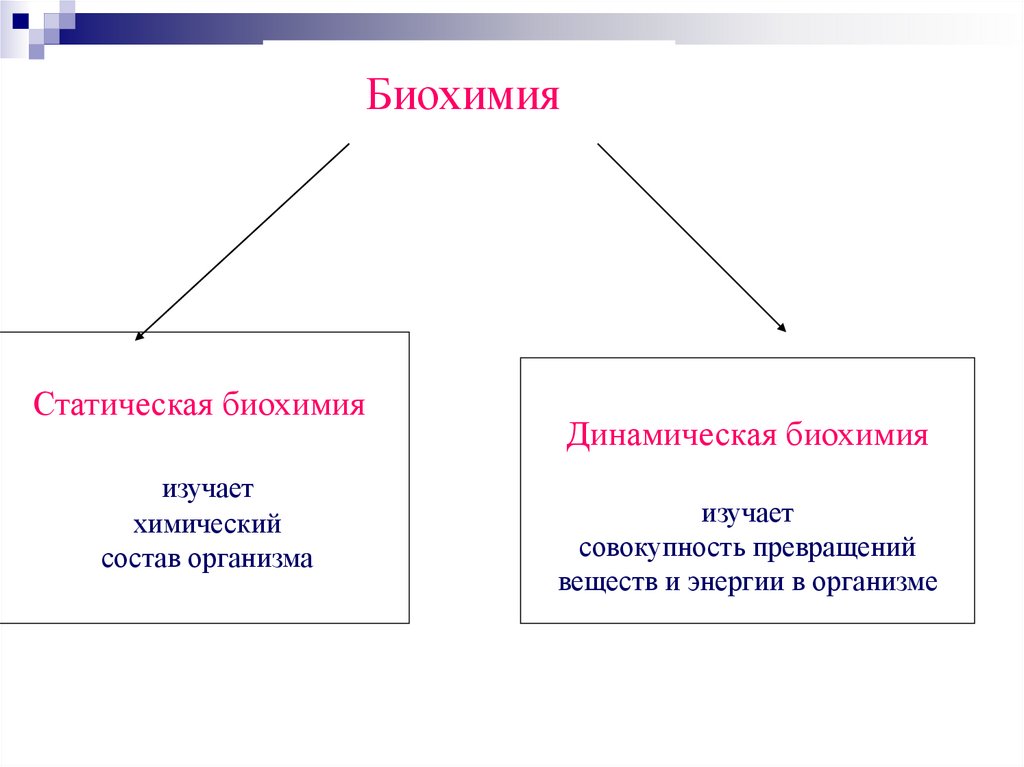
БиохимияСтатическая биохимия
изучает
химический
состав организма
Динамическая биохимия
изучает
совокупность превращений
веществ и энергии в организме
4.
В зависимости от объекта исследованиявыделяют
биохимию человека и животных,
биохимию растений,
биохимию микроорганизмов.
5.
Разделы биохимииэволюционная биохимия,
энзимология,
биохимия витаминов,
квантовая биохимия,
молекулярная биология,
клиническая биохимия.
6.
Клиническая биохимияраздел биохимии, изучающий изменения биохимических
процессов в организме человека при патологических состояниях,
а также разрабатывающий методы обнаружения этих изменений
в целях диагностики и прогноза заболеваний,
изучает структуру и обмен индивидуальных биомолекул в норме
и при болезнях человека.
7.
Значение клинической биохимииНа современном этапе развития медицины
возросло значение биохимических исследований.
Применение новых лекарств, методов лечения,
проведение хирургических вмешательств и
реанимационных мероприятий требует
постоянного биохимического контроля.
Лабораторные методы исследования составляют до
75% всех видов исследования пациента.
8.
Биохимические исследованияпозволяют
выявить причину заболевания,
предложить рациональный и эффективный путь лечения,
разработать методику ранней диагностики,
следить за ходом болезни,
контролировать эффективность лечения.
9.
Основные достижения биохимииустановлены основные особенности функции клеток и их регуляторных
механизмов,
открыта двойная спираль ДНК,
многие ферменты изучены и получены в чистом виде,
выяснены особенности строения и функционирования мембран,
установлено как клетки запасают и используют энергию,
открыты окислительное фосфорилирование, АОС,
установлены метаболические пути синтеза и распада главных биомолекул,
накоплены данные о механизме действия гормонов,
открыты регуляторные пептиды,
установлены основные особенности защитных систем организма,
определён механизм действия ряда лекарств,
установлены основные особенности генетически детерминированной гибели
клеток,
установлены биохимические основы ряда заболеваний.
10.
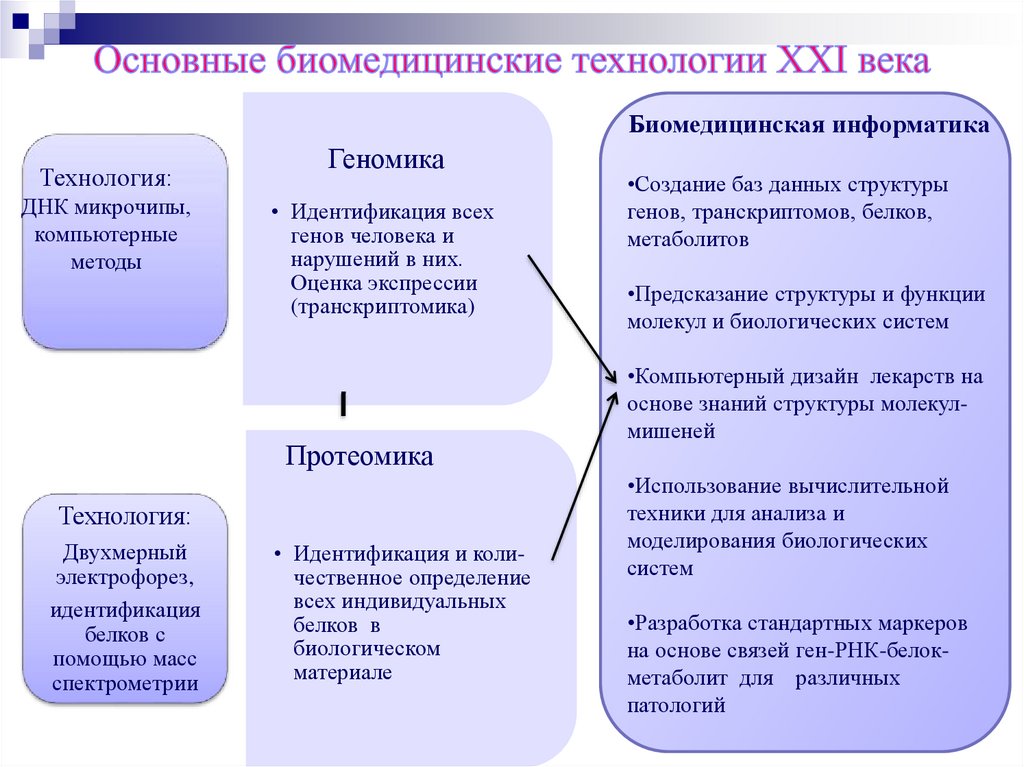
Биомедицинская информатикаТехнология:
ДНК микрочипы,
компьютерные
методы
Геномика
• Идентификация всех
генов человека и
нарушений в них.
Оценка экспрессии
(транскриптомика)
Протеомика
Технология:
Двухмерный
электрофорез,
идентификация
белков с
помощью масс
спектрометрии
• Идентификация и количественное определение
всех индивидуальных
белков в
биологическом
материале
•Создание баз данных структуры
генов, транскриптомов, белков,
метаболитов
•Предсказание структуры и функции
молекул и биологических систем
•Компьютерный дизайн лекарств на
основе знаний структуры молекулмишеней
•Использование вычислительной
техники для анализа и
моделирования биологических
систем
•Разработка стандартных маркеров
на основе связей ген-РНК-белокметаболит для различных
патологий
11.
ПРОТЕОМИКАГеномика – наука, занимающаяся изучением структуры и
функций генов. 30 – 35 тысяч генов, кодирующих белки.
Биоинформатика – наука, занимающаяся изучением
биологической информации с помощью математических,
статистических и компьютерных методов.
Протеомика – наука, занимающаяся изучением белков,
их функций и взаимодействий в живых организмах. В
теле человека 300000 белков.
Метаболомика - наука, занимающаяся изучением
образования и роли небольших молекул в процессе
метаболизма различных природных соединений в
организме.
12.
ПРОТЕОМИКАНачало развития протеомики можно связать с
опытами Фредерика Сенгера. Он изучал структуру
инсулина и впервые определил его аминокислотную
последовательность и положение дисульфидных связей.
13.
ПРОТЕОМэто совокупность белков организма, производимых клеткой,
тканью или организмом в определённый период времени.
14.
Методы протеомикиметод двумерного гель-электрофореза в
полиакриламиде
микросеквенирование белков
высокоэффективная жидкостная хроматография
масс-спектрометрия
использование белковых чипов
15.
ПротеомикаРезультаты протеомики будут использоваться для быстрой разработки
новых лекарственных средств и методов лечения.
На сегодняшний день 95% всех фармакологических средств
воздействуют на белки.
Протеомика может помочь идентифицировать и оценить важность
появления новых белков гораздо эффективнее, что ускорит разработку новых
диагностических тестов и терапевтических средств.
16.
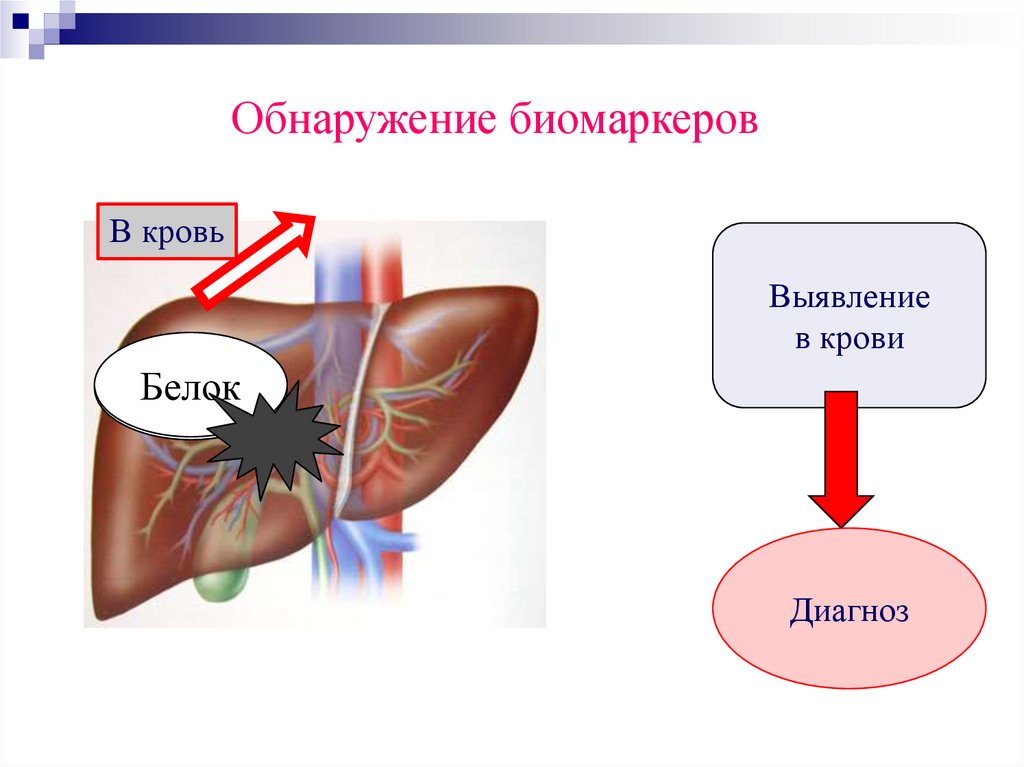
Обнаружение биомаркеровВ кровь
Выявление
в крови
Белок
Белок
Диагноз
17.
Белкисамый многочисленный класс макромолекул,
полипептиды, содержащие 50 и более АМК, соединённых
пептидными связями.
Пептидные связи – ковалентные, уникальны по размерам.
18.
БелкиКаждый организм характеризуется уникальным набором
белков. В организме человека содержится 50000
индивидуальных белков (около 15 кг).
На долю белков приходится 70-80 % в мышцах, печени,
селезёнке, почках.
АМК и белки содержат 95% всего азота в организме.
Содержание азота в белках 16%
19.
Функции белковструктурная,
каталитическая,
регуляторная
рецепторная,
иммунологическая,
защитная,
транспортная,
сократительная,
питательная,
дыхательная,
обезвреживающая,
геннорегуляторная,
создание биопотенциалов мембран,
гомеостатическая,
индивидуальное строение органов,
обеспечивают хорошее зрение.
энергетическая
20.
Специфические особенности белковопределяются
длиной полипептидной цепи,
различиями АМК состава,
порядком чередования АМК.
21.
Классификация аминокислот позаменимости
заменимые,
незаменимые
(Вал, Иле, Лей, Лиз, Мет, Тре, Три, Фен) ,
частично заменимые (Арг, Гис),
условно заменимые (Цис, Тир).
R
C
N
C
N
R
N
R
N
R
R
C
N
C
C
N
N
R
C
R
C
N
22.
Незаменимые аминокислотыВал, Иле, Лей, Лиз, Мет, Тре, Три, Фен.
Незаменимые АМК для детей: Вал, Иле, Лей, Лиз, Мет, Тре, Три,
Фен, Гис и Арг.
Скорость синтеза Гис и Арг недостаточна для того, чтобы
обеспечить рост организма в детстве.
Исключение какой-либо АМК из пищи сопровождается развитием
отрицательного азотистого баланса, истощением, остановкой в
росте, нарушениями со стороны нервной системы.
При отсутствии Гис, Арг – анемия.
При отсутствии Три – катаракта.
При отсутствии Лиз - кариес, задержка роста.
При отсутствии Мет страдает печень.
23.
Незаменимые аминокислотыМЕТИОНИН
в твороге, молоке, яйцах, бобах, фасоли, чечевице, сое
24.
Незаменимые аминокислотыТРИПТОФАН
в овсе, бананах, сушёных финиках, арахисе, кунжуте, кедровых
орехах, молоке, йогурте, твороге.
25.
Незаменимые аминокислотыАРГИНИН
в мясе, семенах тыквы, арахисе,
кунжуте, йогурте, сыре
26.
Первичная структура белкапорядок, последовательность расположения АМК в
полипептидной цепи.
27.
Свойства первичной структуры белкауникальна, детерминирована генетически,
стабильность обеспечивается в основном пептидными связями,
возможно участие небольшого числа дисульфидных связей,
в первичной структуре детерминированы вторичная, третичная и
четвертичная структуры белковой молекулы,
в полипептидной цепи могут быть обнаружены разнообразные
комбинации АМК:
не во всех белках содержатся все 20 АМК,
ни в одном белке АМК не содержатся в эквивалентных
отношениях,
некоторые АМК встречаются редко и в меньшем количестве
(гли в 10 раз чаще, чем три).
28.
Изучена первичная структура у ряда белковинсулин,
миоглобин,
гемоглобин,
цитохром С,
АКТГ,
рибонуклеаза,
АСТ,
химотрипсиноген.
29.
Даже небольшие изменения первичной структурыизменяют свойства белков
HbA1 - у здоровых людей,
HbS - у больных серповидно-клеточной анемией.
HbS в шестом положении β-цепи вместо глу имеет валин.
Отличаются белки по физическим, химическим и
биологическим свойствам.
30.
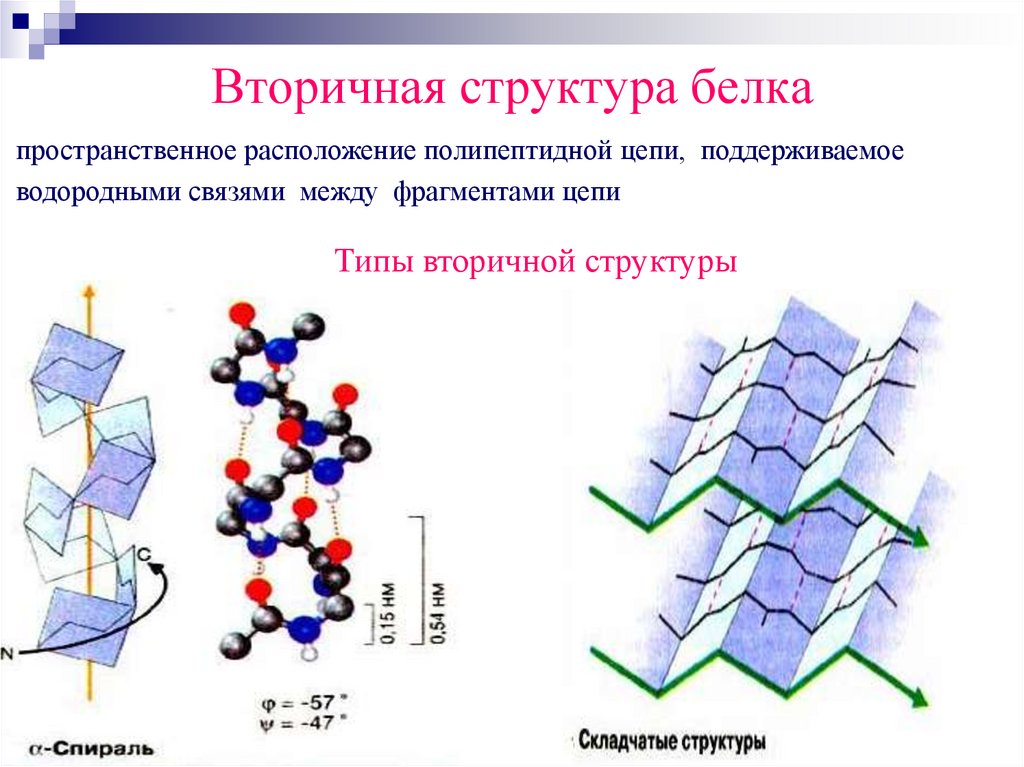
Вторичная структура белкапространственное расположение полипептидной цепи, поддерживаемое
водородными связями между фрагментами цепи
Типы вторичной структуры
31.
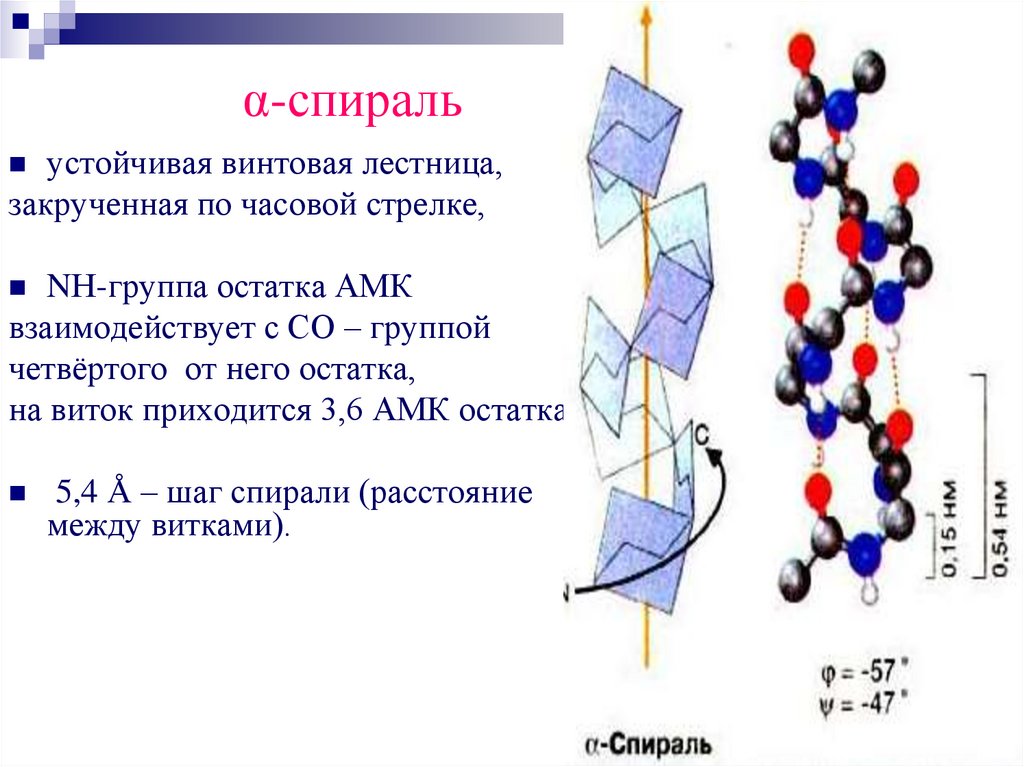
α-спиральустойчивая винтовая лестница,
закрученная по часовой стрелке,
NН-группа остатка АМК
взаимодействует с СО – группой
четвёртого от него остатка,
на виток приходится 3,6 АМК остатка,
5,4 Å – шаг спирали (расстояние
между витками).
32.
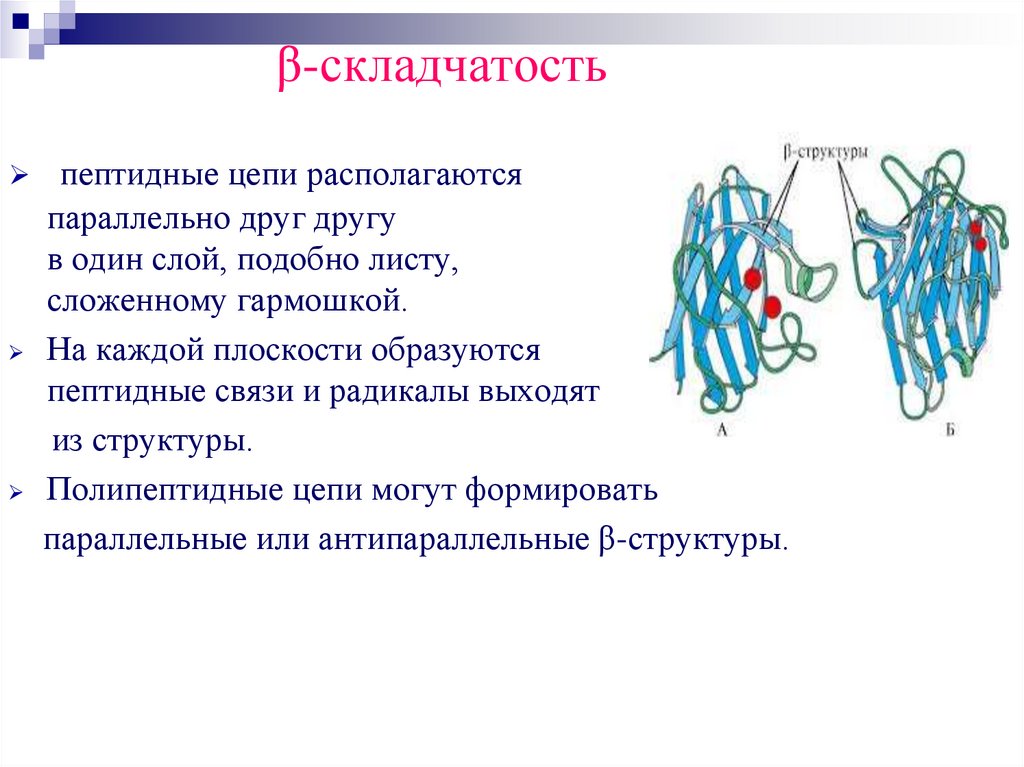
β-складчатостьпептидные цепи располагаются
параллельно друг другу
в один слой, подобно листу,
сложенному гармошкой.
На каждой плоскости образуются
пептидные связи и радикалы выходят
из структуры.
Полипептидные цепи могут формировать
параллельные или антипараллельные β-структуры.
33.
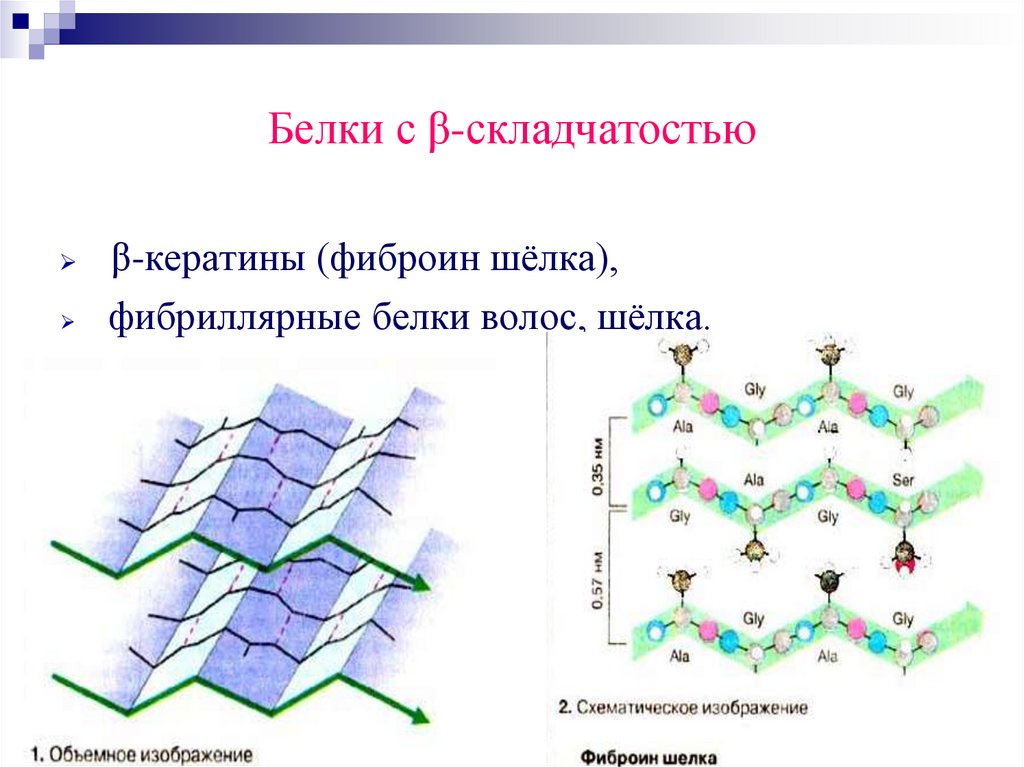
Белки с β-складчатостьюβ-кератины (фиброин шёлка),
фибриллярные белки волос, шёлка.
34.
Содержание разных типов вторичныхструктур в белках
только α-спираль (гемоглобин, миоглобин),
α-спираль и β-складчатость (ЛДГ, фосфоглицераткиназа),
β-складчатость (СОД),
белки, имеющие в составе незначительное количество регулярных
вторичных структур.
35.
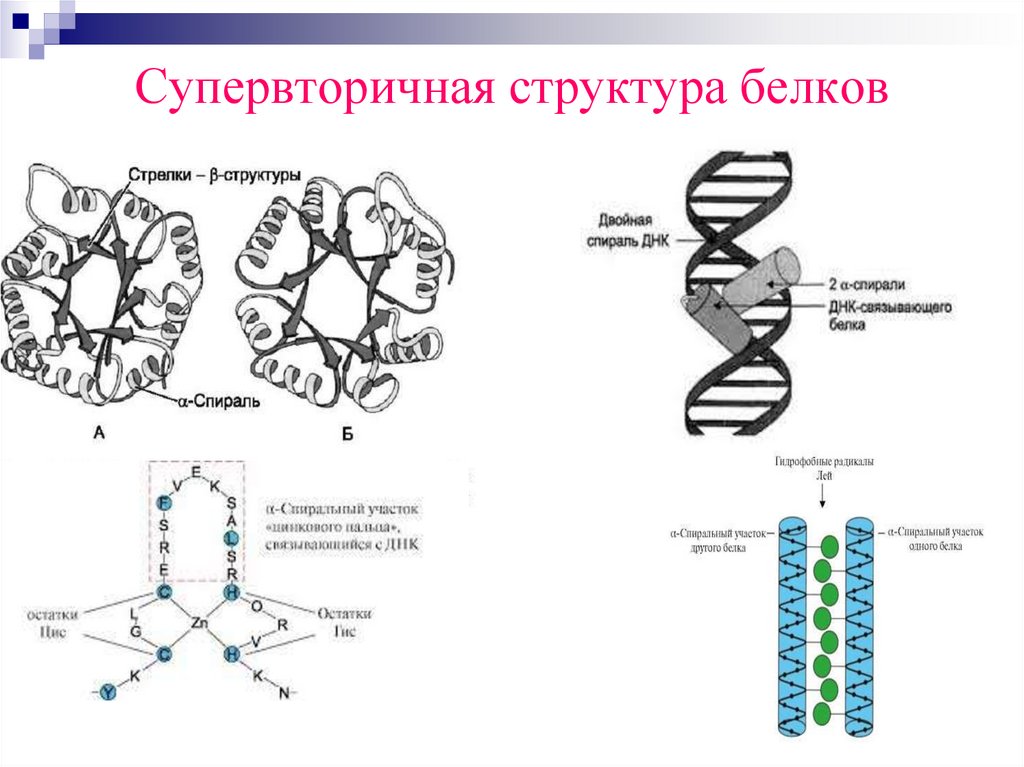
Супервторичная структура белков36.
Третичная структура белковой молекулыпространственное расположение пептидной цепи,
поддерживаемое межрадикальными связями.
Все биологические свойства белков связаны с
сохранностью их третичной структуры.
37.
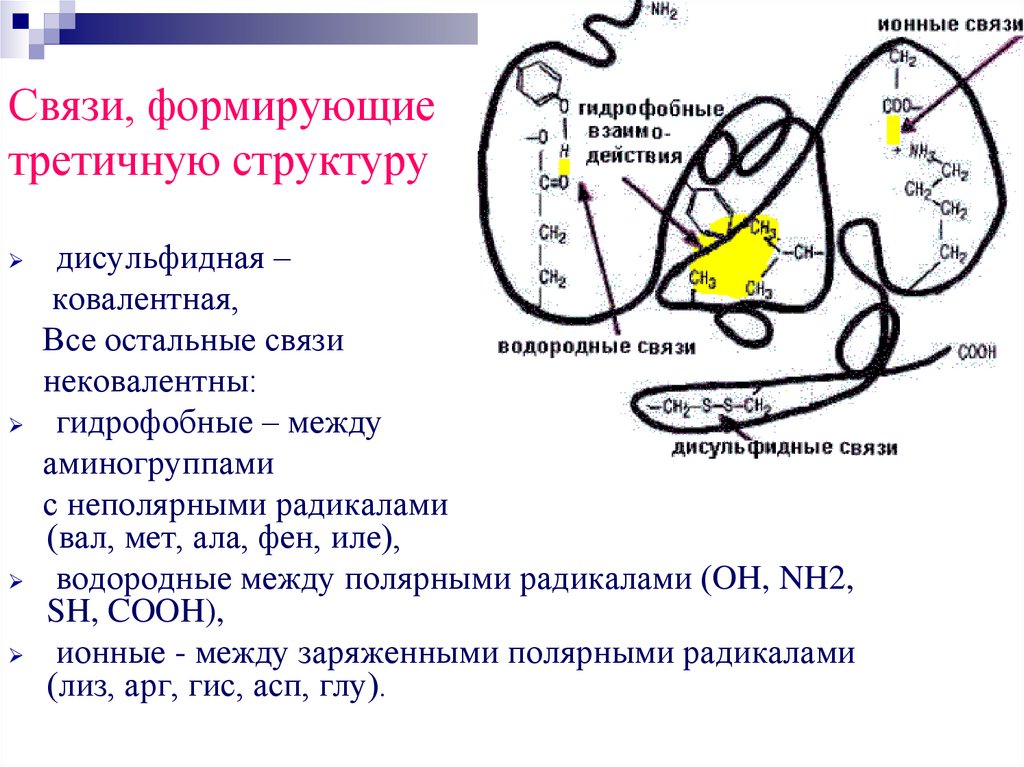
Связи, формирующиетретичную структуру
дисульфидная –
ковалентная,
Все остальные связи
нековалентны:
гидрофобные – между
аминогруппами
с неполярными радикалами
(вал, мет, ала, фен, иле),
водородные между полярными радикалами (OH, NH2,
SH, COOH),
ионные - между заряженными полярными радикалами
(лиз, арг, гис, асп, глу).
38.
Белки с известной третичной структуройгемоглобин,
трипсин,
лизоцим,
инсулин,
цитохром.
39.
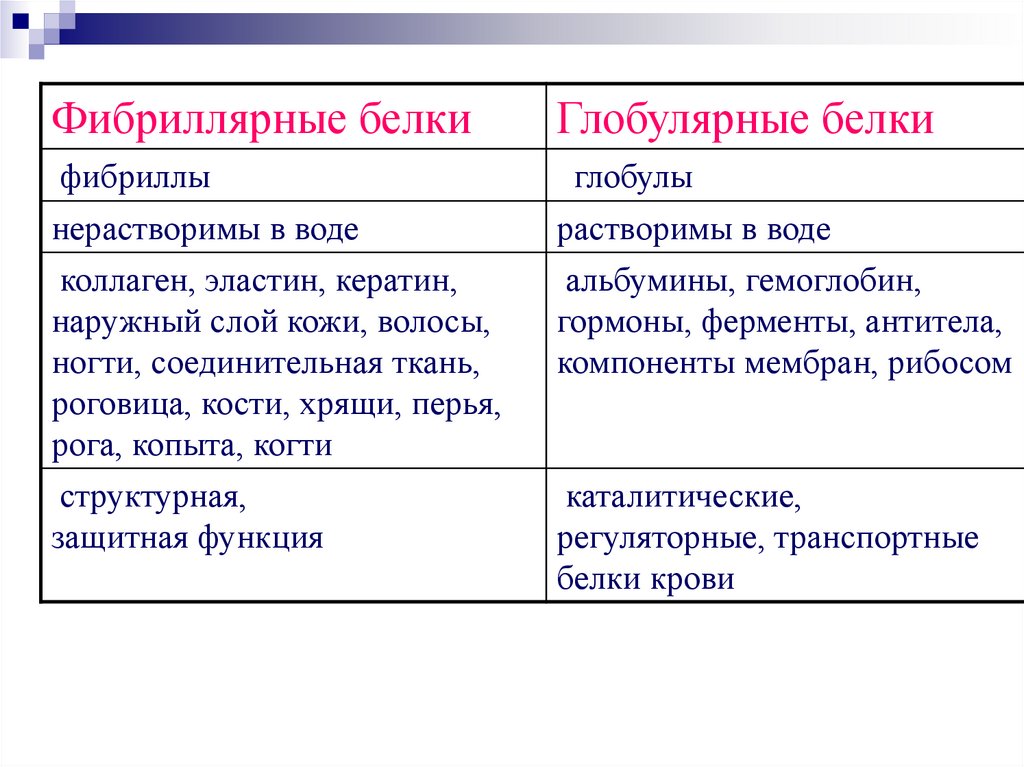
Фибриллярные белкиГлобулярные белки
фибриллы
глобулы
нерастворимы в воде
коллаген, эластин, кератин,
наружный слой кожи, волосы,
ногти, соединительная ткань,
роговица, кости, хрящи, перья,
рога, копыта, когти
структурная,
защитная функция
растворимы в воде
альбумины, гемоглобин,
гормоны, ферменты, антитела,
компоненты мембран, рибосом
каталитические,
регуляторные, транспортные
белки крови
40.
Четвертичная структура белкабелок может состоять из нескольких цепей, число и
взаиморасположение в пространстве которых различно.
41.
Олигомерные белкисостоят из нескольких полипептидных цепей:
гемоглобин - 4,
гексокиназа – 2,
ГЛДГ - 6,
ферритин - 24.
42.
Связи, поддерживающие четвертичнуюструктуру белка
гидрофобные,
ионные,
водородные.
43.
Структурная организация белковой молекулыКаждый белок характеризуется уникальной структурой,
обеспечивающей уникальность его функций
44.
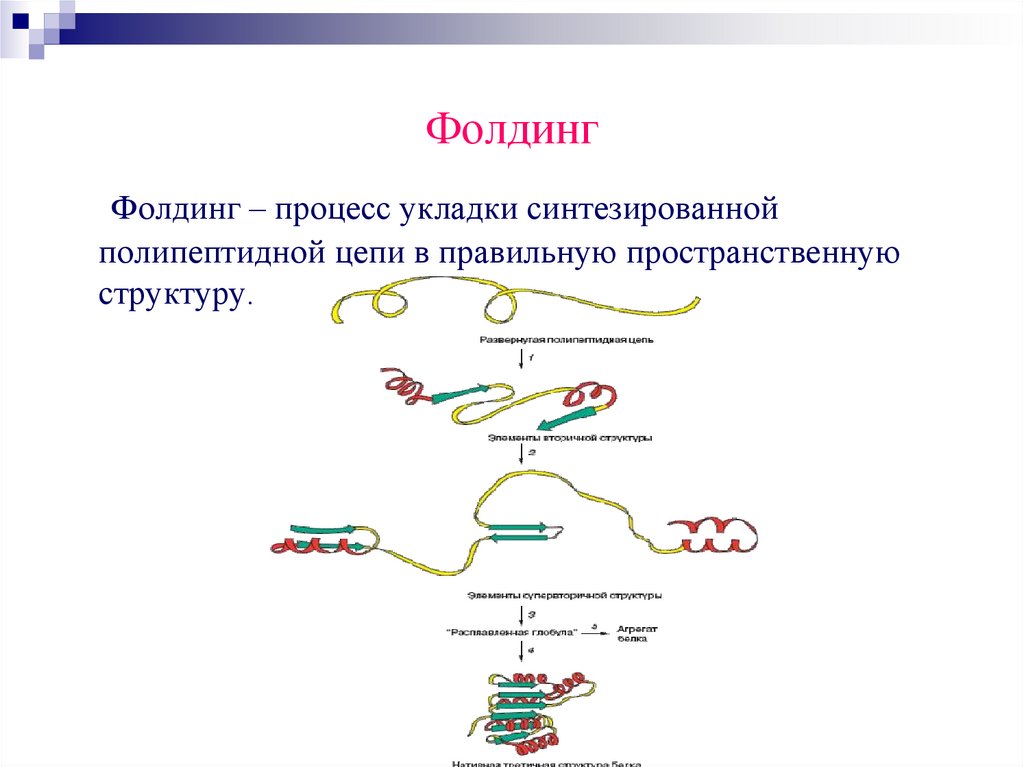
ФолдингФолдинг – процесс укладки синтезированной
полипептидной цепи в правильную пространственную
структуру.
45.
ШапероныШапероны – белки, с помощью которых осуществляется
фолдинг.
Конститутивные шапероны. Синтез не зависит от
стрессовых воздействий на клетки организма.
Индуцибельные шапероны (белки теплового шока).
Синтезируются при стрессовом воздействии.
46.
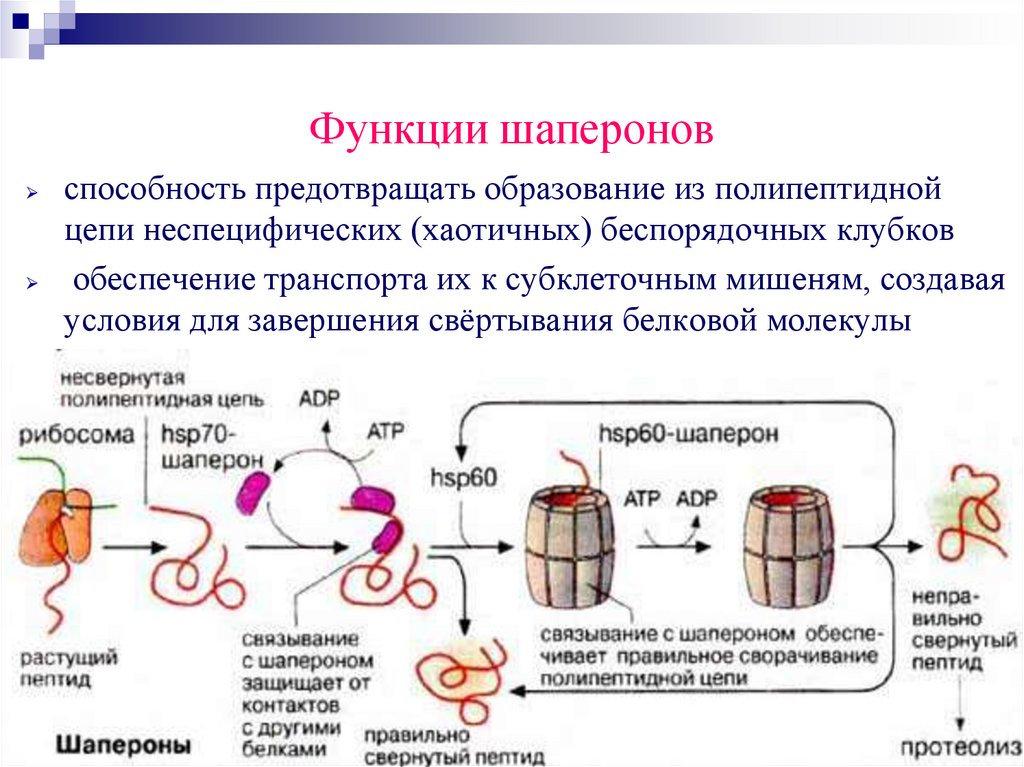
Функции шапероновспособность предотвращать образование из полипептидной
цепи неспецифических (хаотичных) беспорядочных клубков
обеспечение транспорта их к субклеточным мишеням, создавая
условия для завершения свёртывания белковой молекулы
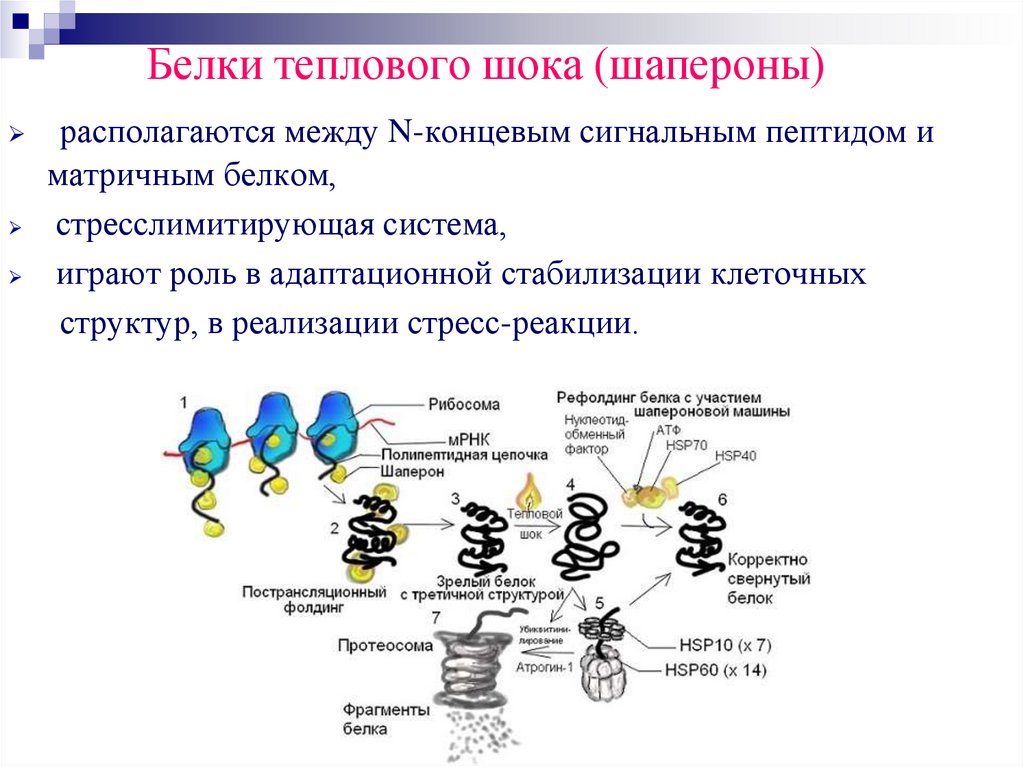
47.
Белки теплового шока (шапероны)располагаются между N-концевым сигнальным пептидом и
матричным белком,
стресслимитирующая система,
играют роль в адаптационной стабилизации клеточных
структур, в реализации стресс-реакции.
48.
Нарушение фолдингаОписан ряд наследственных заболеваний человека,
развитие которых связывают с нарушением фолдинга:
пигментозы, фиброзы, болезнь Альцгеймера, прионовые
болезни, болезнь Паркинсона, сахарный диабет 2 типа.
49.
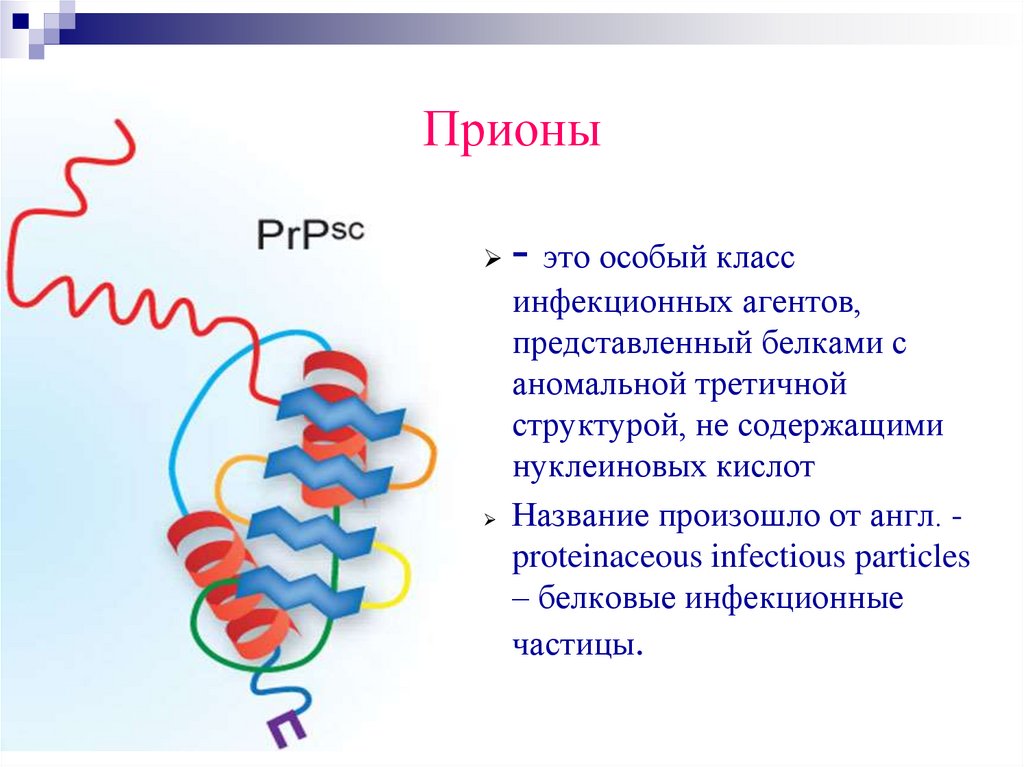
Прионы- это особый класс
инфекционных агентов,
представленный белками с
аномальной третичной
структурой, не содержащими
нуклеиновых кислот
Название произошло от англ. proteinaceous infectious particles
– белковые инфекционные
частицы.
50.
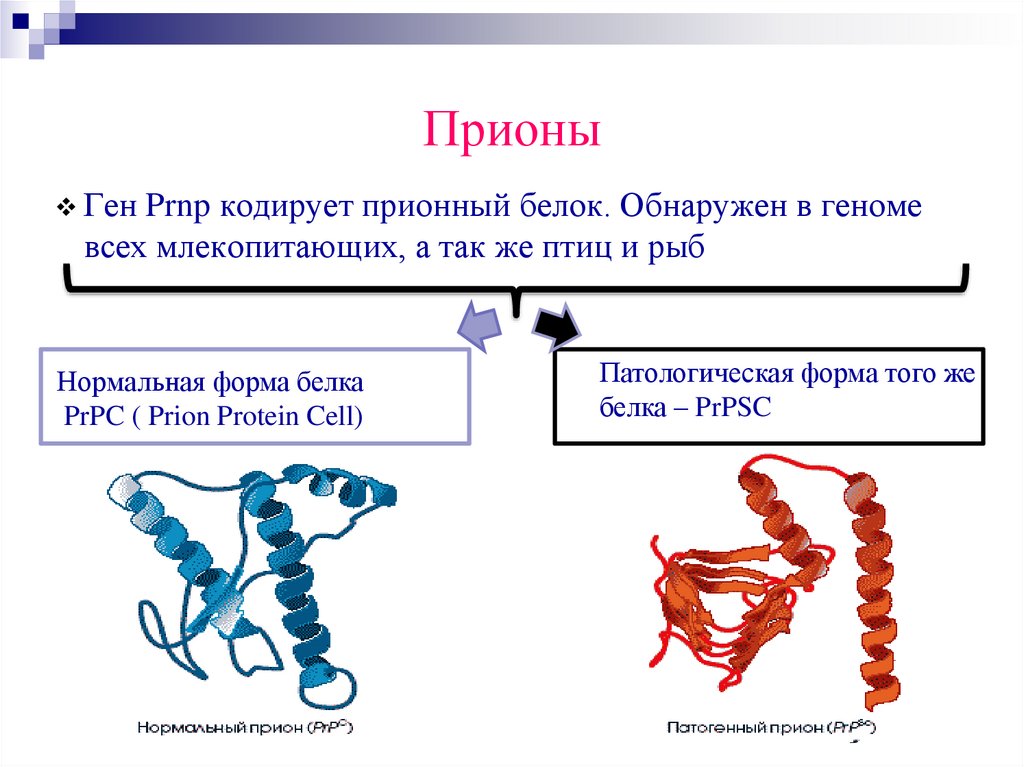
ПрионыГен Prnp кодирует прионный белок. Обнаружен в геноме
всех млекопитающих, а так же птиц и рыб
Нормальная форма белка
PrPC ( Prion Protein Cell)
Патологическая форма того же
белка – PrPSC
51.
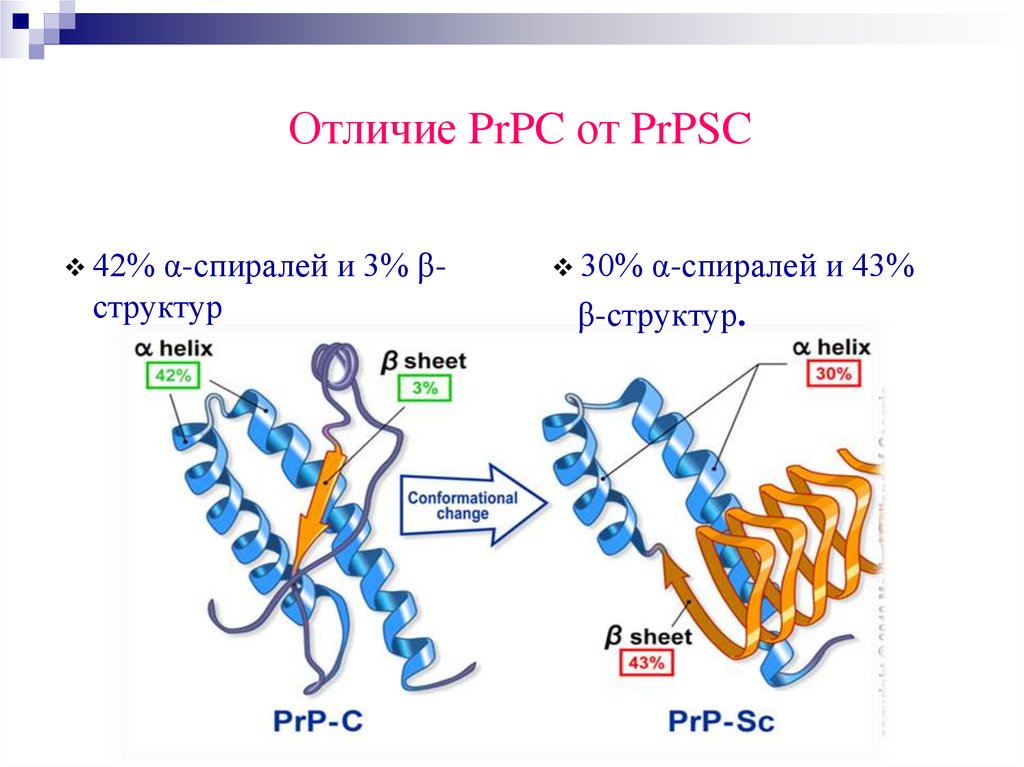
Отличие PrPC от PrPSC42% α-спиралей и 3% β-
структур
30% α-спиралей и 43%
β-структур.
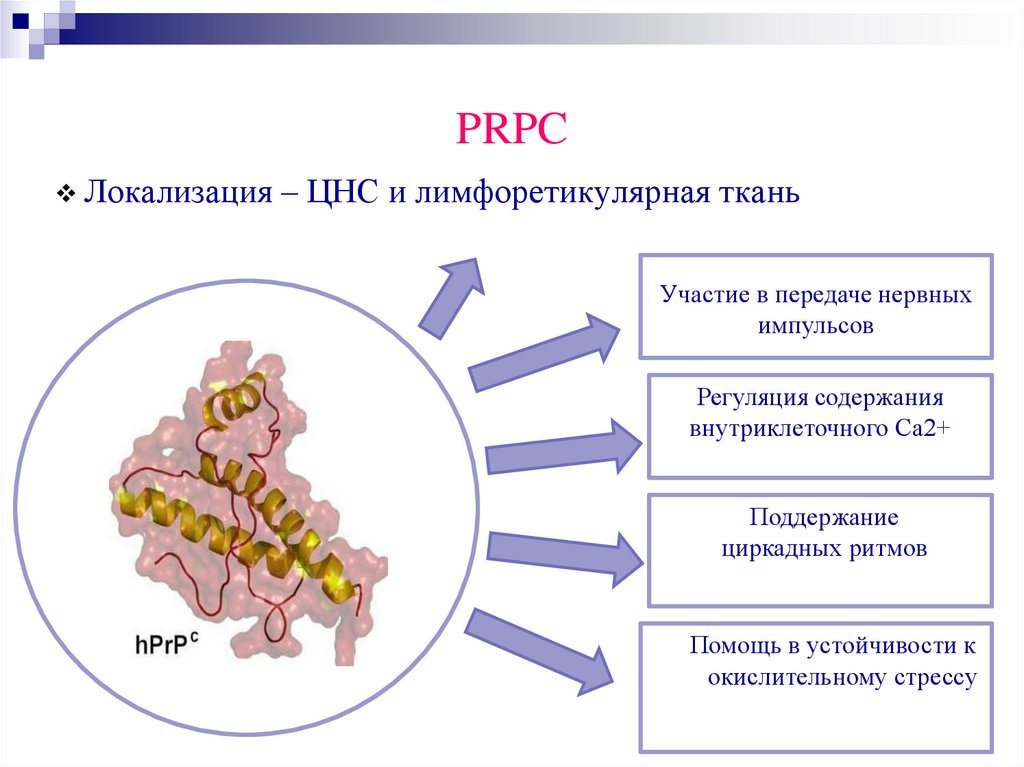
52.
PRPCЛокализация – ЦНС и лимфоретикулярная ткань
Участие в передаче нервных
импульсов
Регуляция содержания
внутриклеточного Са2+
Поддержание
циркадных ритмов
Помощь в устойчивости к
окислительному стрессу
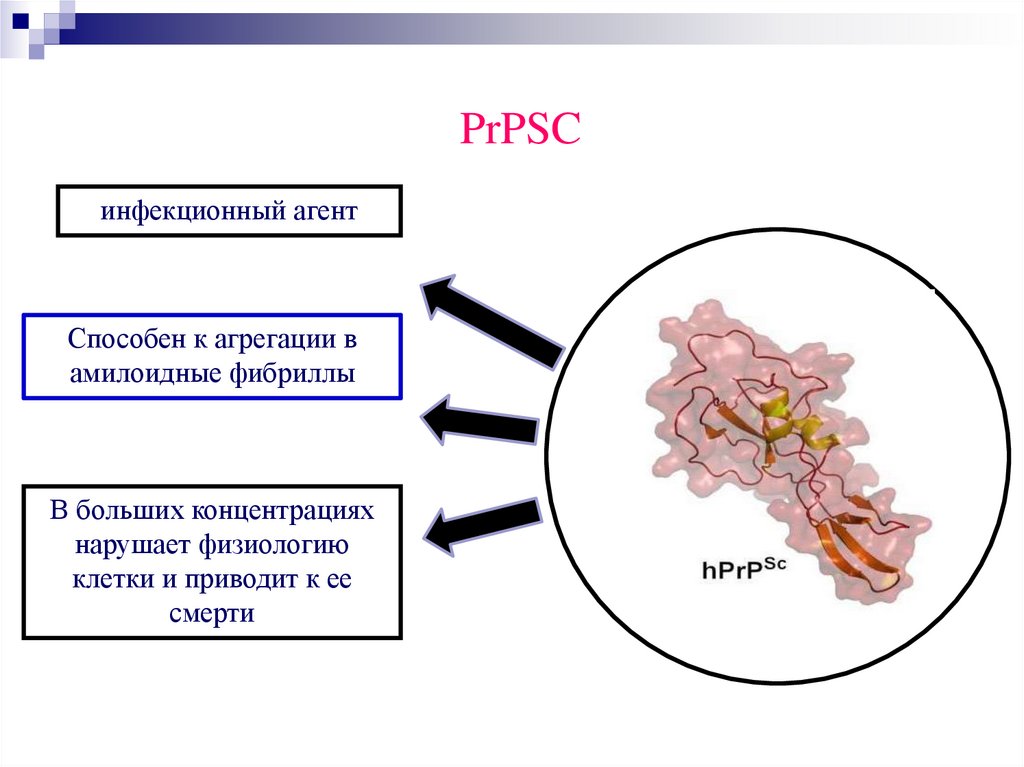
53.
PrPSCинфекционный агент
Способен к агрегации в
амилоидные фибриллы
В больших концентрациях
нарушает физиологию
клетки и приводит к ее
смерти
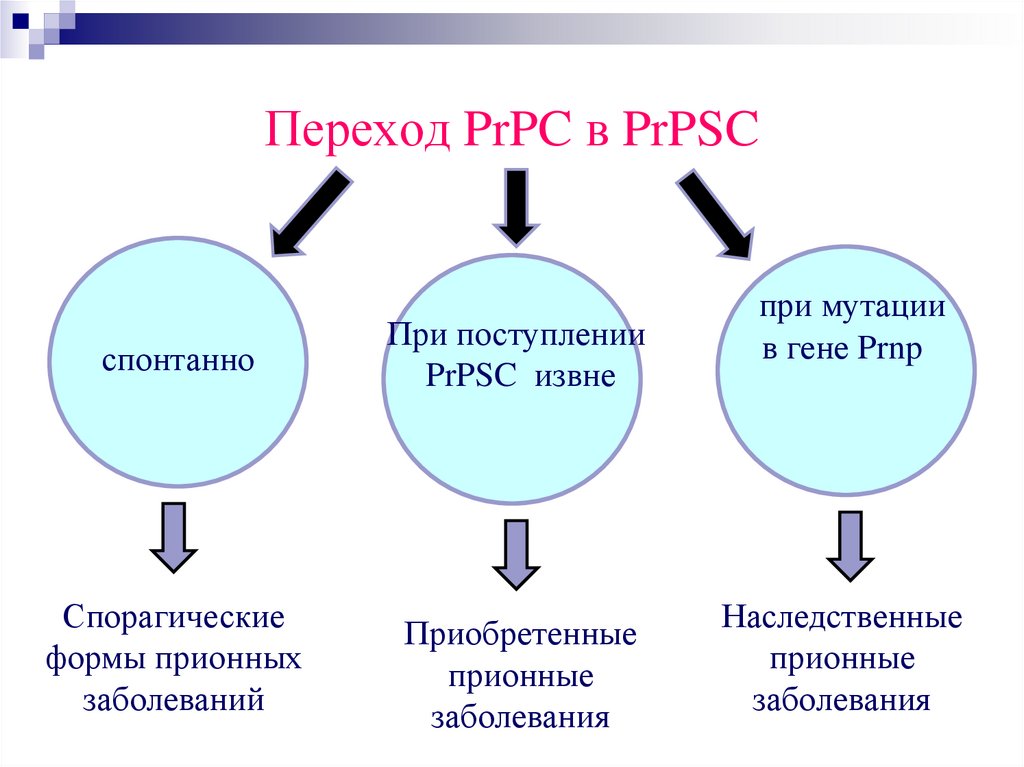
54.
Переход PrPC в PrPSCспонтанно
При поступлении
PrPSC извне
Спорагические
формы прионных
заболеваний
Приобретенные
прионные
заболевания
при мутации
в гене Prnp
Наследственные
прионные
заболевания
55.
Классификация белков56.
Классификация белковпростые белки,
сложные белки
57.
Классификация простых белковальбумины,
глобулины,
гистоны,
протамины,
протеиноиды.
58.
Альбуминыглобулярные белки,
молекулярная масса 70 000,
растворимы в воде,
ИЭТ 5,
высаливаются 100% сульфатом аммония,
синтез в печени.
59.
Функции альбуминовдепо белка в организме,
осморегуляция,
неспецифическая защита,
транспорт лекарств, металлов, холестерина, билирубина,
желчных пигментов, гормонов.
60.
Глобулиныглобулярные белки,
молекулярная масса 150 000 дальтон,
растворимы в солевых растворах,
ИЭТ 7,
имеют ряд фракций,
высаливаются 50% сульфатом аммония,
синтезируются в печени и В-лимфоцитах.
61.
Функции глобулиновкаталитическая,
транспортная,
защитная
γ-глобулины являются антителами.
62.
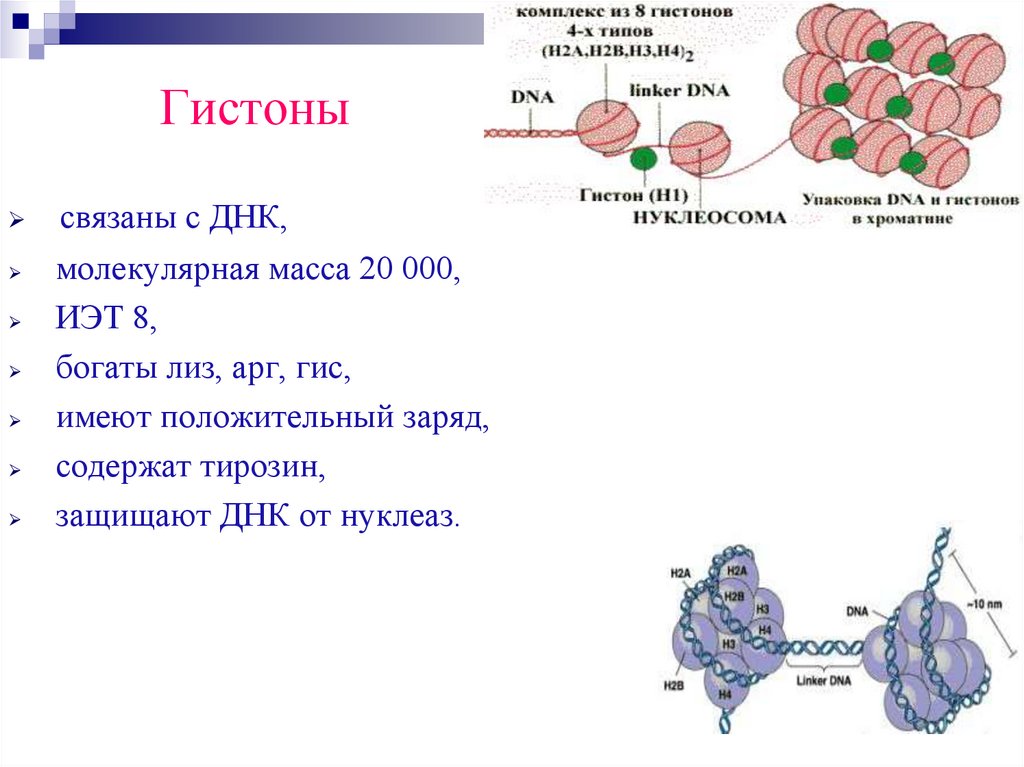
Гистонысвязаны с ДНК,
молекулярная масса 20 000,
ИЭТ 8,
богаты лиз, арг, гис,
имеют положительный заряд,
содержат тирозин,
защищают ДНК от нуклеаз.
63.
Протаминымолекулярная масса 5000,
ИЭТ 11,
содержат много арг, лиз,
имеют положительный заряд,
не содержат тирозин,
являются белковым компонентом нуклеопротеинов.
64.
ПротеиноидыФибриллярные белки:
коллаген,
эластин,
кератины.
65.
КоллагенТреть общего белка организма приходится на коллаген –
основной белок соединительной ткани.
Молекулярная масса коллагена 300 000.
Содержится коллаген в коже, роговице, костях,
хрящах.
66.
Аминокислотныйсостав коллагена
глицин -30%,
гидроксипролин – 15%,
пролин – 5%,
67.
Строение коллагенамолекула коллагена состоит из 3 полипептидных цепей,
в каждой примерно 1000 АМК,
вторичная структура коллагена – 3 спирали перевиты
друг с другом, образуя плотный жгут (тропоколлаген),
все 3 цепи параллельны.
Молекулы коллагена образуют микрофибриллы,
из них образуются пучки волокон.
Тройная спираль коллагена стабилизируется
межцепочечными сшивками между лизиновыми и
гидроксилизиновыми остатками.
Гидроксипролин стабилизирует тройную спираль
коллагена по отношению к действию протеолитических
ферментов.
68.
Уникальная особенность метаболизмагидроксипролина
Эта АМК, входящая в состав белков пищи, не включается в
коллаген.
Пищевой пролин является предшественником гидроксипролина
в составе коллагена.
На каждый моль пролина
декарбоксилируется 1 моль
α-кетоглутарата с образованием сукцината. В результате
реакции один атом кислорода поступает в сукцинат, а другой в
пролин.
Аскорбиновая кислота
2+
α-кетоглутарат
О2
пролин
Fe
сукцинат
пролилгидроксилаза
гидроксипролин
69.
КоллагенИзвестно 19 типов коллагена.
Определённую роль в синтезе коллагена играют
белки-шапероны, обеспечивающие «контроль качества»
коллагена.
Ряд заболеваний связан с нарушением синтеза
коллагена. Основная причина - мутации.
Коллаген 1 типа содержится в костях, дентине, роговице,
сухожилиях.
С дефектом коллагена 1 типа связан несовершенный
остеогенез (ломкость костей, аномалии зубов,
гиперподвижность суставов).
70.
Сложные белкихромопротеины состоят из простого белка и связанного с
ним окрашенного компонента,
гемопротеины: железосодержащие - красные,
магнийсодержащие -зелёные, медьсодержащие – голубые,
жёлтые флавопротеины.
71.
Гемопротеиныгемоглобин,
миоглобин,
цитохромы,
каталаза,
пероксидаза.
72.
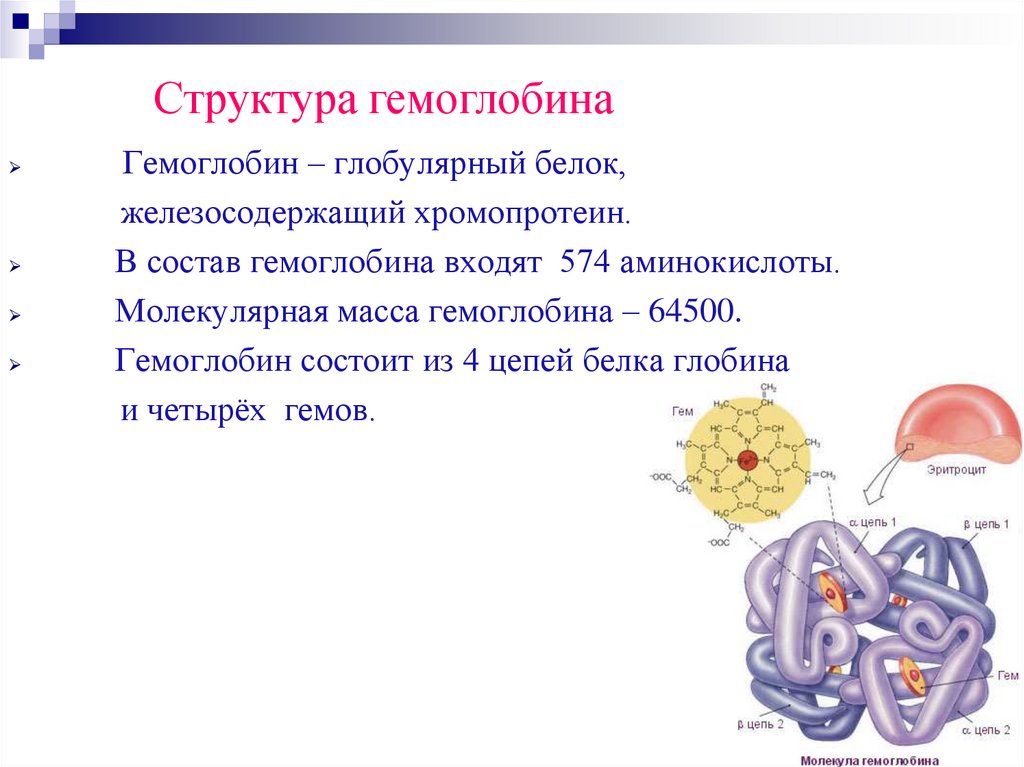
Структура гемоглобинаГемоглобин – глобулярный белок,
железосодержащий хромопротеин.
В состав гемоглобина входят 574 аминокислоты.
Молекулярная масса гемоглобина – 64500.
Гемоглобин состоит из 4 цепей белка глобина
и четырёх гемов.
73.
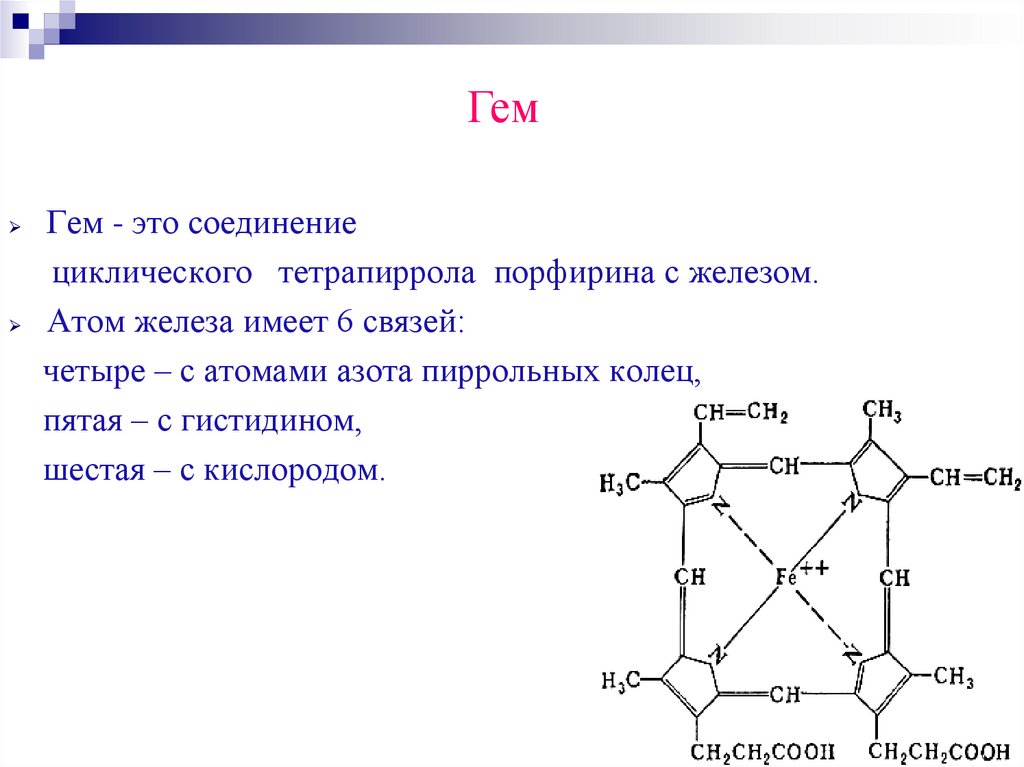
ГемГем - это соединение
циклического тетрапиррола порфирина с железом.
Атом железа имеет 6 связей:
четыре – с атомами азота пиррольных колец,
пятая – с гистидином,
шестая – с кислородом.
74.
Глобинсинтезируется в нормобластах
состоит из четырёх полипептидных цепей:
2α -цепи по 141 АМК,
2β -цепи по 146 АМК.
содержит много гистидина.
Первичная структура – последовательность АМК, соединённых
пептидной связью.
Вторичная структура – α-спираль.
Спирализованные неподвижные участки (70%)
прерываются подвижными неспирализованными.
Третичная структура – глобулярный белок.
Четвертичная структура – белок состоит из 4-х полипептидных цепей
С каждой цепью связан один гем.
75.
Флавопротеиныксантиноксидаза,
СДГ,
альдегидоксидаза,
ацил-КоА-ДГ.
ксантиноксидаза
76.
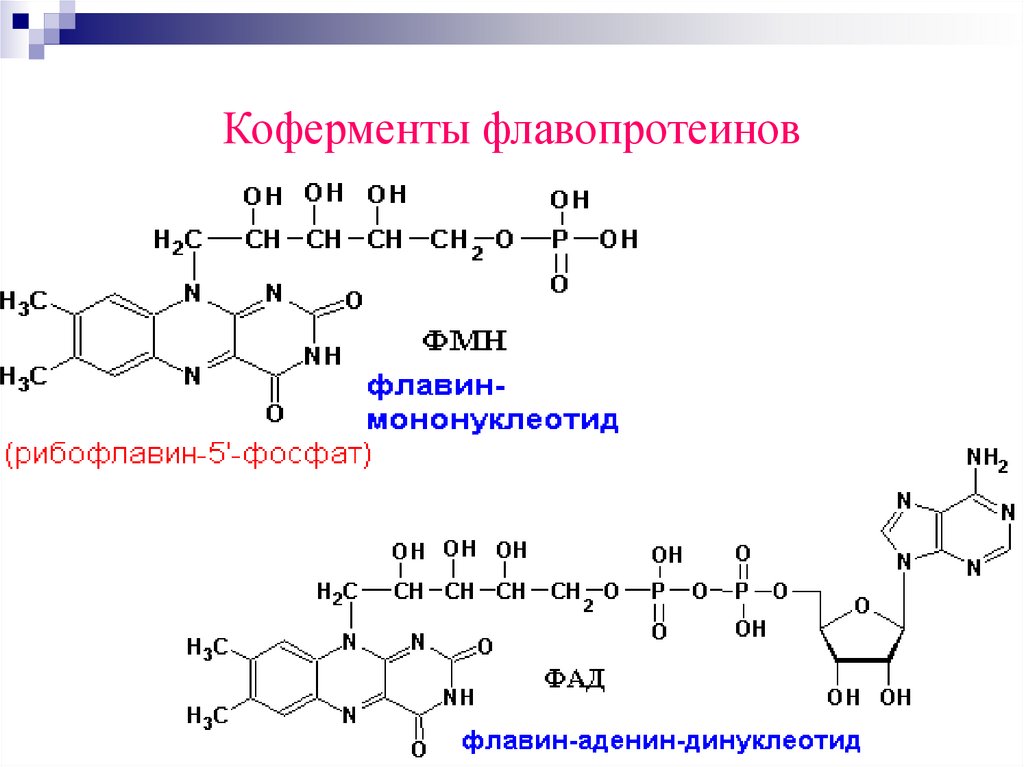
Коферменты флавопротеинов77.
МеталлопротеиныБелки содержащие негеминовое железо
ферритин – депо железа в организме, в составе этого
белка находится 20% железа организма, образуется в
печени и селезёнке,
трансферрин.
78.
Белки-ферменты - металлопротеиныСu-содержащие: цитохромоксидаза, церулоплазмин,
тирозиназа,
Mn-содержащие: аргиназа,
Zn-содержащие: карбоангидраза, алкогольДГ.
79.
Фосфопротеинысостоят из белка и фосфорной кислоты,
фосфорная кислота присоединяется через ОН-группу
серина,
в большом количестве содержатся в клетках ЦНС
казеиноген в молоке,
овальбумин и фосвитин в яйцах,
ихтулин в икре рыбы,
80.
Биологическая роль фосфопротеиноввходят в состав мозга,
в растущем организме фосфор – пластический материал,
способны отдавать фосфорную кислоту для макроэргов и
ферментов.
81.
Липопротеиныв простетическую группу входят ТАГ, фосфолипиды,
холестерин
синтезируются в печени и в слизистой оболочке
кишечника.
82.
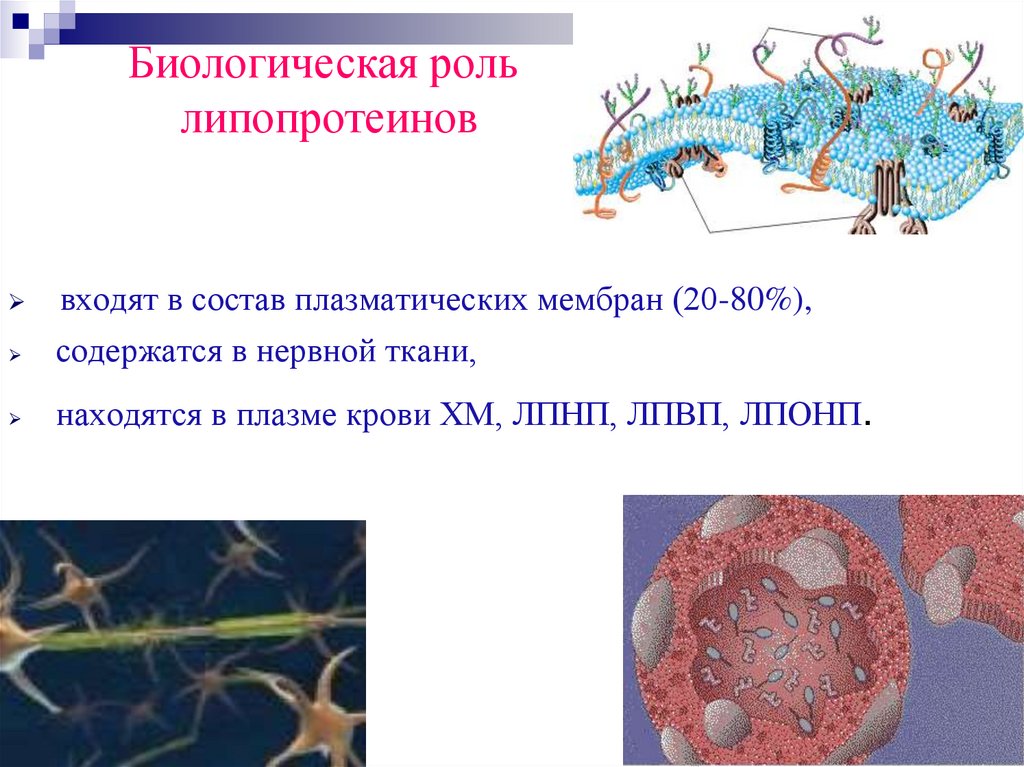
Биологическая рольлипопротеинов
входят в состав плазматических мембран (20-80%),
содержатся в нервной ткани,
находятся в плазме крови ХМ, ЛПНП, ЛПВП, ЛПОНП.
83.
Гликопротеиныбелки, содержащие олигосахаридные цепи, ковалентно
присоединённые к полипептидной основе,
углеводные компоненты ковалентно соединены с азотом
аспарагина молекулы белка,
при развитии ряда болезней (рак, астма, ревматоидный артрит)
изменяются структуры гликопротеинов.
84.
Углеводный компонент гликопротеиновгалактоза, глюкоза, манноза, N-ацетилгалактозамин,
N-ацетилглюкозамин, N-ацетилнейраминовая кислота,
фукоза.
Наличие углеводного компонента увеличивает специфичность
взаимодействия белка с присоединяемыми молекулами и
защищает от действия протеаз.
85.
Функции гликопротеиновструктурная (находятся в плазматических мембранах),
смазочная и защитная (муцины, слизь),
транспорт витаминов, липидов, микроэлементов,
иммунологическая (иммуноглобулины, антигены
гистосовместимости, комплемент, интерферон),
гормоны (хорионический гонадотропин, ТТГ),
ферменты,
места клеточных контактов распознавания,
гормональные рецепторы,
лектины влияют на эмбриональное развитие и
дифференцировку, могут влиять на выбор мест
метастазирования раковых клеток.
86.
В организме человека гликопротеины содержатся вклеточных оболочках,
костях,
хрящах,
слюне,
секретах желёз,
крови.
87.
ФибронектинФибронектин — гликопротеин внеклеточного матрикса.
Этот белок связывается с коллагеном, фибрином,
интегринами (мембранными рецепторными белками),
способствует адгезии клеток.
Если на поверхности злокачественных клеток снижается
количество фибронектина, то они менее прочно связаны
между собой и становится возможным метастазирование.
88.
Нуклеопротеиныбелок – гистоны, протамины,
НК – ДНК, РНК – полинуклеотиды, состоящие из
мононуклеотидов.
89.
Значение нуклеотидовсинтез НК,
энергетическая роль,
коферменты,
транспортная функция.
90.
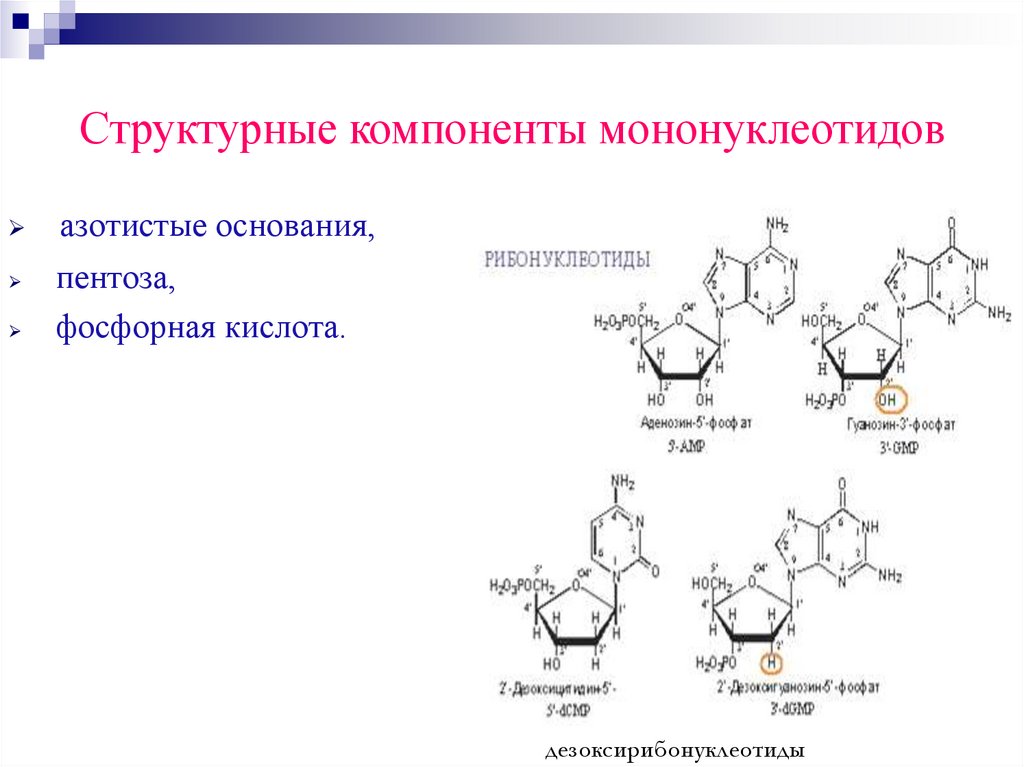
Структурные компоненты мононуклеотидовазотистые основания,
пентоза,
фосфорная кислота.
дезоксирибонуклеотиды
91.
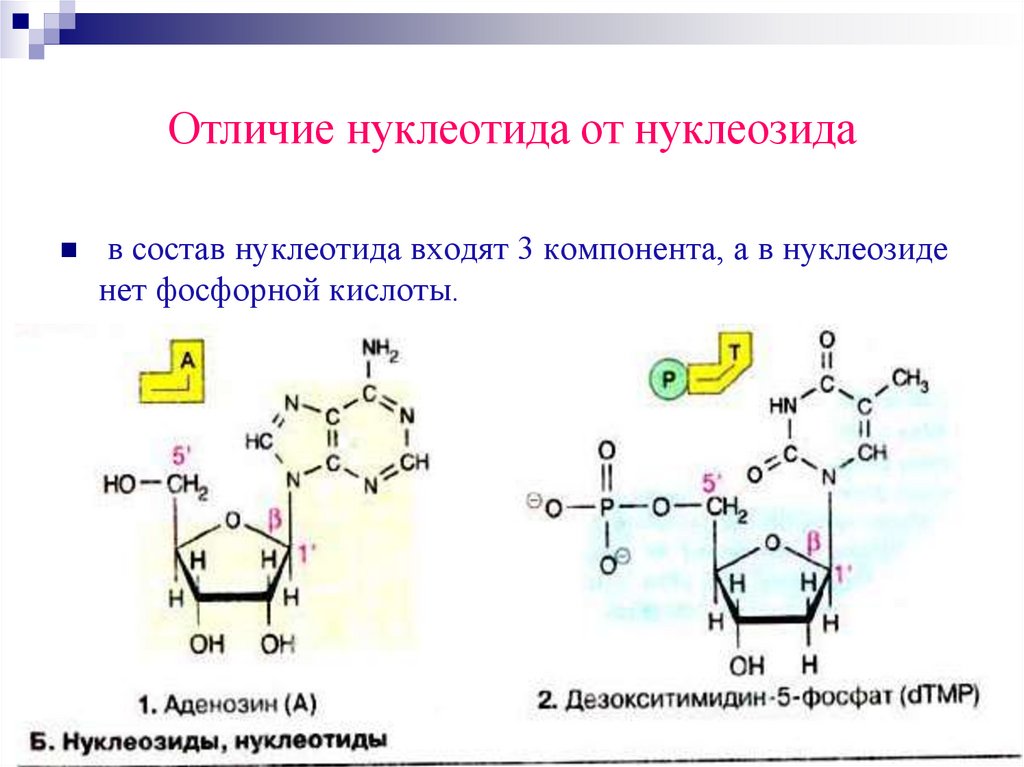
Отличие нуклеотида от нуклеозидав состав нуклеотида входят 3 компонента, а в нуклеозиде
нет фосфорной кислоты.
92.
Первичная структура нуклеиновых кислотпоследовательность мононуклеотидов, соединённых 3`-5` фосфодиэфирной связью.
93.
Вторичная структура нуклеиновых кислотпространственное расположение одной (РНК) или двух
(ДНК) полинуклеотидных цепей, стабилизируемое
водородными связями между основаниями .
94.
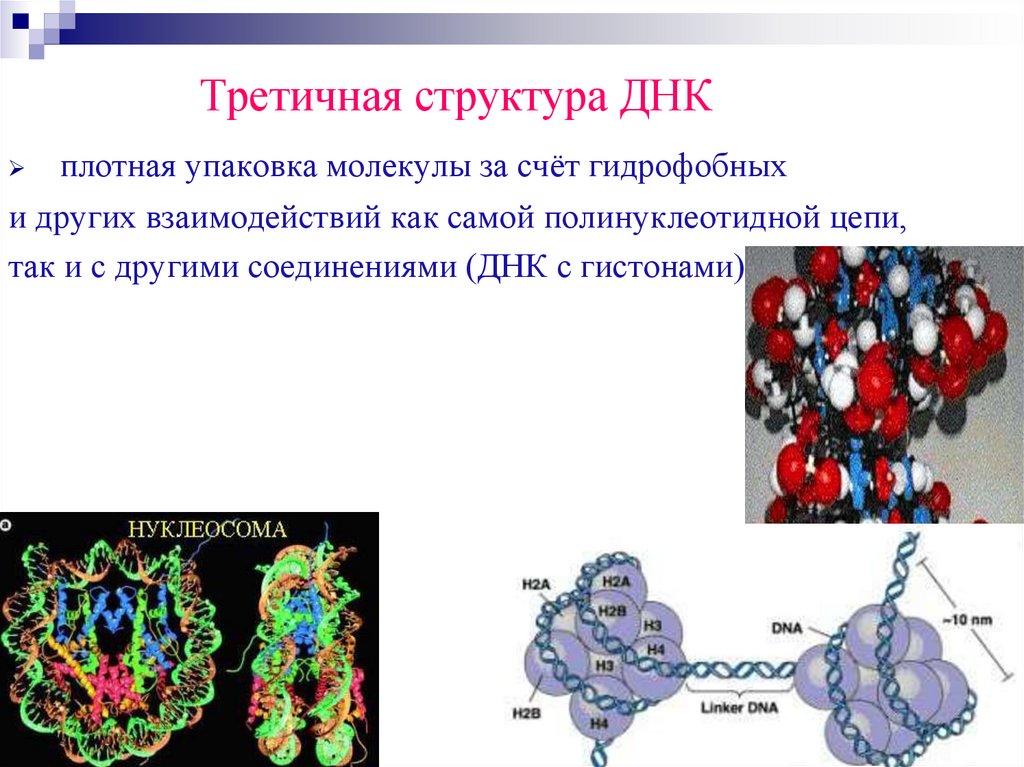
Третичная структура ДНКплотная упаковка молекулы за счёт гидрофобных
и других взаимодействий как самой полинуклеотидной цепи,
так и с другими соединениями (ДНК с гистонами).


































































 biology
biology chemistry
chemistry








