Similar presentations:
Электролиз. Интегрированный урок (химия + физика)
1.
Приходько ЮлияАлексеевна
Учитель математики и
физики
МОУ «СОШ №1 с УИОП»
Г. Губкин Белгородской
области
Электролиз
Интегрированный урок
(химия + физика)
11 класс
2.
Цели урока:-Проверка, корректировка и углубление знаний
учащихся по теме «Электролиз» через эксперимент
и решение задач.
-Формирование навыков техники выполнения
эксперимента, умения решать расчетные и
качественные задачи, составлять химические
реакции, протекающие при электролизе растворов и
расплавов электролитов.
-Воспитание самостоятельности, организованности,
развитие творческих способностей, логического
мышления, внимания, памяти.
3.
« Химик без знания физики подобен человеку,который все должен искать щупом»
М.В.Ломоносов
4. Группы
Ряд 1Ряд 2
Ряд 3
5.
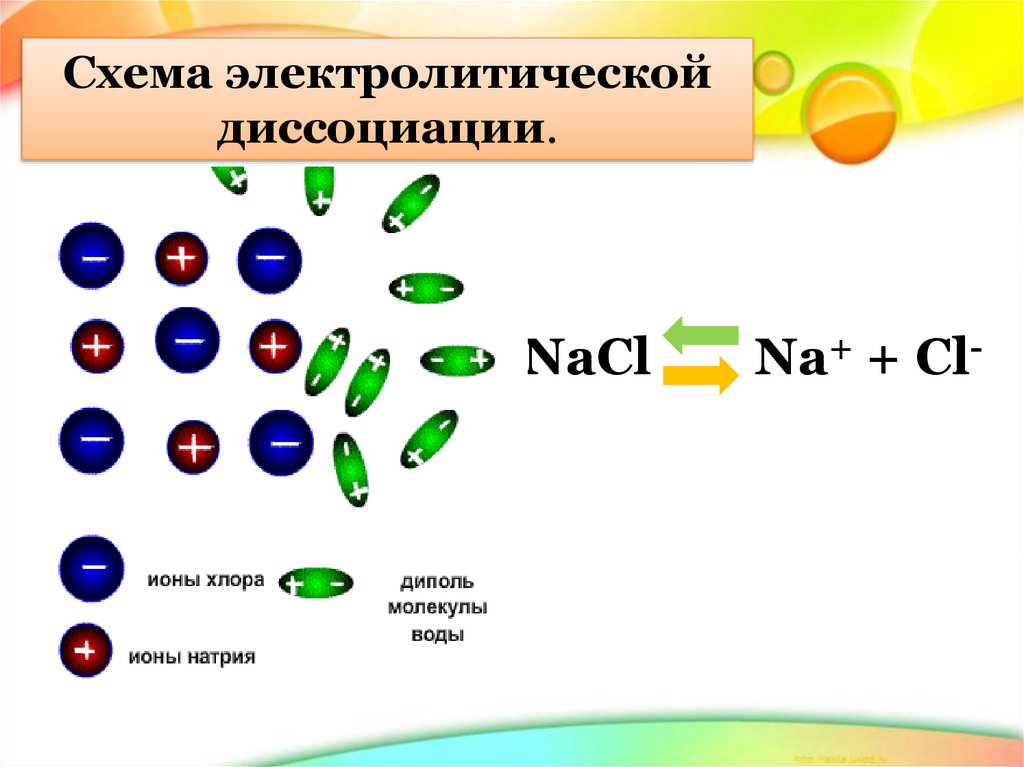
Схема электролитическойдиссоциации.
NaCl
Na+ + Cl-
6.
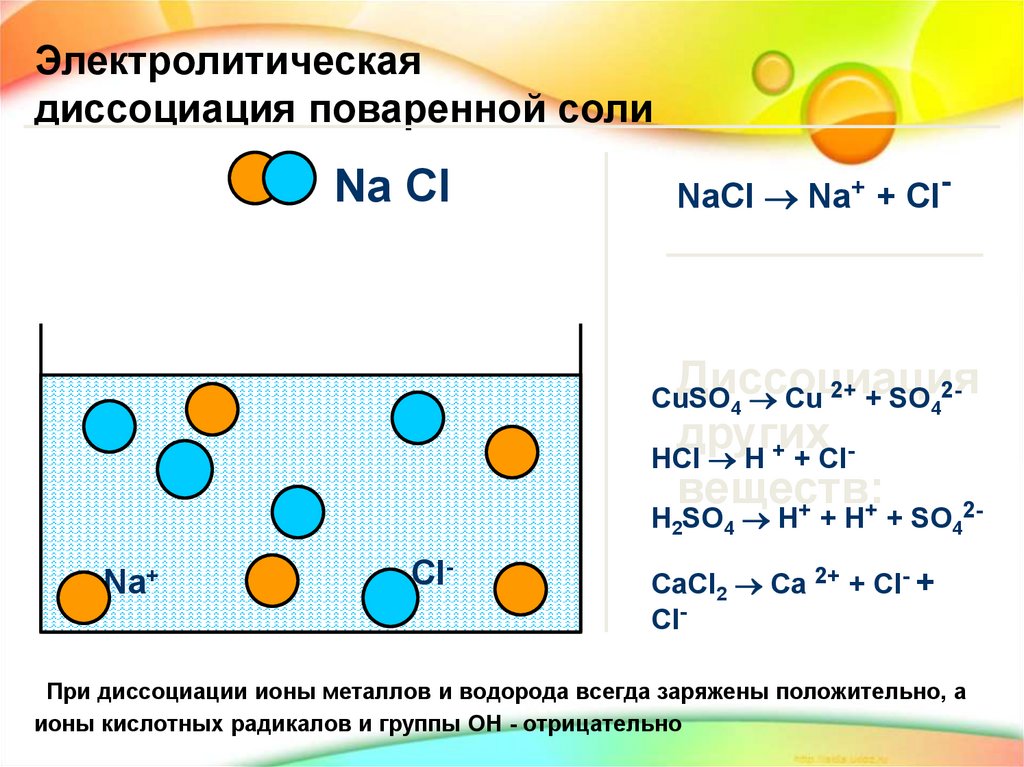
Электролитическаядиссоциация поваренной соли
Na Cl
NaCl Na+ + Cl-
Диссоциация
2+ + SO 2CuSO
Cu
4
4
других
HCl H + + Clвеществ:
+
+
H2SO4 H + H + SO42-
Na+
Cl-
CaCl2 Ca 2+ + Cl- +
Cl-
При диссоциации ионы металлов и водорода всегда заряжены положительно, а
ионы кислотных радикалов и группы ОН - отрицательно
7.
Положительные ионы (катионы)движутся к катоду, отрицательные
ионы (анионы) движутся к аноду
- (катод)
+ (анод)
-
+
+
-
+
-
+
Электролиз – это
процесс
выделения на
электродах
веществ,
связанный с
окислительно –
восстановительн
ыми реакциями.
8.
Электрохимическийряд напряжений
металлов
Полностью восстанавливаются
Совсем не восстанавливаются
9. Окисление анионов
Практически не окисляютсяОкисляются в первую очередь
10.
Исследовал электролиз и открыл его законыанглийский физик Майкл Фарадей в 1834 году
Первый закон электролиза
Масса вещества,
выделившегося на электродах
при электролизе, прямо
пропорциональна величине
заряда, прошедшего через
электролит
k – электрохимический эквивалент вещества
(равен массе вещества, выделившегося при
прохождении через электролит заряда 1 Кл)
Майкл Фарадей (1791 – 1867)
Открыл явление
электромагнитной индукции,
законы электролиза, ввел
представления об
электрическом и магнитном
поле
m kq
m k I t
11.
Второй закон электролизаПри одинаковом количестве электричества (электрическом
заряде, прошедшем через электролит) масса вещества,
выделившегося при электролизе, пропорциональна отношению
молярной массы вещества к валентности
M1 M 2
m1 : m2 k1 : k 2
:
z1 z 2
M – масса выделившегося вещества
k – электрохимический эквивалент
М – молярная масса вещества
z – валентность вещества
Заряд, необходимый для выделения 1 моля вещества,
одинаков для всех электролитов. Он называется
числом Фарадея F
4
F N A e 9.65 10 Кл / моль
Электрохимический
эквивалент и число Фарадея
связаны соотношением
M
k
zF
12. Практическая часть.
13.
Для теоретиковРассчитайте массу серебра которая образуется
при электролизе водного раствора нитрата
серебра с графитовыми электродами на аноде,
если выделился кислород массой 6 г.
14.
Для теоретиковНа заводе был подвергнут
электролизу раствор, содержащий
468 кг хлорида натрия.
Полученные газы были
использованы для синтеза
хлороводорода. Образовавшийся
хлороводород растворили в 708 л
воды. Рассчитайте массовую долю
хлороводорода в полученной
соляной кислоте.
15.
Решение16.
Для теоретиков• Для серебрения ложек ток 1,8А
пропускался через раствор соли серебра
в течении 5ч. Катодом служит 12 ложек,
каждая из которых имеет площадь
поверхности 50 см^2. Какой толщины
слой серебра отложился на ложках?
17.
Решение18.
Гимнастикадля глаз
19. Зрительная гимнастика
Тренажер Базарного В.Ф.20.
21.
22.
23.
24.
25.
26. Будьте здоровы!
27.
Наширезультаты
28.
ПРИМЕНЕНИЕЭЛЕКТРОЛИЗА
Получение химически
чистых веществ
Гальваностегия
Гальванопластика
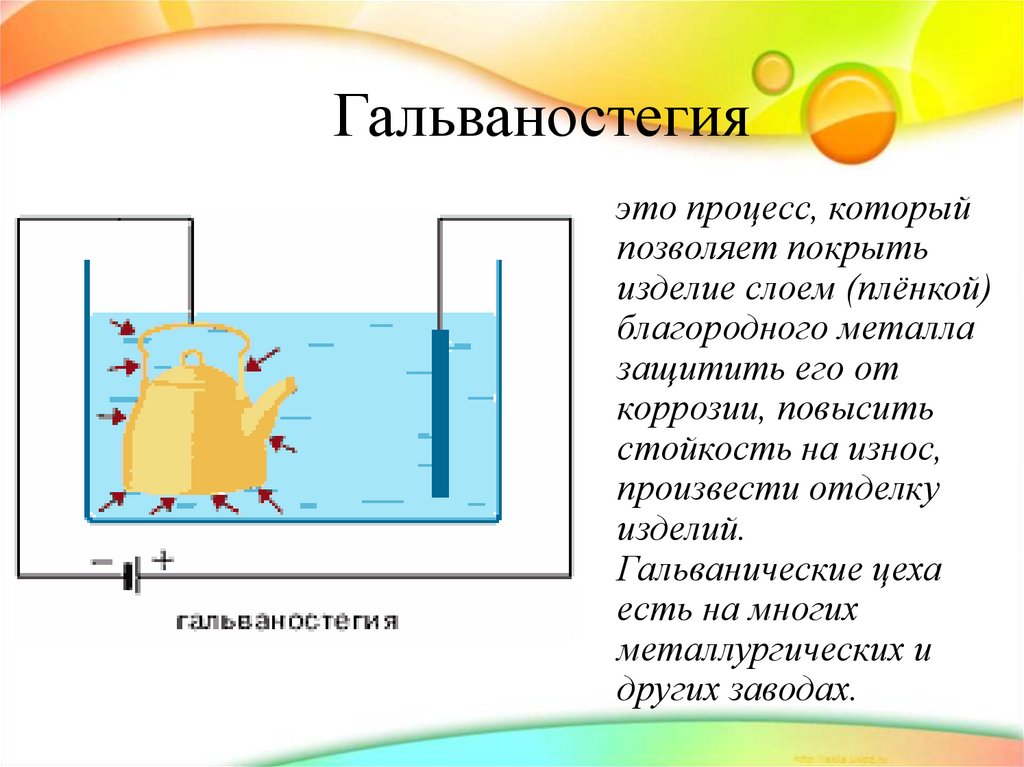
29. Гальваностегия
это процесс, которыйпозволяет покрыть
изделие слоем (плёнкой)
благородного металла
защитить его от
коррозии, повысить
стойкость на износ,
произвести отделку
изделий.
Гальванические цеха
есть на многих
металлургических и
других заводах.
30. Покрытие предметов слоем благородного металла
31.
32.
33. ГАЛЬВАНОПЛАСТИКА
это получение электролитическимспособом более толстых отложений (до
нескольких миллиметров).
Копия барельефа,
полученная методом
гальванопластики
34.
• Изготовление медалей, монет.35.
• Произведения искусства:Барельефы для:
Исаакиевского собора
36.
Петропавловского собора37.
Эрмитажа38.
Зимнего дворца39.
Большого театра40.
• Медные клише для типографии41.
• Пресс-формы из пластмассы, резины,металла
42. Пресс-формы из пластмассы, резины, металла
43.
Получениеалюминия
44.
45.
Домашнее заданиеПриходько Юлия Алексеевна
Учитель математики и физики
МОУ «СОШ №1 с УИОП»
Г. Губкин Белгородской области










































 physics
physics








