Similar presentations:
Вычисление массовой доли растворенного вещества в растворе
1.
Вычисление массовой доли растворенноговещества в растворе. Вычисление количества
вещества, массы или объема по количеству
вещества, массе или объему одного из реагентов
или продуктов реакции.
2.
300 г раствора нитрата бария прибавили избытокраствора сульфата натрия. Масса выпавшего осадка
составила 23,3 г. Определите концентрацию соли в
исходном растворе.
3.
Дано:m (p-p) =300 г
m (BaSO4) = 23,3 г
Найти:
W (р-ра) - ?
4.
Дано:m (p-p) =300 г
m (BaSO4) = 23,3 г
Найти:
W (р-ра) - ?
w = m (в) / m (р-ра)
n = m/M
5.
Дано:m (p-p) =300 г
m (BaSO4) = 23,3 г
Найти:
W (р-ра) - ?
w = m (в) / m (р-ра)
n = m/M
Решение:
6.
Дано:m (p-p) =300 г
m (BaSO4) = 23,3 г
Найти:
W (р-ра) - ?
w = m (в) / m (р-ра)
n = m/M
Решение:
Ba(NO3)2 +Na2SO4= BaSO4 +2NaNO3 (1б)
7.
Дано:m (p-p) =300 г
m (BaSO4) = 23,3 г
Найти:
W (р-ра) - ?
w = m (в) / m (р-ра)
n = m/M
Решение:
Ba(NO3)2 +Na2SO4= BaSO4 +2NaNO3 (1б)
1)М (BaSO4) = 233г/моль
n(BaSO4) = 23,3/233 = 0,1 моль.
8.
Дано:m (p-p) =300 г
m (BaSO4) = 23,3 г
Найти:
W (р-ра) - ?
w = m (в) / m (р-ра)
n = m/M
Решение:
0,1 моль.
Ba(NO3)2 +Na2SO4= BaSO4 +2NaNO3 (1б)
1)М (BaSO4) = 233г/моль
n(BaSO4) = 23,3/233 = 0,1 моль.
9.
Дано:m (p-p) =300 г
m (BaSO4) = 23,3 г
Найти:
W (р-ра) - ?
w = m (в) / m (р-ра)
n = m/M
Решение:
0,1 моль.
Ba(NO3)2 +Na2SO4= BaSO4 +2NaNO3 (1б)
1)М (BaSO4) = 233г/моль
n(BaSO4) = 23,3/233 = 0,1 моль.
По уравнению:
n(BaSO4) = n(Ba(NO3)2) = 0,1 моль
(1б)
10.
Дано:m (p-p) =300 г
m (BaSO4) = 23,3 г
Найти:
W (р-ра) - ?
w = m (в) / m (р-ра)
n = m/M
Решение:
0,1 моль.
Ba(NO3)2 +Na2SO4= BaSO4 +2NaNO3 (1б)
0,1 моль
1)М (BaSO4) = 233г/моль
n(BaSO4) = 23,3/233 = 0,1 моль.
По уравнению:
n(BaSO4) = n(Ba(NO3)2) = 0,1 моль
(1б)
11.
Дано:m (p-p) =300 г
m (BaSO4) = 23,3 г
Найти:
W (р-ра) - ?
w = m (в) / m (р-ра)
n = m/M
Решение:
0,1 моль.
Ba(NO3)2 +Na2SO4= BaSO4 +2NaNO3 (1б)
0,1 моль
1)М (BaSO4) = 233г/моль
n(BaSO4) = 23,3/233 = 0,1 моль.
По уравнению:
n(BaSO4) = n(Ba(NO3)2) = 0,1 моль;
M(Ba(NO3)2)=261 г/моль (1б)
12.
Дано:m (p-p) =300 г
m (BaSO4) = 23,3 г
Найти:
W (р-ра) - ?
w = m (в) / m (р-ра)
n = m/M
Решение:
0,1 моль.
Ba(NO3)2 +Na2SO4= BaSO4 +2NaNO3 (1б)
0,1 моль
1)М (BaSO4) = 233г/моль
n(BaSO4) = 23,3/233 = 0,1 моль.
По уравнению:
n(BaSO4) = n(Ba(NO3)2) = 0,1 моль;
M(Ba(NO3)2)=261 г/моль (1б)
m(Ba(NO3)2) = n(Ba(NO3)2) х M(Ba(NO3)2) = 0,1 х 261 = 26,1 г.
13.
Дано:m (p-p) =300 г
m (BaSO4) = 23,3 г
Найти:
W (р-ра) - ?
w = m (в) / m (р-ра)
n = m/M
Решение:
0,1 моль.
Ba(NO3)2 +Na2SO4= BaSO4 +2NaNO3 (1б)
1)М (BaSO4) = 233г/моль
n(BaSO4) = 23,3/233 = 0,1 моль.
По уравнению:
n(BaSO4) = n(Ba(NO3)2) = 0,1 моль
m(Ba(NO3)2) = n(Ba(NO3)2) х M(Ba(NO3)2) = 0,1 х 261 = 26,1 г.
W(Ba(NO3)2) = m(вещ.) / m р-ра = 26,1 / 300 = 0,087 или 8,7%.
(1б)
14.
Дано:m (p-p) =300 г
m (BaSO4) = 23,3 г
Найти:
W (р-ра) - ?
w = m (в) / m (р-ра)
n = m/M
Решение:
0,1 моль.
Ba(NO3)2 +Na2SO4= BaSO4 +2NaNO3 (1б)
1)М (BaSO4) = 233г/моль
n(BaSO4) = 23,3/233 = 0,1 моль.
По уравнению:
n(BaSO4) = n(Ba(NO3)2) = 0,1 моль
(1б)
m(Ba(NO3)2) = n(Ba(NO3)2) х M(Ba(NO3)2) = 0,1 х 261 = 26,1 г.
W(Ba(NO3)2) = m(вещ.) / m р-ра = 26,1 / 300 = 0,087 или 8,7%.
(1б)
15.
Дано:m (p-p) =300 г
m (BaSO4) = 23,3 г
Найти:
W (р-ра) - ?
w = m (в) / m (р-ра)
n = m/M
Решение:
0,1 моль.
Ba(NO3)2 +Na2SO4= BaSO4 +2NaNO3 (1б)
1)М (BaSO4) = 233г/моль
n(BaSO4) = 23,3/233 = 0,1 моль.
По уравнению:
n(BaSO4) = n(Ba(NO3)2) = 0,1 моль
(1б)
m(Ba(NO3)2) = n(Ba(NO3)2) х M(Ba(NO3)2) = 0,1 х 261 = 26,1 г.
W(Ba(NO3)2) = m(вещ.) / m р-ра = 26,1 / 300 = 0,087 или 8,7%.
Ответ: массовая доля соли составляет 8,7%
(1б)
16.
Критерии оцениванияБаллы
Ответ правильный и полный, включает все названные элементы
3
Правильно записаны два первых элемента из названных выше
2
Правильно записан один из названных выше элементов (1-й или
2-й)
1
Все элементы ответа записаны неверно
0
Максимальный балл
3
17.
2.150 г раствора сульфата натрия прибавили избытокраствора хлорида бария. Масса выпавшего осадка
составила 23,3 г. Определите концентрацию соли в
исходном растворе.
18.
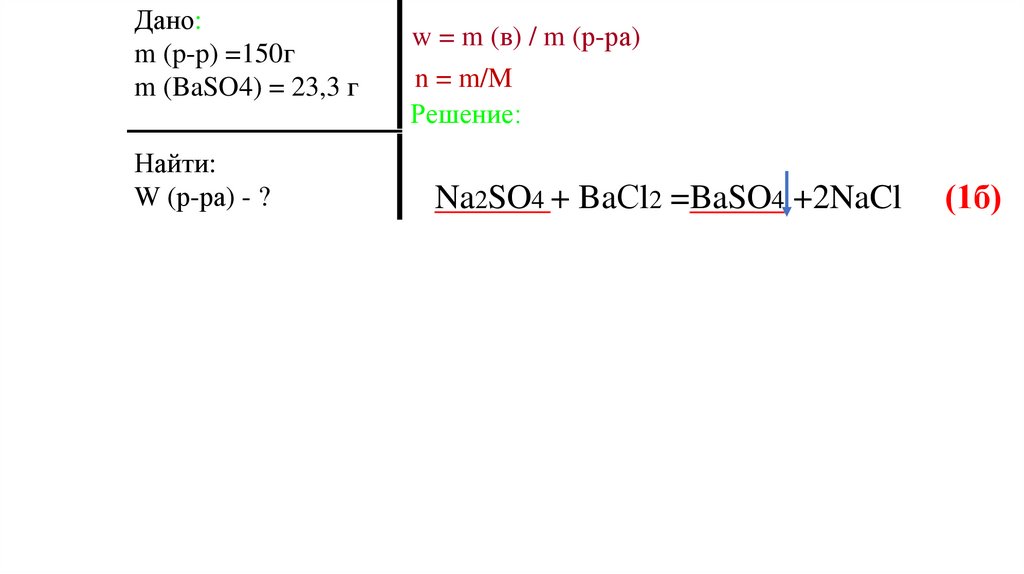
Дано:m (p-p) =150г
m (BaSO4) = 23,3 г
Найти:
W (р-ра) - ?
19.
Дано:m (p-p) =150г
m (BaSO4) = 23,3 г
Найти:
W (р-ра) - ?
w = m (в) / m (р-ра)
n = m/M
20.
Дано:m (p-p) =150г
m (BaSO4) = 23,3 г
Найти:
W (р-ра) - ?
w = m (в) / m (р-ра)
n = m/M
Решение:
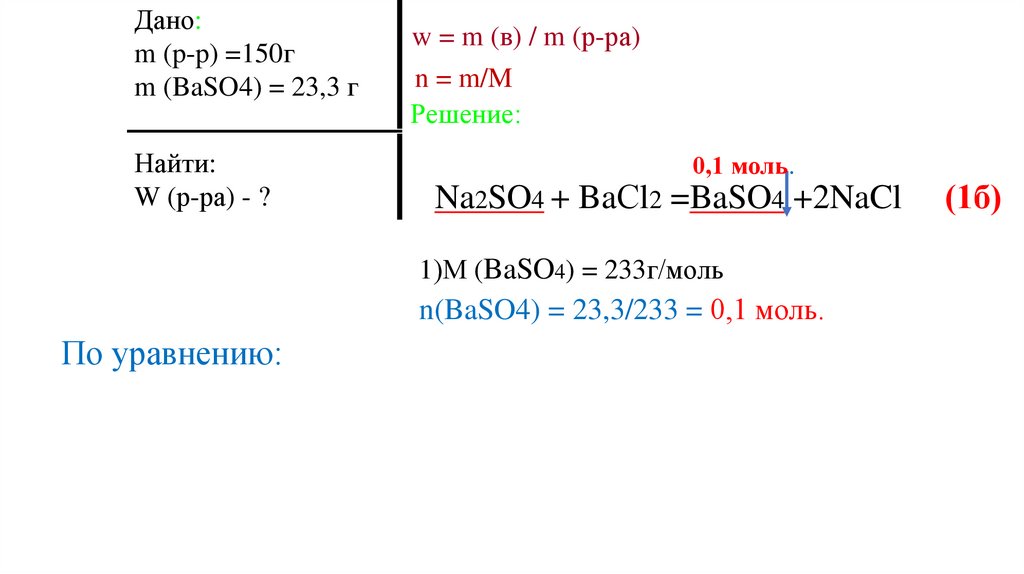
21.
Дано:m (p-p) =150г
m (BaSO4) = 23,3 г
Найти:
W (р-ра) - ?
w = m (в) / m (р-ра)
n = m/M
Решение:
Na2SO4 + BaСl2 =BaSO4 +2NaCl
(1б)
22.
Дано:m (p-p) =150г
m (BaSO4) = 23,3 г
Найти:
W (р-ра) - ?
w = m (в) / m (р-ра)
n = m/M
Решение:
Na2SO4 + BaСl2 =BaSO4 +2NaCl
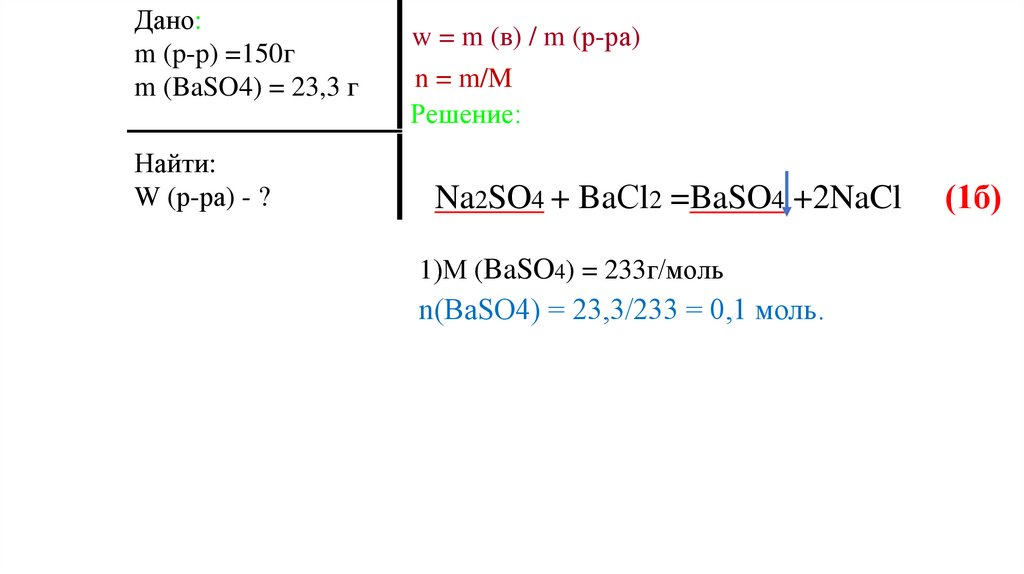
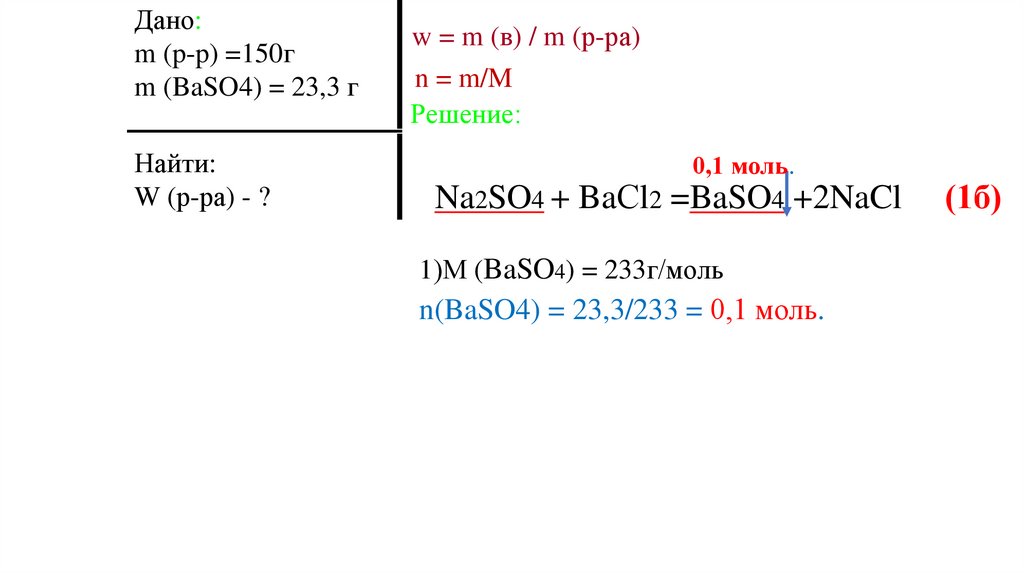
1)М (BaSO4) = 233г/моль
n(BaSO4) = 23,3/233 = 0,1 моль.
(1б)
23.
Дано:m (p-p) =150г
m (BaSO4) = 23,3 г
Найти:
W (р-ра) - ?
w = m (в) / m (р-ра)
n = m/M
Решение:
0,1 моль.
Na2SO4 + BaСl2 =BaSO4 +2NaCl
1)М (BaSO4) = 233г/моль
n(BaSO4) = 23,3/233 = 0,1 моль.
(1б)
24.
Дано:m (p-p) =150г
m (BaSO4) = 23,3 г
Найти:
W (р-ра) - ?
w = m (в) / m (р-ра)
n = m/M
Решение:
0,1 моль.
Na2SO4 + BaСl2 =BaSO4 +2NaCl
1)М (BaSO4) = 233г/моль
n(BaSO4) = 23,3/233 = 0,1 моль.
По уравнению:
(1б)
25.
Дано:m (p-p) =150г
m (BaSO4) = 23,3 г
Найти:
W (р-ра) - ?
w = m (в) / m (р-ра)
n = m/M
Решение:
0,1 моль.
Na2SO4 + BaСl2 =BaSO4 +2NaCl
(1б)
1)М (BaSO4) = 233г/моль
n(BaSO4) = 23,3/233 = 0,1 моль.
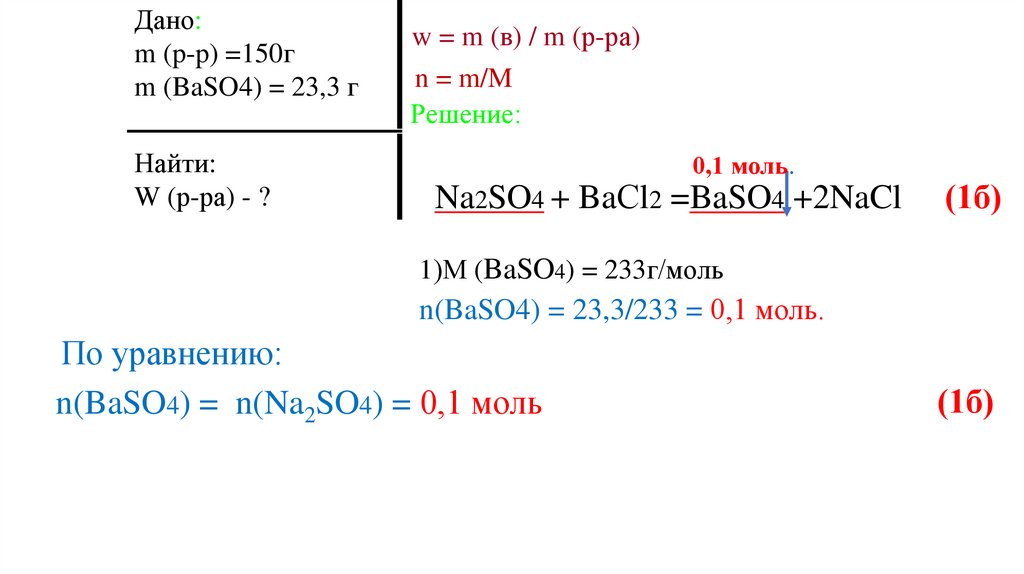
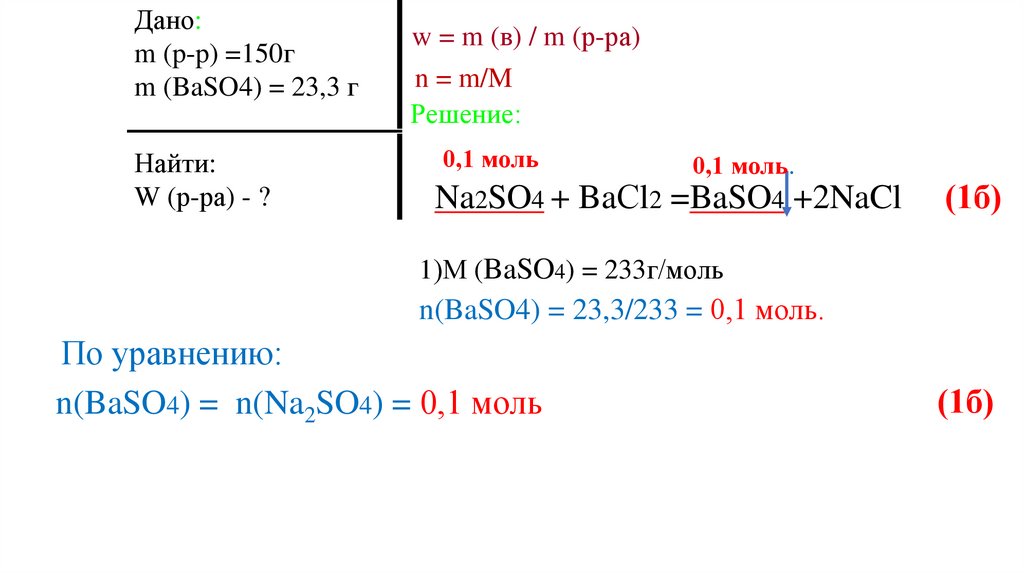
По уравнению:
n(BaSO4) = n(Na2SO4) = 0,1 моль
(1б)
26.
Дано:m (p-p) =150г
m (BaSO4) = 23,3 г
Найти:
W (р-ра) - ?
w = m (в) / m (р-ра)
n = m/M
Решение:
0,1 моль
0,1 моль.
Na2SO4 + BaСl2 =BaSO4 +2NaCl
(1б)
1)М (BaSO4) = 233г/моль
n(BaSO4) = 23,3/233 = 0,1 моль.
По уравнению:
n(BaSO4) = n(Na2SO4) = 0,1 моль
(1б)
27.
Дано:m (p-p) =150г
m (BaSO4) = 23,3 г
Найти:
W (р-ра) - ?
w = m (в) / m (р-ра)
n = m/M
Решение:
0,1 моль
Na2SO4 + BaСl2 =BaSO4 +2NaCl
(1б)
1)М (BaSO4) = 233г/моль
n(BaSO4) = 23,3/233 = 0,1 моль.
По уравнению:
n(BaSO4) = n(Na2SO4) = 0,1 моль
M(Na2SO4)=142 г/моль
(1б)
28.
Дано:m (p-p) =150г
m (BaSO4) = 23,3 г
Найти:
W (р-ра) - ?
w = m (в) / m (р-ра)
n = m/M
Решение:
0,1 моль
Na2SO4 + BaСl2 =BaSO4 +2NaCl
(1б)
1)М (BaSO4) = 233г/моль
n(BaSO4) = 23,3/233 = 0,1 моль.
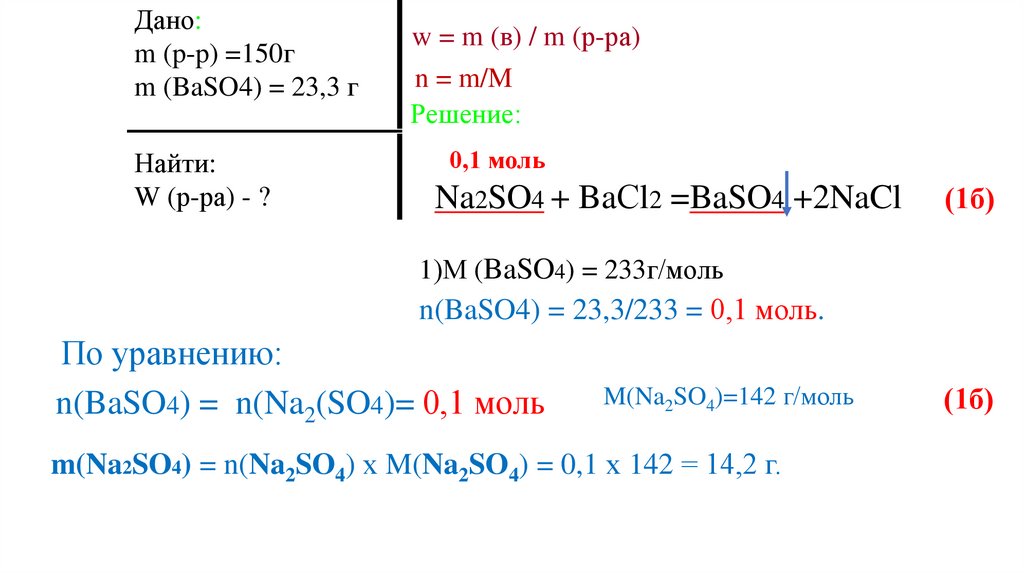
По уравнению:
n(BaSO4) = n(Na2(SO4)= 0,1 моль
M(Na2SO4)=142 г/моль
m(Na2SO4) = n(Na2SO4) х M(Na2SO4) = 0,1 х 142 = 14,2 г.
(1б)
29.
Дано:m (p-p) =150г
m (BaSO4) = 23,3 г
Найти:
W (р-ра) - ?
w = m (в) / m (р-ра)
n = m/M
Решение:
Na2SO4 + BaСl2 =BaSO4 +2NaCl
(1б)
1)М (BaSO4) = 233г/моль
n(BaSO4) = 23,3/233 = 0,1 моль.
По уравнению:
n(BaSO4) = n(Na2SO4) = 0,1 моль
M(Na2SO4)=142 г/моль
(1б)
m(Na2SO4) = n(Na2SO4) х M(Na2SO4) = 0,1 х 142 = 14,2 г.
W(Na2SO4) = m(вещ.) / m р-ра = 14,2 / 150 = 0,0946 или 9,5%.
(1б)
30.
Критерии оцениванияБаллы
Ответ правильный и полный, включает все названные элементы
3
Правильно записаны два первых элемента из названных выше
2
Правильно записан один из названных выше элементов (1-й или
2-й)
1
Все элементы ответа записаны неверно
0
Максимальный балл
3
31.
1. Рассчитайте массу осадка,который выпадет при сливании
500 г 2%-ного раствора иодида
калия с избытком раствора
нитрата свинца
32.
Дано:m (p-p) =500 г
w (KI) = 2% или 0,02
Найти:
m (PbI₂) - ?
33.
Дано:m (p-p) =500 г
w (KI) = 2% или 0,02
Найти:
m (PbI₂) - ?
m (в-во) = m (p-p) ∙ w (в долях)
n = m/M
Решение:
34.
Дано:m (p-p) =500 г
w (KI) = 2% или 0,02
Найти:
m (PbI₂) - ?
m (в-во) = m (p-p) ∙ w (в долях)
n = m/M
Решение:
2KI + Pb(NO₃)₂ = 2 KNO₃ + PbI₂↓
(1б)
35.
Дано:m (p-p) =500 г
w (KI) = 2% или 0,02
Найти:
m (PbI₂) - ?
m (в-во) = m (p-p) ∙ w (в долях)
n = m/M
Решение:
2KI + Pb(NO₃)₂ = 2 KNO₃ + PbI₂↓
1)m (KI) = 500 г ∙ 0,02 = 10 г
Mr (KI) = 166;M (KI) = 166 г/моль n (KI) = 10 г/ 166г/моль = 0,06 моль
(1б)
36.
Дано:m (p-p) =500 г
w (KI) = 2% или 0,02
Найти:
m (PbI₂) - ?
m (в-во) = m (p-p) ∙ w (в долях)
n = m/M
Решение:
0,06 моль
2KI + Pb(NO₃)₂ = 2 KNO₃ + PbI₂↓
1)m (KI) = 500 г ∙ 0,02 = 10 г
Mr (KI) = 166;M (KI) = 166 г/моль n (KI) = 10 г/ 166г/моль = 0,06 моль
(1б)
37.
Дано:m (p-p) =500 г
w (KI) = 2% или 0,02
Найти:
m (PbI₂) - ?
m (в-во) = m (p-p) ∙ w (в долях)
n = m/M
Решение:
0,06 моль
2KI + Pb(NO₃)₂ = 2 KNO₃ + PbI₂↓
(1б)
1)m (KI) = 500 г ∙ 0,02 = 10 г
Mr (KI) = 166;M (KI) = 166 г/моль n (KI) = 10 г/ 166г/моль = 0,06 моль
По уравнению реакции:
n (PbI₂) = n (KI)/2= 0,03 моль
(1б)
38.
Дано:m (p-p) =500 г
w (KI) = 2% или 0,02
Найти:
m (PbI₂) - ?
m (в-во) = m (p-p) ∙ w (в долях)
n = m/M
Решение:
0,06 моль
2KI + Pb(NO₃)₂ = 2 KNO₃ + PbI₂↓
(1б)
1)m (KI) = 500 г ∙ 0,02 = 10 г
Mr (KI) = 166;M (KI) = 166 г/моль n (KI) = 10 г/ 166г/моль = 0,06 моль
По уравнению реакции:
n (PbI₂) = n (KI)/2= 0,03 моль
Mr (PbI₂) = 461; M (PbI₂) = 461 г/моль
(1б)
39.
Дано:m (p-p) =500 г
w (KI) = 2% или 0,02
Найти:
m (PbI₂) - ?
m (в-во) = m (p-p) ∙ w (в долях)
n = m/M
Решение:
0,06 моль
2KI + Pb(NO₃)₂ = 2 KNO₃ + PbI₂↓
(1б)
1)m (KI) = 500 г ∙ 0,02 = 10 г
Mr (KI) = 166;M (KI) = 166 г/моль n (KI) = 10 г/ 166г/моль = 0,06 моль
По уравнению реакции:
n (PbI₂) = n (KI)/2= 0,03 моль
(1б)
Mr (PbI₂) = 461; M (PbI₂) = 461 г/моль
m (PbI₂) = M (PbI₂) ∙ n (PbI₂) = 461 г/моль ∙ 0,03 моль = 13,83 г
(1б)
40.
Дано:m (p-p) =500 г
w (KI) = 2% или 0,02
Найти:
m (PbI₂) - ?
m (в-во) = m (p-p) ∙ w (в долях)
n = m/M
Решение:
0,06 моль
2KI + Pb(NO₃)₂ = 2 KNO₃ + PbI₂↓
(1б)
1)m (KI) = 500 г ∙ 0,02 = 10 г
Mr (KI) = 166;M (KI) = 166 г/моль n (KI) = 10 г/ 166г/моль = 0,06 моль
По уравнению реакции:
n (PbI₂) = n (KI)/2= 0,03 моль
(1б)
Mr (PbI₂) = 461; M (PbI₂) = 461 г/моль
m (PbI₂) = M (PbI₂) ∙ n (PbI₂) = 461 г/моль ∙ 0,03 моль = 13,83 г
Ответ: масса образовавшегося осадка (PbI₂) составляет 13,83 г
(1б)
41.
Задачи для самостоятельного решения42.
3. 300 г раствора силиката натрия прибавили избытокраствора нитрата кальция. Масса выпавшего осадка
составила 12,0 г. Определите концентрацию соли в
исходном растворе.
43.
4. К 150 г раствора карбоната калия прибавилиизбыток раствора соляной кислоты. При этом
выделился газ объемом 3,36 л (н. у.). Определите
концентрацию соли в исходном растворе.
44.
5. К 250 г раствора гидрокарбоната натрия прибавилиизбыток раствора бромоводородной кислоты. При
этом выделился газ объемом 5,6 л. Определите
концентрацию соли в исходном растворе.


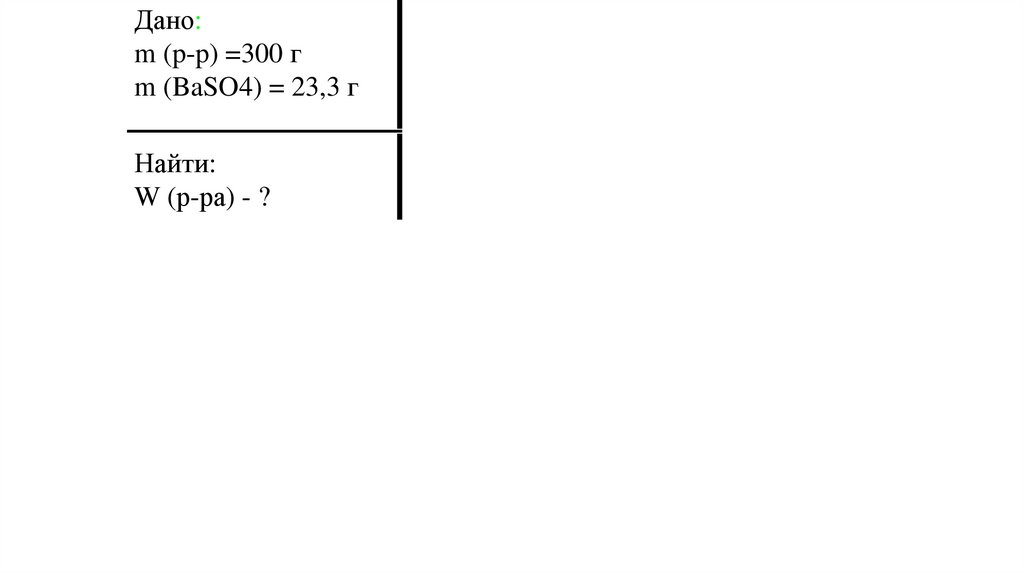


































 chemistry
chemistry








