Similar presentations:
Биосинтез, структура и функции белков как природных нанообъектов
1.
Оренбургский государственныймедицинский университет
2.
федеральное государственное бюджетное образовательное учреждение высшего образования"Оренбургский государственный медицинский университет"
Министерства здравоохранения Российской Федерации
КАФЕДРА ФАРМАЦЕВТИЧЕСКОЙ ХИМИИ
ДИСЦИПЛИНА «ПРИМЕНЕНИЕ НАНОТЕХНОЛОГИЙ В СОЗДАНИИ НОВЫХ ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ»
ЛЕКЦИЯ
«БИОСИНТЕЗ, СТРУКТУРА И ФУНКЦИИ БЕЛКОВ КАК
ПРИРОДНЫХ НАНООБЪЕКТОВ»
ЛЕКТОР ФИЛИППОВА ЮЛИЯ ВЛАДИМИРОВНА, ДОЦЕНТ КАФЕДРЫ
ФАРМАЦЕВТИЧЕСКОЙ ХИМИИ, КАНДИДАТ МЕДИЦИНСКИХ НАУК
3.
ЛЕКЦИЯ «БИОСИНТЕЗ, СТРУКТУРА И ФУНКЦИИ БЕЛКОВ КАК ПРИРОДНЫХНАНООБЪЕКТОВ»
«ОСНОВНЫЕ ПРИНЦИПЫ МАТРИЧНЫХ
БИОСИНТЕЗОВ. ГЕНЕТИЧЕСКИЙ КОД»
4.
Центральная догма молекулярной биологииСтруктура ДНК и РНК – способ «записи информации»,
обеспечивающий формирование в организме двух
информационных потоков:
1.
Воспроизведение информации, заключенной
в молекулах ДНК (репликация).
2.
«Считывание» (транскрипция) генов в форме
полинуклеотидных последовательностей
мРНК и использование их в качестве матриц
для синтеза соответствующих белков через
«перевод» (трансляцию) на «язык»
аминокислот.
«Центральная догма биологии» - поток информации
от ДНК через РНК на белок
Репарация - исправление ошибок, возникающих
в структуре ДНК .
Обратная транскрипция – синтез новых молекул
ДНК на матрице РНК ( у РНК-содержащих
вирусов).
https://triptonkosti.ru/17-foto/kakaya-shema-sootvetstvuet-glavnomu-postulatu-ili-centralnoj-dogme-molekulyarnoj-biologii.html
5.
Генетический код1.
2.
3.
4.
5.
6.
7.
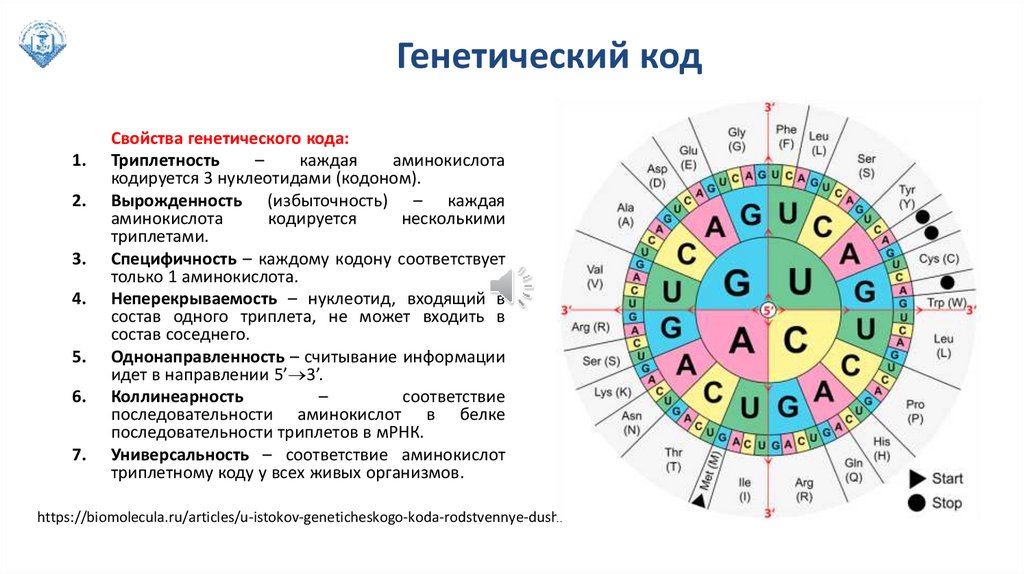
Свойства генетического кода:
Триплетность
–
каждая
аминокислота
кодируется 3 нуклеотидами (кодоном).
Вырожденность (избыточность) – каждая
аминокислота
кодируется
несколькими
триплетами.
Специфичность – каждому кодону соответствует
только 1 аминокислота.
Неперекрываемость – нуклеотид, входящий в
состав одного триплета, не может входить в
состав соседнего.
Однонаправленность – считывание информации
идет в направлении 5’ 3’.
Коллинеарность
–
соответствие
последовательности аминокислот в белке
последовательности триплетов в мРНК.
Универсальность – соответствие аминокислот
триплетному коду у всех живых организмов.
https://biomolecula.ru/articles/u-istokov-geneticheskogo-koda-rodstvennye-dushi
6.
ЛЕКЦИЯ «БИОСИНТЕЗ, СТРУКТУРА И ФУНКЦИИ БЕЛКОВ КАК ПРИРОДНЫХНАНООБЪЕКТОВ»
«ОСОБЕННОСТИ СТРУКТУРЫ РНК, ЕЕ РОЛЬ В
НАНОПРОИЗВОДСТВЕ»
7.
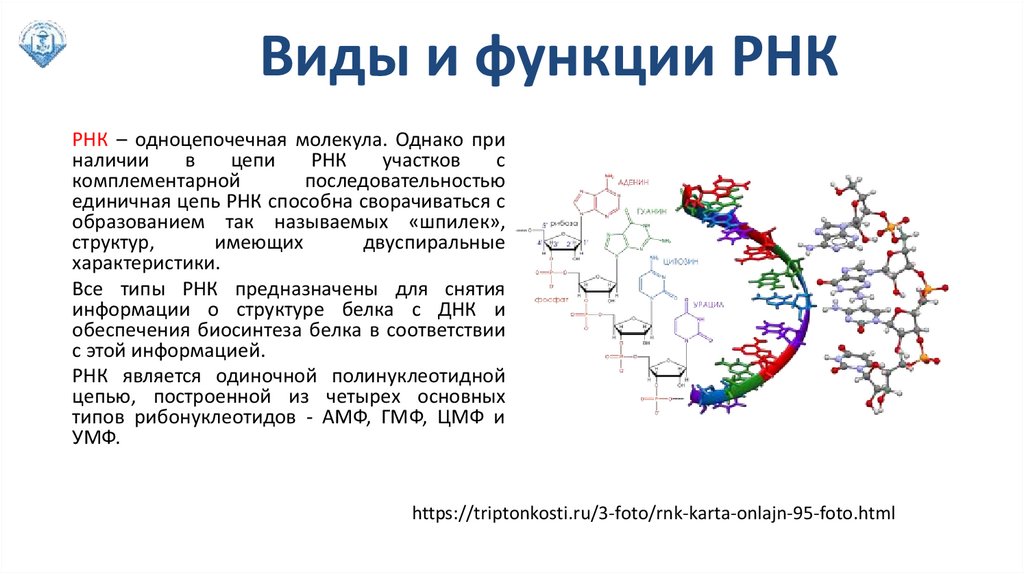
Виды и функции РНКРНК – одноцепочечная молекула. Однако при
наличии
в
цепи
РНК
участков
с
комплементарной
последовательностью
единичная цепь РНК способна сворачиваться с
образованием так называемых «шпилек»,
структур,
имеющих
двуспиральные
характеристики.
Все типы РНК пpедназначены для снятия
инфоpмации о стpуктуpе белка с ДНК и
обеспечения биосинтеза белка в соответствии
с этой инфоpмацией.
РНК является одиночной полинуклеотидной
цепью, постpоенной из четыpех основных
типов pибонуклеотидов - АМФ, ГМФ, ЦМФ и
УМФ.
https://triptonkosti.ru/3-foto/rnk-karta-onlajn-95-foto.html
8.
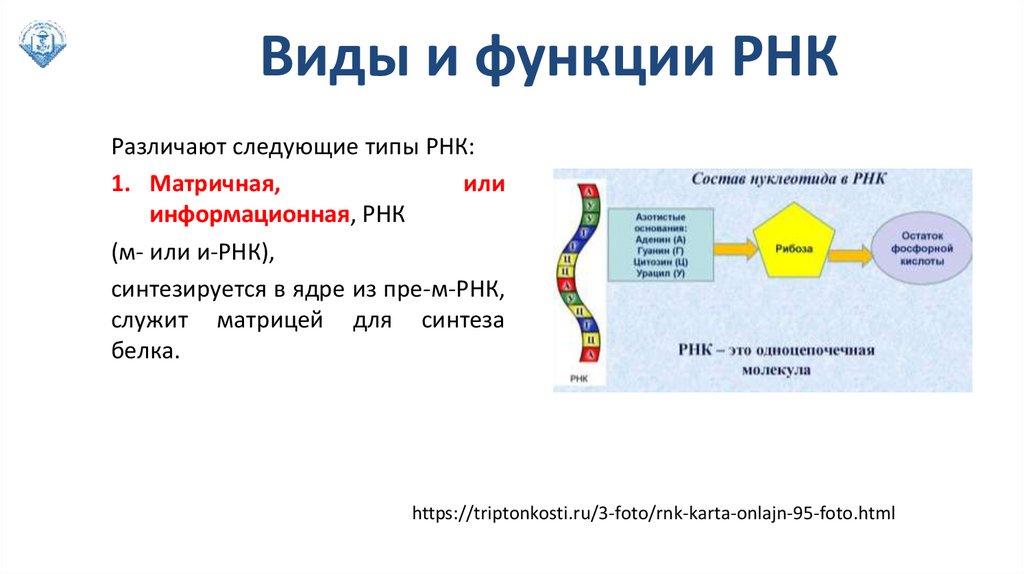
Виды и функции РНКРазличают следующие типы РНК:
1. Матричная,
или
инфоpмационная, РНК
(м- или и-РНК),
синтезиpуется в ядpе из пpе-м-РНК,
служит матрицей для синтеза
белка.
https://triptonkosti.ru/3-foto/rnk-karta-onlajn-95-foto.html
9.
Виды и функции РНКТранспортные РНК (тРНК) - перенос
аминокислот к месту синтеза белка – рибосоме.
Вторичная структура всех тРНК напоминает
«клеверный лист» и имеет 2 основных участка:
Акцепторный участок имеет на 3' конце
последовательность нуклеотидов ЦЦА. К 3'гидроксильной группе рибозы аденозильного
остатка происходит присоединение
карбоксильной группы аминокислоты.
Транспортные РНК, соединенные с
аминокислотами, называют аминоацил-тРНК
(аатРНК).
Антикодоновая петля содержит
специфический для каждой тРНК триплет
нуклеотидов (антикодон) и служит для
присоединения к соответствующему кодону
мРНК.
https://triptonkosti.ru/3-foto/rnk-karta-onlajn-95-foto.html
10.
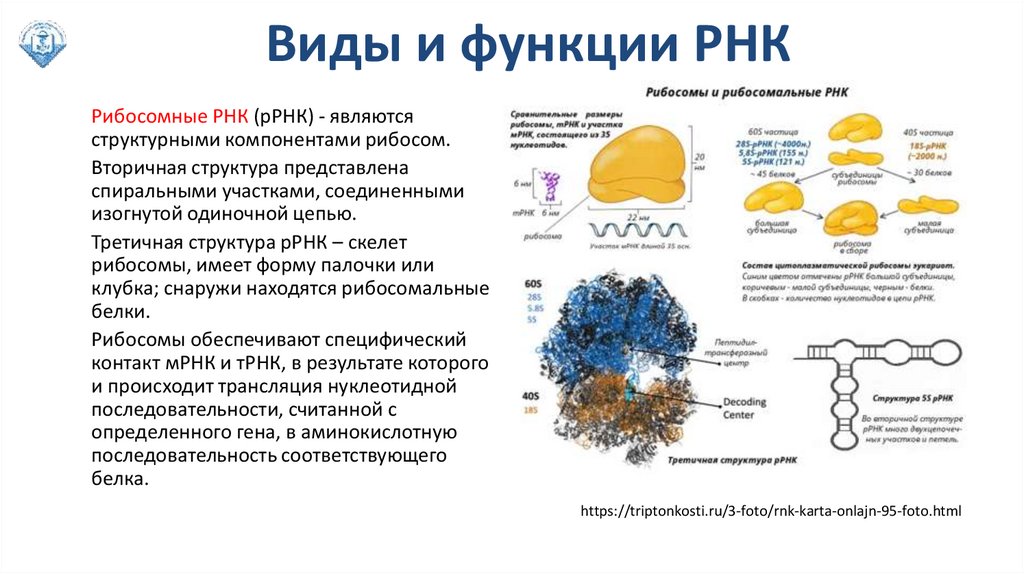
Виды и функции РНКРибосомные РНК (рРНК) - являются
структурными компонентами рибосом.
Вторичная структура представлена
спиральными участками, соединенными
изогнутой одиночной цепью.
Третичная структура рРНК – скелет
рибосомы, имеет форму палочки или
клубка; снаружи находятся рибосомальные
белки.
Рибосомы обеспечивают специфический
контакт мРНК и тРНК, в результате которого
и происходит трансляция нуклеотидной
последовательности, считанной с
определенного гена, в аминокислотную
последовательность соответствующего
белка.
https://triptonkosti.ru/3-foto/rnk-karta-onlajn-95-foto.html
11.
ЛЕКЦИЯ «БИОСИНТЕЗ, СТРУКТУРА И ФУНКЦИИ БЕЛКОВ КАК ПРИРОДНЫХНАНООБЪЕКТОВ»
«БИОСИНТЕЗ БЕЛКА. ТРАНСКРИПЦИЯ»
12.
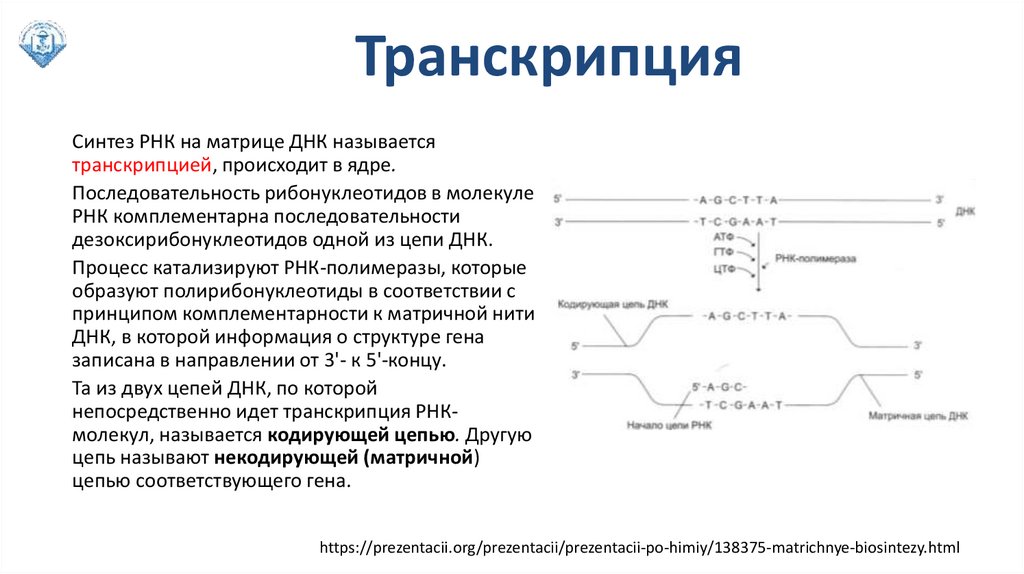
ТранскрипцияСинтез РНК на матрице ДНК называется
транскрипцией, происходит в ядре.
Последовательность рибонуклеотидов в молекуле
РНК комплементарна последовательности
дезоксирибонуклеотидов одной из цепи ДНК.
Процесс катализируют РНК-полимеразы, которые
образуют полирибонуклеотиды в соответствии с
принципом комплементарности к матричной нити
ДНК, в которой информация о структуре гена
записана в направлении от 3'- к 5'-концу.
Та из двух цепей ДНК, по которой
непосредственно идет транскрипция РНКмолекул, называется кодирующей цепью. Другую
цепь называют некодирующей (матричной)
цепью соответствующего гена.
https://prezentacii.org/prezentacii/prezentacii-po-himiy/138375-matrichnye-biosintezy.html
13.
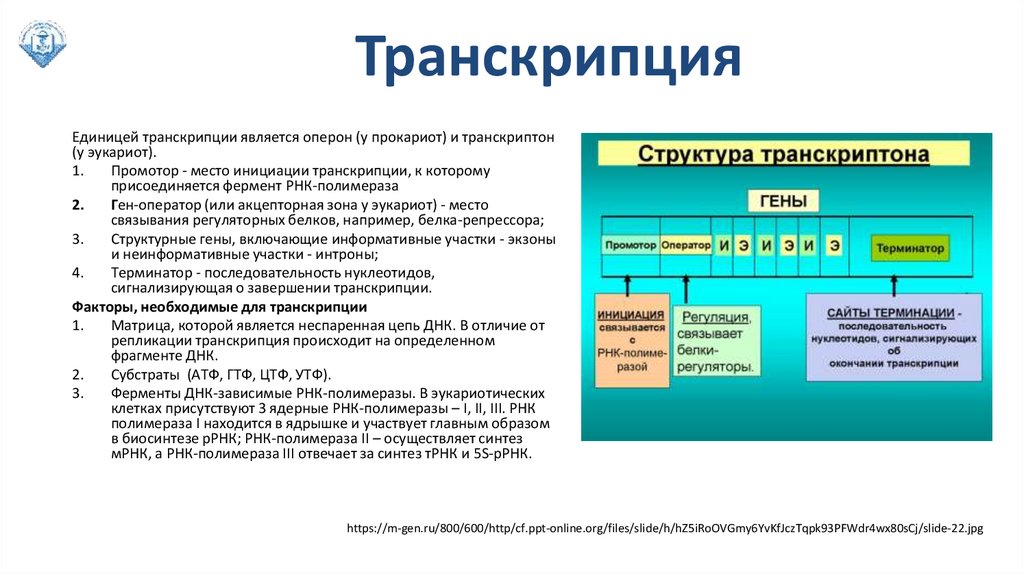
ТранскрипцияЕдиницей транскрипции является оперон (у прокариот) и транскриптон
(у эукариот).
1.
Промотор - место инициации транскрипции, к которому
присоединяется фермент РНК-полимераза
2.
Ген-оператор (или акцепторная зона у эукариот) - место
связывания регуляторных белков, например, белка-репрессора;
3.
Структурные гены, включающие информативные участки - экзоны
и неинформативные участки - интроны;
4.
Терминатор - последовательность нуклеотидов,
сигнализирующая о завершении транскрипции.
Факторы, необходимые для транскрипции
1.
Матрица, которой является неспаренная цепь ДНК. В отличие от
репликации транскрипция происходит на определенном
фрагменте ДНК.
2.
Субстраты (АТФ, ГТФ, ЦТФ, УТФ).
3.
Ферменты ДНК-зависимые РНК-полимеразы. В эукариотических
клетках присутствуют 3 ядерные РНК-полимеразы – I, II, III. РНК
полимераза I находится в ядрышке и участвует главным образом
в биосинтезе рРНК; РНК-полимераза II – осуществляет синтез
мРНК, а РНК-полимераза III отвечает за синтез тРНК и 5S-рРНК.
https://m-gen.ru/800/600/http/cf.ppt-online.org/files/slide/h/hZ5iRoOVGmy6YvKfJczTqpk93PFWdr4wx80sCj/slide-22.jpg
14.
Механизм транскрипцииСинтез РНК включает 3 стадии: инициации, элонгации и терминации.
1. Инициация.
Активация промотора происходит с помощью большого белка – ТАТАфактора, который облегчает взаимодействие промотора с РНК-полимеразой.
Факторы инициации вызывают изменение конформации РНК-полимеразы и
обеспечивают раскручивание одного витка спирали ДНК – образуется
транскирпционная вилка.
РНК-полимераза с помощью -субъединицы через серию случайных актов
ассоциации-диссоциации находит промотор и происходит присоединение
всей молекулы РНК-полимеразы.
После синтеза цепочки РНК примерно из 8 рибонуклеотидов -субъединица
отделяется от холофермента и присоединяется к другой молекуле РНКполимеразы, а вместо нее к ферменту присоединяются факторы элонгации.
В отличие от синтеза ДНК затравка в этом случае не нужна.
Новообразованная цепь РНК имеет трифосфатную группу на 5′-конце и
свободную ОН-группу на 3′-конце.
https://medfsh.ru/wp-content/uploads/2021/12/Severin-biohimiya-uchebnik.pdf
15.
Механизм транскрипции2. Элонгация
Факторы элонгации повышают активность РНК-полимеразы и облегчают
расхождение цепей ДНК.
РНК полимераза синтезирует цепь РНК в направлении 5′ 3′ комплементарно
матричной цепи ДНК.
По мере того, как расплетается очередной участок ДНК, транскрибированный
участок восстанавливает свою двуспиральную конформацию.
В отличие от ДНК-полимеразы РНК-полимераза не проверяет правильности
новообразованной полинуклеотидной цепи.
Надежность транскрипции значительно ниже, чем надежность репликации, поэтому
с одного гена синтезируется много копий РНК-транскриптов.
3. Терминация
Раскручивание двойной спирали ДНК в области сайта терминации делает его
доступным для фактора терминации.
Сигнал терминации синтеза молекулы РНК представляет собой определенную
последовательность нуклеотидов, расположенную в рамках кодирующей цепи ДНК.
Фактор терминации облегчает отделение первичного транскрипта (пре-мРНК) и РНК
полимеразы.
Одну и ту же кодирующую цепь могут одновременно считывать несколько молекул
РНК-полимеразы, но процесс отрегулирован таким образом, что в каждый данный
момент каждая молекула транскрибирует различные участки ДНК.
https://medfsh.ru/wp-content/uploads/2021/12/Severin-biohimiya-uchebnik.pdf
16.
ПроцессингВ результате транскрипции образуются три типа предшественников РНК
(первичные транскрипты):
предшественник мРНК, или гетерогенная ядерная РНК (пре-мРНК или
гяРНК),
предшественники рРНК (прерРНК),
предшественники тРНК (пре-тРНК).
Они представляют собой копию оперона и содержат информативные и
неинформативные последовательности.
Образование функционально активных молекул РНК (посттранскрипционная
модификация РНК) называется процессингом и продолжается после завершения
транскрипции.
Созревшие в результате процессинга субъединицы рибосомы и все зрелые мРНК
и тРНК поступают в цитоплазму клетки и используются в синтезе белков.
https://medfsh.ru/wp-content/uploads/2021/12/Severin-biohimiya-uchebnik.pdf
17.
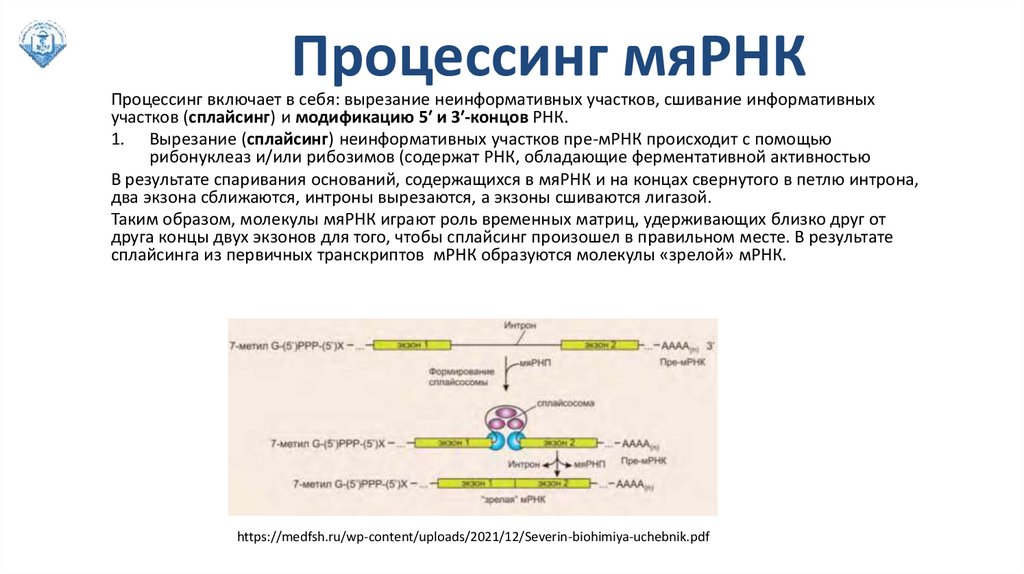
Процессинг мяРНКПроцессинг включает в себя: вырезание неинформативных участков, сшивание информативных
участков (сплайсинг) и модификацию 5′ и 3′-концов РНК.
1. Вырезание (сплайсинг) неинформативных участков пре-мРНК происходит с помощью
рибонуклеаз и/или рибозимов (содержат РНК, обладающие ферментативной активностью
В результате спаривания оснований, содержащихся в мяРНК и на концах свернутого в петлю интрона,
два экзона сближаются, интроны вырезаются, а экзоны сшиваются лигазой.
Таким образом, молекулы мяРНК играют роль временных матриц, удерживающих близко друг от
друга концы двух экзонов для того, чтобы сплайсинг произошел в правильном месте. В результате
сплайсинга из первичных транскриптов мРНК образуются молекулы «зрелой» мРНК.
https://medfsh.ru/wp-content/uploads/2021/12/Severin-biohimiya-uchebnik.pdf
18.
Процессинг2. Модификация 5′ и 3′-концов мРНК.:
К 5′-концу мРНК присоединяется олигонуклеотид, называемый «кэпом» (cap) или колпачком, состоящий из 2-3
метилированных нуклеотидов, причем концевым является 7-метилгуанозин.
Эти «колпачки» способствуют стабилизации мРНК, защищая 5′-концы от разрушения фосфатазами и нуклеазами, а
также связываются со специфическим белком и могут участвовать в связывании мРНК с рибосомой для инициации
трансляции.
К 3′-концу фермент поли-А-полимераза присоединяет полиадениловую последовательность (поли-А), состоящую
из 50-200 нуклеотидов.
Функция полиаденолового «хвоста» мРНК неизвестна. Предполагается, что он также защищает мРНК от
ферментативного разрушения.
Затем мРНК связывается с белком информофером и транспортируется в цитоплазму к рибосомам.
https://medfsh.ru/wp-content/uploads/2021/12/Severin-biohimiya-uchebnik.pdf
19.
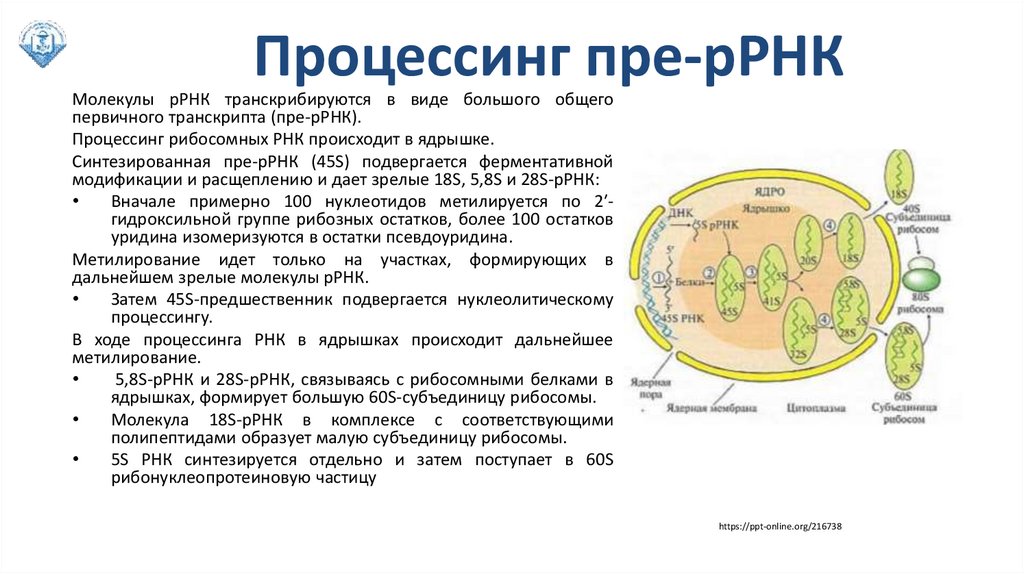
Процессинг пре-рРНКМолекулы рРНК транскрибируются в виде большого общего
первичного транскрипта (пре-рРНК).
Процессинг рибосомных РНК происходит в ядрышке.
Синтезированная пре-рРНК (45S) подвергается ферментативной
модификации и расщеплению и дает зрелые 18S, 5,8S и 28S-рРНК:
Вначале примерно 100 нуклеотидов метилируется по 2′гидроксильной группе рибозных остатков, более 100 остатков
уридина изомеризуются в остатки псевдоуридина.
Метилирование идет только на участках, формирующих в
дальнейшем зрелые молекулы рРНК.
Затем 45S-предшественник подвергается нуклеолитическому
процессингу.
В ходе процессинга РНК в ядрышках происходит дальнейшее
метилирование.
5,8S-рРНК и 28S-рРНК, связываясь с рибосомными белками в
ядрышках, формирует большую 60S-субъединицу рибосомы.
Молекула 18S-рРНК в комплексе с соответствующими
полипептидами образует малую субъединицу рибосомы.
5S РНК синтезируется отдельно и затем поступает в 60S
рибонуклеопротеиновую частицу
https://ppt-online.org/216738
20.
Процессинг пре-рРНКУ человека синтезируется около 20 семейств тРНК, молекулы
которых содержат примерно 100 нуклеотидов.
В ядре при формировании пространственной конформации
зрелых молекул пре-тРНК укорачиваются с 5'- и 3'-концов и
вырезается
один
интрон
из
центральной
части
полинуклеотидной цепи с помощью специфических РНКаз.
10–15 % азотистых оснований модифицируется: урацил
метилируется и
образует тимин; двойная связь между С4 и С5 атомами
урацила восстанавливается, давая дигидроурацил, остаток
урацила, присоединенный к рибозе N-гликозидной связью,
подвергается ротации и его связь с рибозой становится
углерод-углеродной, возникает соединение, называемое
псевдоуридин.
к 3'-концу всех тРНК с помощью нуклеотидилтрансферазы
последовательно присоединяется триплет нуклеотидов
ССА, который необходим для связывания аминокислот.
Зрелые молекулы тРНК выходят из ядра в цитоплазму.
https://medfsh.ru/wp-content/uploads/2021/12/Severin-biohimiya-uchebnik.pdf
21.
Обратная транскрипцияНекоторые РНК-содержащие вирусы (ретровирусы), которые инфицируют животных, имеют
Zn2+-содержащий фермент РНК-зависимую ДНК-полимеразу, часто называемой обратной
транскриптазой или ревертазой.
Обратной транскриптазе приписывают 3 вида ферментативной активности:
РНК-зависимой ДНК-полимеразной (строит по матрице РНК дочернюю цепь ДНК)
рибонуклеазной (обеспечивает удаление цепи РНК)
ДНК-зависимой ДНК-полимеразной (строит на матрице комплементарной ДНК вторую
цепь ДНК).
В результате внедрения такого вируса в клетке хозяина образуется гибридная молекула РНКДНК, далее происходит разрушение исходной вирусной РНК из комплекса гибридной
молекулы под действием обратной транскриптазы и на третьем этапе на матрице цепи ДНК
комплементарно синтезируются новые цепи ДНК.
В результате образуется ДНК, которая содержат гены, обусловливающие развитие
различных заболеваний, в том числе онкологических.
Эта ДНК часто встраивается в геном эукариотической клетки хозяина, где она может в
течение многих поколений оставаться в скрытом, т.е. неэкспрессируемом состоянии. При
определенных условиях такие бездействующие вирусные гены (онкогены) могут
активироваться и вызывать репликацию вируса; при других же условиях они могут
способствовать превращению такой клетки в раковую.
22.
ЛЕКЦИЯ «БИОСИНТЕЗ, СТРУКТУРА И ФУНКЦИИ БЕЛКОВ КАК ПРИРОДНЫХНАНООБЪЕКТОВ»
«ТРАНСЛЯЦИЯ. ПОСТТРАНСЛЯЦИОННАЯ
МОДИФИКАЦИЯ ПОЛИПЕПТИДОВ, ПОНЯТИЕ
О ШАПЕРОНАХ»
23.
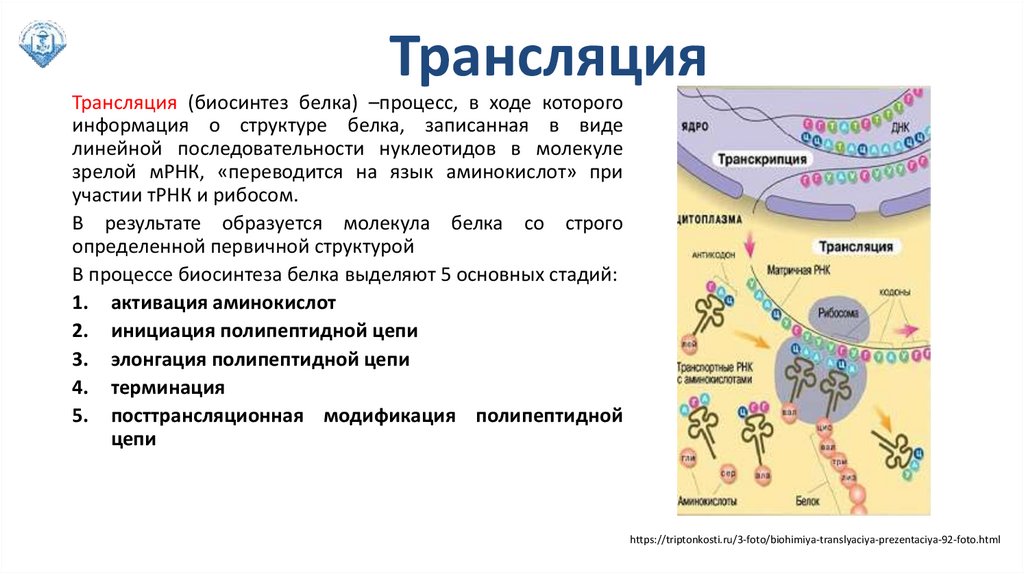
ТрансляцияТрансляция (биосинтез белка) –процесс, в ходе которого
информация о структуре белка, записанная в виде
линейной последовательности нуклеотидов в молекуле
зрелой мРНК, «переводится на язык аминокислот» при
участии тРНК и рибосом.
В результате образуется молекула белка со строго
определенной первичной структурой
В процессе биосинтеза белка выделяют 5 основных стадий:
1. активация аминокислот
2. инициация полипептидной цепи
3. элонгация полипептидной цепи
4. терминация
5. посттрансляционная модификация полипептидной
цепи
https://triptonkosti.ru/3-foto/biohimiya-translyaciya-prezentaciya-92-foto.html
24.
ТрансляцияСтадия 1 - активация аминокислот. Протекает в цитозоле.
Каждая из 20 аминокислот ковалентно присоединяется к определенной тРНК, используя для этого энергию АТФ.
Значение стадии:
активация СООН-группы аминокислоты, которая может участвовать в образовании пептидной связи
аминокислоты сами не могут узнавать кодоны мРНК, а переносятся к рибосомам тРНК, которые
посредством специфических антикодонов узнают кодоны мРНК и выполняют, таким образом, роль
адапторных молекул.
Условия:
1.
20 аминокислот; 10 аминокислот являются незаменимыми и должны поступать с пищей; если отсутствует
хотя бы одна аминокислота, процесс биосинтеза белка прекращается
2.
ферменты аминоацил-тРНК-синтетазы(аминоацил-тРНК- лигазы)
3.
тРНК
4.
АТФ
5.
Mg2+
Активация аминокислот и их присоединение к тРНК осуществляется специфическими аминоацил-тРНКсинтетазами, которые называют активирующими ферментами.
Общий вид катализируемой реакции может быть выражен уравнением:
Аминокислота + тРНК +АТФ+ Mg2+ Аминоацил-тРНК + АМФ + РРн
Фермент имеет 4 центра связывания: 1) для тРНК; 2) для АТФ; 3) для аминокислоты; 4) для воды.
Гидролитическая активность фермента необходима для удаления «неправильной» аминокислоты с
последующим присоединением «правильной» аминокислоты к тРНК. Аминокислоты, для которых имеется две и
более тРНК, активируются обычно одним ферментом.
https://medfsh.ru/wp-content/uploads/2021/12/Severin-biohimiya-uchebnik.pdf
25.
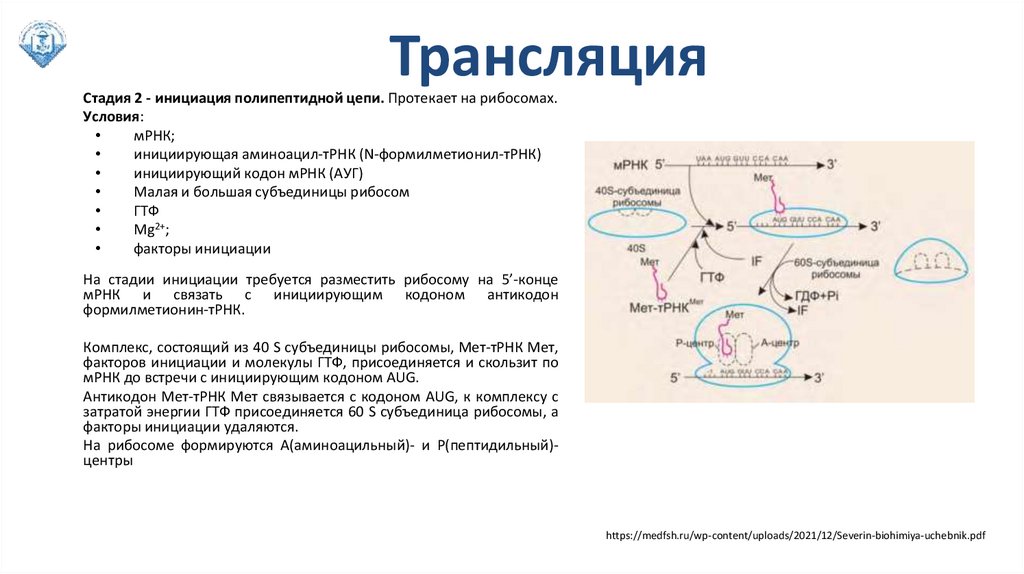
ТрансляцияСтадия 2 - инициация полипептидной цепи. Протекает на рибосомах.
Условия:
мРНК;
инициирующая аминоацил-тРНК (N-формилметионил-тРНК)
инициирующий кодон мРНК (АУГ)
Малая и большая субъединицы рибосом
ГТФ
Mg2+;
факторы инициации
На стадии инициации требуется разместить рибосому на 5’-конце
мРНК и связать с инициирующим кодоном антикодон
формилметионин-тРНК.
Комплекс, состоящий из 40 S субъединицы рибосомы, Мет-тРНК Мет,
факторов инициации и молекулы ГТФ, присоединяется и скользит по
мРНК до встречи с инициирующим кодоном AUG.
Антикодон Мет-тРНК Мет связывается с кодоном AUG, к комплексу с
затратой энергии ГТФ присоединяется 60 S субъединица рибосомы, а
факторы инициации удаляются.
На рибосоме формируются А(аминоацильный)- и Р(пептидильный)центры
https://medfsh.ru/wp-content/uploads/2021/12/Severin-biohimiya-uchebnik.pdf
26.
ТрансляцияСтадия 3 - элонгация полипептидной цепи. Протекает на
рибосомах.
Условия:
инициаторный комплекс, образованный на
предыдущей стадии
полный набор аминоацил-тРНК
Mg2+
факторы элонгации
пептидилтрансфераза
ГТФ
Цикл элонгации включает 3 этапа:
1.
связывание аминоацил-тРНК в А-центре происходит
за счет энергии ГТФ и при участии фактора элонгации
EF1
2.
образование пептидной связи
катализирует
пептидилтрансфераза, активный центр которой
формируется рРНК, входящей в состав большой
субъединицы рибосомы
3.
Траслокацию — перемещение рибосомы по мРНК от
5’- к 3’-концу на один кодон идет с использованием
энергии ГТФ
https://medfsh.ru/wp-content/uploads/2021/12/Severin-biohimiya-uchebnik.pdf
27.
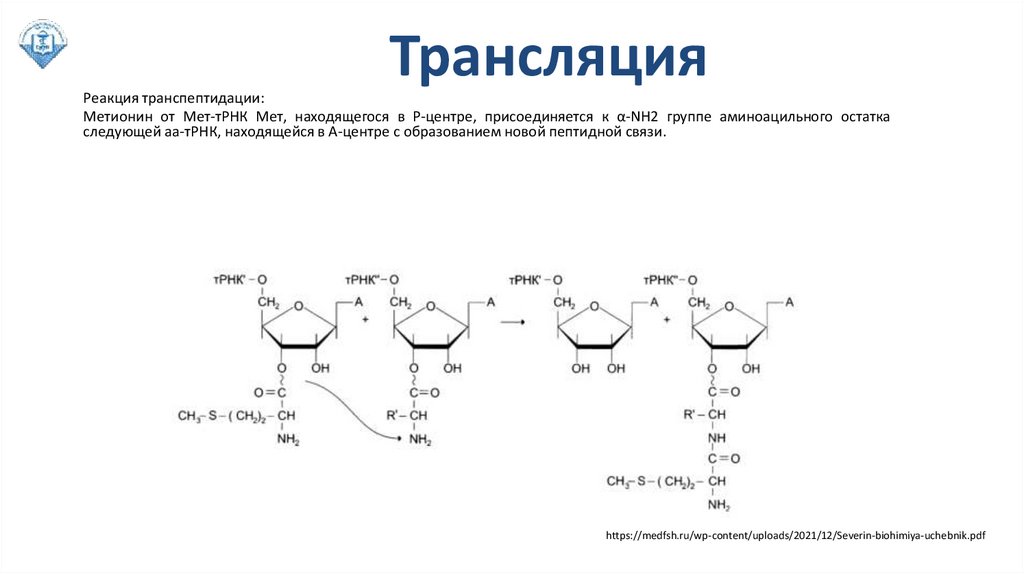
ТрансляцияРеакция транспептидации:
Метионин от Мет-тРНК Мет, находящегося в Р-центре, присоединяется к α-NH2 группе аминоацильного остатка
следующей аа-тРНК, находящейся в А-центре с образованием новой пептидной связи.
https://medfsh.ru/wp-content/uploads/2021/12/Severin-biohimiya-uchebnik.pdf
28.
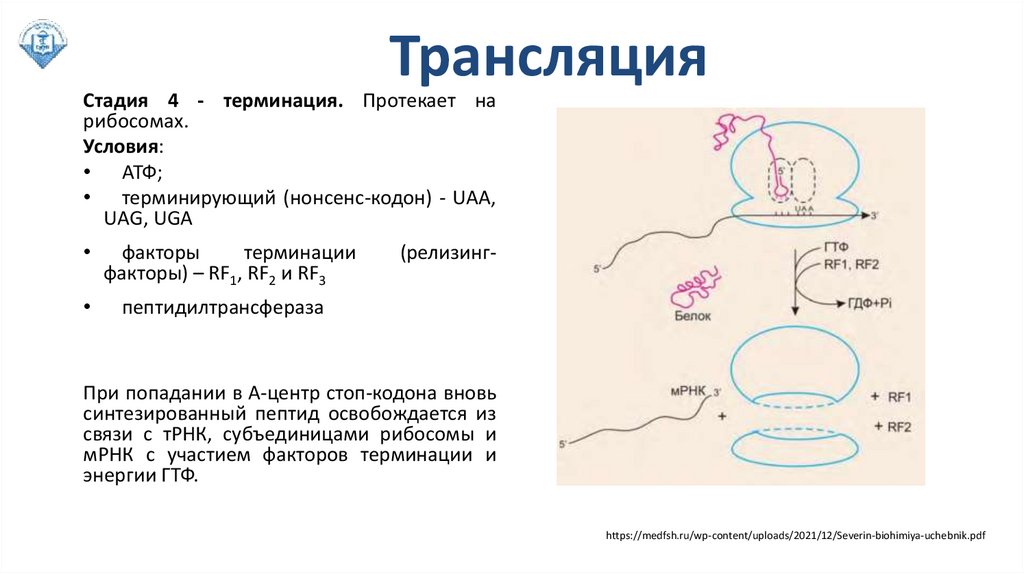
ТрансляцияСтадия 4 - терминация. Протекает на
рибосомах.
Условия:
• АТФ;
• терминирующий (нонсенс-кодон) - UАА,
UАG, UGА
факторы
терминации
факторы) – RF1, RF2 и RF3
пептидилтрансфераза
(релизинг-
При попадании в А-центр стоп-кодона вновь
синтезированный пептид освобождается из
связи с тРНК, субъединицами рибосомы и
мРНК с участием факторов терминации и
энергии ГТФ.
https://medfsh.ru/wp-content/uploads/2021/12/Severin-biohimiya-uchebnik.pdf
29.
ТрансляцияСтадия 5 - посттрансляционная модификация полипептидной цепи
Полипептиды, являющиеся продуктами трансляции, не всегда функционально активны и требуют
дополнительных посттрансляционных преобразований, включающих:
• фолдинг молекул. В процессе синтеза полипептидных цепей на рибосоме при участии белков —
шаперонов происходит формирование термодинамически наиболее выгодной пространственной
конформации;
• образование дисульфидных связей между остатками цистеина. Эта модификация имеет важное
значение для проявления активности многих белков (инсулина, иммуноглобулинов, рибонуклеазы и
др.);
• частичный протеолиз, который имеет место при синтезе всех белков на экспорт и некоторых
внутриклеточных белков;
• присоединение простетической группы, обеспечивающее образование сложных белков;
• сборку протомеров в олигомерные белки, необходимую для образования молекул с четвертичной
структурой;
• модификацию аминокислотных остатков, свойственную многим белкам. Так, фосфорилирование
гидроксильных групп в остатках Сер, Тре и Тир, гидроксилирование остатков Про и Лиз в молекулах
коллагенов; карбоксилирование остатков Глу в факторах свертывания крови II, VII, IХ, Х и др.,
метилирование остатков Арг и Лиз в молекулах гистонов; йодирование остатков Тир в белке
щитовидной железы тиреоглобулине и т.д. являются необходимым этапом в синтезе и
функционировании биологически активных молекул
30.
ШапероныМногие модификации осуществляются в ЭР. Здесь происходит фолдинг
полипептидных цепей и формирование уникальной третичной или
четвертичной структуры.
Шапероны - это специальные белки, которые способствуют правильному
сворачиванию, или фолдингу, других белков. Когда молодой белок в
процессе трансляции постепенно выходит из рибосомы, он попадает в среду,
в которой не так просто принять верную пространственную структуру: другие
белки так и норовят образовать с ним агрегаты. Шапероны связывают новый
белок и помогают ему правильно свернуться.
Шапероны относят также к белкам теплового шока (анг. heat shock proteins,
Hsp), чей уровень в клетке резко повышается при слишком высокой
температуре. Тепловой шок способен привести к денатурации белков
(нарушении трёхмерной структуры) и последующей их агрегации.
Шапероны спасают клетку от этого.
31.
ЛЕКЦИЯ «БИОСИНТЕЗ, СТРУКТУРА И ФУНКЦИИ БЕЛКОВ КАК ПРИРОДНЫХНАНООБЪЕКТОВ»
«РЕГУЛЯЦИЯ БИОСИНТЕЗА БЕЛКА НА УРОВНЕ
ТРАНСКРИПЦИИ»
32.
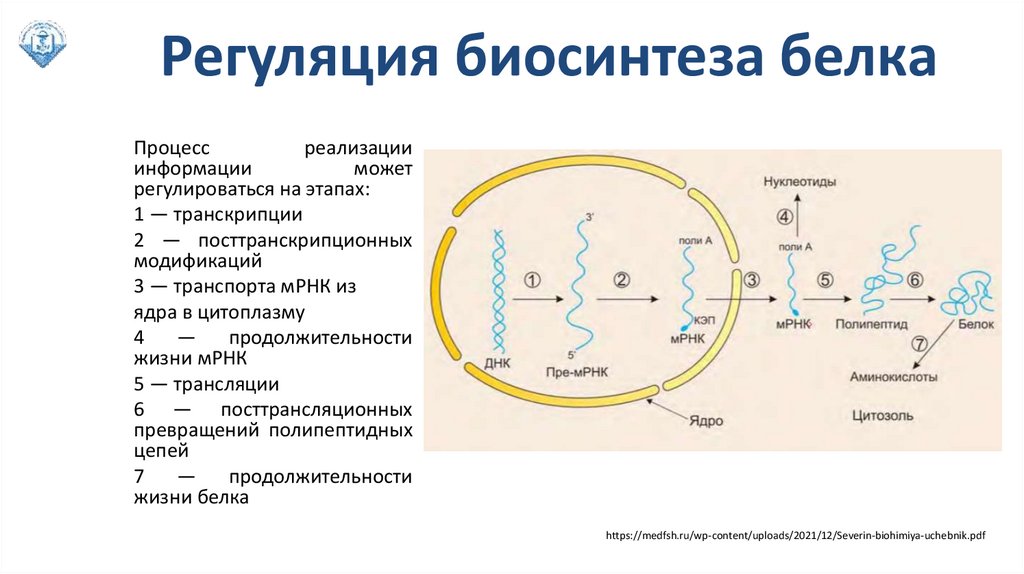
Регуляция биосинтеза белкаПроцесс
реализации
информации
может
регулироваться на этапах:
1 — транскрипции
2 — посттранскрипционных
модификаций
3 — транспорта мРНК из
ядра в цитоплазму
4
—
продолжительности
жизни мРНК
5 — трансляции
6 — посттрансляционных
превращений полипептидных
цепей
7
—
продолжительности
жизни белка
https://medfsh.ru/wp-content/uploads/2021/12/Severin-biohimiya-uchebnik.pdf
33.
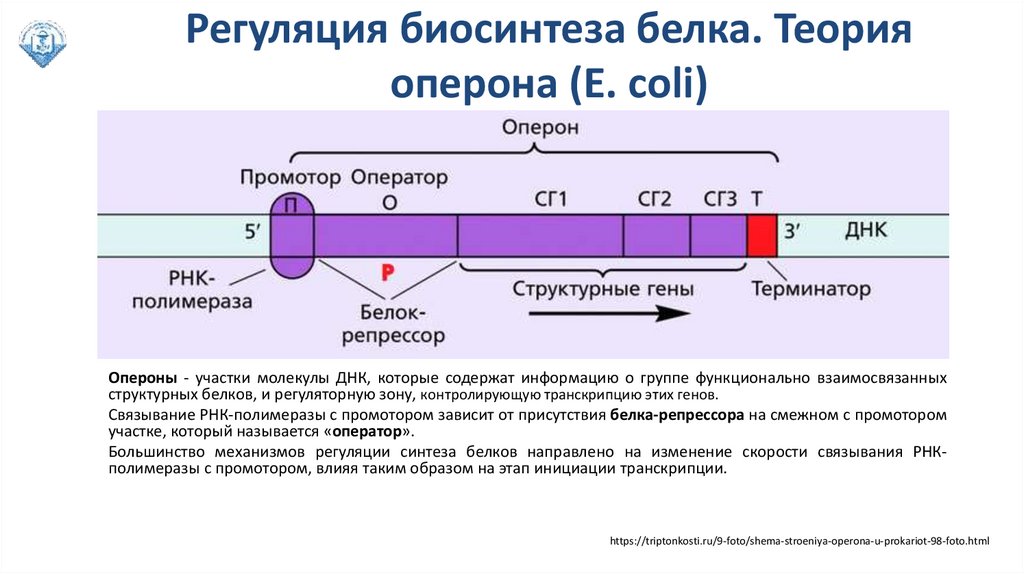
Регуляция биосинтеза белка. Теорияоперона (E. coli)
Опероны - участки молекулы ДНК, которые содержат информацию о группе функционально взаимосвязанных
структурных белков, и регуляторную зону, контролирующую транскрипцию этих генов.
Связывание РНК-полимеразы с промотором зависит от присутствия белка-репрессора на смежном с промотором
участке, который называется «оператор».
Большинство механизмов регуляции синтеза белков направлено на изменение скорости связывания РНКполимеразы с промотором, влияя таким образом на этап инициации транскрипции.
https://triptonkosti.ru/9-foto/shema-stroeniya-operona-u-prokariot-98-foto.html
34.
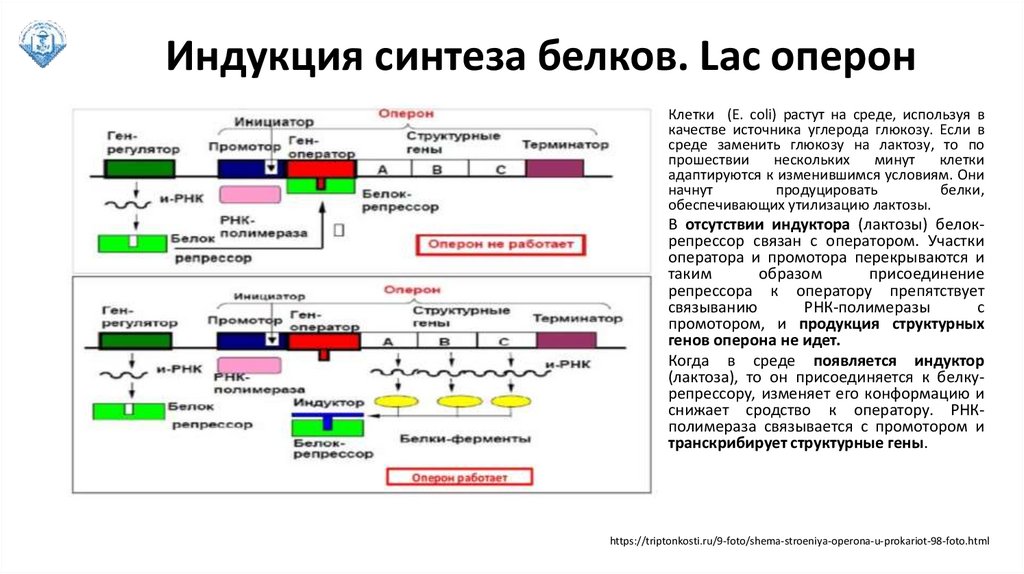
Индукция синтеза белков. Lac оперонКлетки (E. coli) растут на среде, используя в
качестве источника углерода глюкозу. Если в
среде заменить глюкозу на лактозу, то по
прошествии
нескольких
минут
клетки
адаптируются к изменившимся условиям. Они
начнут
продуцировать
белки,
обеспечивающих утилизацию лактозы.
В отсутствии индуктора (лактозы) белокрепрессор связан с оператором. Участки
оператора и промотора перекрываются и
таким
образом
присоединение
репрессора к оператору препятствует
связыванию
РНК-полимеразы
с
промотором, и продукция структурных
генов оперона не идет.
Когда в среде появляется индуктор
(лактоза), то он присоединяется к белкурепрессору, изменяет его конформацию и
снижает сродство к оператору. РНКполимераза связывается с промотором и
транскрибирует структурные гены.
https://triptonkosti.ru/9-foto/shema-stroeniya-operona-u-prokariot-98-foto.html
35.
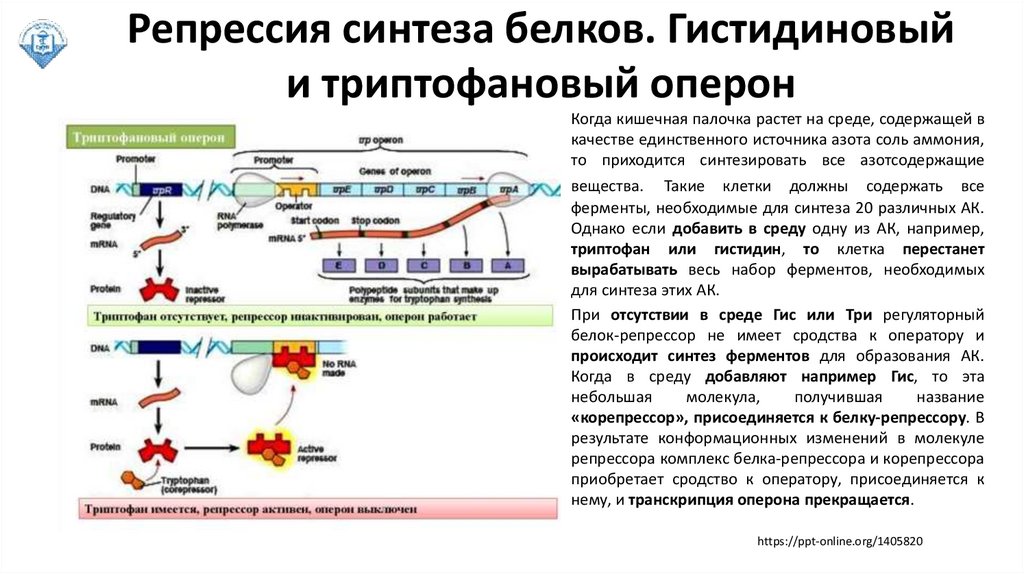
Репрессия синтеза белков. Гистидиновыйи триптофановый оперон
Когда кишечная палочка растет на среде, содержащей в
качестве единственного источника азота соль аммония,
то приходится синтезировать все азотсодержащие
вещества. Такие клетки должны содержать все
ферменты, необходимые для синтеза 20 различных АК.
Однако если добавить в среду одну из АК, например,
триптофан или гистидин, то клетка перестанет
вырабатывать весь набор ферментов, необходимых
для синтеза этих АК.
При отсутствии в среде Гис или Три регуляторный
белок-репрессор не имеет сродства к оператору и
происходит синтез ферментов для образования АК.
Когда в среду добавляют например Гис, то эта
небольшая
молекула,
получившая
название
«корепрессор», присоединяется к белку-репрессору. В
результате конформационных изменений в молекуле
репрессора комплекс белка-репрессора и корепрессора
приобретает сродство к оператору, присоединяется к
нему, и транскрипция оперона прекращается.
https://ppt-online.org/1405820
36.
Регуляция биосинтеза белка (экспрессиигенов) у эукариотов
Механизмы:
стабильной репрессии транскрипции одних генов и прочтения
(экспрессии) других на протяжении всей жизни организма,
причем в разных тканях стабильной репрессии подвергаются
разные гены
адаптивной регуляции, обеспечивающей приспособление
организма к меняющимся условиям внутренней и внешней
среды.
На молекуле эукариотической ДНК имеются короткие специфические
последовательности, которые участвуют в регуляции экспрессии генов.:
энхансеры (enhancer — усилитель) - присоединение белков к этому
регуляторному участку ДНК увеличивает (индуцирует) скорость
транскрипции
сайленсеры (silencer — тушитель) - присоединение белков к этому
регуляторному участку ДНК замедляет (репрессирует) транскрипцию..
Область, обеспечивающая регуляцию экспрессии генов, включает
промоторный
участок
и
дополнительные
регуляторные
последовательности, в которые входят энхансеры, сайленсеры,
гормоночувствительные участки, последовательности GC, СААТ и др.
Белки, связывающиеся с ДНК в этих участках, называют
специфическими регуляторными белками. Они влияют на скорость
транскрипции генов, связываясь с белками-посредниками или
коактиваторами, передающими сигнал на основные транскрипционные
факторы и РНК-полимеразу.
https://medfsh.ru/wp-content/uploads/2021/12/Severin-biohimiya-uchebnik.pdf
37.
ЛЕКЦИЯ «БИОСИНТЕЗ, СТРУКТУРА И ФУНКЦИИ БЕЛКОВ КАК ПРИРОДНЫХНАНООБЪЕКТОВ»
«БЕЛКИ-РЕЦЕПТОРЫ. НАНОБИОСЕНСОРЫ, ИХ
ПРИМЕНЕНИЕ В ДИАГНОСТИКЕ И ЛЕЧЕНИИ
ЗАБОЛЕВАНИЙ. БЕЛКОВЫЕ «НАНОМОТОРЫ»
В ЖИВЫХ КЛЕТКАХ.»
38.
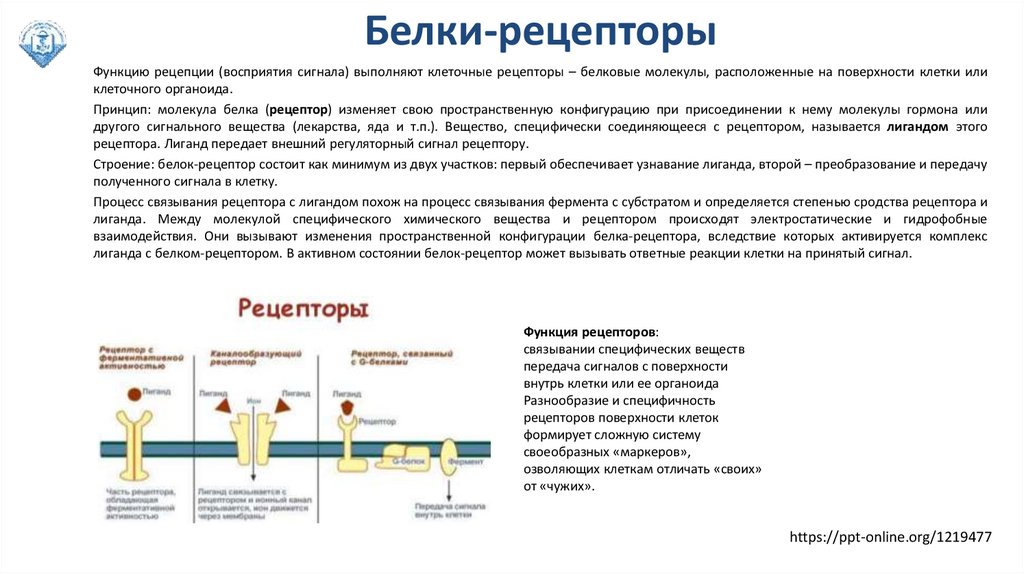
Белки-рецепторыФункцию рецепции (восприятия сигнала) выполняют клеточные рецепторы – белковые молекулы, расположенные на поверхности клетки или
клеточного органоида.
Принцип: молекула белка (рецептор) изменяет свою пространственную конфигурацию при присоединении к нему молекулы гормона или
другого сигнального вещества (лекарства, яда и т.п.). Вещество, специфически соединяющееся с рецептором, называется лигандом этого
рецептора. Лиганд передает внешний регуляторный сигнал рецептору.
Строение: белок-рецептор состоит как минимум из двух участков: первый обеспечивает узнавание лиганда, второй – преобразование и передачу
полученного сигнала в клетку.
Процесс связывания рецептора с лигандом похож на процесс связывания фермента с субстратом и определяется степенью сродства рецептора и
лиганда. Между молекулой специфического химического вещества и рецептором происходят электростатические и гидрофобные
взаимодействия. Они вызывают изменения пространственной конфигурации белка-рецептора, вследствие которых активируется комплекс
лиганда с белком-рецептором. В активном состоянии белок-рецептор может вызывать ответные реакции клетки на принятый сигнал.
Функция рецепторов:
связывании специфических веществ
передача сигналов с поверхности
внутрь клетки или ее органоида
Разнообразие и специфичность
рецепторов поверхности клеток
формирует сложную систему
своеобразных «маркеров»,
озволяющих клеткам отличать «своих»
от «чужих».
https://ppt-online.org/1219477
39.
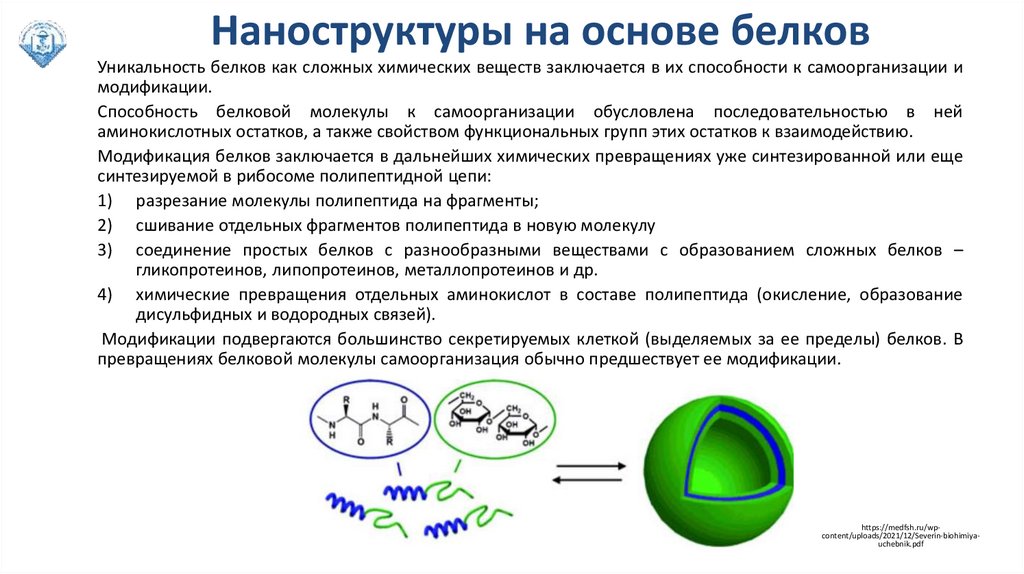
Наноструктуры на основе белковУникальность белков как сложных химических веществ заключается в их способности к самоорганизации и
модификации.
Способность белковой молекулы к самоорганизации обусловлена последовательностью в ней
аминокислотных остатков, а также свойством функциональных групп этих остатков к взаимодействию.
Модификация белков заключается в дальнейших химических превращениях уже синтезированной или еще
синтезируемой в рибосоме полипептидной цепи:
1) разрезание молекулы полипептида на фрагменты;
2) сшивание отдельных фрагментов полипептида в новую молекулу
3) соединение простых белков с разнообразными веществами с образованием сложных белков –
гликопротеинов, липопротеинов, металлопротеинов и др.
4) химические превращения отдельных аминокислот в составе полипептида (окисление, образование
дисульфидных и водородных связей).
Модификации подвергаются большинство секретируемых клеткой (выделяемых за ее пределы) белков. В
превращениях белковой молекулы самоорганизация обычно предшествует ее модификации.
https://medfsh.ru/wpcontent/uploads/2021/12/Severin-biohimiyauchebnik.pdf
40.
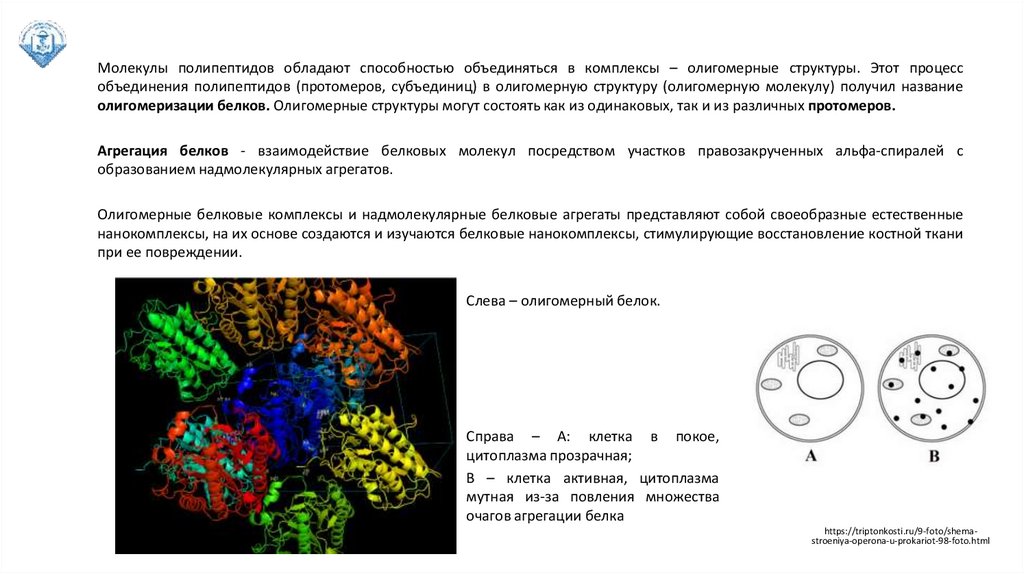
Молекулы полипептидов обладают способностью объединяться в комплексы – олигомерные структуры. Этот процессобъединения полипептидов (протомеров, субъединиц) в олигомерную структуру (олигомерную молекулу) получил название
олигомеризации белков. Олигомерные структуры могут состоять как из одинаковых, так и из различных протомеров.
Агрегация белков - взаимодействие белковых молекул посредством участков правозакрученных альфа-спиралей с
образованием надмолекулярных агрегатов.
Олигомерные белковые комплексы и надмолекулярные белковые агрегаты представляют собой своеобразные естественные
нанокомплексы, на их основе создаются и изучаются белковые нанокомплексы, стимулирующие восстановление костной ткани
при ее повреждении.
Слева – олигомерный белок.
Справа – А: клетка в покое,
цитоплазма прозрачная;
В – клетка активная, цитоплазма
мутная из-за повления множества
очагов агрегации белка
https://triptonkosti.ru/9-foto/shemastroeniya-operona-u-prokariot-98-foto.html
41.
Наноконструкции на основе белковКатионные белки – белки, которые приобретают
положительный заряд, применяются как основа для
самособирающихся наночастиц.
Такие наночастицы обладают антимикробным
действием и могут заменять традиционные
антибиотики.
Механизм действия белковых наночастиц:
Белковые наночастицы продырявливают
оболочку бактерий во многих местах и такие
микроорганизмы с обнаженной цитоплазмой
незамедлительно погибают.
В сравнении с антибиотиками белковые наночастицы
обладают двумя преимуществами:
проникают через клеточные и тканевые барьеры,
«сооружаемые» организмом вокруг органов, в
том числе и больных органов;
не дают нежелательных побочных эффектов при
их применении.
https://triptonkosti.ru/9-foto/shema-stroeniya-operona-u-prokariot-98-foto.html
42.
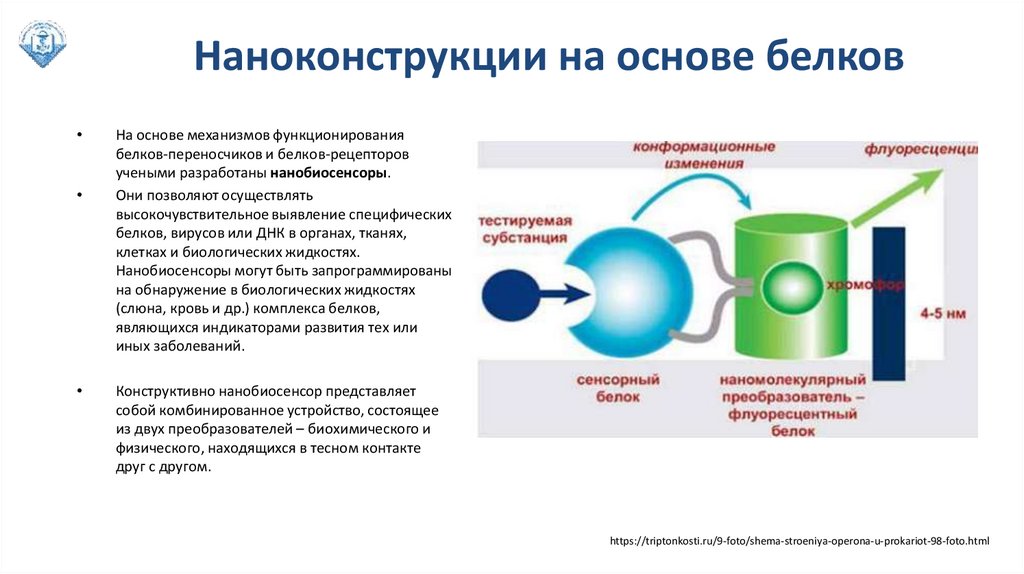
Наноконструкции на основе белковНа основе механизмов функционирования
белков-переносчиков и белков-рецепторов
учеными разработаны нанобиосенсоры.
Они позволяют осуществлять
высокочувствительное выявление специфических
белков, вирусов или ДНК в органах, тканях,
клетках и биологических жидкостях.
Нанобиосенсоры могут быть запрограммированы
на обнаружение в биологических жидкостях
(слюна, кровь и др.) комплекса белков,
являющихся индикаторами развития тех или
иных заболеваний.
Конструктивно нанобиосенсор представляет
собой комбинированное устройство, состоящее
из двух преобразователей – биохимического и
физического, находящихся в тесном контакте
друг с другом.
https://triptonkosti.ru/9-foto/shema-stroeniya-operona-u-prokariot-98-foto.html
43.
Наноконструкции на основе белковКак были созданы биоанализаторы:
Некоторые белки имеют свойство образовывать
регулярные структуры в виде кристаллических
решеток, многие бактерии, в частности,
формируют на своей поверхности
одномолекулярные слои кристаллического
белка, называемые S-слоями.
Исследователи удалили белковый S-слой с
поверхности бактерии и разбили его на
«субъединицы».
Поместив затем субъединицы в раствор, они
добились объединения их в кристаллическую
решетку, формируемую уже на кремниевых,
металлических и синтетических подложках.
К помещенному на подложку S-слою были
добавлены специальные сенсорные молекулы,
которые вместе со слоем сформировали точный
биоаналитический сенсор.
Фотография рельефа кристаллизованного белка
CCM2177, синтезируемого бактерией,
полученная с помощью сканирующего электронного
микроскопа.
Расстояния между центрами решетки составляют 13,1 нм
https://triptonkosti.ru/9-foto/shema-stroeniya-operona-u-prokariot-98-foto.html
44.
Наноконструкции на основе белковНа основе нанопроводов создан уникальный нанобиосенсор,
позволяющий выявлять единичные вирусы, нуклеотидов в ДНК,
выявление злокачественных клеток.
Связывание вируса со специфическим белком-рецептором
(антителом), нанесенным на поверхность нанопровода, вызывает
значимое изменение электрической проводимости.
Наибольший интерес для медицины представляют два
направления использования нанобиосенсоров в совокупности с
наноконтейнерами:
обнаружение антител, специфичных к антигенам больных
клеток;
избирательная доставки лекарственных средств
непосредственно к больным клеткам.
Использование медикаментозных препаратов, заключенных в
наночастицы, сводит до минимума их разрушение и утрату
активности по пути к больному органу.
При этом предотвращается возникновение нежелательных
побочных явлений, а также возрастает эффективность применения
препарата.
Принцип работы
белков-рецепторов
Нанопровод (темно-серого
цвета) с изоляцией
на основе бимолекулярного
слоя липидов клеточной
мембраны (оранжево-голубого
цвета)
и молекулами белковрецепторов (сиреневого цвета)
https://triptonkosti.ru/9-foto/shema-stroeniya-operona-u-prokariot-98-foto.html
45.
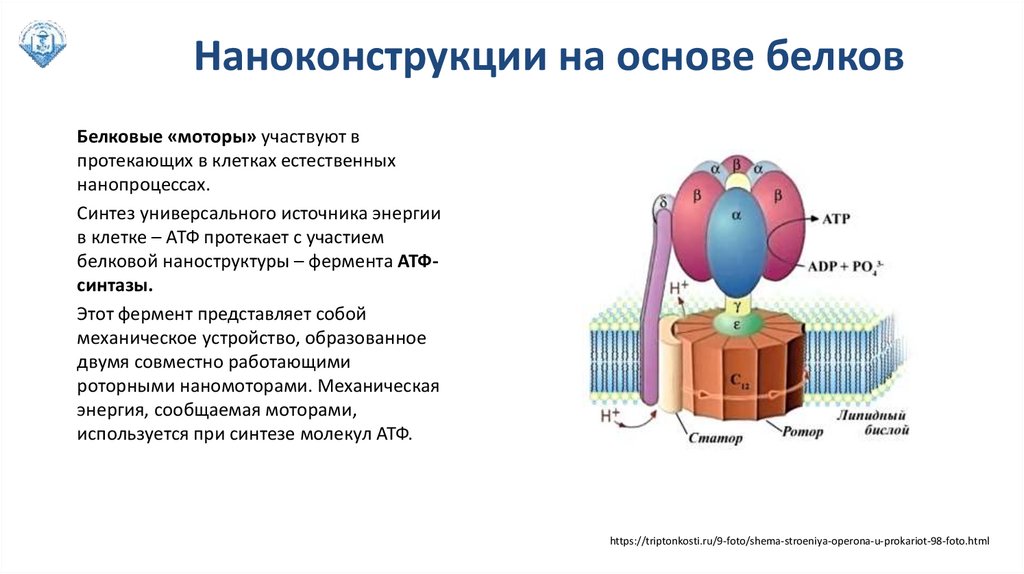
Наноконструкции на основе белковБелковые «моторы» участвуют в
протекающих в клетках естественных
нанопроцессах.
Синтез универсального источника энергии
в клетке – АТФ протекает с участием
белковой наноструктуры – фермента АТФсинтазы.
Этот фермент представляет собой
механическое устройство, образованное
двумя совместно работающими
роторными наномоторами. Механическая
энергия, сообщаемая моторами,
используется при синтезе молекул АТФ.
https://triptonkosti.ru/9-foto/shema-stroeniya-operona-u-prokariot-98-foto.html
46.
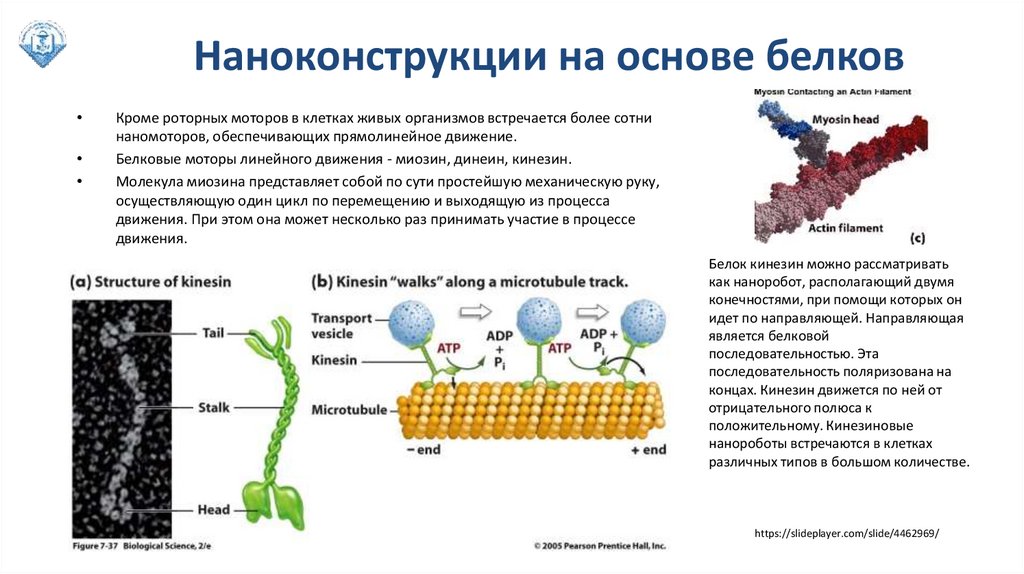
Наноконструкции на основе белковКроме роторных моторов в клетках живых организмов встречается более сотни
наномоторов, обеспечивающих прямолинейное движение.
Белковые моторы линейного движения - миозин, динеин, кинезин.
Молекула миозина представляет собой по сути простейшую механическую руку,
осуществляющую один цикл по перемещению и выходящую из процесса
движения. При этом она может несколько раз принимать участие в процессе
движения.
Белок кинезин можно рассматривать
как наноробот, располагающий двумя
конечностями, при помощи которых он
идет по направляющей. Направляющая
является белковой
последовательностью. Эта
последовательность поляризована на
концах. Кинезин движется по ней от
отрицательного полюса к
положительному. Кинезиновые
нанороботы встречаются в клетках
различных типов в большом количестве.
https://slideplayer.com/slide/4462969/
47.
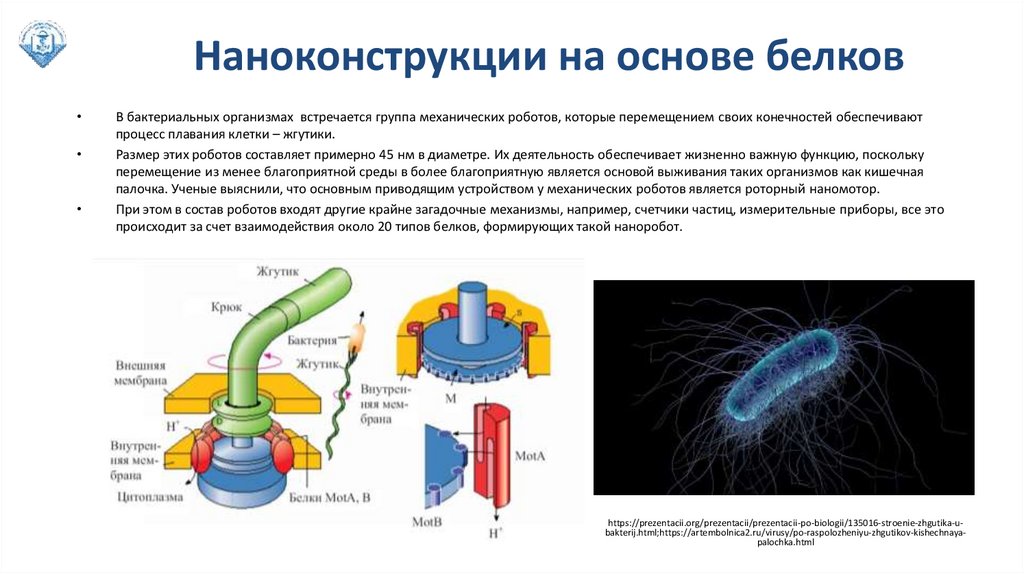
Наноконструкции на основе белковВ бактериальных организмах встречается группа механических роботов, которые перемещением своих конечностей обеспечивают
процесс плавания клетки – жгутики.
Размер этих роботов составляет примерно 45 нм в диаметре. Их деятельность обеспечивает жизненно важную функцию, поскольку
перемещение из менее благоприятной среды в более благоприятную является основой выживания таких организмов как кишечная
палочка. Ученые выяснили, что основным приводящим устройством у механических роботов является роторный наномотор.
При этом в состав роботов входят другие крайне загадочные механизмы, например, счетчики частиц, измерительные приборы, все это
происходит за счет взаимодействия около 20 типов белков, формирующих такой наноробот.
https://prezentacii.org/prezentacii/prezentacii-po-biologii/135016-stroenie-zhgutika-ubakterij.html;https://artembolnica2.ru/virusy/po-raspolozheniyu-zhgutikov-kishechnayapalochka.html
48.
Рекомендуемая литератураРамбиди, Н. Г. Физические и химические основы нанотехнологий. / Рамбиди Н. Г. , Берёзкин А. В. - Москва : ФИЗМАТЛИТ,
2009. - 456 с. - ISBN 978-5-9221-0988-8. - Текст : электронный // URL :
http://www.studmedlib.ru/book/ISBN9785922109888.html
Биохимия: учебник для студентов медицинских вузов [Текст] / Л. В. Авдеева, Т. Л. Алейникова, Л. Е. Андрианова [и др.] ;
ред. Е. С. Северин. - ГЭОТАР-Медиа, 2020. - 768 с.
Фостер, ЛиннНанотехнологии. Наука, инновации и возможности [Электронный ресурс] : монография / ЛиннФостер ; пер. А.
Хачояна. — Электрон. текстовые данные. — М. :Техносфера, 2008. — 352 c. — 978-5-94836-161-1. — Режим доступа:
http://www.iprbookshop.ru/13282.html
Витязь, П. А. Основы нанотехнологий и наноматериалов [Электронный ресурс] : учебное пособие / П. А. Витязь, Н. А.
Свидунович. — Электрон. текстовые данные. — Минск :Вышэйшая школа, 2010. — 302 c. — 978-985-06-1783-5. — Режим
доступа: http://www.iprbookshop.ru/20108.html
Верещагина, Я. А. Инновационные технологии. Введение в нанотехнологии [Электронный ресурс] : учебное пособие / Я. А.
Верещагина. — Электрон. текстовые данные. — Казань : Казанский национальный исследовательский технологический
университет, 2009. — 115 c. — 978-5-7882-0778-0. — Режим доступа: http://www.iprbookshop.ru/61850.html
)
Контакты: yu.v.filippova@orgma.ru


























 biology
biology