Similar presentations:
Фосфор и его соединения
1. ФОСФОР И ЕГО СОЕДИНЕНИЯ
«Фосфор – элемент жизни имыслительной деятельности»
А.Е. Ферсман.
2.
Задача 1Формула сернистого газа SO2.
Рассчитайте массу серы в 8 г этого
оксида?
3.
Считается, что фосфор открылв 1669 году алхимик из
Гамбурга Хеннинг Бранд. Он
был разорившимся купцом и
пытался разбогатеть с
помощью алхимии.
Предполагая, что
физиологические продукты
могут содержать «первичную
материю», которая считалась
основой философского камня,
Бранд заинтересовался
человеческой мочей.
4.
Он собрал около тонны мочи из солдатских казарми выпаривал ее до образования сиропообразной
жидкости. Эту жидкость он вновь дистиллировал
и получил тяжелое красное «уринное масло»,
которое Перегонялось с образованием твердого
остатка. Нагревая последний, без доступа воздуха,
он заметил образование белого дыма, оседавшего
на стенках сосуда и ярко светившего в темноте.
Бранд назвал полученное им
вещество фосфором, что в
переводе с греческого означает
«светоносец».
5.
И лишь 1777 году К.В. Шееле разработал способполучения фосфора из рога и костей животных.
6.
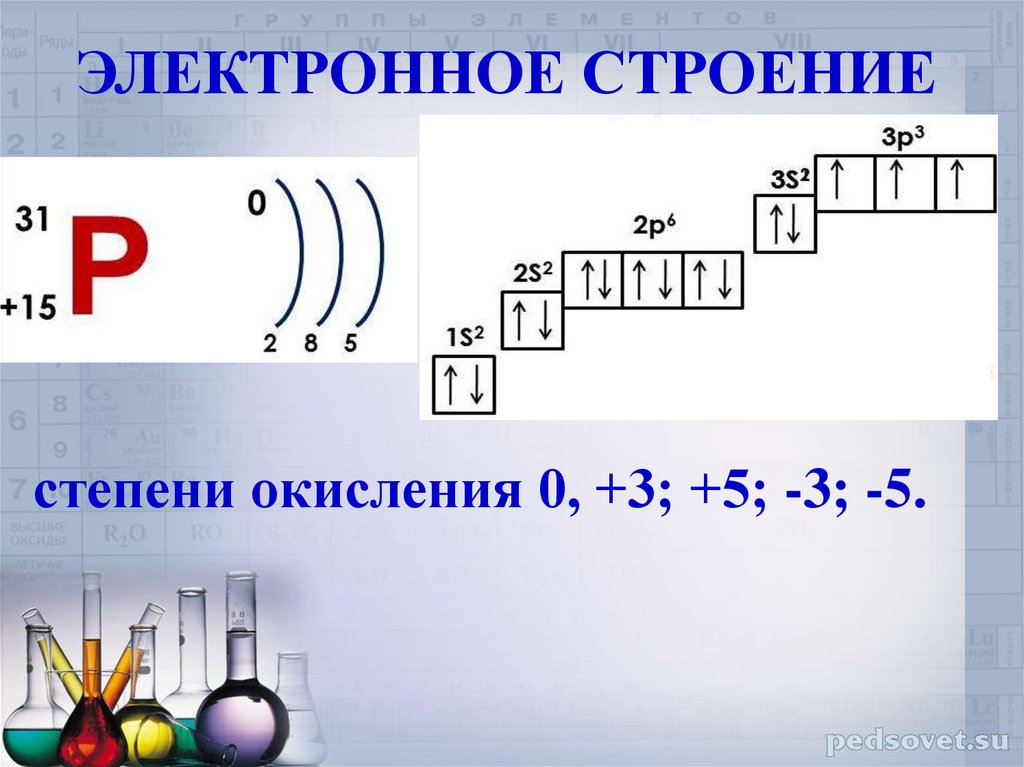
ЭЛЕКТРОННОЕ СТРОЕНИЕстепени окисления 0, +3; +5; -3; -5.
7.
АПАТИТCa3(PO4)2
ФТОРОПАТИТ
3Ca3(PO4)2 · CaF2
8.
ПОЛУЧЕНИЕ ФОСФОРА9.
АЛЛОТРОПИЯФОСФОР БЕЛЫЙ
ФОСФОР
КРАСНЫЙ
ФОСФОР ЧЕРНЫЙ
10.
Вопрос аллотропии фосфора сложен и доконца не решён. Иногда выделяют и четыре
модификации простого вещества — белый,
красный, черный и металлический фосфор.
11.
Горение белого фосфораХранение белого фосфора
Белый фосфор окисляется кислородом уже при
обычных условиях, а в тонкоизмельченном
состоянии самовоспламеняется, поэтому его
хранят под водой. Окисление фосфора
сопровождается свечением. Химическая энергия
непосредственно превращается в световую.
12.
Химические свойстваВ химических реакциях проявляет окислительновосстановительную двойственность.
Как окислитель взаимодействует со многими металлами,
образуя фосфиды.
Фосфор непосредственно с водородом не реагирует.
Как восстановитель взаимодействует с более
электроотрицательными неметаллами.
При недостатке кислорода или при комнатной
температуре окисляется до оксида фосфора (III).
При сгорании фосфора в кислороде или на воздухе
образуется оксид фосфора (V).
13.
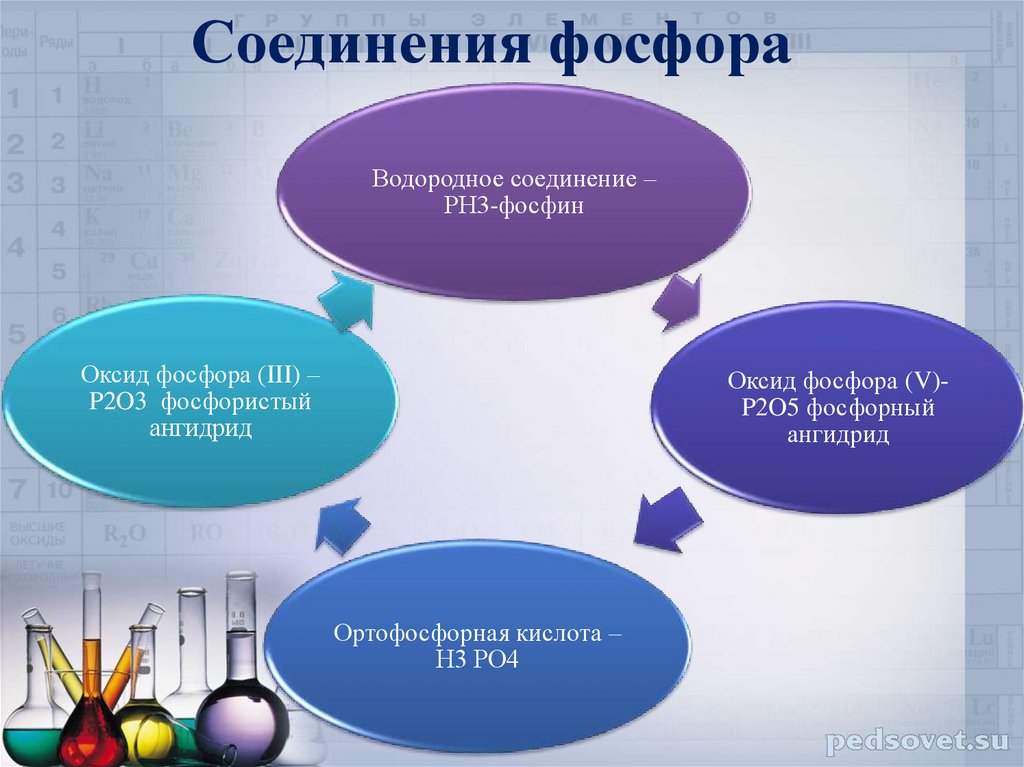
Соединения фосфораВодородное соединение –
РН3-фосфин
Оксид фосфора (III) –
P2O3 фосфористый
ангидрид
Оксид фосфора (V)P2O5 фосфорный
ангидрид
Ортофосфорная кислота –
Н3 РО4
14.
Оксиды фосфора (V) – P2O5 фосфорный ангидрид• Гигроскопичный порошок белого цвета,
хорошо растворимый в воде.
• Получают оксид фосфора (V), при горении
фосфора на воздухе или в кислороде:
4Р + 5О2 —› 2Р2О5
15.
Ортофосфорная кислота – Н3РО4• Твердое бесцветное кристаллическое вещество,
нелетучее, хорошо растворимое в воде.
• Получают эту кислоту, при взаимодействии оксида
фосфора (V) с водой
Р2О5 + 3Н2О —› 2Н3РО4
• Из фосфина
РН3 + 2О2 —› Н3РО4
• Из фосфора и серной конц. или азотной кислот
16.
Как трехосновная кислота,диссоциирует ступенчато.
Н3РО4 ↔ Н+ + Н2РО4―
(дигидрофосфат-ион)
Н2РО4― ↔ Н+ + НРО42―
(гидрофосфат-ион)
НРО42― ↔ Н+ + РО42―
(фосфат-ион)
17.
Соли фосфорной кислоты - фосфаты• При полном замещении всех атомов
водорода на атомы металла, образуются:
Фосфаты – Na3PO4
• При неполном замещении атомов водорода
на атомы металла, образуются:
Гидрофосфаты – Na2HPO4;
Дигидрофосфаты – NaH2PO4;
18.
Фосфаты почти всех металлов в воде нерастворимы.
Дигидрофосфаты всех металлов
хорошо растворимы в воде.
Гидрофосфаты по растворимости
занимают промежуточное положение.
Все нерастворимые в воде фосфаты
растворяются в растворах сильных кислот.
19.
Качественная реакция на фосфат-ион• Для определения фосфат – ионов используют
нитрат серебра. Так как в результате данной
реакции, выпадает осадок желтого цвета:
• Na3PO4 + 3AgNO3 —› Ag3PO4 ↓ + 3NaNO3
осадок желтого цвета
20.
Немало легенд и “жутких” историй связано сфосфором. Вспомним хотя бы известный рассказ
Артура Конан Дойля “Собака Баскервилей”. Вот что
увидел доктор Ватсон:
21.
22.
Пр
ф
и
о
м
с
е
ф
н
о
е
р
н
а
и
е
23.
Применение фосфора: спичкиЗажигательная поверхность спичечного
коробка покрыта смесью красного
фосфора и порошка стекла. В состав
спичечной головки входят окислители
(PbO2, KСlO3, BaCrO4) и восстановители
(S, Sb2S3). При трении от зажигательной
поверхности смесь, нанесенная на спичку,
воспламеняется.
24.
Первые фосфорные спички – с головкой из белогофосфора – были созданы лишь 1827 г. Такие
спички загорались при трении о любую
поверхность, что нередко приводило к пожарам.
Кроме того, белый фосфор очень ядовит. Описаны
случаи отравления фосфорными спичками как изза неосторожного обращения, так и с целью
самоубийства: для этого достаточно было съесть
несколько спичечных головок.
Промышленное производство
безопасных спичек началось
в Швеции в 60-х гг. XIX века.
25.
Применение фосфораНемало ортофосфорной кислоты потребляет пищевая
промышленность. Дело в том, что на вкус
разбавленная ортофосфорная кислота очень приятна и
небольшие ее добавки в мармелады, лимонады и
сиропы заметно улучшают их вкусовые качества. Этим
же свойством обладают и некоторые соли фосфорной
кислоты. Гидрофосфаты кальция, например, с давних
пор входят в хлебопекарные порошки, улучшая вкус
булочек и хлеба.
26.
27.
Интересны и другие примененияортофосфорной кислоты в промышленности.
Например, было замечено, что пропитка
древесины самой кислотой и ее солями делают
дерево негорючим. На этой основе сейчас
производят огнезащитные краски, негорючие
фосфодревесные плиты, негорючий фосфатный
пенопласт и другие строительные материалы.
28.
Реакция организма нанедостаток и избыток фосфора
Недостаток фосфора
Развивается
заболевание рахит,
снижается
умственная и
мышечная
деятельность.
Избыток фосфора
Развивается
мочекаменная
болезнь,
соединения
фосфора высоко
токсичны
(летальная доза
60 мг.).
29.
ЗакреплениеЗадание 1
Напишите уравнения реакций, с помощью
которых можно осуществить следующие
превращения:
Р → Р2О5 → Н3РО4 → Li3РО4
30.
Задание 2Напишите уравнения реакций, с помощью
которых можно осуществить следующие
превращения:
P → Mg3P2 → PH3 → H3PO4→ Na3PO4→ Ca3(PO4)2
31.
Задание 3Сколько килограммов 80% -й фосфорной
кислоты можно получить из 31 кг фосфора,
содержащего 5% примесей?
32.
Резервные задания:1
В 980 г 5% -го раствора фосфорной
кислоты растворили 152 г оксида фосфора
(V). Вычислите массовую долю фосфорной
кислоты в полученном растворе.
33.
Домашнее задание:1.
2.
3.
§§24 - 26 учить.
Вопросы 3- 6 стр. 72-73.
Задача 1 стр. 73.
34.
Индивидуальное домашнеезадание:
Дима «История спичек»
Максим «Минеральные
удобрения»































 chemistry
chemistry








