Similar presentations:
Строение атома. Периодический закон
1.
Лекция 2.Строение атома. Периодический закон
Лектор:доц. каф. 908
Ефремова Екатерина
Игоревна
еmail:
«Атомы бесчисленны по величине и многообразию, носятся они во Вселенной,
кружась в вихре, и таким образом рождается все сложное: огонь, вода, воздух, земля»
Демокрит
2.
ПЛАН ЛЕКЦИИI. Модели строения атома
II. Современная теория строения
атома. Квантовая механика
III. Квантовые числа
IV. Порядок заполнения электронами
энергетических уровней
V. Периодический закон
Д. И. Менделеева
2
3.
Основные открытияна рубеже XIX – XX веков
⚫ Атомные спектры (1859 г., Кирхгофф)
⚫ Фотоэффект (1888 г., Столетов)
⚫ Катодные лучи (1859 г., Перрен)
⚫ Рентгеновское излучение (1895 г.)
⚫ Радиоактивность урана (1896 г. Бекккерель)
⚫ Открытие электрона (1897 г., Томсон)
⚫ Открытие ядра атома (1911 г., Резерфорд)
3
4.
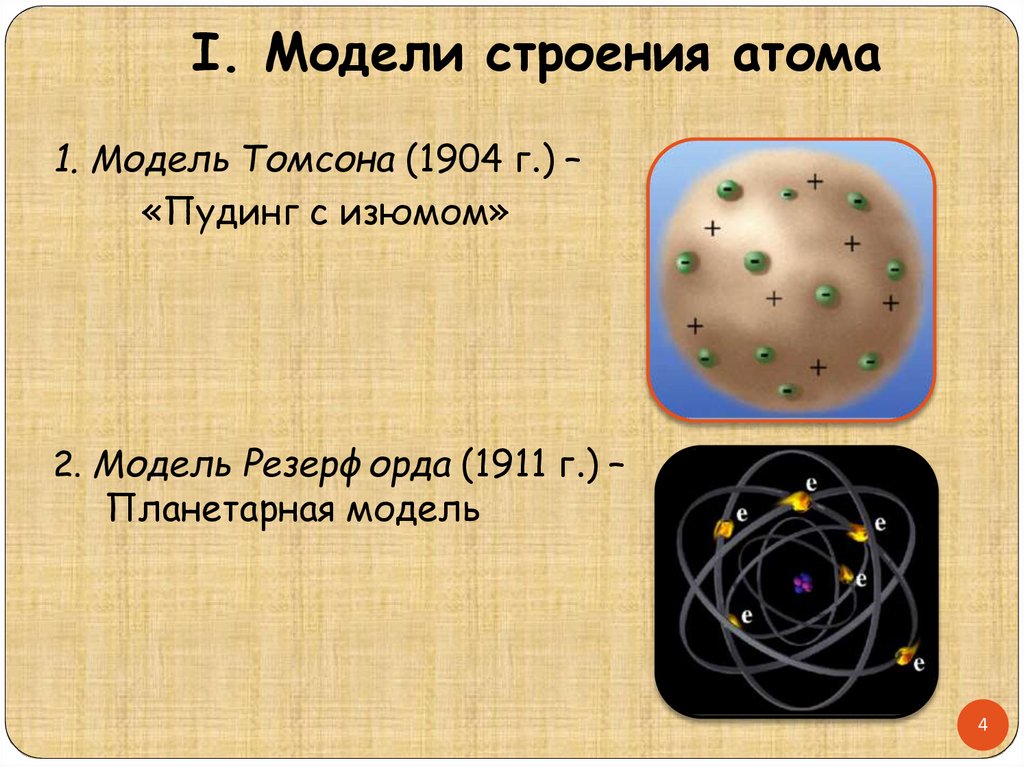
I. Модели строения атома1. Модель Томсона (1904 г.) –
«Пудинг с изюмом»
2. Модель Резерфорда (1911 г.) –
Планетарная модель
4
5.
Положения модели Резерфорда:1. Атомы химических элементов имеют сложное
внутреннее строение.
2.В центре
атома
заряженное ядро.
находится
положительно
3.Весь положительный заряд и почти вся масса
атома сосредоточена в ядре атома.
4.Вокруг ядра по замкнутым орбиталям движутся
электроны. Их число равно заряду ядра.
5
6.
3. Модель Бора (1913 г.)е
Постулаты Бора
1. Электроны способны находиться в атоме
только
на
некоторых
разрешенных
–
стационарных орбитах. По этим орбитам
электроны движутся, не испуская и не поглощая
энергии.
2. Излучение или поглощение порции энергии
происходит при переходе электрона с одной
стационарной орбиты на другую.
6
7.
Состав атомаАтом хлора
Атомный номер (Z)
Ядро атома состоит из протонов (p) и
нейтронов (n);
P = Z;
n = A – Z;
⚫ Заряд ядра атома определяется числом
Относительная атомная
масса элемента (А)
протонов.
⚫ Масса
ядра
определяется
протонов и нейтронов.
суммой
Число электронов (е) = Р.
Для атома хлора:
Число протонов – положительных частиц = 17;
Число нейтронов – незаряженных частиц = 35 – 17 = 18;
Число электронов – отрицательных частиц = 17
6
8.
II. Современная теория строения атома.Квантовая (волновая) механика
Квантовая механика - наука, изучающая
закономерности движения микрообъектов.
Двойственная природа электрона
(корпускулярно-волновой дуализм)
Гипотеза Луи де Бройля (1924 г.):
Любая частица массой (m) и движущаяся со
скоростью (v), является одновременно волной с
длиной (λ).
(h – постоянная планка
λ = h/mv
= 6.626·10-34 Дж·с)
Чем больше скорость движущегося
выражены его волновые свойства.
объекта,
тем
больше
8
9.
Принцип неопределённостиГейзенберга
Невозможно одновременно точно определить
координаты и импульс движущегося в атоме
электрона в силу его волновых свойств.
х· рх ≥ h/2π
х – неопределённость положения электрона
рх - неопределённость импульса электрона
Таким образом, в данный момент времени можно
говорить лишь о вероятности нахождения электрона в
различных точках околоядерного пространства.
9
10.
Уравнение ШрёдингераВ 1926 г. Эрвин Шрёдингер предложил волновое
уравнение, учитывающее двойственную природу
электрона.
h – постоянная Планка;
m – масса электрона; Е – его полная энергия;
U – потенциальная энергия; x, y, z – координаты;
ψ – волновая функция электрона (амплитуда его волнового
движения в трёхмерном пространстве);
10
11.
Уравнение Шрёдингераψ2 –
вероятность
нахождения
определяет
электрона в точке пространства возле ядра.
Физический
смысл
имеет
величина
ψ2dV – определяет вероятность нахождения
электрона в элементарном объёме.
Атомная орбиталь (АО) – область атомного
пространства, в котором движется электрон.
11
12.
III. Квантовые числаСледствием решения уравнения Шрёдингера
являются квантовые числа, характеризующие
поведение электрона в атоме.
1) Главное квантовое число (n) – определяет
энергетический уровень электрона, удаленность
уровня от ядра, размер электронного облака.
- Принимает целые значения (n = 1, 2, 3 ... ∞) и
соответствует номеру периода.
12
13.
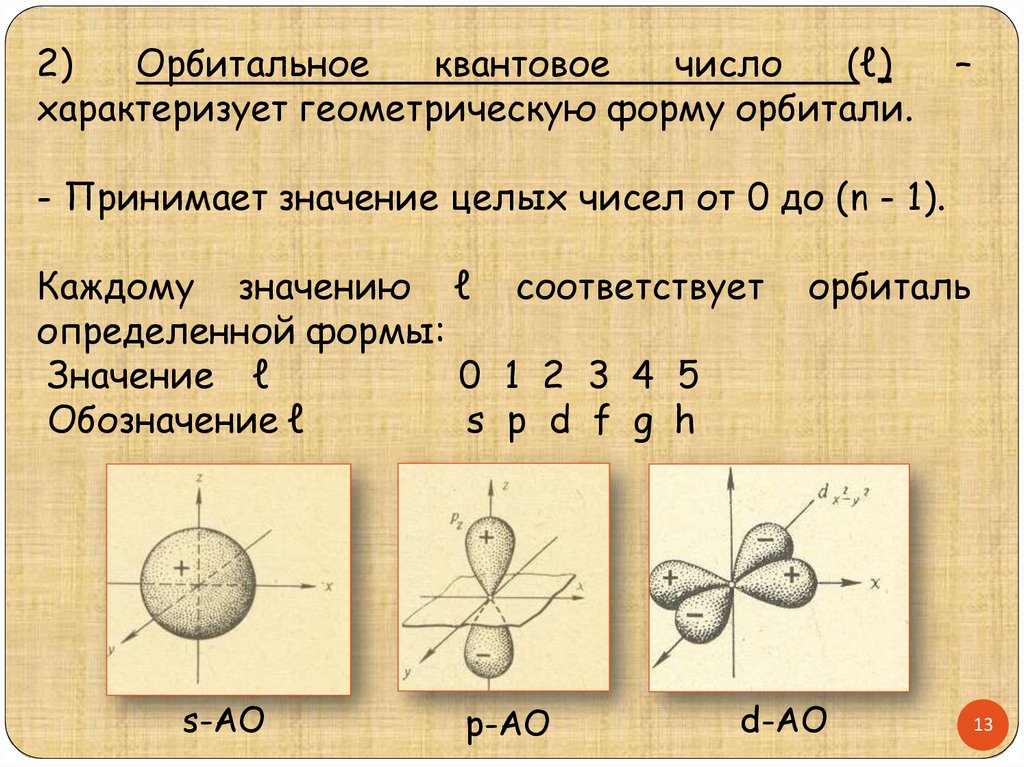
2)Орбитальное
квантовое
число
(ℓ)
характеризует геометрическую форму орбитали.
–
- Принимает значение целых чисел от 0 до (n - 1).
Каждому значению ℓ соответствует
определенной формы:
Значение ℓ
0 1 2 3 4 5
s p d f g h
Обозначение ℓ
s-АО
р-АО
орбиталь
d-АО
13
14.
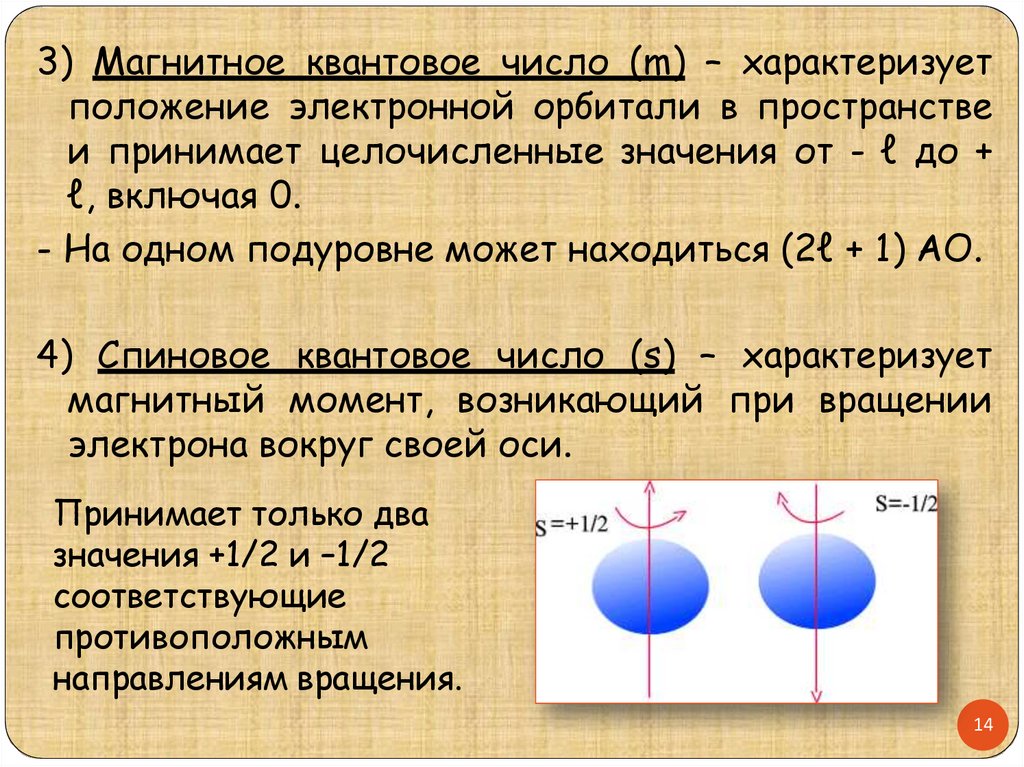
3) Магнитное квантовое число (m) – характеризуетположение электронной орбитали в пространстве
и принимает целочисленные значения от - ℓ до +
ℓ, включая 0.
- На одном подуровне может находиться (2ℓ + 1) АО.
4) Спиновое квантовое число (s) – характеризует
магнитный момент, возникающий при вращении
электрона вокруг своей оси.
Принимает только два
значения +1/2 и –1/2
соответствующие
противоположным
направлениям вращения.
14
15.
IV. Порядок заполнения электронамиэнергетических уровней
1) Принцип наименьшей энергии
Электрон в атоме в первую очередь стремиться
занять энергетический уровень и подуровень с
наименьшей энергией.
15
16.
- Правила Клечковского1
правило: Электрон в атоме в первую очередь занимает
подуровень с наименьшим значением (n + ℓ).
Например, можно было бы предположить, что 3d-подуровень
по энергии ниже, чем 4s. Однако согласно правилу
Клечковского, энергия 4s-состояния меньше, чем 3d:
для 4s сумма (n + l) = 4 + 0 = 4, а для 3d (n + l) = 3 + 2 = 5
правило: При равенстве суммы (n + ℓ) двух
подуровней,
электрон
занимает
подуровень
с
наименьшим значением ℓ.
Ряд заполнения электронов атомных орбиталей:
1S<2S<2P<3S<3P<4S~3d<4P<5S~4d<5P<6S~4f~5d<6P<7S~5f
~6d<7p
2
16
17.
2) Принцип запрета ПаулиВ атоме не может быть двух электронов с
одинаковым набором четырёх квантовых
чисел.
Следствие: на одной атомной орбитали может
располагаться не более двух электронов с
антипараллельными спинами.
Максимальная ёмкость:
⚫ атомной орбитали – 2 электрона
⚫ подуровня – 2(2 ℓ + 1) электронов
⚫ уровня – 2n2 электронов
17
18.
3) Правило ГундаПри прочих равных условиях суммарный спин
системы должен быть максимальным.
18
19.
Электронные формулы1)Полная электронная формула отражает порядок
заполнения электронами атомных орбиталей, уровней
и подуровней.
Пример: 32Ge 1s22s22p63s23p64s23d104p2
2)Электронная
формула
валентных
электронов
записывается только для электронов, которые могут
принимать участие в образовании химических связей:
Пример: 32Ge …4s24p2
19
20.
Задание 1:Запишите полную электронную формулу для
химического элемента с порядковым номером
17, укажите формулу валентных электронов.
20
21.
Решение:1S22S22P63S23P5
3S23P5
- формула валентных электронов,
участвуют в образовании химической связи
которые
21
22.
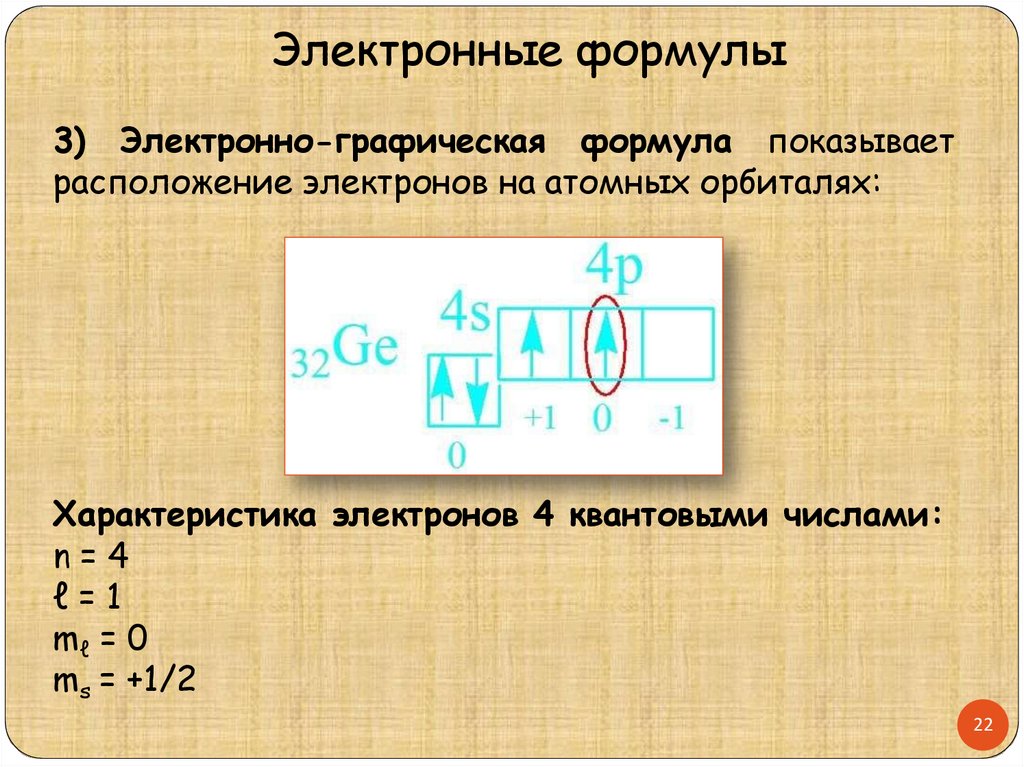
Электронные формулы3) Электронно-графическая формула показывает
расположение электронов на атомных орбиталях:
Характеристика электронов 4 квантовыми числами:
n=4
ℓ=1
mℓ = 0
ms = +1/2
22
23.
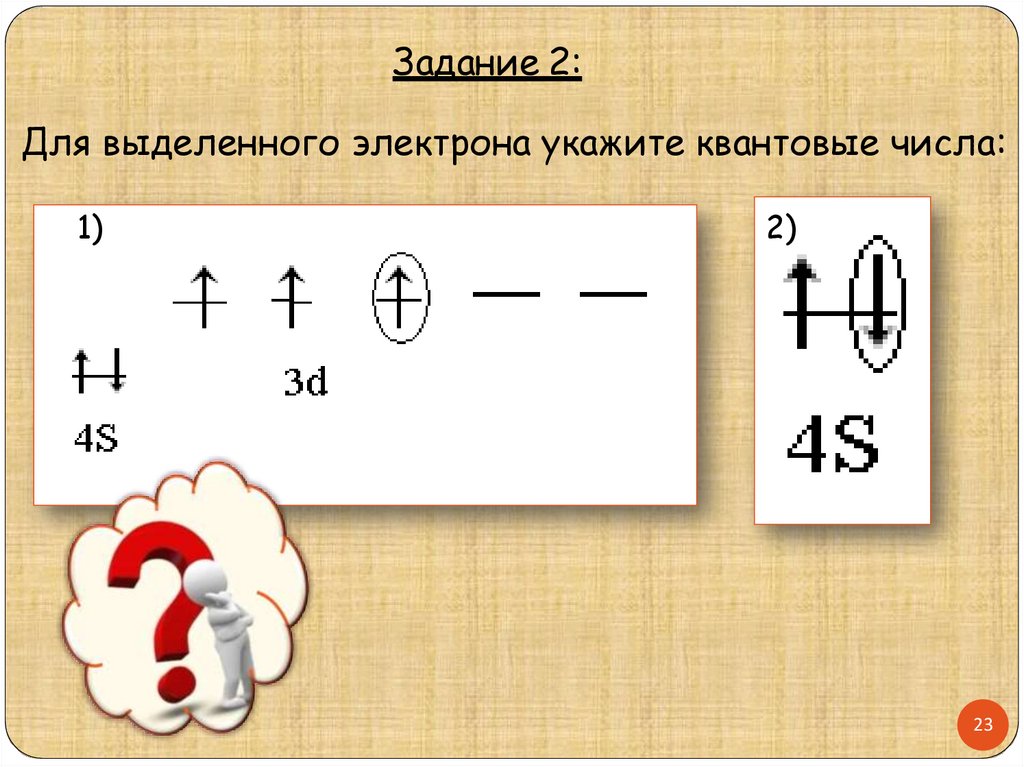
Задание 2:Для выделенного электрона укажите квантовые числа:
1)
2)
23
24.
Явление «провала» электроновАтом стремится перейти в состояние с устойчивой
электронной конфигурацией.
Повышенной устойчивостью обладают полностью
или
наполовину
заполненные
электронами
подуровни: р3 и р6, d5 и d10, f7 и f14
Пример:
элемент
Cr
Pd
Cu
каноническая формула
4s23d4
5s24d8
4s23d9
реальная формула
4s13d5
5s04d10
4s13d10
24
25.
V. Периодический законД.И. Менделеева
Периодический закон открыт Д.И.Менделеевым в 1869 г.
Свойства простых веществ, а так же образованных
ими соединений находятся в периодической
зависимости от заряда ядра атома.
Периодическая сист ема элемент ов – графическое
(табличное) выражение периодического закона.
25
26.
Короткопериодная периодическая система26
27.
Периодическая таблицаСодержит 7 периодов и 8 групп
Группы - вертикальные столбцы элементов с
одинаковым числом валентных электронов, равным
номеру группы.
- Различают главные (А) и побочные (Б) подгруппы.
-В главных подгруппах сверху вниз металлические
свойства усиливаются, а неметаллические ослабевают.
Периоды - горизонтальные ряды элементов с
одинаковым максимальным значением главного
квантового числа валентных электронов.
-Номер
периода обозначает число энергетических
уровней в атоме элемента.
27
28.
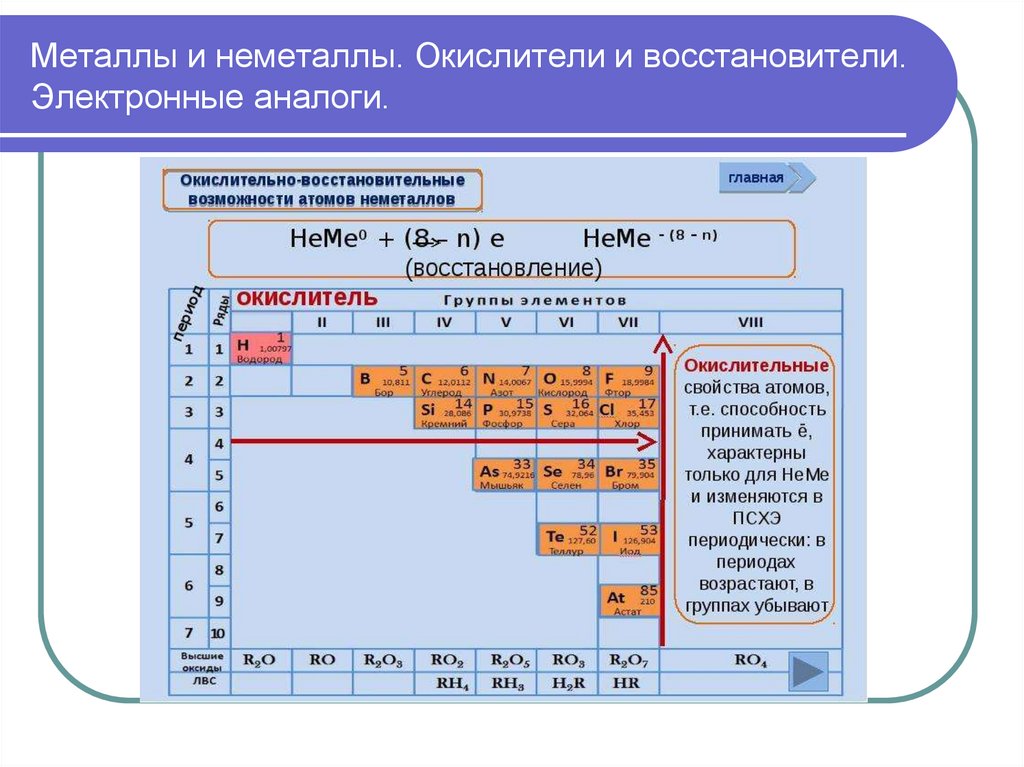
Металлы и неметаллы. Окислители и восстановители.Электронные аналоги.
29.
Периодичность изменениясвойств элементов
Энергия ионизации (Iион) – энергия, необходимая
для отрыва электрона от атома.
-Возрастает по периоду, уменьшается по группе.
Сродство к электрону (Еср) – энергия, которая
выделяется (или затрачивается) при присоединении
электрона к нейтральному атому.
-Уменьшается по периоду, увеличивается по группе.
Электроотрицательность (ЭО) – способность атома
притягивать к себе электроны.
- Возрастает по периоду, уменьшается по группе.
29
30.
Спасибо завнимание!
























 chemistry
chemistry








