Similar presentations:
Гидролиз. Открытый урок
1. Открытый урок «ГИДРОЛИЗ» Гарибян Дж.А.учитель химии ГБОУ690
ОТКРЫТЫЙ УРОК «ГИДРОЛИЗ»ГАРИБЯН ДЖ.А.УЧИТЕЛЬ ХИМИИ ГБОУ690
2.
3. Гидролиз -
ГИДРОЛИЗ от греч. «гидро» - вода,«лизис» - разложение.
4. повторим
ПОВТОРИМ5. Электролиты и неэлектролиты . Электролитическая диссоциация
ЭЛЕКТРОЛИТЫ И НЕЭЛЕКТРОЛИТЫ .ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ
Электролитами
называют вещества,
растворы или
расплавы которых
проводят
электрический ток
Н/р: соли, кислоты,
основания.
Неэлектролитами
называются
вещества, растворы
или расплавы
которых не проводят
электрический ток.
Н/р: многие
органические
вещества (сахар,
эфир, бензол и др.)
6.
ЦЕЛЬ: ИЗУЧИТЬ ИЗМЕНЕНИЕОКРАСКИ РАСТВОРОВ
ИНДИКАТОРОВ В СОЛЯХ
ЗАДАЧА:СПРОГНОЗИРОВАТЬ
СРЕДУ РАСТВОРОВ солей
7.
Процесс распада электролитов на ионыв водном растворе или расплаве
называется электролитической
диссоциацией.
Положительные ионы называют
катионами,
отрицательные ионы – анионами.
К катионам относятся: ион водорода и ионы металлов, катионы
основных солей.
К анионам относятся: гидроксид-ион, ионы кислотных
остатков, анионы кислых солей.
8. Диссоциация кислот:
ДИССОЦИАЦИЯ КИСЛОТ:H2SO4 → 2H+ + SO42HCl → H+ + ClHNO3 → H+ + NO32-
9. Диссоциация оснований:
ДИССОЦИАЦИЯ ОСНОВАНИЙ:NaOH → Na+ + OH-;
Ca(OH)2 → Ca2+ + 2OH-;
10.
Диссоциация растворимыхсолей:
NaCI
Na+
+ CI-
AI2(SO4)3 2AI3+ + 3SO42-
11. Диссоциация воды:
ДИССОЦИАЦИЯ ВОДЫ:Н2О →
+
Н
+ ОН
–
12.
В чистой воде соотношение ионовводорода и гидроксид-ионов равное:
Н+ = ОНсреда нейтральная;
При добавлении кислоты равновесие
нарушается:
Н+ > ОНсреда раствора кислая;
При добавлении щёлочи:
Н+ < ОНсреда раствора щелочная.
13. ГИПОТЕЗА 1.если фенолфталеин меняет свою окраску , то перед нами – щелочь 2. Если фенолфталеин не меняет свокй окраски , то
ГИПОТЕЗА1.ЕСЛИ ФЕНОЛФТАЛЕИН МЕНЯЕТ
СВОЮ ОКРАСКУ , ТО ПЕРЕД НАМИ –
ЩЕЛОЧЬ
2. ЕСЛИ ФЕНОЛФТАЛЕИН НЕ МЕНЯЕТ
СВОКЙ ОКРАСКИ , ТО ПЕРЕД НАМИ
СОЛЬ.ФЕНОЛФТАЛЕИН МЕНЯЕТ СВОЮ
ОКРАСКУ В ПРИБОРКЕ С ВЕЩЕСТВОМ, ТО
ПЕРЕД НАМИ ЩЕЛ
2. ЕСЛИ ФЕНОЛФТАЛЕИН НЕ МЕНЯЕТ СВОЙ
ЦВЕТ, ТО ПЕРЕД НАМИ СОЛЬ.
14.
ЦЕЛЬ: ИЗУЧИТЬ ИЗМЕНЕНИЕОКРАСКИ РАСТВОРОВ
ИНДИКАТОРОВ В СОЛЯХ
ЗАДАЧА:СПРОГНОЗИРОВАТЬ
СРЕДУ РАСТВОРОВ
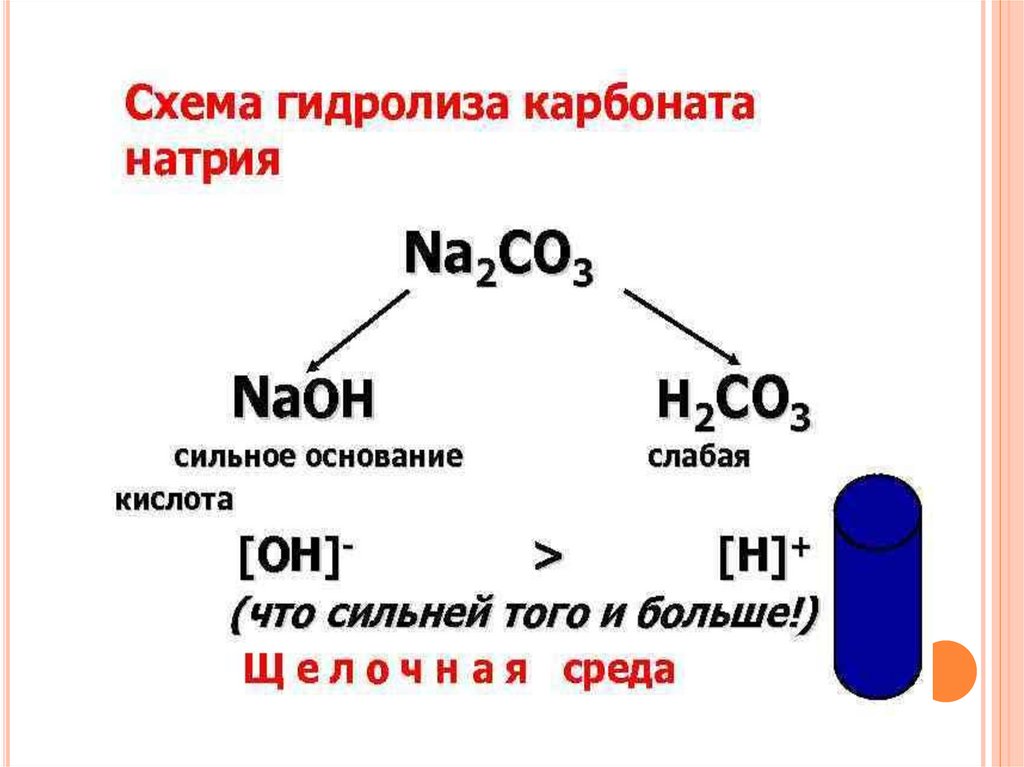
15. 4 типа солей:
4 ТИПА СОЛЕЙ:соль, образованная
сильной кислотой и слабым основанием
(ALCl3);
сильным основанием и слабой кислотой
(Na2 СО3);
сильным основанием и сильной кислотой
(NaCl);
слабым основанием и слабой кислотой
(СН3СООNH4).
16.
Соль, образованная сильной кислотой ислабым основанием.
AlCl3
→ Al3+ + 3Cl-;
Н2О → Н+ + ОН –;
Al3+ + Н+ + ОН – →: AlОН2+ + Н+;
в растворе в свободном виде
остался ион водорода (Н+), значит
среда раствора кислая;
полное уравнение гидролиза:
AlCl3 + Н2О → AlОНCl2 + НCl;
17.
18. Гидролиз солей –
ГИДРОЛИЗ СОЛЕЙ –реакция обмена между солью и водой,
приводящая к образованию слабого
электролита.
19.
Соль, образованная сильным основанием исильной кислотой
NaСl + Н2О ↔
Na Сl ↔ Na + + Сl¯
Н2О ↔ OH¯ + H +
Все ионы остаются в растворе – гидролиз не
происходит. Среда нейтральная, рН =7, т.к.
концентрации катионов водорода и
гидроксид - анионов в растворе равны, как в
чистой воде.
20.
Соль, образованная слабым основанием исильной кислотой.
CH3COONH4
CH3COO- +NH4+
Н2О → Н+ + ОН –;
CH3COO- + NH4+ +H2O
CH3COOH +
NH3*H2O
CH3COONH4 + H2O
CH3COOH + NH3*H2O
В этом случае гидролизу подвергаются как
катион,
так
анион,
образуются
слабые
электролиты, и среда раствора оказывается
близкой к нейтральной или слабокислая, или
слабощелочная,
что
зависит
от
констант
диссоциации кислоты и основания.
21.
Индикаторы –вещества,которые меняют
окраску в зависимости
от среды.
22.
23.
24. ОТВЕТЫ: ПЕРВЫЙ ВАРИАНТ 1-А,2-Б,3-А
ВТОРОЙ ВАРИАНТ1-Б, 2-В,3-Б























 chemistry
chemistry








