Similar presentations:
Трансплантационная иммунология. Особенности трансплантационного иммунитета. Иммунология репродукции
1.
Дисциплина: «Иммунология»Тема лекции: «Трансплантационная иммунология.
Особенности трансплантационного иммунитета.
Иммунология репродукции»
Лектор: зав. кафедрой гистологии и
биологии д-р биол. наук Ирина Юрьевна Саяпина
Благовещенск 2024
2.
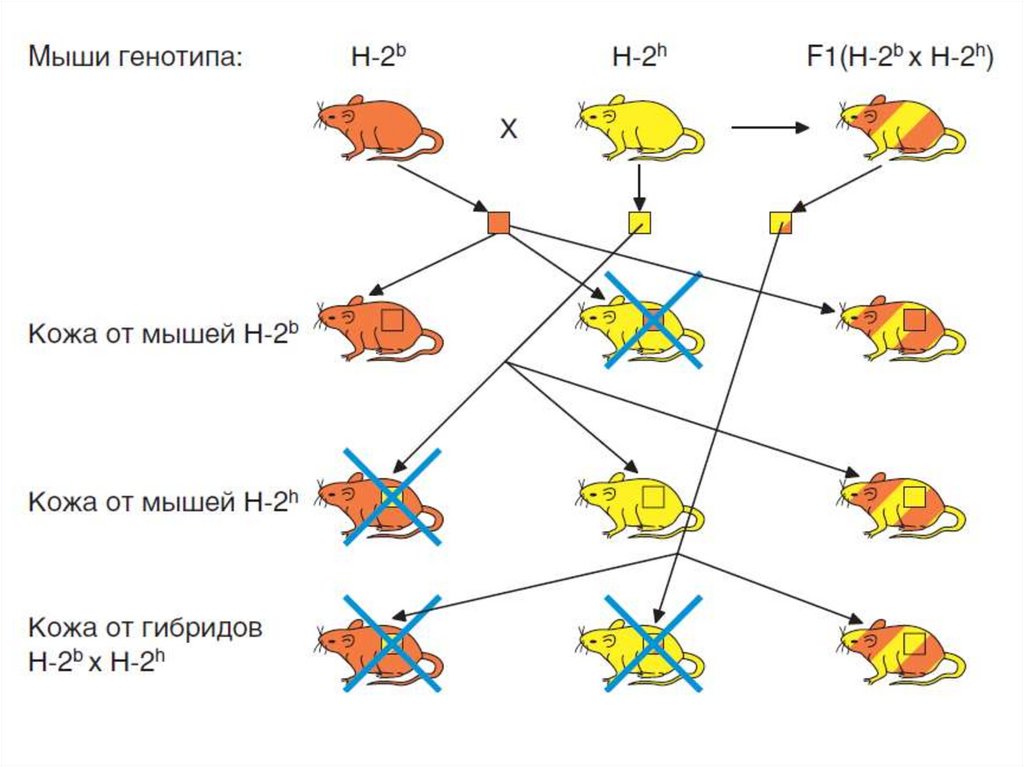
Генетика гистосовместимостиУспехи в изучении генетических основ тканевой несовместимости и
трансплантационного иммунитета были связаны с использованием
генетически чистых линий мышей. Они следовали за достижениями в
изучении локусов гистосовместимости MHC.
Дж. Снелл (G.D. Snell) — один из сооткрывателей MHC — сформулировал
генетические законы трансплантации:
• сингенные трансплантаты (внутри генетически чистой линии или
между однояйцовыми близнецами) приживаются;
• аллогенные трансплантаты (между мышами разных линий) отторгаются;
• трансплантаты от мышей родительской линии приживаются у гибридов первого поколения (F1) с мышами другой линии;
• трансплантаты от гибридов F1 приживаются у F1, но отторгаются у
мышей обеих родительских линий.
Законы трансплантации соответствуют представлениям о кодоминантной природе наследования антигенов гистосовместимости, т.е. экспрессии
обоих аллелей в условиях гетерозиготности.
3.
4.
Молекулы главного комплекса гистосовместимости,или трансплантационные антигены
(МНС – mayor histocompatibility complex)
Изучение молекул МНС как явления биологического мира –
П. Догерти, П. Горер, Дж. Снелл, Р. Цинкернагель.
Дж. Доссе, 1952 год – открытие HLA-антигенов (Human
Leukocyte Antigen).
Геномная организация главного комплекса
гистосовместимости:
У человека расположен на 6-й хромосоме, представляет
собой отрезок ДНК из 50 генов. Особенность данного
комплекса: полигенность и полиморфизм, гены наследуются
по типу кодоминирования.
Гены МНС делятся на три группы: МНС I, МНС II, МНС III.
Гены HLA I класса представлены тремя локусами: HLA-А, HLAВ и HLA-С;
Гены HLA I класса представлены тремя локусами: HLA-DP,
HLA-DQ и HLA-DR;
5.
Трансплантация – пересадка тканей илиорганов, изъятых хирургическим путем из
организма донора, в организм реципиента.
Виды трансплантации:
1. Аутотрансплантация – пересадка собственных тканей;
2. Аллотрансплантация – пересадка тканей и органов
между генетически чужеродными организмами в
пределах одного биологического вида;
3. Ксенотрансплантация – пересадка тканей и органов
между организмами разных биологических видов;
4. Изотрансплантация – пересадка между генетически
идентичными (сингенными) организмами (сингенная
трансплантация).
6.
Трансплантационный иммунитет напримере пересадки кожи
• После пересадки аллогенного кожного лоскута
происходит его васкуляризация (3-4 сутки)
• На 5-7 сутки появляются признаки иммунной
реакции организма (инфильтрация
мононуклеарами, развитие иммунного
воспаления).
• На 10-12 сутки трансплантат отторгается
(тромбоз сосудов, некроз ткани, отделение
трансплантата от кожи реципиента).
7.
• Трансплантационная реакция сочетает в себедве формы клеточного иммунитета:
цитотоксическую и воспалительную;
• CD8+ Т-лимфоциты – основные эффекторные
клетки, отвечающие за уничтожение клеток
аллотрансплантата;
• CD4+ Т-клетки (Th 1 типа) – обеспечивают
развитие иммунного воспаления, которое
приводит к гибели пересаженной ткани через
нарушение трофики и активацию механизмов
врожденного иммунитета.
8.
Афферентное звено трансплантационного иммунитета(индуктивная фаза ИО). Распознавание АГ
Активация CD8+ Т-клеток
реципиента
Активация
CD4+ Т-клеток
реципиента
9.
Две формы клеточногоиммунитета:
1. цитотоксическая (справа)
2. воспалительная (слева);
10.
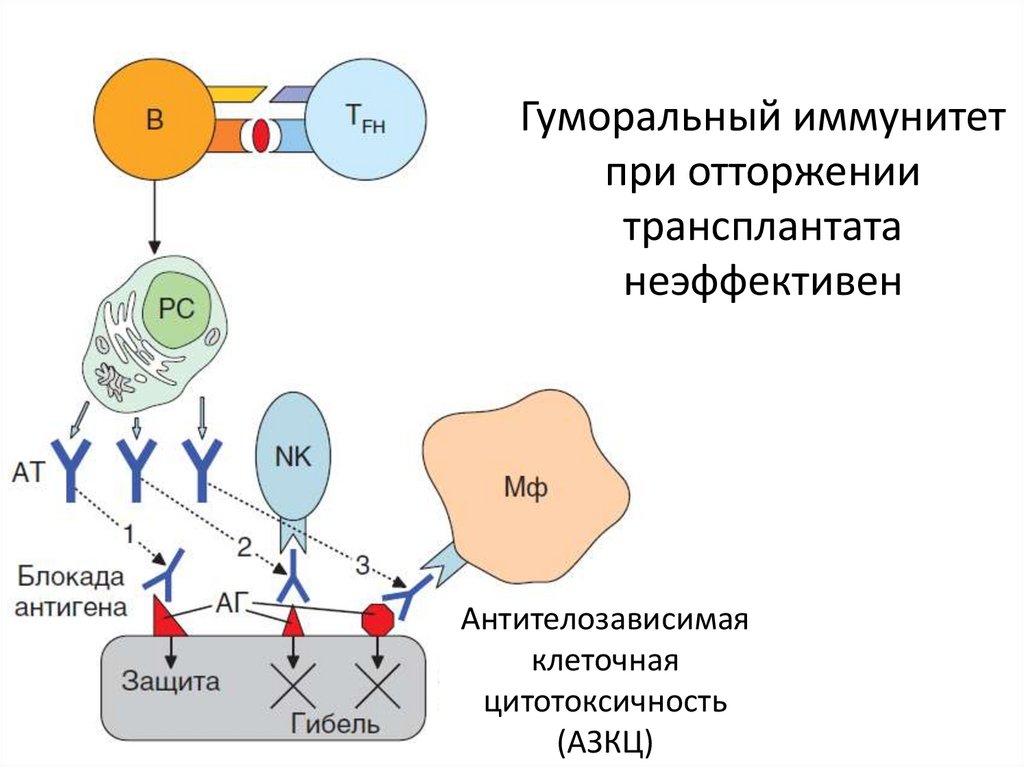
Гуморальный иммунитетпри отторжении
трансплантата
неэффективен
Антителозависимая
клеточная
цитотоксичность
(АЗКЦ)
11.
Иммунологическая реакция РХПТ(реакция «хозяин против трасплантата»)
• Развивается при пересадке
неиммунокомпетентных тканей и органов
(почки, печень, сердце, поджелудочная
железа и др.)
Иммунологическая реакция РТПХ
(реакция «трасплантат против хозяина»)
• Развивается при пересадке
иммунокомпетентных тканей и органов
(костный мозг, суспензия лимфоцитов,
пуповинная кровь, СК периферической крови);
• Развивается параллельно с реакцией РХПТ.
12.
В тактике клинической трансплантациирешающую роль имеют 2 процедуры:
1. Подбор донора (HLA-типирование).
2. Иммуносупрессивная терапия.
Подбор пары донор-реципиент.
HLA-типирование
1. Определение степени гистосовместимости (HLAфенотип донора и реципиента);
2. Определение предсуществующих антител у
реципиента к HLA-антигенам донора;
3. Определение антиэндотелиальных антител у
реципиента к антигенам донора;
4. Оценка исходного иммунного статуса
реципиента.
13.
Антигены HLA-локусов – DRB, DQA,DQB, DPА, DPB, A, B, C.
• Решающее значение имеет совместимость по
генам HLA II класса, особенно антигены DRB.
• По генам HLA I класса наибольшее значение
имеют антигены HLA-В.
• При полной совместимости по этим генам и
адекватной иммуносупрессивной терапии
приживление донорской почки в течение года
составляет 90%.
14.
Препараты дляиммуносупрессивной терапии
• Циклические антибиотики (циклоспорин А)
• Такролимус (програф, FK 506)
Предотвращают активацию Т-лимфоцитов
(блокируют передачу сигнала активации в ядро),
выработку ИЛ-2, пролиферацию клона Тлимфоцитов.
• Рапамицин – блокирует передачу сигнала
активации от рецептора ИЛ-2, предотвращает
активацию и пролиферацию Т-лимфоцитов.
15.
Клинические формы отторжениятрансплантата:
• Сверхострое – на операционном столе или в
первые часы после операции;
• Острое – в течение первого месяца после
трансплантации;
• Хроническое (отсроченное) – через несколько
лет после трансплантации.
16.
Сверхострое отторжение• Развивается при наличии у реципиента
предсуществующих антител к АГ донора.
• После подключения донорского органа к
кровотоку антитела попадают в кровеносные
сосуды трансплантата, образуют иммунные
комплексы с АГ эндотелиальных клеток.
• Активируется система комплемента по
классическому пути, эндотелий повреждается.
• Активируется свертывающая система крови,
развивается тромбоз сосудов трансплантата и
фибриноидный некроз.
17.
Острое отторжение• Основные причины – неадекватная
иммуносупрессивная терапия или ошибка HLAфенотипирования.
• Иммунологические механизмы – клеточноопосредованный иммунитет (цитотоксический
вариант + воспалительный вариант).
Рассмотрены в начале лекции
• Профилактика острого отторжения –
иммунологический мониторинг реципиента.
Проводится тонкоигольная аспирационная
биопсия ткани трансплантата с последующим
иммунологическим и морфологическим
исследованием.
18.
Препараты для лечения кризаотторжения
• Антилимфоцитарная сыворотка;
• ОКТ-3 – моноклональные антитела к молекуле
CD3 (входит в комплекс TCR, передает сигнал
активации в цитоплазму Т-клетки).
• Глюкокортикостероиды (высокие дозы).
19.
Хроническое (отсроченное)отторжение
• Причина – недостаточная иммуносупрессивная терапия.
• Вызывается антителами (гуморальный иммунитет), в
меньшей степени клеточные механизмы.
• Клинически проявляется как медленное, но
прогрессирующее снижение функции донорского органа.
• Гистологическая картина – воспалительное повреждение
кровеносных сосудов, интерстициальный фиброз
(замещение паренхимы органа на соединительную ткань).
• Повышение дозы иммуносупрессоров неэффективно и
бесполезно.
• Спасти трансплантат невозможно. Необходимо удаление
поврежденного донорского органа с последующей
заменой на новый орган.
20.
Иммунология репродукции.Иммунологические взаимоотношения в
системе мать-плод
• Плод – на 50% является генетически
чужеродным организмом, так как
экспрессирует отцовские HLA-антигены.
• Плод – неотторгаемый аллотрансплантат, 9
месяцев развивающийся в утробе матери.
• С первых часов после зачатия и до начала
родов поддерживается состояние
иммунологической толерантности иммунной
системы матери по отношению к отцовским
HLA-антигенам.
21.
Механизмы, обеспечивающиеиммунологическую толерантность
организма матери
• Оплодотворение – низкий уровень экспрессии
HLA-антигенов на сперматозоидах,
иммуносупрессивное действие семенной плазмы,
присутствие в слизистой оболочке женских
половых путей Т-супрессоров и макрофагов с
генетически сниженной активностью.
• Зигота защищена оболочкой оплодотворения
(модифицированная zona pellucida), которая не
экспрессирует HLA-антигены.
• Дробление – весь период дробления до начала
имплантации, бластоциста покрыта оболочкой
оплодотворения.
22.
Механизмы локальной иммуносупрессии всоставе фетоплацентарного комплекса
• Симпластотрофобласт (покрывает ворсины хориона) – не
экспрессирует HLA-антигены I и II класса, а только
«неклассические» HLA-G антигены (разновидность HLA-Ib
антигенов), они являются лигандами для ингибирующих
рецепторов NK-клеток;
• Лимфоциты плаценты синтезируют
противовоспалительные цитокины (ИЛ-10, ТФР-β);
• ИЛ-10 подавляет функциональную активность
макрофагов, ТФР-β угнетает NK-клетки;
• В организме беременной синтезируются IgG,
экранирующие антигены трофобласта;
• α-фетопротеин (вырабатывается в желточном мешке и
печени плода) – обладает иммуносупрессорным
действием
23.
• Плацентарные гормоны (прогестерон,хорионический гонадотропин) – поддерживают
состояние локальной иммуносупрессии.
24.
Иммунологическое бесплодие• Может быть вызвано следующими
иммунологическими факторами:
• Вторичным иммунодефицитом у женщины;
• Наличием антиспермальных антител (у любого
из партнеров);
• Повышенной степенью гистосовместимости
между партнерами.






















 medicine
medicine








