Similar presentations:
Химическая кинетика и катализ
1.
Химическая кинетика и катализ1
2.
ХИМИЧЕСКАЯ КИНЕТИКА И КАТАЛИЗ (ХК)Это раздел химии, изучающий скорость и
механизм протекания хим. р-ций, а также факторы,
влияющие на скорость р-ции.
Методы ХК широко используют в биологии и
медицине. Скорость биохим. р-ций сбалансирована и за счет этого обеспечивается стационарное
состояние организма.
Изменение скорости какой-либо реакции в
организме может быть как причиной патологии,
так и защитной функцией организма.
2
3.
Механизмы реакцийДве реакции имеющие одинаковое
значение энергии Гиббса ∆G могут идти с
различной скоростью.
Это объясняется различием
механизмов протекающих реакций.
Последовательность и характер
стадий химических реакций называется
механизмом.
3
4.
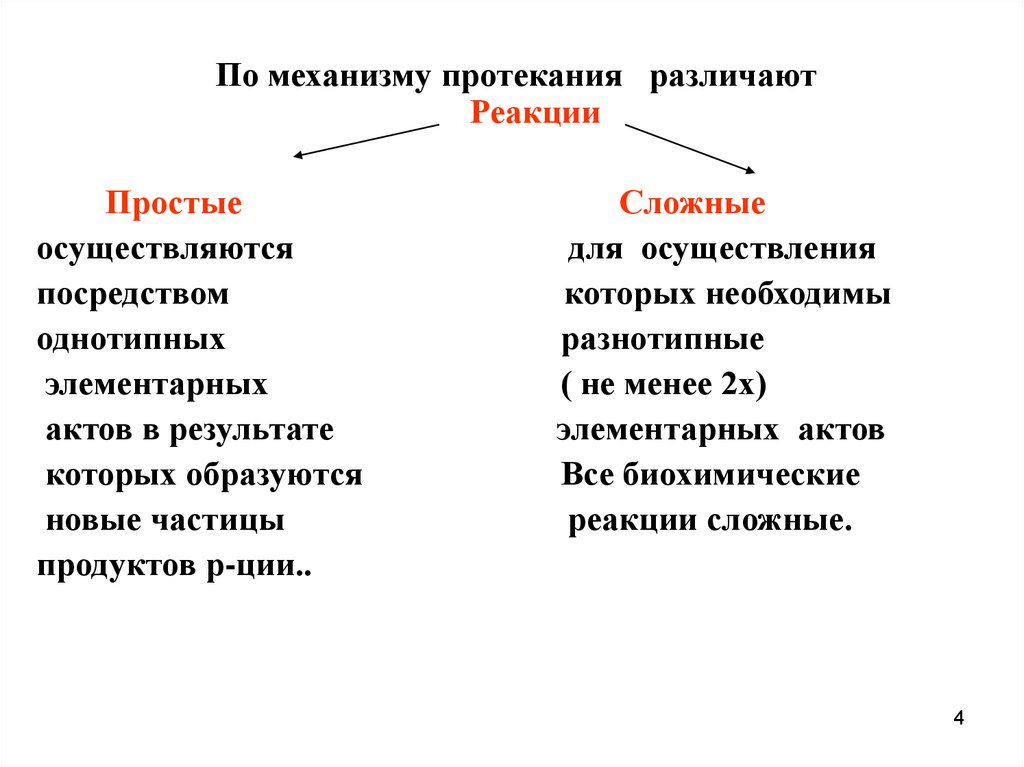
По механизму протекания различаютРеакции
Простые
осуществляются
посредством
однотипных
элементарных
актов в результате
которых образуются
новые частицы
продуктов р-ции..
Сложные
для осуществления
которых необходимы
разнотипные
( не менее 2х)
элементарных актов
Все биохимические
реакции сложные.
4
5.
Различают следующие сложные реакции:1) параллельные- когда из одних и тех же исходных веществ
образуются различные продукты, т.е. идущие
одновременно в нескольких направлениях:
КСlO3
KCl + О2.
KCl + КСlO4
2) последовательные - идущие через несколько различных
промежуточных стадий
(А В С D ...)
Крахмал→декстрины→мальтоза→глюкоза ...→CO2+H2O
фотосинтез, биологическое окисление глюкозы
5
6.
Цепные реакции также можно отнести кпоследовательным реакциям. В них стадии
превращения исходных соединений в продукты
многократно повторяются:
Cl2 Cl Cl
Cl H 2 HCl H
H Cl2 HCl Cl
Николай Семенов
(15.04.1896 -25.09.1986)
Cl Cl Cl2 (обрыв цепи)
H H H 2 (обрыв цепи)
6
7.
Сопряженные - такие реакции, которые не могутпротекать одна без другой, или когда протекание
одной реакции вызывает начало другой :
АТФ+ H2O → АДФ + H3PO4
∆G°= -29,2 кДж/моль
экзэргоническая
глюкоза + H3PO4→ глюкоза H2PO4 + H2O
∆G°= +13,1 кДж/моль
эндэргоническая
Суммарная р-ция
глюкоза +АТФ→глюкоза-6-фосфат+АДФ+16,1 кДж/моль
7
8.
Классификация химических реакций1. Мономолекулярные
- в элементарном акте
взаимодействия участвует одна молекула
I2 = 2I
CI2 = 2CI
2. Бимолекулярные - в элементарном акте
взаимодействия встречаются две молекулы.
Важно, чтобы столкновение произошло теми
частями молекулы, которые способны
реагировать– стерический
(пространственный) фактор!
8
9.
Тримолекулярные –2NO O2 2NO 2
Одновременная встреча в элементарном акте
трех молекул случается довольно редко.
Реально реакции протекают через две и большее
число промежуточных стадий моно- или
бимолекулярных реакций.
9
10.
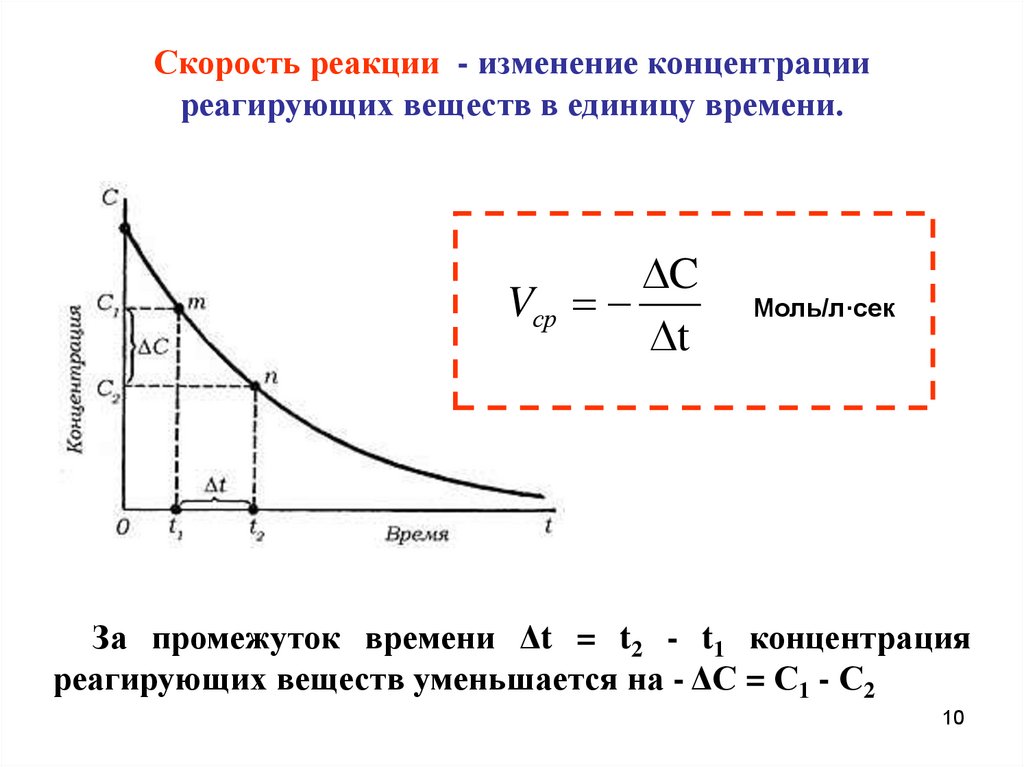
Скорость реакции - изменение концентрацииреагирующих веществ в единицу времени.
C
Vср
t
Моль/л·сек
За промежуток времени Δt = t2 - t1 концентрация
реагирующих веществ уменьшается на - ΔС = С1 - С2
10
11.
Средняя скорость неотражает истинной
скорости в каждый
момент времени.
dC
v
dt
Моль/л·сек
Истинную скорость реакции в данный
момент принято выражать отношением
бесконечно малого изменения концентрации
dC к бесконечно малому отрезку времени dt,
в течение которого произошло изменение
концентрации:
11
12.
Любая хим. р-ция это столкновениямолекул в результате которых одни связи
разрываются, а другие образуются.
Со временем концентрация исходных в-в
(С1)уменьшается, а концентрация продуктов
(С2)увеличивается.
Скорость химического процесса тоже со
временем будет уменьшаться , поскольку
концентрация исходных в-в постепенно
уменьшается и число столкновений молекул в
единицу времени соответственно падает.
12
13.
Закон Гульберга и Вааге( закон действующих масс )
отражает взаимосвязь между скоростью
реакции и концентрацией реагирующих
веществ в случае , когда взаимодействуют два
и более веществ. Если дана реакция:
aA + bB → cC + dD это химическое уравнение
ʋ =k[A]a ·[B]b
это кинетическое уравнение
13
14.
Скорость гомогенной реакции припостоянной температуре
пропорциональна произведению
молярных концентраций
реагирующих веществ, возведенных в
степени, численно равные их
стехиометрическим коэффициентам.
ГУЛЬДБЕРГ
Като Максимилиан
(2.08.1836-14.1.1902)
aA bB dD fF
v k[A] [B]
a
b
Здесь A,B,D, F - жидкости или газы
14
15.
k - константа скорости химическойреакции численно равна скорости
химической реакции при концентрациях
всех реагирующих веществ, равных
1 моль/л [A]=[B] или их произведения
равны 1, тогда ʋ = k·1a ·1b
k зависит от:
природы реагирующих веществ и
температуры
15
16.
Иногда скорость реакции рассчитанная поуравнению Гульберга и Вааге не совпадает с
экспериментально полученными данными .
Это может говорить о не одинаковом влиянии
концентрации каждого вещества на скорость
реакции.
Поэтому было введено понятие порядок
реакции (n) - который показывает как на
самом деле скорость реакции зависит от
концентрации, каждого из
реагирующих
веществ: ʋ = k[A]p ·[B]q
тогда порядок реакции n = p + q .
16
17.
Здесь p и q экспериментально полученныевеличины не всегда совпадающие со
стехиометрическими коэффициентами.
n- может принимать значения : 0, 1, 2, 3,
может быть дробным.
Если количество одного из реагентов в ходе
реакции остается неизменным, то говорят о
псевдомолекулярных реакциях. В них
молекулярность не совпадает с порядком
реакции.
Порядок псевдомолекулярной реакции всегда
ниже чем молекулярность.
17
18. Например :
C12H22O11+ H2O → C6H12O6 + C6H12O6Бимолек-я р-ция
глюкоза
фруктоза
ʋ =k [H2O]·[C12H22O11]
здесь k [H2O] = const
k1
ʋ = k1 [C12H22O11]
n=1
Это биомолекулярная реакция первого порядка
18
19.
Различаютреакции
гомогенные когда все исходные в-ва
находятся в одной фазе
2H2O(г)+O2(г)= 2H2O(ж)
Эта р-ция идет в газовой
фазе (среде).
Скорость в них зависит от
числа соударений между
частицами реагирующих
в-в в единицу времени
в единице объема.
гетерогенныекогда все исходные в-ва
находятся в разных фазах:
СO2(г)+NaOH(ж)= NaHCO3
Скорость в них зависит
от числа соударений на
единицу поверхности
раздела фаз.
Чем сильнее измельчены
реагирующие вещества ,
тем больше поверхность
раздела и тем больше
скорость реакции.
19
20.
ФАКТОРЫ, ВЛИЯЮЩИЕ НА СКОРОСТЬГОМОГЕННЫХ РЕАКЦИЙ
1. Природа химических соединений
Реакции между молекулами протекают обычно
медленно, между ионами и радикалами –
быстро:
AgNO3( р р ) KCl( р р ) быстро
AgCl KNO3
быстро
H Cl очень
HCl
20
21.
2. Влияние концентрации реагентов:чем выше концентрация, тем больше
скорость реакции, это связано с увеличением
числа эффективных соударений молекул.
v k[A] [B]
a
b
3. Изменение давления: влияет только на
газовые реакции, а влияние аналогично
влиянию концентрации реагирующих
веществ.
21
22.
4.Зависимость скорости реакции от температуры
определяет правило Вант -Гоффа :
при повышении температуры на каждые 10° скорость
гомогенной реакции увеличивается в 2-4 раза.
Объясняется это тем, что у частиц увеличивается
кинетическая энергия, а значит и сила их соударения.
Соответственно легче разрушаются связи в
молекулах исходных веществ и образуются новые
химические связи с образованием продуктов.
22
23.
Закон Вант-ГоффаЯкоб Вант-Гофф
(30.08.1852 –
1.03.1911)
v 2 v1 ·
T2 T1
10
Здесь -температурный коэффициент
скорости реакции, который показывает во
сколько раз увеличивается скорость данной
реакции при увеличении температуры на 10
градусов.
Для биохимических реакций = 7-9.
23
24.
Однако даже при повышении температурыне все молекулы вступают во взаимодействие, а
только те, которые обладают повышенным
запасом кинетической энергии. Это необходимо
для расшатывания тех связей,
которые
перестраиваются в ходе реакции
энергии,
достаточным
Химическая реакция напоминает
туристский поход, маршрут которого проложен
чрез вершину горы. Только сильные могут
преодолеть вершину.
24
25.
Та минимальная дополнительнаяэнергия, которую нужно сообщить
молекуле, чтобы она стала активной
называется энергией активации (Еа).
Это по существу, тот энергетический
барьер, который есть у каждого взаимодействия и который должны преодолеть
молекулы реагирующих веществ.
25
26.
Уравнение Аррениусаотражает влияниетемпературы на энергию
активации Еа
Сванте Аррениус
(19.02.1859-2.10.1927)
K Аo ·e
E
RT
E — энергия активацииК— константа скорости реакции при обычных
условиях
Ао—число эффективных столкновений за 1 сек в
единице объема
26
27.
5. Влияние катализаторов на скорость реакции.Катализ это процесс идущий с участием
катализатора. Если при этом скорость реакции
увеличивается, то катализ называют положительным,
если же скорость реакции уменьшается , то
отрицательным.
Катализаторы действуют только на т/динамически
возможные реакции (∆G<0)
Все каталитические процессы - сложные
многостадийные:
A + B → AB
реагенты продукт
К - катализатор
1 стадия A + K→ AK
2 стадия AK + B →AB +K (выброс катализатора )
27
28.
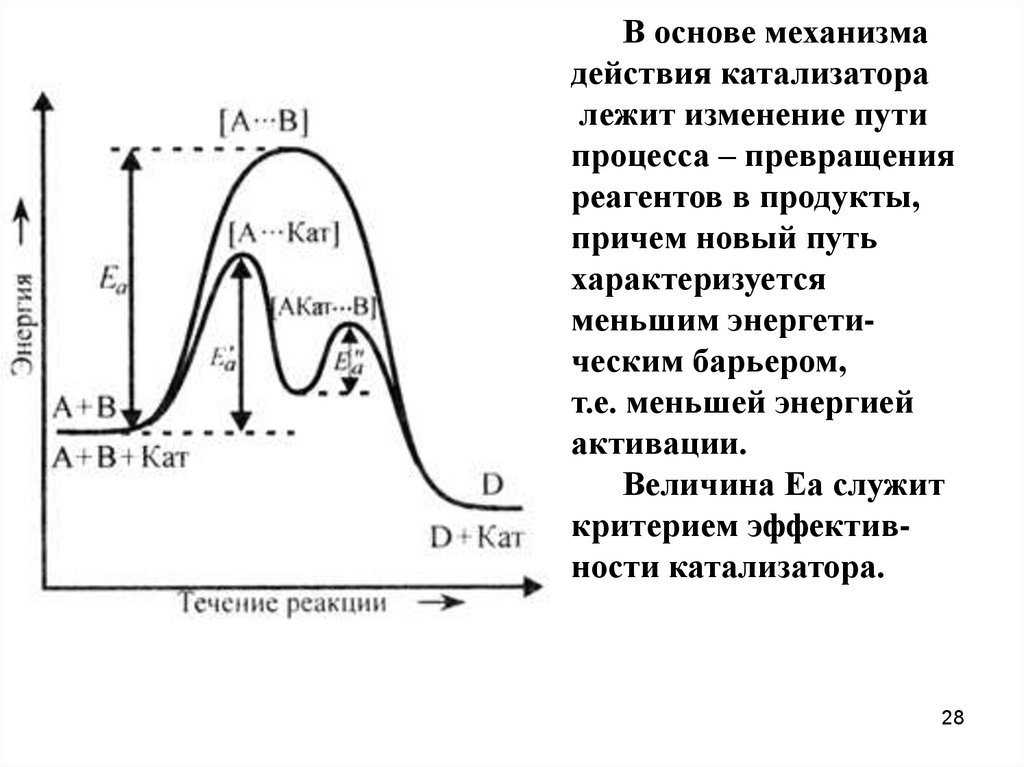
В основе механизмадействия катализатора
лежит изменение пути
процесса – превращения
реагентов в продукты,
причем новый путь
характеризуется
меньшим энергетическим барьером,
т.е. меньшей энергией
активации.
Величина Еа служит
критерием эффективности катализатора.
28
29.
Большинство реакций в организме идут сучастием биокатализаторов - ферментов.
Отличительной чертой ферментов является их
высокая эффективность, если обычный
катализатор ускоряет реакцию в 1000 раз, то
фермент - в 1 млн. раз. Они обладают высокой
специфичностью, т.е. избирательностью,
например:
1. 1 субстрат - 1фермент: фосфатаза расщепляет
эфиры фосфорной кислоты.
2. пептидаза- пищеварительный фермент
расщепляет пептидные связи в любых белках.
29
30.
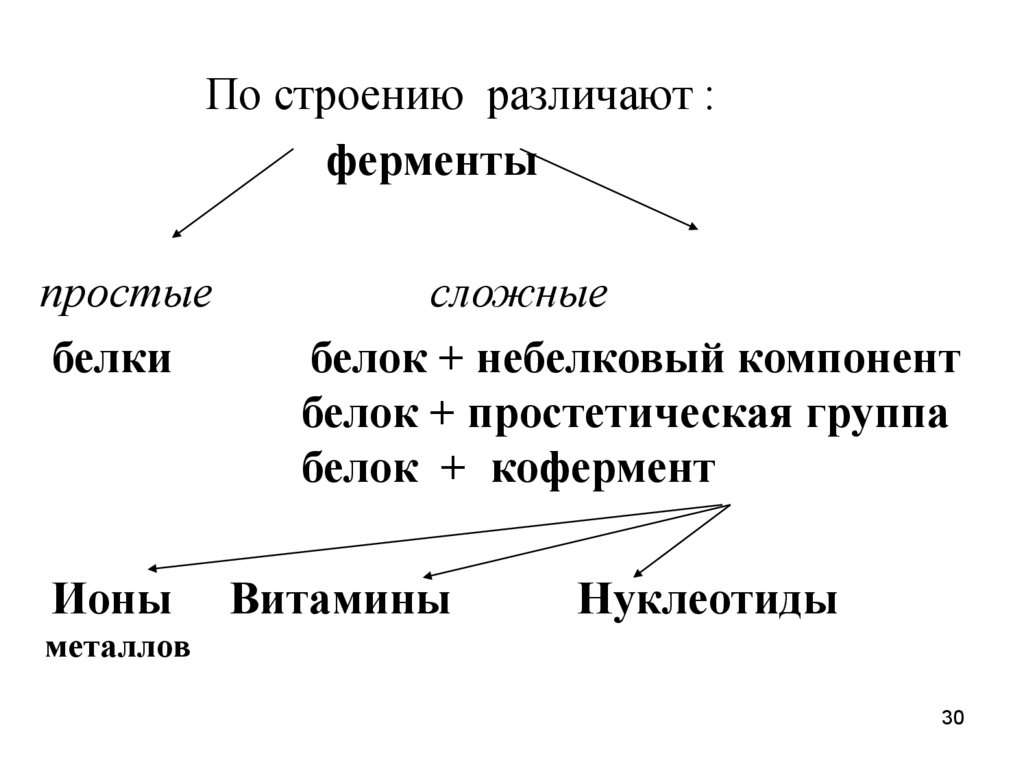
По строению различают :ферменты
простые
белки
Ионы
сложные
белок + небелковый компонент
белок + простетическая группа
белок + кофермент
Витамины
Нуклеотиды
металлов
30
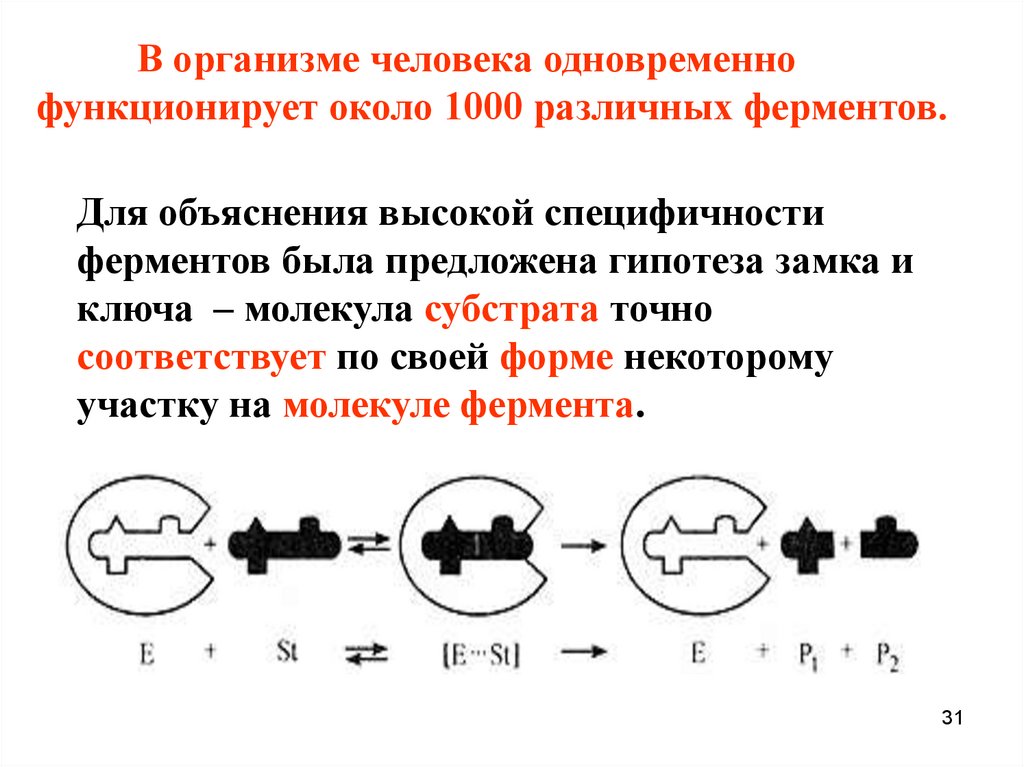
31.
В организме человека одновременнофункционирует около 1000 различных ферментов.
Для объяснения высокой специфичности
ферментов была предложена гипотеза замка и
ключа – молекула субстрата точно
соответствует по своей форме некоторому
участку на молекуле фермента.
31
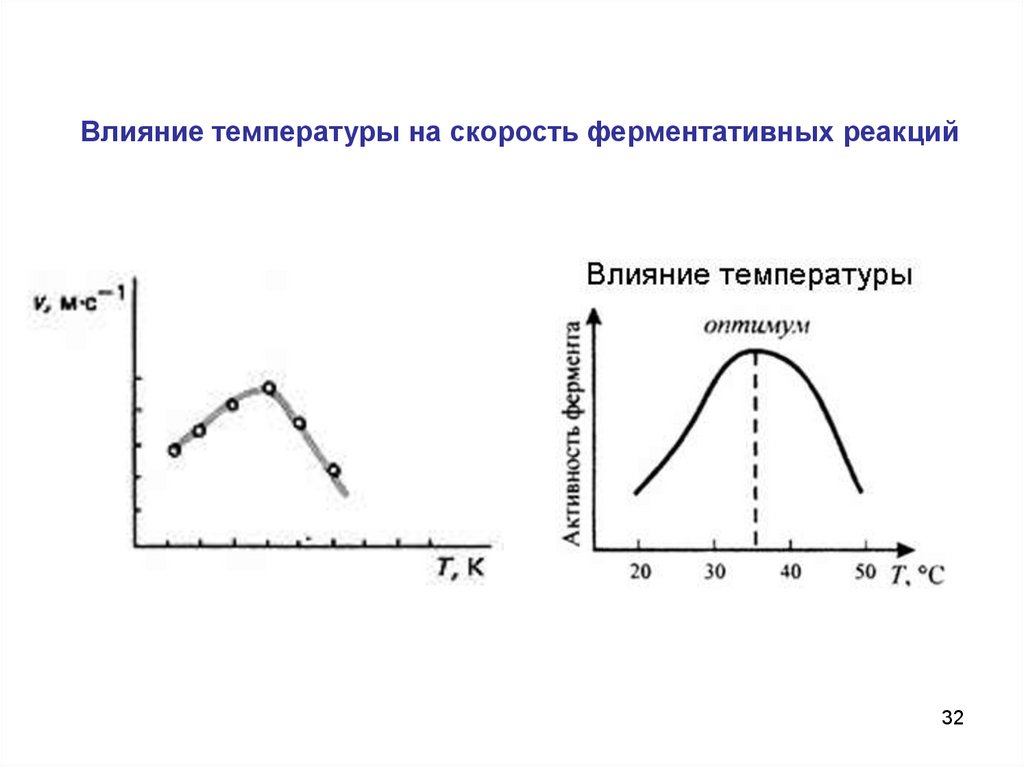
32.
Влияние температуры на скорость ферментативных реакций32
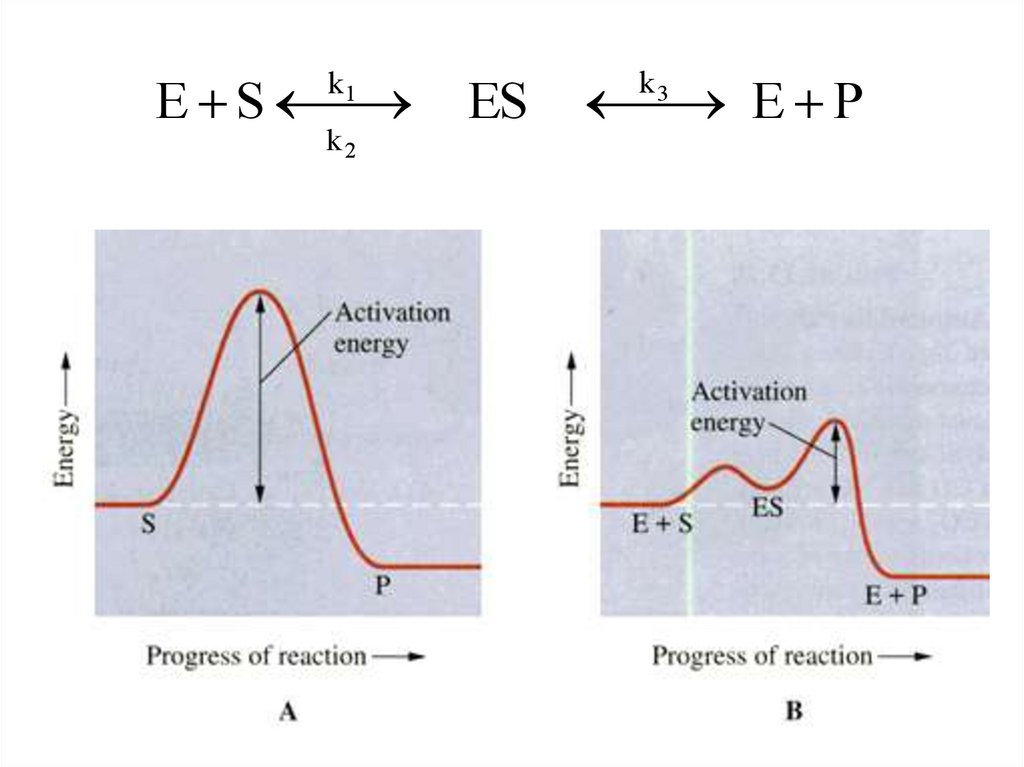
33.
E Sk1
k2
ES
E P
k3
33
34.
Значение ферментативных реакцийПрименение ферментов в качестве
лекарственных препаратов;
Разработка методов диагностики с
помощью ферментов;
Производство антибиотиков;
Синтез окси- и аминокислот, гидролиз
крахмала;
Изготовление кисломолочных продуктов,
сыра, алкогольных напитков, обработка
фруктов и овощей;
34
35.
Химическое равновесиеНекоторые химические реакции
прекращаются до того как исходные вещества
прореагируют полностью.
При этом в системе одновременно
присутствуют как не прореагировавшие
исходные вещества, так и образовавшиеся
продукты.
Если условия проведения реакции остаются
неизменными, то химический состав таких систем
не изменяется а такие реакции называют
обратимыми.
35
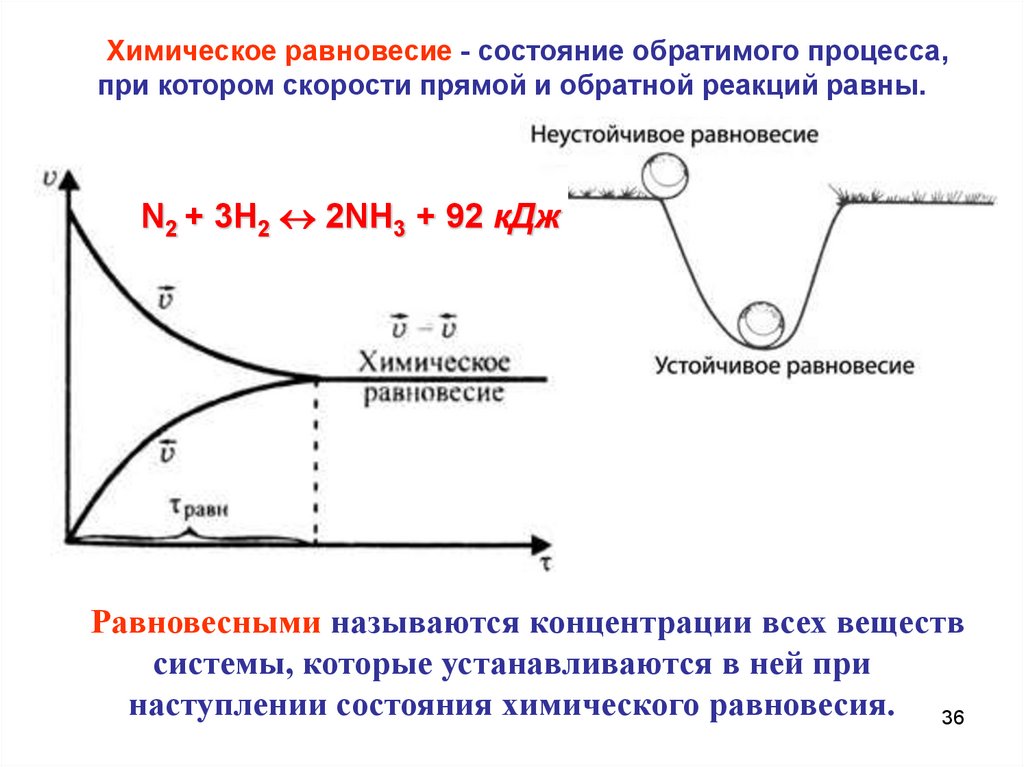
36.
Химическое равновесие - состояние обратимого процесса,при котором скорости прямой и обратной реакций равны.
N2 + 3H2 2NH3 + 92 кДж
Равновесными называются концентрации всех веществ
системы, которые устанавливаются в ней при
наступлении состояния химического равновесия. 36
37.
Для таких реакций ∆G≈0 и приизменении концентрации возможно
изменение знака с -∆G на +∆G или
наоборот. Многие биохимические
реакции обратимы. Это позволяет
организму экономно расходовать
энергию.
37
38.
Реакциинеобратимые, идущие:
1. с выпадением осадка
AgNO3+NaCl→ AgCl↓+NaNO3
Ag+ + Cl¯→ AgCl↓
2. с выделением газа
Na2CO3 + 2HCl → 2NaCl + H2O + CO2↑
CO32- + 2H+ → H2O + CO2↑
3. с образованием слабого электролита
NaOH + HCl → NaCl + H2O
OH¯ + H+→ H2O
38
39.
обратимые по направлению химическиереакции, которые при данных внешних
условиях могут самопроизвольно
протекать в двух направлениях:
N2+3H2 ⇆ 2NH3
H2O + CO2 ⇆ H2CO3
CH3COOH ⇆ CH3COO¯ + H+
39
40.
В общем виде обратимые реакции можно записатьaA bB dD fF
В состоянии химического равновесия:
v v
a b d f
k[A] [B] k[D] [F]
ГУЛЬДБЕРГ
Като Максимилиан
(2.08.1836-14.1.1902)
d
f
k [D] [ F]
K равн
a
b
k [A ] [B]
40
41.
Константа химического равновесия отношение произведения равновесныхконцентраций конечных продуктов
к произведению равновесных концентраций
исходных веществ, возведенных в степени,
равные их стехиометрическим коэффициентам.
Константа химического равновесия это
отношение констант скоростей прямой и
обратной реакций
Кравн зависит от:
а) природы вещества
б) температуры
41
42.
Анри Ле-Шателье(8.10.1850 – 17.09.1936)
Принцип Ле Шателье
Если на систему, находящуюся
в состоянии равновесия
оказывается внешнее
воздействие, равновесие
смещается в таком направлении,
чтобы свести к минимуму
влияние этого воздействия.
42
43.
"Изменение любого фактора, могущего влиять насостояние химического равновесия системы веществ,
вызывает
в
ней
реакцию,
стремящуюся
противодействовать производимому изменению.
Повышение температуры вызывает реакцию,
стремящуюся понизить температуру, то есть идущую
с поглощением тепла.
Увеличение
давления
вызывает
реакцию,
стремящуюся вызвать уменьшение давления, то есть
сопровождающуюся уменьшением объема...".
43
44.
Применение принципа Ле Шателье1. При увеличении концентрации
исходных веществ увеличивается
скорость прямой реакции ʋ1 и равновесие
смещается вправо. Например, для
реакции
N2 + 3H2 2NH3 + 92 кдж
При уменьшении концентрации исходных
веществ уменьшится ʋ1, но тогда увеличится
ʋ2 и равновесие сместится влево.
44
45.
2. Влияние изменения температуры насмещение равновесия
N2 + 3H2 2NH3 + 92 кдж
1. При понижении температуры равновесие
смещается в сторону экзотермической
реакции. Здесь – вправо.
2. При повышении температуры равновесие
смещается в сторону эндотермической
реакции. Здесь – влево.
45
46.
3. Влияние изменения давления.N2+3H2 2NH3
Влияние давления для равновесных газовых
реакций определяется числом моль до и после
реакции :
1. при увеличении давления равновесие
сместится в сторону уменьшения объемов или
числа частиц, здесь вправо;
2) при уменьшении давления - в сторону
увеличения объемов или числа частиц, здесь влево
3) при
n кон=n исх - не влияет
46






































 chemistry
chemistry








