Similar presentations:
Анализ лекарственных средств неорганических соединений натрия: натрия гидрокарбонат, натрия тиосульфат, натрия нитрит
1.
Министерство Здравоохранения Республики КазахстанЮжно-Казахстанская государственная фармацевтическая академия
Кафедра фармацевтической и токсикологической химии
АНАЛИЗ ЛЕКАРСТВЕННЫХ СРЕДСТВ
НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙ НАТРИЯ:
НАТРИЯ ГИДРОКАРБОНАТ, НАТРИЯ ТИОСУЛЬФАТ,
НАТРИЯ НИТРИТ, НАТРИЯ ТЕТРАБОРАТ.
ТРЕБОВАНИЯ К КАЧЕСТВУ И МЕТОДЫ АНАЛИЗА.
Выполнила: Онлас Айзада
Группа: 305 Б-ФР
Принял: Махова Е.Г.
Шымкент 2017
2.
ПЛАНI
II
III
IV
• Введение. Химический элемент натрий и его
важнейшие соединения.
• АНАЛИЗ ЛЕКАРСТВЕННЫХ СРЕДСТВ НЕОРГАНИЧЕСКИХ
СОЕДИНЕНИЙ НАТРИЯ: НАТРИЯ ГИДРОКАРБОНАТ, НАТРИЯ
ТИОСУЛЬФАТ, НАТРИЯ НИТРИТ, НАТРИЯ ТЕТРАБОРАТ.
ТРЕБОВАНИЯ К КАЧЕСТВУ И МЕТОДЫ АНАЛИЗА.
• Заключение.
• Список использованной литературы.
3.
ВВЕДЕНИЕНа́трий — элемент главной подгруппы
первой группы, третьего периода
периодической системы химических
элементов Д. И. Менделеева, с атомным
номером 11.
Промышленное получение натрия по способу Девилля,
распространённое в 19 веке. AC — железная трубка со
смесью соды, угля и мела; B — холодильник Донни и
Мареска; R — приёмник с нефтью.
4.
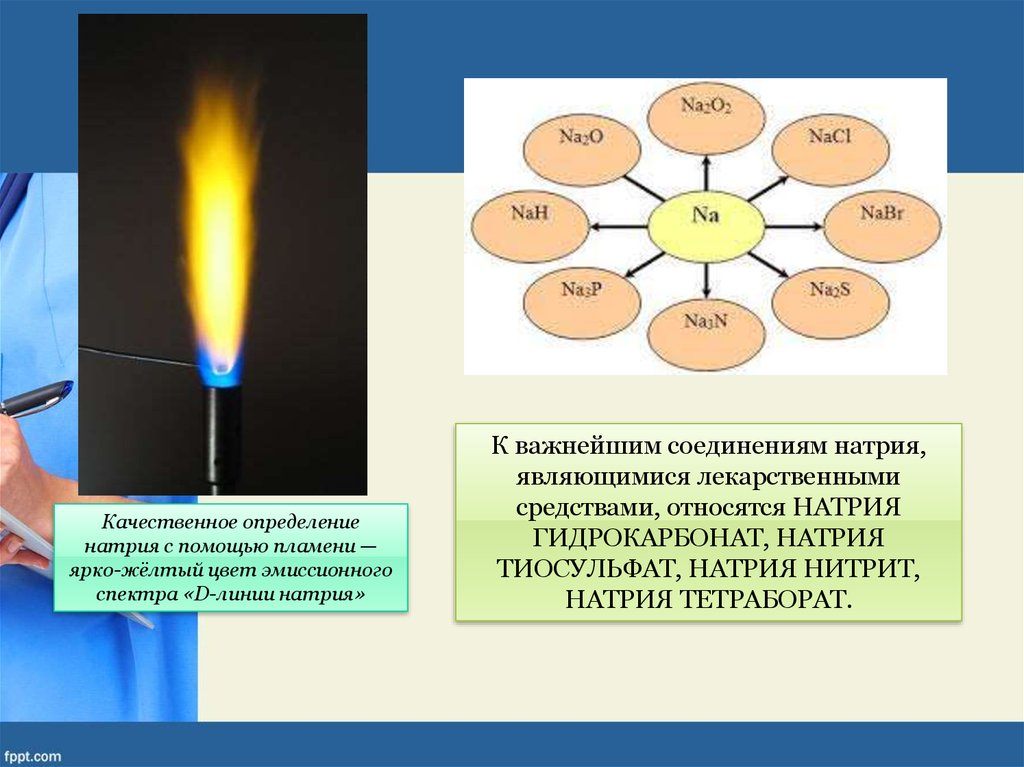
Качественное определениенатрия с помощью пламени —
ярко-жёлтый цвет эмиссионного
спектра «D-линии натрия»
К важнейшим соединениям натрия,
являющимися лекарственными
средствами, относятся НАТРИЯ
ГИДРОКАРБОНАТ, НАТРИЯ
ТИОСУЛЬФАТ, НАТРИЯ НИТРИТ,
НАТРИЯ ТЕТРАБОРАТ.
5. Натрия гидрокарбонат Natrii hydrocarbonas
Белый кристаллический порошок без запаха,солено-щелочного вкуса. Устойчив в сухом
воздухе, медленно разлагается во
влажном. Легко растворим в воде (1:2) с
образованием щелочных растворов (pH
5% раствора 8,1), практически
нерастворим в этаноле. Молекулярная
масса 84,01.
Na2CO3 * 10H2O + CO2
2NaHCO3 +
9H2O
6. Испытание на чистоту
• Согласно ГФ в ЛСнедопустимыми примесями
являются соли аммония, тяжелые
металлы, а допустимыми —
хлориды, сульфаты, железо,
калий, мышьяк, содержание
которых оценивается с
использованием эталонов.
7. Определение подлинности
Сухая реакция(Фармакопейная)
Соль Натрия, внесённая в
бесцветное пламя спиртовки,
окрашивает пламя в жёлтый
цвет.
8.
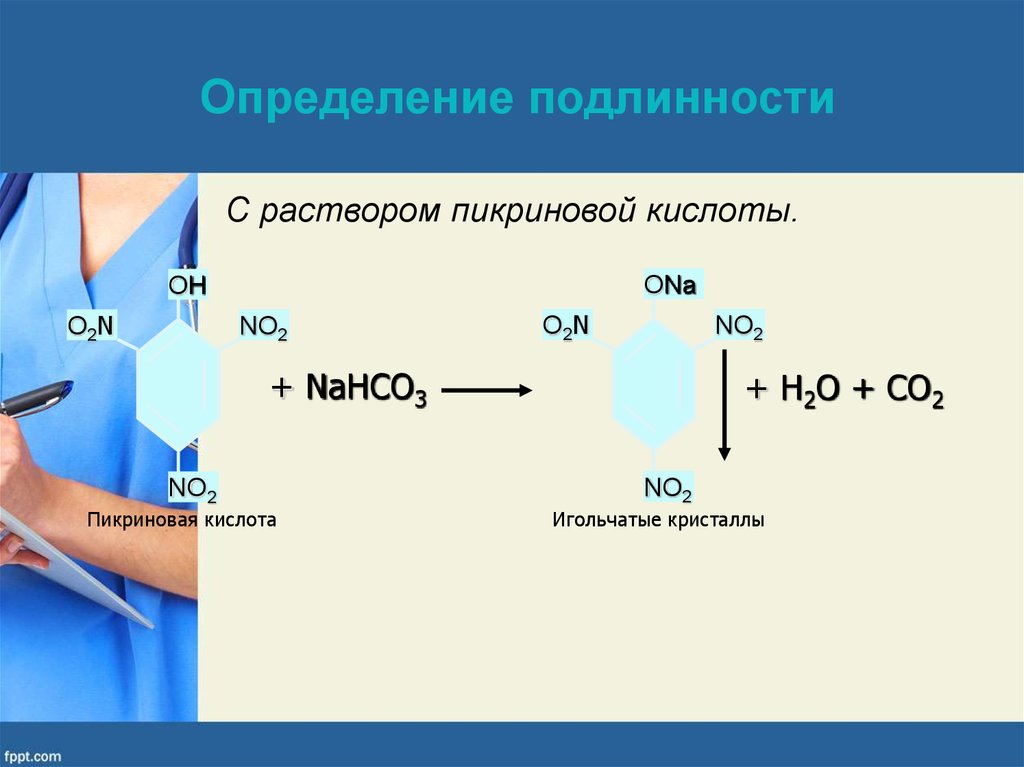
Определение подлинностиС раствором пикриновой кислоты.
ONa
OH
O2 N
NO2
O2 N
NO2
+ NaHCO3
NO2
Пикриновая кислота
+ H2O + CO2
NO2
Игольчатые кристаллы
9.
Определение подлинностиВзаимодействие с минеральными кислотами
При взаимодействии NaHCO3 с любой
минеральной кислотой выделяются пузырьки
газа.
2NaHCO3 + H2SO4
2CO2↑ + 2H2O + Na2SO4
10.
Метод ацидиметрии;Титрант HCl 0,1 моль/л;
Индикатор метиловый красный;
Титрование ведут от жёлтой до розовой окраски
N aHC O3 HCl
NaCl CO2 H2O
11. Хранение
Натрия гидрокарбонат хранят в хорошоукупоренных банках, в сухом месте вдали от
источников огня. Он устойчив в сухом
воздухе, но во влажном воздухе медленно
теряет диоксид углерода и переходит в
карбонат натрия.
12. Применение
• В качестве антацидного средства• Наружно в виде полосканий
• Готовят раствор для инъекций 4%
• Прописывается в микстурах вместе с
Натрия бензоатом и Термопсисом как
отхаркивающее средство.
13. Натрия тиосульфат (Sodium thiosulfate)
Бесцветныепрозрачные
гранулы
или
кристаллы без запаха, солоновато-горькие на
вкус; очень легко растворим в воде (1:1),
практически
нерастворим
в
спирте;
молекулярная масса 248,17 (пентагидрат).
14. Испытание на чистоту
• Допустимые: хлориды, тяжелыеметаллы, железо.
• Недопустимые: сульфиты,
сульфаты, кальций, мышьяк,
селен.
15. Определение подлинности
Сухая реакция(Фармакопейная)
Соль Натрия, внесённая в
бесцветное пламя спиртовки,
окрашивает пламя в жёлтый
цвет.
16.
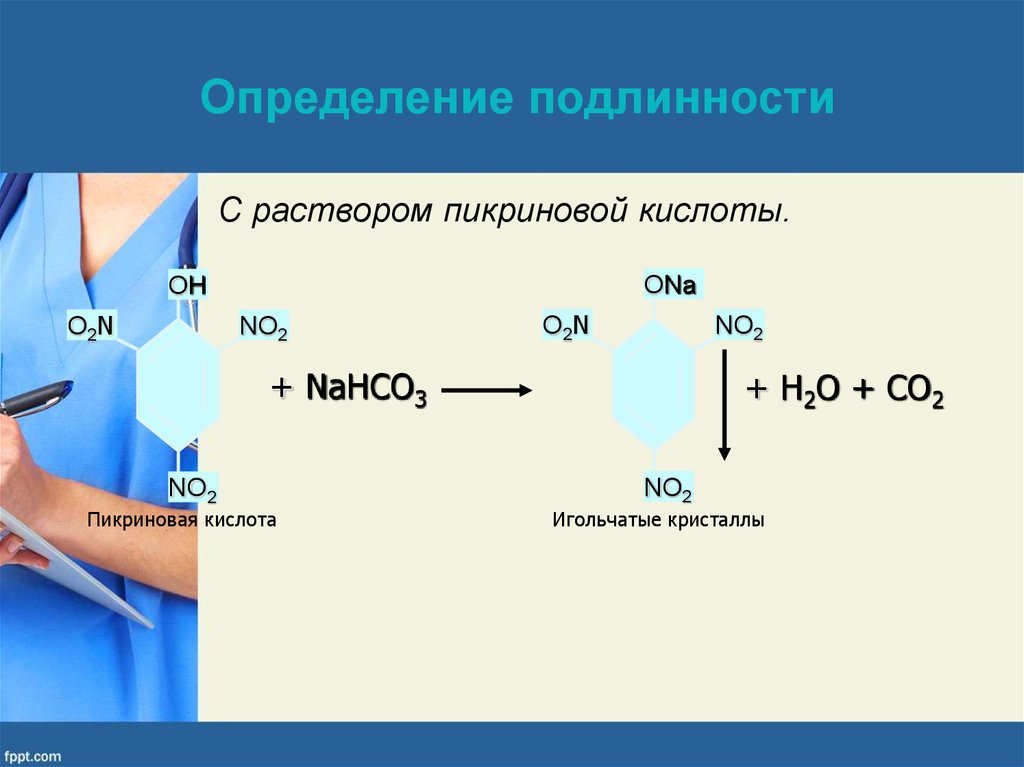
Определение подлинностиС раствором пикриновой кислоты.
ONa
OH
O2 N
NO2
O2 N
NO2
+ NaHCO3
NO2
Пикриновая кислота
+ H2O + CO2
NO2
Игольчатые кристаллы
17.
Определение подлинности1. С раствором Нитрата серебра образуется
сначала белый осадок, затем жёлтый и затем
чёрный:
Na2S2O3 + 2AgNO3
Ag2S2O3↓ + 2NaNO3
Белый осадок
Ag2S2O3↓
Ag2SO3 + S↓ + H2O
Ag2SO3 + S↓
Жёлтый
осадок
Ag2S↓ + H2 SO4
Чёрный
осадок
18.
Определение подлинности2. С растворами минеральных кислот Тиосульфат
натрия образует Тиосерную кислоту, которая
разлагается с выделением серы, диоксида серы и
воды
2NaCl + SO2 + H2O + S↓
Na2S2O3 + 2HCl
светло-жёлтый
осадок
3. С раствором FeCl3 образуется Тиосульфат
железа (III) фиолетового цвета. Окраска быстро
исчезает, так как эта соль восстанавливается до
солей железа (II).
2FeCl3 + 3Na2S2O3
Fe2(S2O3)3
6NaCl + Fe2(S2O3)3
FeS2O3 + FeS4O6
фиолетовое
окрашивание
19. Количественное определение
•Метод йодометрии, прямое титрование;•Титрант раствор I2 0,1 моль/л;
•Индикатор Крахмал;
•Среда нейтральная;
•Титрование ведут до синего окрашивания.
2Na2S2O3 + I2
2S2O32- - 2ē
I20 + 2ē
2NaI + Na2S4O6
S4O62-
2I¯
20. Хранение, применение
• Натрия тиосульфат хранят в хорошо укупоренной таре. Взащищенном от света месте, при температуре 18–20 °C.
• При отравлении As, Hg, Pb, синильной кислотой, солями
йода, брома применяют В/в, по 5-50 мл 30% раствора или
внутрь, по 2-3 г на прием в виде 10% раствора.
• При чесотке - наружно, втирают в кожу 60% раствор, после
высыхания смачивают 6% раствором HCl.
• 30% раствор для инъекций – при аллергических
заболеваниях, артритах, невралгиях.
21.
Натрия тетраборатNatrii tetraboras
Бесцветные прозрачные кристаллы; при
хранении на воздухе выветриваются и
покрываются белым налётом.
Хорошо растворим в воде, глицерине;
нерастворим в спирте.
Водные растворы щелочной реакции.
22. Испытание на чистоту
• Допустимые: мышьяк, хлориды,сульфаты, железо.
• Недопустимые: карбонаты.
23.
Определение подлинностиРеакция с куркумовой бумажкой.
Бумажку смачивают раствором Борной кислоты и раствором Соляной
кислоты, затем высушивают. Она окрашивается в красно-бурый цвет.
При смачивании раствором Аммиака – в чёрно-зелёный цвет.
Образование борно-этилового эфира.
Препарат помещают в фарфоровую чашечку, добавляют спирт,
концентрированную H2SO4 и поджигают. Горит пламенем с зелёной
каймой.
Na2B4O7·10H2O + H2SO4
B
OH
OH + 3HOC2H5
OH
4H3BO3 +Na2SO4 + 5H2O
H2SO4
B
O – C2H5
O – C2H5 + 3H2O
O – C2H5
Борно-этиловый
эфир
24. Количественное определение
Метод ацидиметрии;
Титрант HCl 0,1 моль/л;
Индикатор метилоранж;
Титрование ведут от жёлтой до розовой окраски.
Na 2 B4O7 10 H 2O 2 HCl
4 H3BO 3 2 NaCl 5 H 2O
25. Хранение, применение
• Лекарственные препараты соединенийбора хранят в защищенном от света
месте, в хорошо укупоренной таре.
• Применяют как слабое антисептическое
средство, наружно в виде 1 – 2% растворов
для полосканий, промываний.
26.
Натрия нитритNatrii nitris
• Нитрит натрия – это соль азотистой кислоты,
получаемая из оксидов в результате химических
реакций. Нитрит натрия обычно выглядит как
белый и чуть желтоватый порошок или мелкие
кристаллы, не имеет запаха, по вкусу немного
кислый (calorizator). Имеет хорошую
гигроскопичность и быстро растворяется в воде.
27. Испытание на чистоту
• В качестве допустимых примесей в ЛС могутприсутствовать хлориды, сульфаты, тяжелые металлы,
мышьяк.
• Определению хлоридов с помощью серебра нитрата
предшествует разложение натрия нитрита азотной кислотой
во избежание образования малорастворимого белого осадка
серебра нитрита AgN02 (растворимость 1:300).
• Перед определением сульфатов с помощью реакции с
ВаСl2 смесь ЛВ с аммония хлоридом NH4Cl выпаривают и
нагревают до полного разложения образующегося аммония
нитрита:
NH4NО2 N2 + 2Н2О
28.
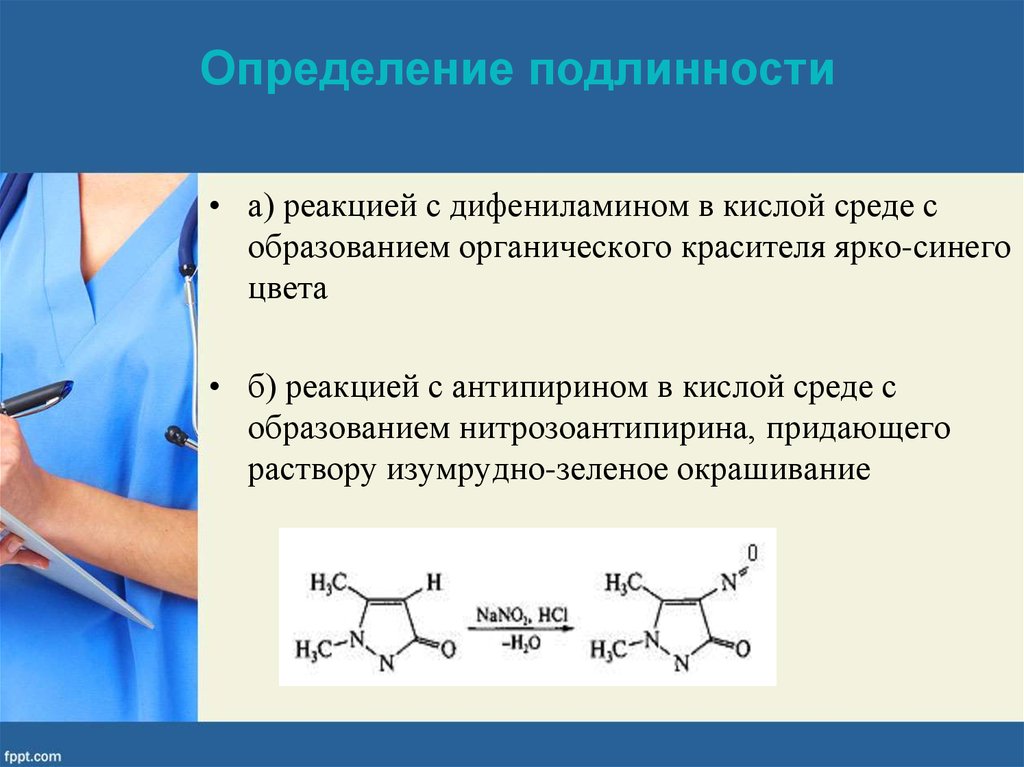
Определение подлинности• а) реакцией с дифениламином в кислой среде с
образованием органического красителя ярко-синего
цвета
• б) реакцией с антипирином в кислой среде с
образованием нитрозоантипирина, придающего
раствору изумрудно-зеленое окрашивание
29.
Определение подлинности• в) по выделению красно-бурых паров
окисла азота при добавлении к
раствору нитрита натрия разведенной
серной кислоты.
30. Количественное определение
• Содержание NaN02 в препарате определяют,окисляя его перманганатом калия, избыток
которого определяют йодометрически
(фармакопейный метод):
31. Хранение, применение
• Список Б. В хорошо укупоренныхбанках оранжевого стекла, в
защищенном от света месте
• Натрия нитрит назначают внутрь,
подкожно и внутривенно (в виде 1%ного раствора) как спазмолитическое
(коронарорасширяющее) средство при
стенокардии.
32.
ЗАКЛЮЧЕНИЕВ данной работе были осмотрены методы
анализа лекарственных средств
неорганических соединений натрия: натрия
гидрокарбонат, натрия тиосульфат,
натрия нитрит, натрия тетраборат,
также требования к качеству.
К
33.
IV.Список использованной литературы1. Арыстанова Т.А. Общая фармацевтическая химия/Учебное пособие.Шымкент.-2008.-157 с.
2. Арзамасцев А.П.. Фармацевтическая химия: учебное пособие, 3-е изд.,
испр.-М.:ГЭОТАР-Медиа.-2006.-640 с.
3. Беликов В.Г. Фармацевтическая химия. В 2-х ч: учебное пособие, 4-е изд.,
перераб. и доп.-М.: МЕДпресс-информ.-2007.-624 с.
4. Государственная
фармакопея
Республики
Казахстан.-Алматы:
Издательский дом «Жибек жолы».-2008.-Том 1.-592 с.
5. Государственная
фармакопея
Республики
Казахстан.Алматы:
Издательский дом «Жибек жолы».-2009.-Том 2.-804 с.
6. Ордабаева С.К. Анализ лекарственных препаратов, производных
ароматических соединений:учебное пособие.-Шымкент.-2012.-270 с.






























 chemistry
chemistry








