Similar presentations:
Химическая связь. Типы кристаллических решеток
1.
Химическая связь.Типы кристаллических решеток
Преподаватель Юридического колледжа
Валентина Владимировна Киреева
2.
РЕМОНТХимическая связь –
взаимодействие атомов в
молекулах, ионах, радикалах,
кристаллах, обеспечивающее
существование различных
химических соединений
3.
РЕМОНТПричина
образования
химической
связи
стремление
атома
завершить свой внешний
уровень (2 е; 8 е)
4.
РЕМОНТИзображение химической связи
1. С помощью электронов в виде
точек, поставленных у знака
химического элемента
Н· + ·Н → Н : Н
2. В виде черточки, которая
символизирует пару электронов
Н-Н
5.
РЕМОНТОсновой возникновения разных
типов химической связи является
электроотрицательность (ЭО).
Электроотрицательность – это
способность атомов оттягивать на
себя электроны от соседнего атома.
ЭО в ПСХЭ усиливается слева
направо и снизу вверх
6.
7.
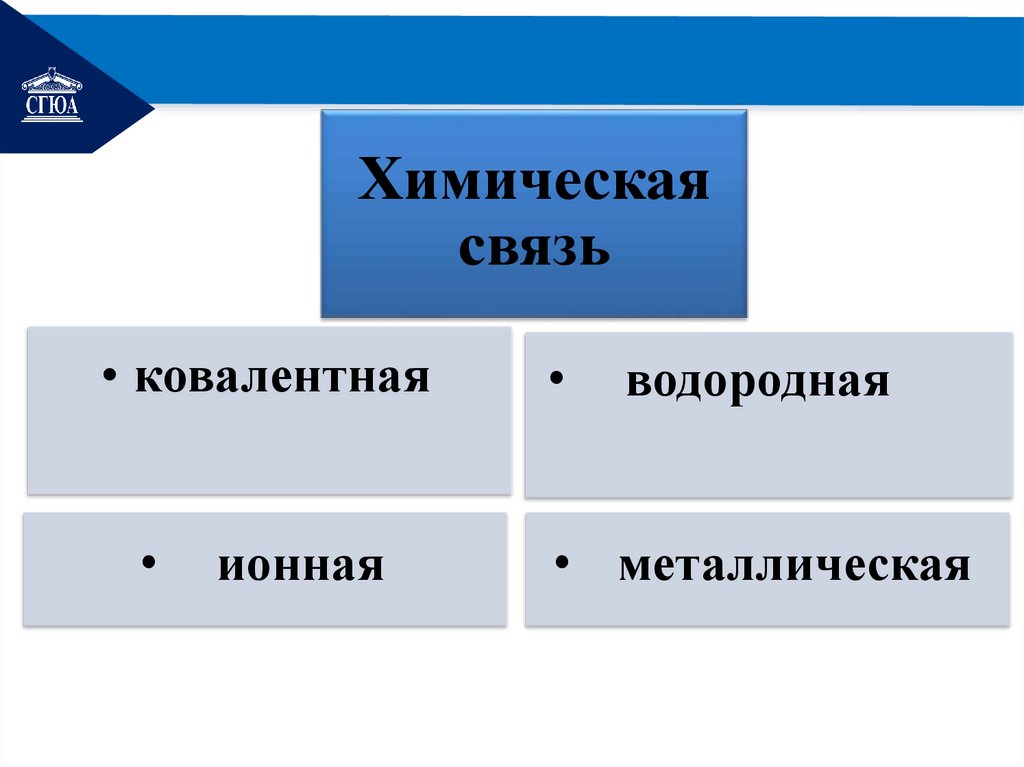
РЕМОНТХимическая
связь
• ковалентная
ионная
водородная
• металлическая
8.
РЕМОНТКовалентная связь
– это связь, возникающая
между атомами неметаллов
за счет образования общих
электронных пар
9.
РЕМОНТКовалентная связь
Ковалентная
неполярная
Ковалентная
полярная
10.
РЕМОНТ11.
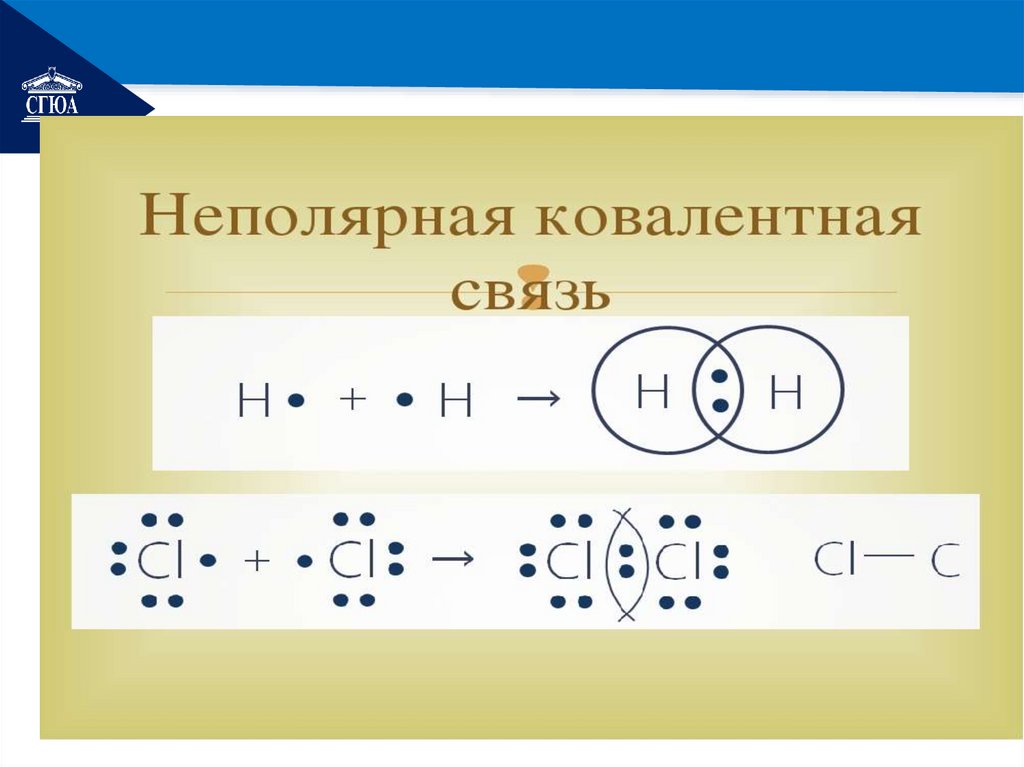
РЕМОНТКовалентная неполярная связь
• возникает между атомами
неметаллов с одинаковой ЭО.
• Общая электронная пара в
равной степени принадлежит
обоим атомам.
• Примеры: О2 Н2 Сl2 I2 графит
12.
РЕМОНТ13.
РЕМОНТКовалентная полярная связь
• Возникает между атомами неметаллов с
разной ЭО.
• Более эо атом оттягивает на себя общую
электронную пару и заряжается
отрицательно.
• Менее эо приобретает избыточный
положительный заряд.
• Примеры: Н2S Н2O CН4 SO2 PН3 CO SiF4
14.
РЕМОНТ15.
РЕМОНТИонная связь
• образуется между положительно и
отрицательно заряженными ионами
металлов и неметаллов
16.
РЕМОНТ• При образовании ионной связи
происходит полный переход
электронов от менее ЭО атома
(металла) к более ЭО атому
(неметаллу).
17.
РЕМОНТАтом, принимающий электроны, – анион:
Cl0 + e → Cl-1
Атом, отдающий электроны, – катион:
Na0 - e → Na+1
Между катионом и анионом возникают силы
электростатического
притяжения
(довольно
сильные - у веществ с таким типом связи высокие
температуры кипения и плавления).
Примеры: NaCl, K2O, BaO, CaCl2, KI, Na2S,
Mg(NO3)2, KH
18.
РЕМОНТМеталлическая связь
Характерна для металлов, атомы
которых на внешнем уровне имеют мало
валентных электронов. Электроны легко
отрываются и в свободном состоянии
(электронный газ)
перемещаются от
катиона к катиону по
всему объему металла
19.
РЕМОНТВодородная связь
- это связь между
электроотрицательными атомами N,
O, Сl, F и положительно заряженным
атомом H, связанным ковалентно с
другим электроотрицательным
aтомом.
20.
РЕМОНТ21.
РЕМОНТ• Существование межмолекулярной водородной
связи повышает температуры плавления и
кипения веществ, увеличивает растворимость
соединений.
• Низкомолекулярным соединениям придаёт
способность в обычных условиях иметь жидкое
агрегатное состояние (этанол (C2H5OH), метанол
(CH3OH) и вода (H2O)), или становиться
жидкостями при охлаждении (аммиак (NH3) и
фтороводород (HF)).
• Определяет многие уникальные свойства воды
22.
Водородная связьРЕМОНТ
межмолекулярная
внутримолекулярная
23.
РЕМОНТ• Наличие внутримолекулярной
водородной связи приводит к
образованию определённой структуры
молекулы (ДНК, белки).
24.
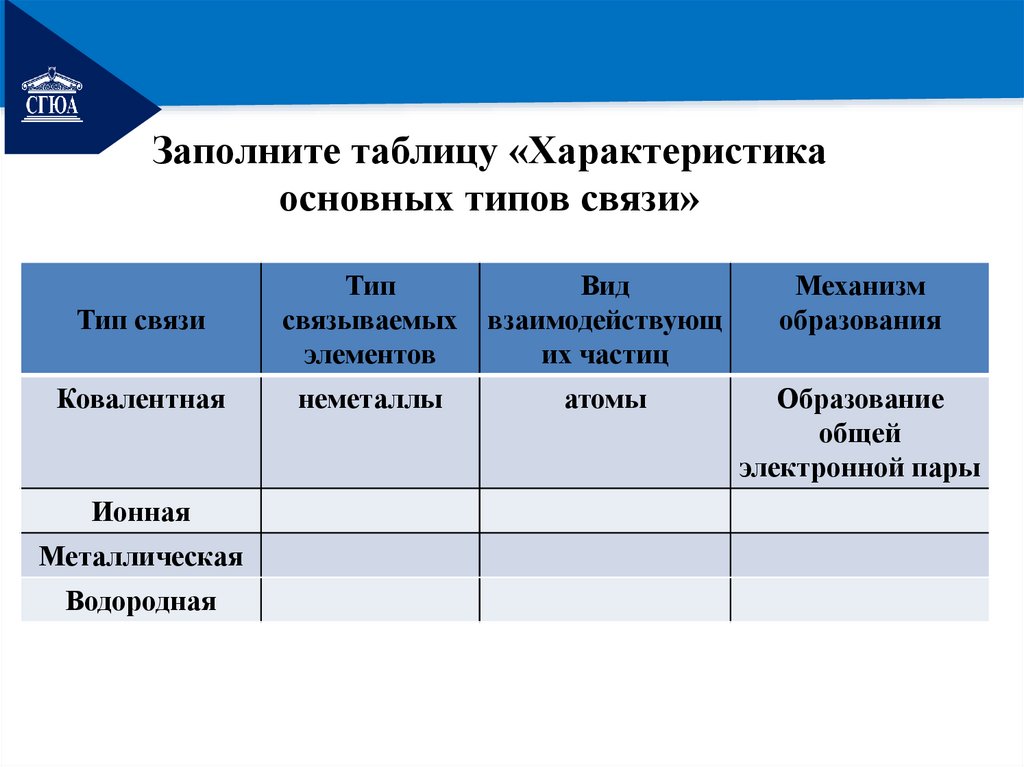
РЕМОНТЗаполните таблицу «Характеристика
основных типов связи»
Тип связи
Тип
связываемых
элементов
Вид
взаимодействующ
их частиц
Механизм
образования
Ковалентная
неметаллы
атомы
Образование
общей
электронной пары
Ионная
Металлическая
Водородная
25.
РЕМОНТЗадание
Определите тип химической
связи
S2, NH3, K2O, H2S, N2, LiCl, Cl3N, цинк,
FeS, CO, CH4, CuCl2, платина, О3,
С (графит), О2, бронза, CаO
26.
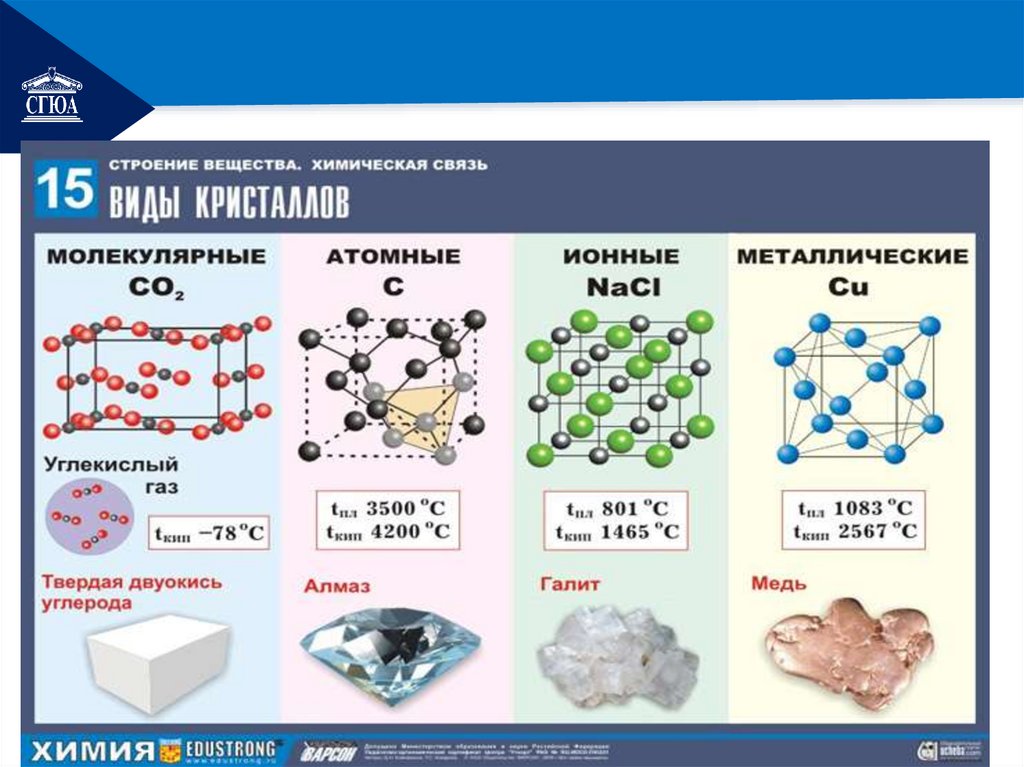
РЕМОНТТипы кристаллических решеток
Кристаллическая решетка –
это упорядоченное
расположение частиц
вещества в пространстве
27.
РЕМОНТТипы
кристаллических
решеток
• атомная
• металлическая
ионная
молекулярная
28.
РЕМОНТПлан характеристики
Тип решетки
В узлах находятся
Тип связи и ее прочность
свойства веществ - примеры
29.
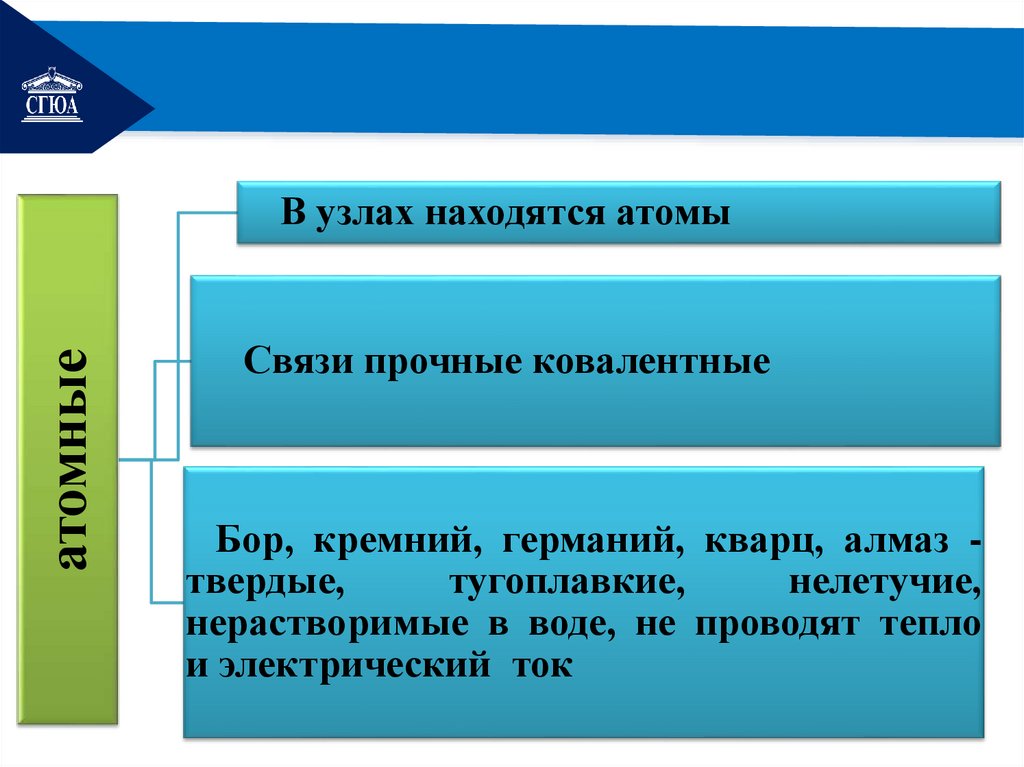
РЕМОНТатомные
В узлах находятся атомы
Связи прочные ковалентные
Бор, кремний, германий, кварц, алмаз твердые,
тугоплавкие,
нелетучие,
нерастворимые в воде, не проводят тепло
и электрический ток
30.
РЕМОНТионные
В узлах находятся ионы
Прочные ионные связи
Соли, некоторые оксиды и гидроксиды
металлов - твердые, хрупкие, малолетучие,
тугоплавкие, проводящие в растворах и
расплавах тепло и электрический ток.
31.
РЕМОНТмолекулярные
В узлах находятся молекулы
Непрочные ковалентные связи, как
полярные, так и неполярные.
Малая твёрдость, низкая температура
плавления,
летучие,
при
обычных
условиях газы или жидкости
(азот,
кислород, вода), но встречаются и твердые
вещества (фосфор, глюкоза, сера, йод)
32.
металлическиеРЕМОНТ
В узлах находятся атомы и катионы
металлов
Прочная связь за счет перемещающихся
свободных электронов
Металлы и сплавы - пластичность, ковкость,
металлический блеск, высокая электро- и
теплопроводность
33.
РЕМОНТ34.
РЕМОНТОпределите типы
кристаллических решёток
следующих веществ, опишите
их свойства:
O2, марганец, CuO, NaCl,
кремний, H2O, F2, CO2, йод,
медь, CaF2, С (алмаз), нафталин
35.
СПАСИБО ЗАВНИМАНИЕ!





























 chemistry
chemistry








