Similar presentations:
Кислород. Взаимодействие веществ с кислородом
1.
Кислород – это вещество, вокругкоторого вращается земная химия.
Я. Берцелиус
2.
Впервые выделилкислород в 1770 году
Новое вещество называли
"огненным воздухом" за
участие в горении, потом
"жизненным воздухом",
поддерживающим дыхание.
Установил, что кислород является составной частью
воздуха. Ввёл название "окси генес" - образующий кислоты.
создал кислородную теорию горения
3.
А история простая…Один ученый как-то раз,
Оксид какой-то нагревая,
Обнаружил странный газ.
Газ без цвета, без названья.
Ярче в нем горит свеча.
И не вреден для дыханья –
Не узнаешь у врача.
Новый газ из колбы вышел –
Никому он не знаком,
Этим газом дышат мыши
Под стеклянным колпаком.
Человек им тоже дышит,
Наш ученый быстро пишет:
Воздух делится на части.
(Эта мысль весьма нова).
Здесь у химика от счастья,
И от воздуха отчасти
Закружилась голова.
4.
О16
8
состав
период II, группа VI (A)
строение
p –8
ē- 8
n- 8
1s22s22p4
+8
свойства
Внешний уровень
незавершен
В.= II
С.о. = -2
Сильный окислитель
5.
Окислород
О2
озон
О3
6.
ОО
→
О
О
Электронная
формула
↓
Газ - без цвета, вкуса и запаха;
в 100V H2O растворяется 3V O2
t кип= -183 С;
t пл = -219 C;
Немного тяжелее воздуха
Малорастворим в воде
О
О
Структурная
формула
↓
О2
Молекулярная
формула
Струя жидкого кислорода
отклонятся в сильном магнитном поле
7.
Промышленный способ (перегонка жидкого воздуха).Лабораторный способ
(разложение некоторых кислородосодержащих веществ)
2KMnO4 –t K2MnO4 + MnO2 + O2
2KClO3 –t ;MnO2 2KCl + 3O2
2H2O2 –MnO2 2H2O + O2
В природе (процесс фотосинтеза)
8.
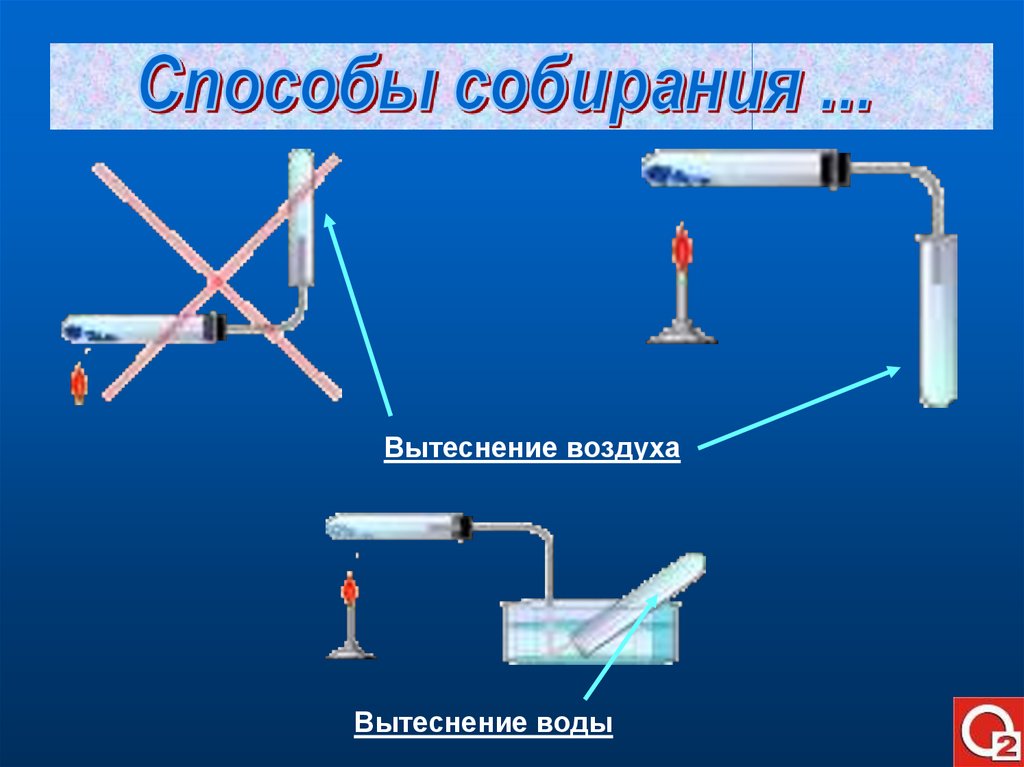
Вытеснение воздухаВытеснение воды
9.
O2KMnO4
O2
O2
H2O
10.
Взаимодействие веществ с кислородом называетсяметаллов
2Mg + O2 2MgO
2Cu + O2 –t 2CuO
окислением.
сложных веществ
2H2S + 3O2 2SO2 + 2H2O
CH4 + 2O2 CO2 + 2H2O
Кислород
поддерживает
горение!
неметаллов
C + O2 CO2
2H2 + O2 2H2O
11.
+ металлкислород
+ неметалл
+ сложное вещество
Оксид металла МеО
Оксид неметалла НеМеО
Оксиды элементов
12.
Получение3O2 2O3
Во время грозы (в природе),
(в лаборатории) в озонаторе
Химические свойства
Неустойчив:
O3 O2 + O
Сильный окислитель:
2KI + O3 + H2O 2KOH + I2 + O2
Обесцвечивает красящие вещества,
отражает УФ - лучи, уничтожает
13.
14.
Распространенность кислородаВ воздухе –
21%
по объему
В земной
коре –
49%по массе
Из каждых 100
атомов 58 –
кислород
В
гидросфере –
89% по массе
В
составе
живых
организмов –
до 65%
по массе
15. Применение кислорода
В течение одной минутычеловек в среднем
употребляет 0,5 л кислорода.
Современный пассажирский
самолет при полете в течение
9 ч расходует 50-75 т
кислорода.













 chemistry
chemistry








