Similar presentations:
Белки - это сложные высокомолекулярные природные соединения (биополимеры)
1.
Белки2.
Белки – это сложные высокомолекулярныеприродные
соединения
(биополимеры),
макромолекулы которых состоят из остатков
α-аминокислот,
соединенных
пептидными
(амидными) связями -СО-NН- .
Свое название белки получили от белого цвета
куриного яйца, на примере которого изучались их
свойства.
В
1838
г.
Н.
Мульдер
назвал
белки протеинами (от греч. protos — первый,
важный). Это же название принято в международной
номенклатуре.
3.
Строение белковКаждый белок имеет свое специфическое
(индивидуальное и постоянное) строение.
Белки отличаются друг от друга числом (от ста до нескольких
тысяч), составом и последовательностью мономеров. Мономерами
белков являются аминокислоты.
Бесконечное разнообразие белков создается за счет различного
сочетания всего 20 α-аминокислот. Каждая аминокислота имеет
свое название, особое строение и свойства. Их общую формулу
можно представить в следующем виде:
4.
Строение белковВ белках α-аминокислоты соединены между собой пептидными
(амидными) связями (-NH-CO-) в пептидные цепи. Образование
пептидных связей происходит в результате взаимодействия
карбоксила одной аминокислоты с аминогруппой другой.
5.
6.
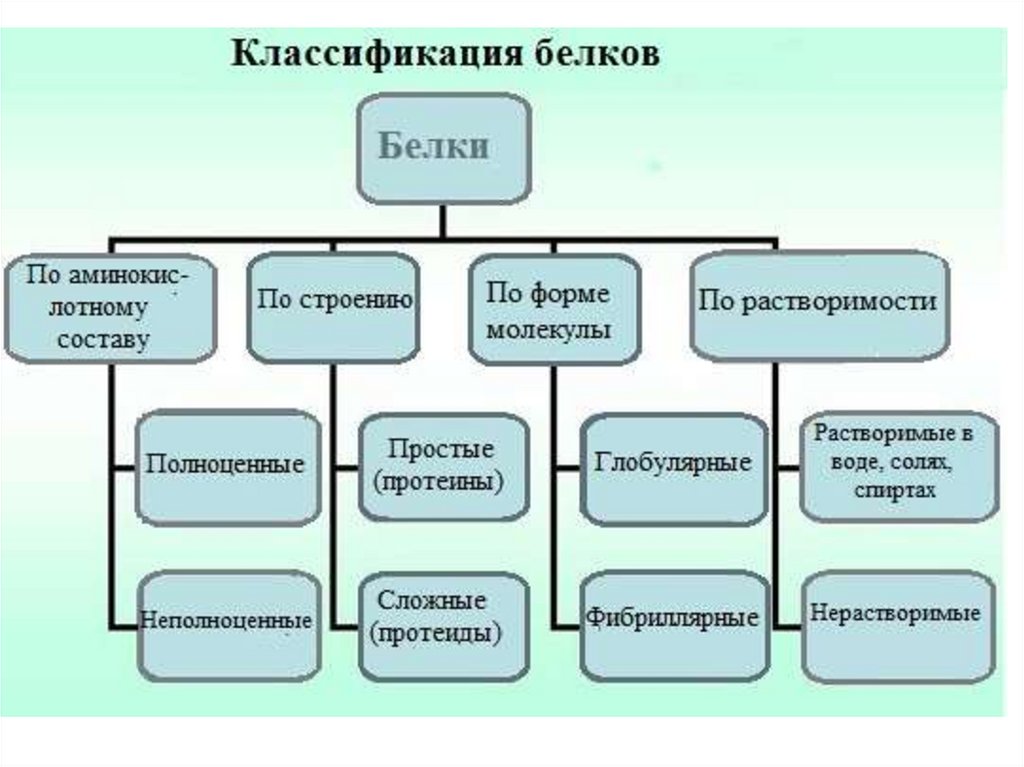
С точки зрения пищевой ценности белков, определяемой их аминокислотнымсоставом и содержанием незаменимых аминокислот, белки подразделяются
на полноценные и неполноценные.
Полноценными считаются белки, включающие в состав восемь незаменимых
аминокислот, которые самостоятельно организм синтезировать не может.
Неполноценными считаются белки, которые содержат недостаточное количество
одной или нескольких незаменимых аминокислот, которые не могут быть
синтезированы организмом.
Полноценные белки содержатся в продуктах животного происхождения (кроме
желатина), а также некоторой растительной пище (горох, фасоль, соя).
Неполноценные белки – преимущественно растительного происхождения.
7.
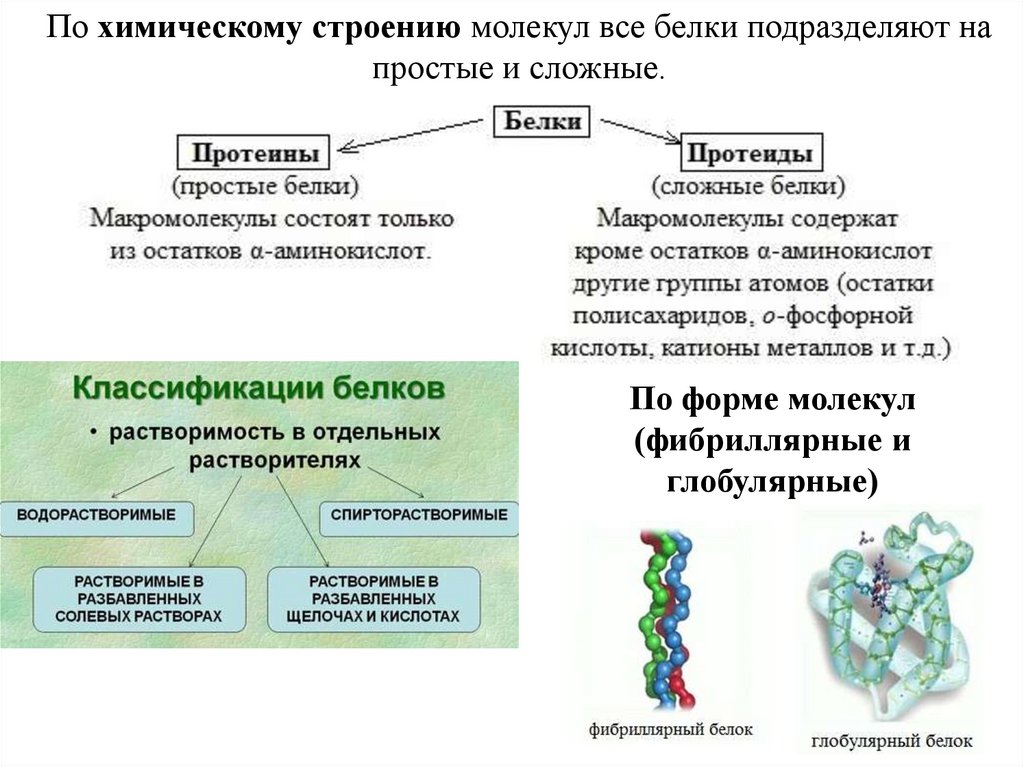
По химическому строению молекул все белки подразделяют напростые и сложные.
По форме молекул
(фибриллярные и
глобулярные)
8.
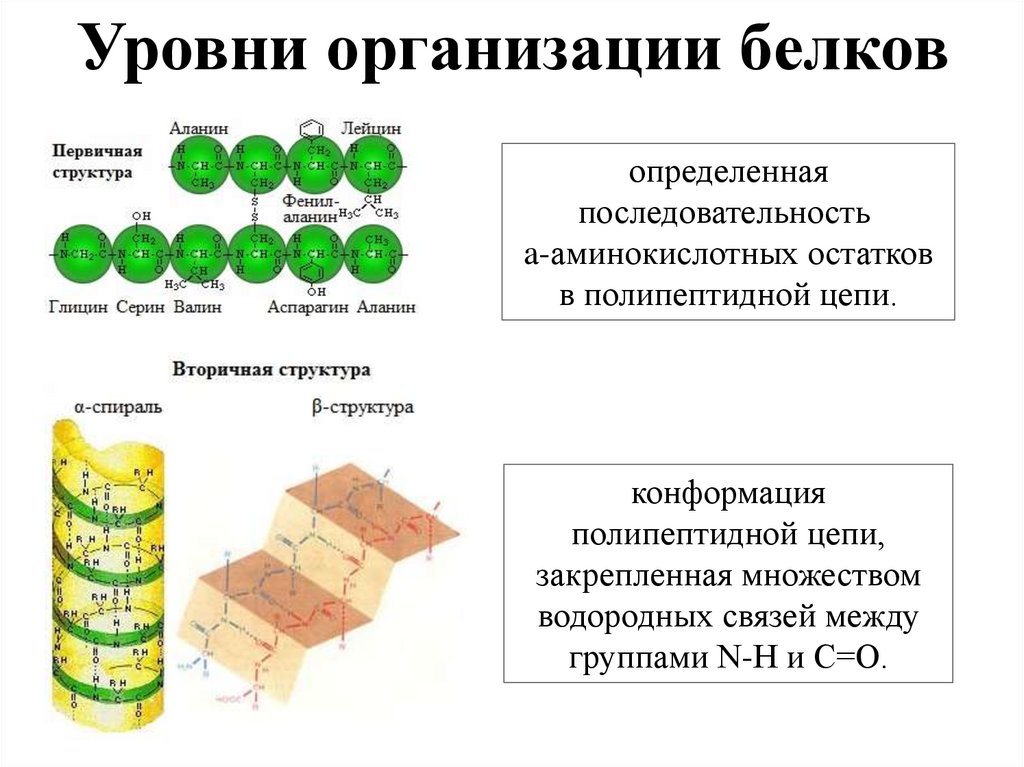
Уровни организации белковопределенная
последовательность
a-аминокислотных остатков
в полипептидной цепи.
конформация
полипептидной цепи,
закрепленная множеством
водородных связей между
группами N-H и С=О.
9.
Уровни организации белковобразованная главным образом за счет
дисульфидных мостиков -S-S- ,
водородных связей, гидрофобных и
ионных взаимодействий.
агрегаты нескольких белковых
макромолекул (белковые комплексы),
образованные за счет взаимодействия
разных полипептидных цепей
10.
Физические свойства белковФизические свойства белков так же разнообразны, как и
функции, которые они выполняют.
Белки — кристаллические вещества белого цвета, в растворе –
бесцветные вещества, если они не несут какой-нибудь хромофорной
(окрашенной) группы, как, например, гемоглобин
Растворимость в воде.
Глобулярные — растворяются в воде, образуют коллоидные растворы
(белок молока – казеин, белок яйца – альбумин);
Фибриллярные — в воде не растворяются (кератин – волосы, ногти,
перья; коллаген – мускулы, сухожилия; фиброин шелка).
Растворы фибриллярных белков обладают большой вязкостью. Примером
может служить коллаген — белок соединительной ткани.
Белки не имеют температуры плавления и кипения, так как
большинство из них при нагревании сворачиваются. При высокой
температуре все белки сгорают.
11.
Химические свойства белков1.Денатурация – это разрушение вторичной и третичной
структуры белка (полное или частичное) и изменение его
природных свойств с сохранением первичной структуры белка.
Денатурация бывает обратимой и необратимой.
Обратимая денатурация белка происходит при употреблении алкоголя,
солёной пищи.
Необратимая денатурация может быть вызвана при действии таких
реагентов, как концентрированные кислоты и щелочи, спирты, в
результате воздействия высокой температуры, радиации, при
отравлении организма солями тяжелых металлов (Hg2+, Pb2+, Си2+).
12.
Химические свойства белков2. Гидролиз белков– это необратимое разрушение первичной
структуры в кислом или щелочном растворе с образованием
аминокислот.
Анализируя продукты гидролиза, можно установить количественный
состав белков.
Переваривание
белков
в
организме
по
своей
сути
представляет ферментативный гидролиз белковых молекул.
В лабораторных условиях и в промышленности проводится кислотный
гидролиз.
В ходе гидролиза белков происходит разрушение пептидных связей.
Гидролиз белка имеет ступенчатый характер:
13.
Химические свойства белков3.Качественные реакции на белки
1) Ксантопротеиновая реакция
содержащих бензольные кольца)
(на
остатки
Белки,
содержащие
остатки
ароматических
аминокислот
(фенилаланина, тирозина), дают желтое
окрашивание
при
действии
концентрированной азотной кислоты.
Причина появления окраски – образование
нитропроизводных
ароматических
аминокислот, например, фенилаланина:
аминокислот,
14.
Химические свойства белков3.Качественные реакции на белки
2) Биуретовая реакция (на пептидные связи)
Все соединения, содержащие пептидную связь, дают фиолетовое
окрашивание при действии на них солей меди (II) в щелочном
растворе.
Причина появления окраски –
образование
комплексных
соединений с координационным
узлом:
15.
Химические свойства белков3.Качественные реакции на белки
3) Цистеиновая реакция (на остатки аминокислот, содержащих серу)
Причина появления окраски –
образование
черного
осадка
сульфида серебра (II) PbS.
16.
Биологическое значение белков• Ферментативная функция
• Транспортная функция
• Структурная функция
• Защитная функция
• Сигнальная функция













 biology
biology








