Similar presentations:
Бензол. Физические свойства
1.
2. Физические свойства
Бензол представляет собой бесцветную,легкоподвижную жидкость с температурой
кипения +80ºС и температурой плавления
+ 5,5ºС.
Он обладает своеобразным запахом, горит
сильно коптящим пламенем, легче воды и
не растворяется в ней.
Пары бензола с воздухом образуют
взрывчатую смесь.
3. Влияние бензола на организм человека
Парыбензола ядовиты.
Бензол является канцерогеном, т.е.
способен вызывать раковые опухоли
(наиболее часто приводит к раку
крови).
Пищевые добавки Е 210 – 219 –
консерванты также канцерогены
(бензоаты)
4. Строение бензола
В свое время былопредложено много
вариантов структурных
формул бензола, но ни
одна из них не смогла
удовлетворительно
объяснить его особые
свойства.
Цикличность строения
бензола подтверждается
тем фактом, что его
однозамещенные
производные не имеют
изомеров.
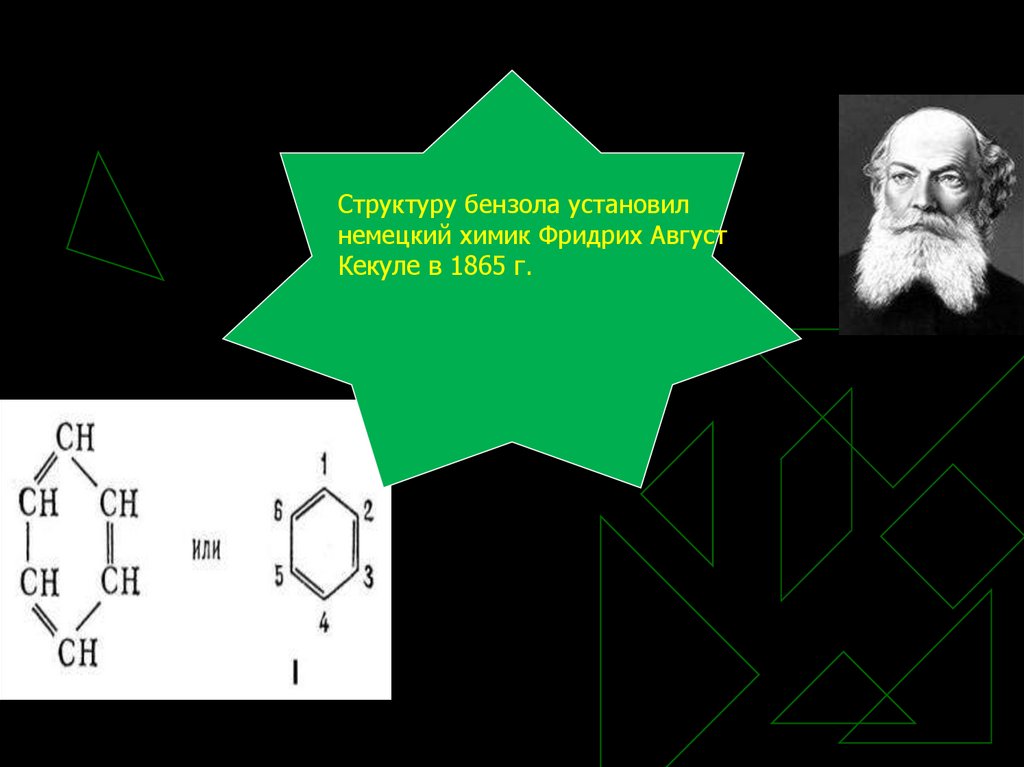
5.
Структуру бензола установилнемецкий химик Фридрих Август
Кекуле в 1865 г.
6.
Электронное строение бензолаСовременное представление об
электронной природе связей в
бензоле основывается на
гипотезе американского физика
и химика, дважды лауреата
Нобелевской премии
Л. Полинга.
Именно по его предложению
молекулу бензола стали
изображать в виде
шестиугольника с вписанной
окружностью, подчеркивая тем
самым отсутствие
фиксированных двойных связей
и наличие единого
электронного облака,
охватывающего все шесть
атомов углерода цикла.
7.
Связь между атомами углерода в бензоле полуторная, т.е. промежуточная междуодинарной связью предельных
углеводородов и двойной связью
непредельных углеводородов – алкенов.
Поэтому структурную формулу бензола
изображают как шестиугольник, в центр
которого вписан круг (бензольное кольцо).
8. Запишите формулу бензола
С6Н6 – молекулярная формула
НС
НС
НС
СН
СН
СН
структурная формула бензола
9. Так как в молекуле бензола полуторная связь, то он вступает в реакции замещения (как предельные углеводороды) и в реакции
присоединения (как непредельныеуглеводороды).
Реакции замещения у бензола идут легче, чем у
предельных углеводородов, бензольное кольцо
в реакциях замещения не разрушается.
Реакции присоединения у бензола идут труднее,
чем у непредельных углеводородов.
Бензольное кольцо в реакциях присоединения
разрушается и у каждого атома С образуется
ещё по одной свободной связи, поэтому бензол
присоединяет сразу 6 атомов.
10. Химические свойства бензола
1.Горение (коптящее пламя)2С6Н6 + 15О2 → 12СО2 + 6Н2О + Q
2. Реакции замещения:
а) бромирование
С6Н6 + Br2 → C6H5Br + HBr
бромбензол
б) нитрование (с азотной кислотой)
С6Н6 + НNО3 → С6Н5NО2 + Н2О
нитробензол
Реакция нитрования протекает в присутствии
серной кислоты (как катализатора).
11.
3. Реакции присоединения:а) гидрирование
С6 Н6 + 3 Н2 → С6 Н12
циклогексан
б) хлорирование:
С6Н6 + 3 Cl2 → C6H6CI6
гексахлорциклогексан
Реакция хлорирования протекает под
действием солнечного света или
ультрафиолетовых лучей.
12.
13. Получение
Бензолполучают из
каменноугольной смолы,
образующейся при коксовании
угля.
В настоящее время бензол
получают из нефти.
Бензол получают синтетическими
методами.
14. Синтетические способы получения бензола
1. Дегидрирование гексанаС6Н14 → С6Н6 + 4Н2
2. Дегидрирование циклогексана
С6Н12 → С6Н6 + 3Н2
3. Тримеризация ацетилена
3С2Н2 → С6Н6
15. Природные источники получения:
Природныеи попутные газы
Нефть
Каменный
уголь
16. Применение
17. Применение бензола и его производных
18.
1.Пластмассы
(полистирол)
19.
2. Красители20.
3. Лекарства21.
4. Взрывчатыевещества
22.
5. Синтетическиекаучуки
23.
6. Синтетическиеволокна
24.
7. Растворители25.
8. Ядохимикаты9. Химическая промышленность
(анилин, сахарин, фенол, стирол…)
























 chemistry
chemistry








