Similar presentations:
Формирование равновесной структуры сплавов в двойных системах
1.
Формирование равновеснойструктуры сплавов
Как происходит
формирование структуры в
различных типах двойных
систем?
1
2.
Основные определенияСплав – вещество, полученное , как правило, сплавлением двух
или более веществ
Система – совокупность фаз, образующих бесчисленное
множество сплавов
Компоненты – вещества, соединением которых получен любой
сплав системы
Фазой называют однородные части сплава (системы),
одинаковые по химическому составу, кристаллическому строению и
свойствам, отделенные от других частей системы поверхностью
раздела, при переходе через которую свойства меняются
скачкообразно
Общие закономерности существования устойчивых фаз,
отвечающих условиям равновесия, могут быть выражены
правилом фаз (Гиббса):
c=k–f+1
c – число степеней свободы – количество независимых
термодинамических переменных, описывающих состояние системы;
k – количество компонентов, образующих систему;
f – количество фаз, находящихся в равновесии
Под структурой сплава понимают видимое в микроскоп
взаимное расположение фаз, их форму и размеры
2
3.
Фазы в металлическихсистемах
Жидкая фаза – однородный жидкий раствор – характерен
почти для всех металлов, растворяющихся друг в друге в
жидком состоянии в любых соотношениях.
Твердые фазы – в зависимости от физико-химического
взаимодействия типы твердых фаз могут быть различными.
1. Механическая смесь двух компонентов А и В образуется
тогда, когда при кристаллизации компоненты сплава не
способны к взаимному растворению в твердом состоянии и не
вступают в химическую реакцию с образованием соединения.
Структура состоит из кристаллов А и В.
2. Химическое соединение. Имеет следующие особенности:
- состав может быть выражен формулой АnВm, где А и В –
элементы (компоненты), n и m – целые числа
- кристаллическая решетка отличается от решеток элементов
(компонентов), образующих соединение
- свойства резко отличаются от свойств элементов
(компонентов), образующих соединение
3
4.
Фазы в металлическихсистемах. Твердые растворы
3. Твердые растворы - фазы, в которых один из компонентов
сплава сохраняет свою кристаллическую решетку, а атомы других
(или другого) компонентов располагаются в решетке первого
компонента (растворителя), изменяя ее периоды
замещения
Атом растворителя
(Rм)
внедрения
Атом растворенного
элемента
(Rэл)
Неограниченные
если решетки
Образуются
путем–замены
атома
одинаковы
и Rэл/Rмет ≤в0,85-1,15
металла-растворителя
его
Feα и Cr)
γ и Mn, растворенного
решетке(Fe
атомами
Ограниченные
– если радиусы или
элемента.
тип решетки различаются
(Feα и Ni, Feγ и Cr)
Образуются путем размещения
Бывают только
атомов растворенного элемента
ограниченные,
в порах решетки металлат.к. число пор
растворителя
ограничено
(Rэл / Rмет ≤ 0,59).
(C, N, O, H, B в железе)
4
5.
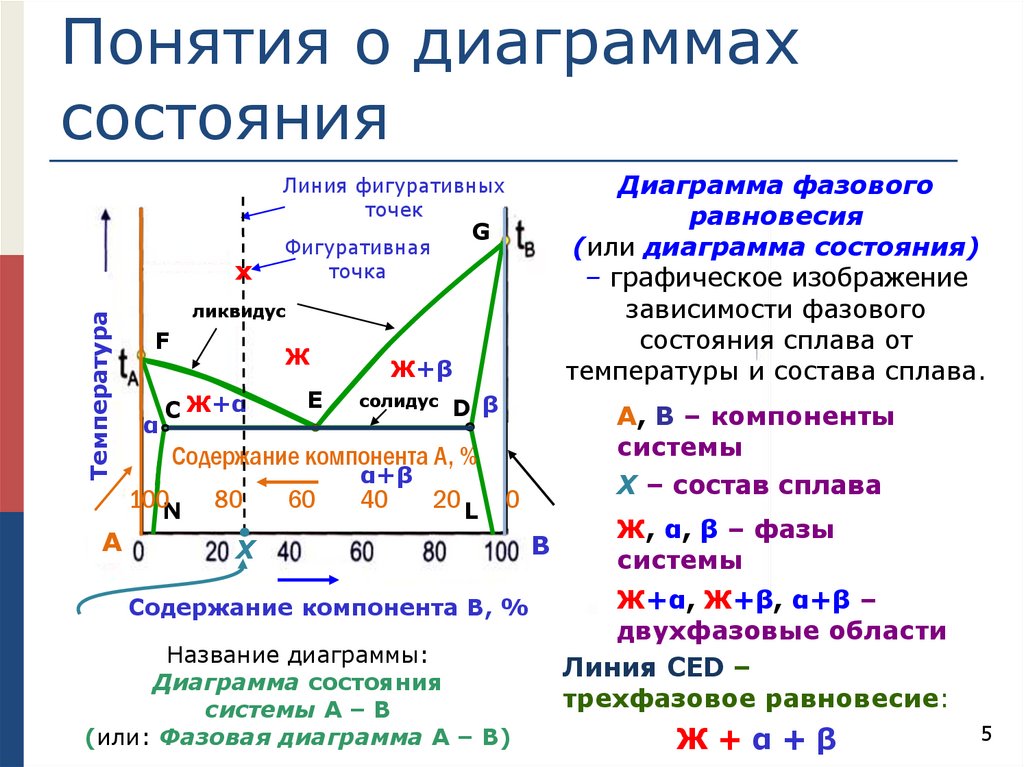
Понятия о диаграммахсостояния
Диаграмма фазового
равновесия
(или диаграмма состояния)
– графическое изображение
зависимости фазового
состояния сплава от
температуры и состава сплава.
Линия фигуративных
точек
Температура
х
ликвидус
F
α
Ж
С Ж+α
Е
Ж+β
солидус
D β
А, В – компоненты
системы
Х – состав сплава
Содержание компонента А, %
100N
А
G
Фигуративная
точка
80
60
α+β
40
20 L
0
Х
Содержание компонента В, %
Название диаграммы:
Диаграмма состояния
системы А – В
(или: Фазовая диаграмма А – В)
В
Ж, α, β – фазы
системы
Ж+α, Ж+β, α+β –
двухфазовые области
Линия СED –
трехфазовое равновесие:
Ж+α+β
5
6.
Понятия о диаграммахсостояния
Диаграмма состояния однокомпонентной системы имеет только
одно измерение - шкалу температур (давление – постоянное).
Точки на этой шкале показывают температуры фазовых
превращений.
Для двухкомпонентной системы диаграмма строится в двух
измерениях. По оси ординат откладывают температуру, по оси
абсцисс – содержание компонентов. Каждая точка на оси абсцисс
соответствует определенному составу сплава. При этом крайние
точки
оси
абсцисс
соответствуют
чистым
компонентам,
промежуточные – двойным сплавам.
Диаграмма равновесия трехкомпонентных сплавов имеет две
концентрационные оси и одну температурную ось.
Состояние сплава данного состава при данной температуре
характеризуется
на
диаграмме
фигуративной
точкой.
Вертикаль,
отвечающая
изменению
температуры
сплава
определенного состава, называется линией фигуративных
точек (линией сплава).
Линии на диаграмме соответствуют фазовым превращениям.
Области между линиями соответствуют тому или иному
равновесному фазовому составу (фазовому равновесию).Между
двумя наклонными линиями в равновесии находятся 2 фазы.
Горизонтальная
линия
соответствует
трехфазовому
равновесию
1
6
7.
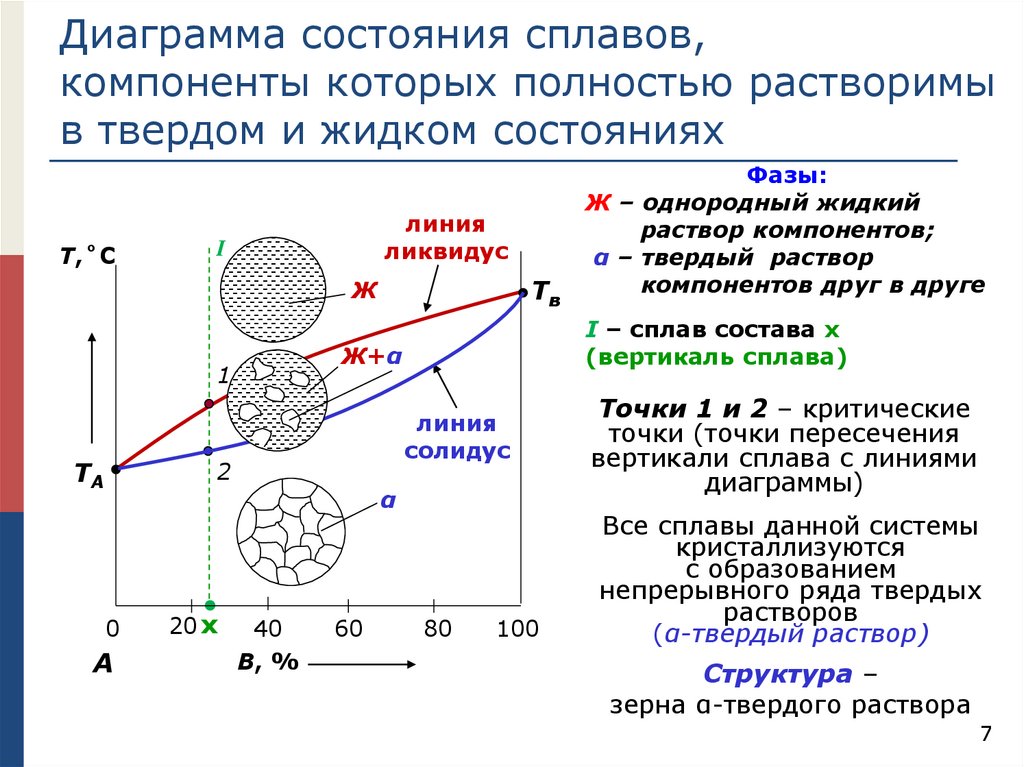
Диаграмма состояния сплавов,компоненты которых полностью растворимы
в твердом и жидком состояниях
Т,˚C
линия
ликвидус
I
Тв
Ж
ТA
I – сплав состава х
(вертикаль сплава)
Ж+α
1
линия
солидус
2
α
0
А
20 х
40
B, %
60
Фазы:
Ж – однородный жидкий
раствор компонентов;
α – твердый раствор
компонентов друг в друге
80
100
Точки 1 и 2 – критические
точки (точки пересечения
вертикали сплава с линиями
диаграммы)
Все сплавы данной системы
кристаллизуются
с образованием
непрерывного ряда твердых
растворов
(α-твердый раствор)
Структура –
зерна α-твердого раствора
7
8.
Правило отрезковТ,˚C
I
Ж
Ж+α
c
Т1
a
Рычаг своими концами
2. Проводим вертикаль сплава
соединяет точки,
I через точку х (показывает
показывающие
состав
сплава): составы фаз,
находящихся
в равновесии
I – сплав состава
х. при
в
ТA
данной температуре
α
Количество жидкости (Ж) в сплаве
I при данной температуре Т1
определяется пропорцией:
Qж = ав/cв · 100 %.
в’
c’
0
А
1. При
температуре
Т1
Правило
отрезков
проводим рычага caв АВ.
действует только в
Его концы, т.е. точки c и в
двухфазовой
области (т.е.
ТB показывают
составы фаз при
между 2-мя
наклонными
температуре
Т1: жидкости
(c’) и
линиями):
твердого раствора
(в’).
20 х 40
B, %
60
80
100
В
Количество твердого раствора
(α) в сплаве при данной
температуре определяется
пропорцией:
8
Qα = cа/cв · 100 % .
9.
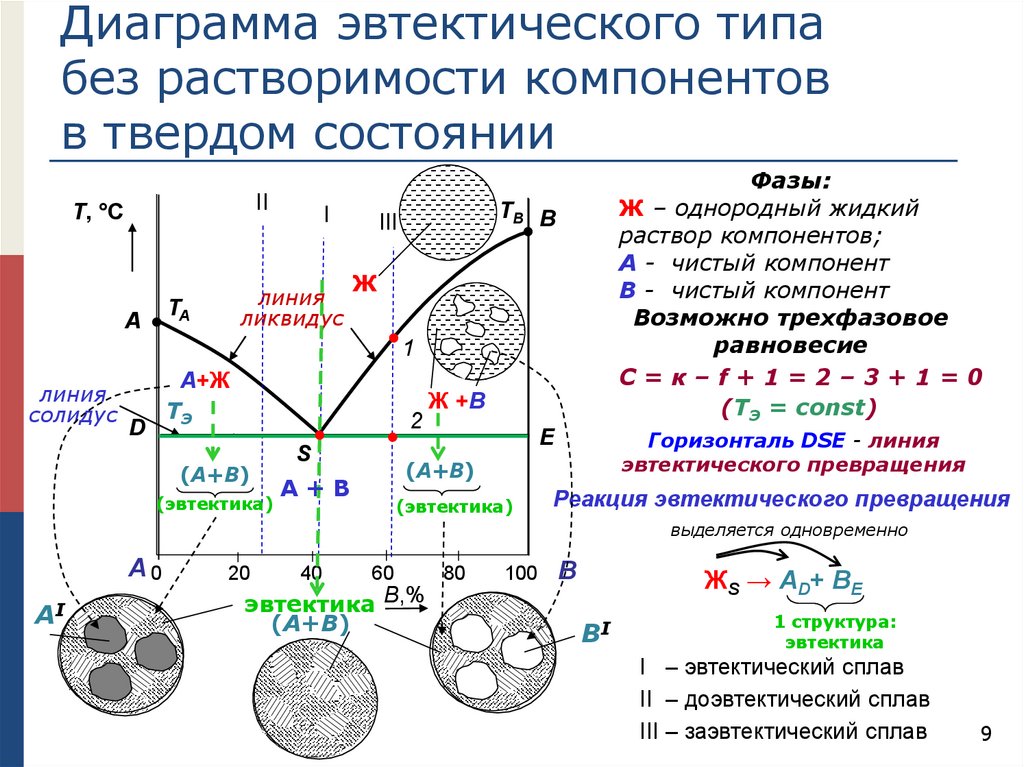
Диаграмма эвтектического типабез растворимости компонентов
в твердом состоянии
II
Т, °С
линия
ликвидус
TA
A
I
Фазы:
Ж – однородный жидкий
раствор компонентов;
А - чистый компонент
В - чистый компонент
Возможно трехфазовое
равновесие
С=к–f+1=2–3+1=0
(TЭ = const)
TB B
III
Ж
1
линия
солидус
А+Ж
TЭ
D
2
(А+В)
(эвтектика)
S
Ж +В
Горизонталь DSE - линия
эвтектического превращения
E
(А+В)
А+В
(эвтектика)
Реакция эвтектического превращения
выделяется одновременно
А0
АI
20
40
60
эвтектика B,%
(А+В)
Ж
80
100
В
ЖS → АD+ ВE
ВI
1 структура:
эвтектика
I – эвтектический сплав
II – доэвтектический сплав
III – заэвтектический сплав
9
10.
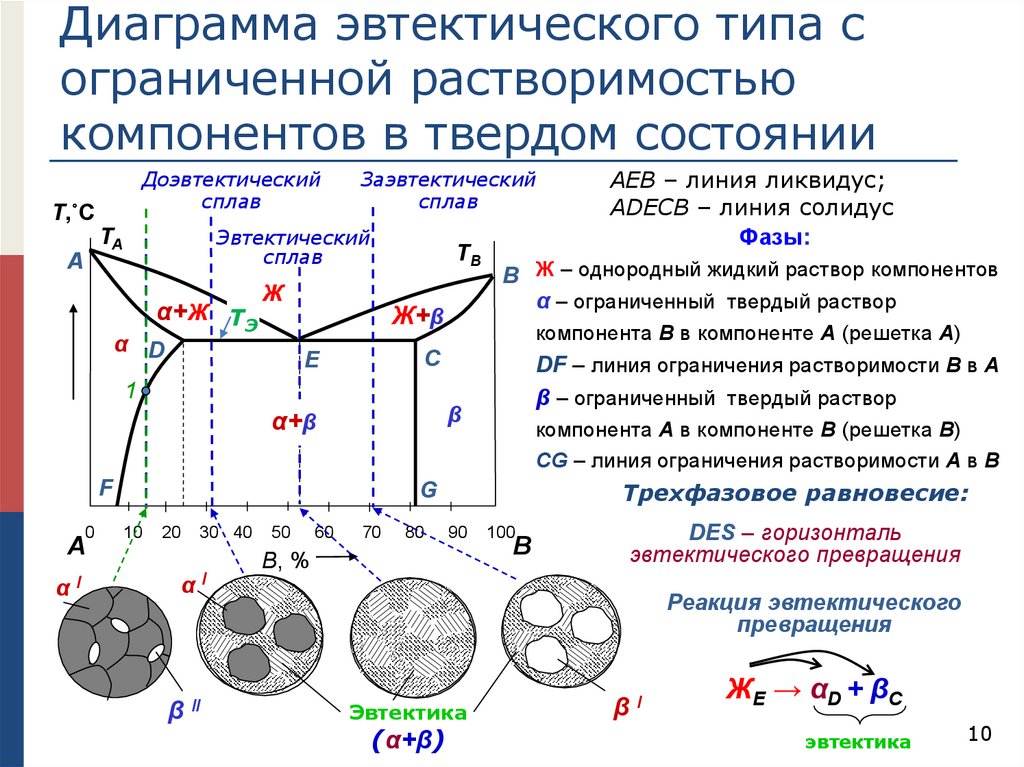
Диаграмма эвтектического типа сограниченной растворимостью
компонентов в твердом состоянии
Доэвтектический
сплав
Т,˚C
Эвтектический
сплав
TA
A
Заэвтектический
сплав
α+Ж TЭ
TB
Ж
α D
Ж+β
Е
F
0
αI
компонента В в компоненте А (решетка А)
DF – линия ограничения растворимости В в А
β – ограниченный твердый раствор
β
α+β
А
B Ж – однородный жидкий раствор компонентов
α – ограниченный твердый раствор
C
1
компонента А в компоненте В (решетка В)
CG – линия ограничения растворимости А в В
Трехфазовое равновесие:
G
10
20
30 40
αI
β II
50
60
70
80
АЕВ – линия ликвидус;
АDEСВ – линия солидус
Фазы:
90
B, %
100
В
DES – горизонталь
эвтектического превращения
Реакция эвтектического
превращения
Эвтектика
(α+β)
βI
ЖE → α D + β C
эвтектика
10
11.
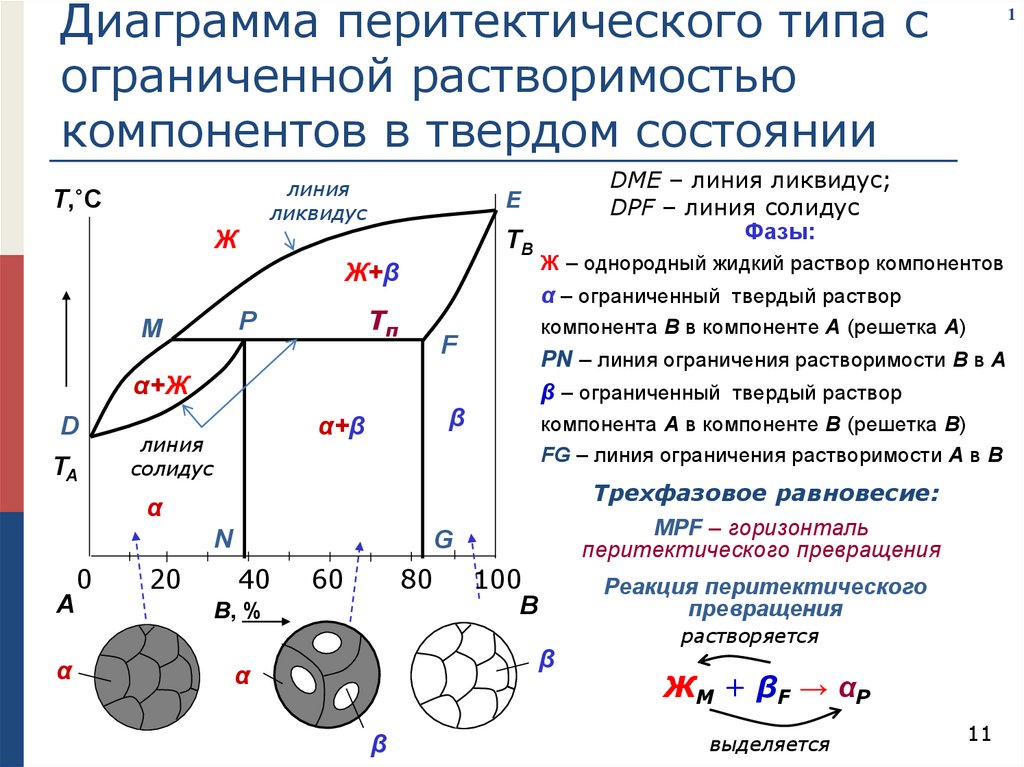
Диаграмма перитектического типа сограниченной растворимостью
компонентов в твердом состоянии
линия
ликвидус
Т,˚C
TB
Ж+β
компонента В в компоненте А (решетка А)
F
PN – линия ограничения растворимости В в А
β – ограниченный твердый раствор
α+Ж
D
TA
β
α+β
линия
солидус
Ж – однородный жидкий раствор компонентов
α – ограниченный твердый раствор
Tп
P
M
DME – линия ликвидус;
DPF – линия солидус
Фазы:
E
Ж
компонента А в компоненте В (решетка В)
FG – линия ограничения растворимости А в В
Трехфазовое равновесие:
α
N
А
α
0
20
1
MPF – горизонталь
перитектического превращения
G
40
60
80
B, %
100
В
Реакция перитектического
превращения
β
α
β
растворяется
ЖM + βF → αP
выделяется
11
12.
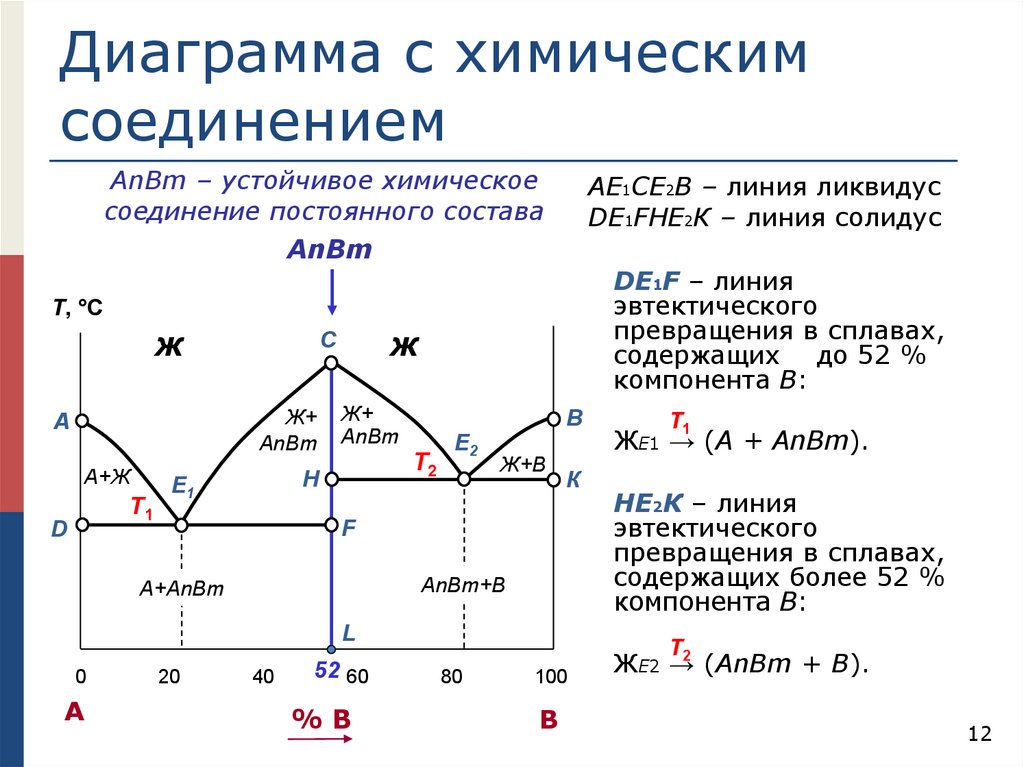
Диаграмма с химическимсоединением
АnВm – устойчивое химическое
соединение постоянного состава
АЕ1СЕ2В – линия ликвидус
DЕ1FHЕ2К – линия солидус
АnВm
DЕ1F – линия
эвтектического
превращения в сплавах,
содержащих до 52 %
компонента В:
Т, °С
Ж
Ж+
АnВm
А
А+Ж
Т1
D
Ж
C
Ж+
АnВm
Т2
H
E1
В
E2
Ж+В
К
F
АnВm+В
A+АnВm
L
0
А
20
40
52 60
%В
Т1
ЖЕ1 → (А + АnВm).
HЕ2К – линия
эвтектического
превращения в сплавах,
содержащих более 52 %
компонента В:
Т
80
100
В
ЖЕ2 →2 (АnВm + В).
12
13.
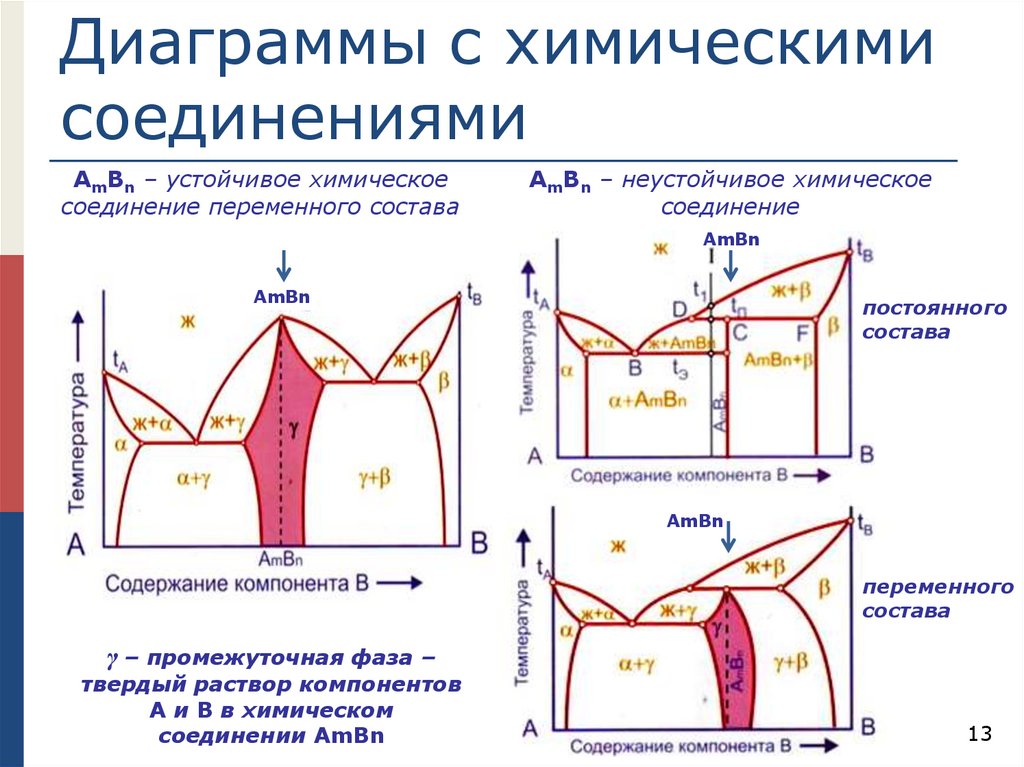
Диаграммы с химическимисоединениями
АmВn – устойчивое химическое
соединение переменного состава
АmВn – неустойчивое химическое
соединение
АmВn
АmВn
постоянного
состава
АmВn
переменного
состава
γ – промежуточная фаза –
твердый раствор компонентов
А и В в химическом
соединении АmВn
13
14.
Диаграммы с полиморфнымипревращениями
t1
t2
t3
t4
Полиморфное превращение в
Полиморфное превращение в одном
двух компонентах – А и В
компоненте – в компоненте А
t1-t2 – интервал кристаллизации
(Аα и А – полиморфные модификации)
tэв – температура эвтектоидного
t1-t2 – интервал температур
превращения
кристаллизации
t3-t4 – интервал температур полиморфного
KEF – линия эвтектоидного превращения
превращения
Линии:
γE → αK+ βF
ас – начало полиморфного γ→α превращения
аb – конец полиморфного γ→α превращения
14
эвтектоид







 chemistry
chemistry








