Similar presentations:
Влияние среды на протекание окислительно-восстановительных реакций (на примере соединений марганца)
1. Влияние среды на протекание окислительно-восстановительных реакций (на примере соединений марганца)
Один опыт я ставлю выше, чем тысячумнений, рожденных только воображением»
М.В. Ломоносов
«
Влияние среды на протекание
окислительновосстановительных реакций
(на примере соединений марганца)
2. Повторим
• Окислительно-восстановительные реакции – это такие реакции,при которых происходит переход электронов от одних атомов,
молекул или ионов к другим.
• Окисление – это процесс отдачи электронов, степень окисления при
этом повышается.
• Восстановление – это процесс присоединения электронов, степень
окисления при этом понижается.
• Атомы, молекулы или ионы, отдающие электроны, окисляются;
являются восстановителями.
Атомы, ионы или молекулы, принимающие электроны,
восстанавливаются; являются окислителями.
• Окислительно – восстановительные реакции – единство двух
противоположных процессов: окисления и восстановления.
3.
• Какие из следующих веществ могут быть:а) только окислителями;
• б) только восстановителями;
• в) и окислителями, и восстановителями:
• CrO3, Mg3P2, NaMnO4, SO2, KI, KNO2,
LiClO4, KH, Fe, H2O2, (NH4)2S, KSCN
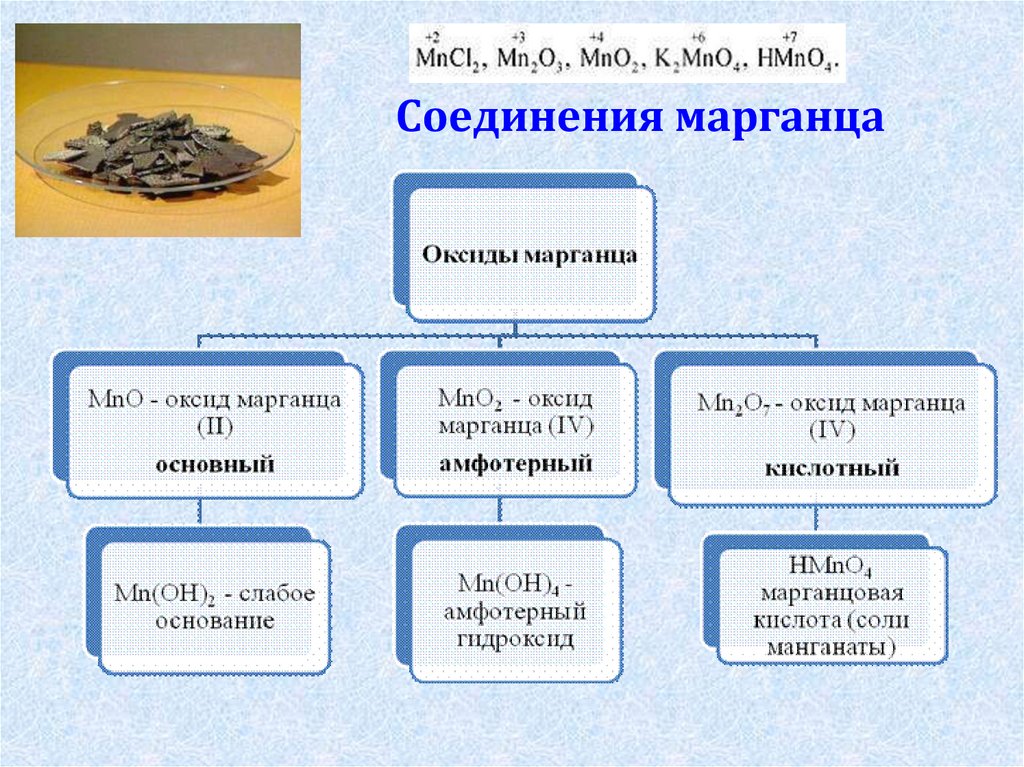
4. Соединения марганца
5.
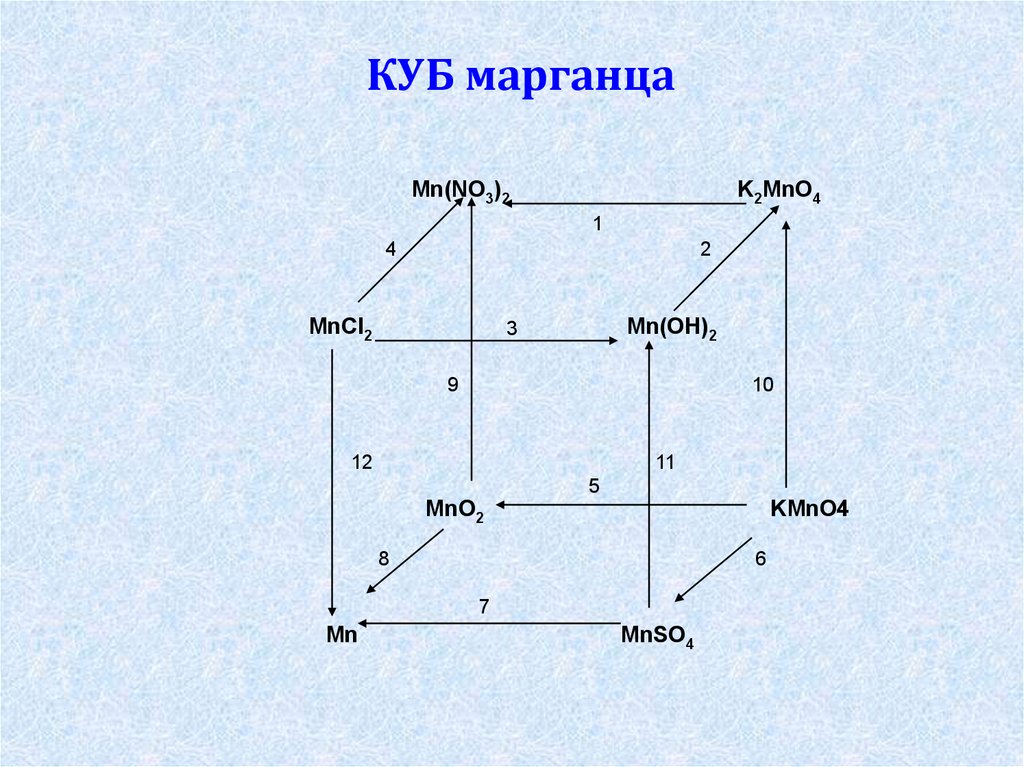
КУБ марганцаMn(NO3)2
K2MnO4
1
4
2
MnCl2
Mn(OH)2
3
9
10
12
11
5
MnO2
KMnO4
8
6
7
Mn
MnSO4
6.
КУБ марганцаMn(NO3)2
K2MnO4
MnCl2
Mn(OH)2
ОН-
Н2О
MnO2
KMnO4
Н+
Mn
MnSO4
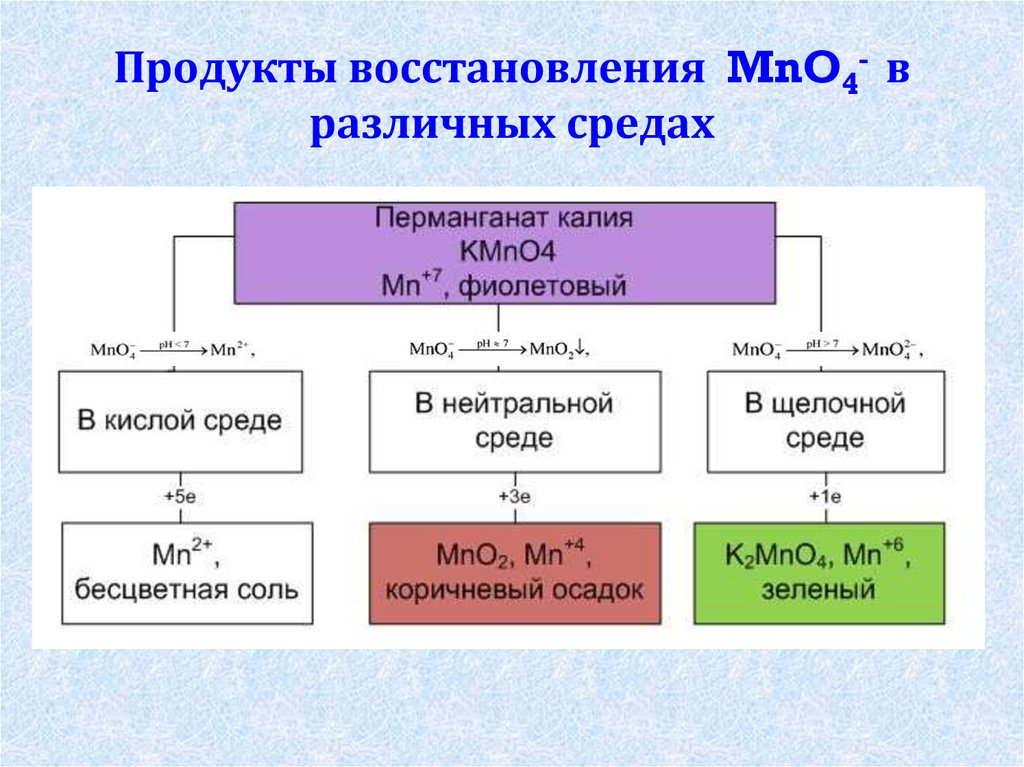
7. Перманганат калия – соль марганцевой кислоты
8.
РастворKMnO4
(малиновый)
Na2SO3
Na2SO3
Среда
Среда
Среда
кислая
нейтральная
щелочная
(H2SO4)
(Н2О)
Na2SO3
(КOH)
контроль
9.
РастворKMnO4
(малиновый)
бесцветный
(в кислой
среде)
бурый
зелёный
(в нейтральной
(в щелочной
среде)
среде)
контроль
10. Продукты восстановления MnO4- в различных средах
11. Составьте уравнения ОВР методом электронного баланса:
KMnO4 + K2SO3 + H2SO4 →KMnO4 + K2SO 3 + H2O→
KMnO4 + K2SO3 + КOH →
укажите окислитель и восстановитель
12.
• 2KMnO4 + 5K2SO3 + 3H2SO4 = 2MnSO4 + 6K2SO4 + 3H2O• 2KMnO4 + 3K2SO 3 + H2O = 2MnO2↓ + 3K2SO4 + 2KOH
• 2KMnO4 + K2SO3 + 2КOH = 2K2MnO4 + K2SO4 + H2O
13.
Kahoot.it• Спасибо за
работу!
14.
Пятна от раствора перманганата калия быстровыводятся раствором пероксида водорода,
подкисленным уксусной кислотой:
2KMnO4 + 9H2O2 + 6CH3COOH =
2Mn(CH3COO)2 +2CH3COOK + 7O2 + 12H2O
Старые пятна перманганата калия содержат
оксид марганца (IV), поэтому будет протекать еще
одна реакция:
MnO2 + 3H2O2 + 2CH3COOH =
Mn(CH3COO)2 + 2O2 + 4H2O











 chemistry
chemistry








