Similar presentations:
Окислители и восстановители в реакциях ОВР. Повторение пройденного материала
1.
Окислители ивосстановители в
реакциях ОВР
Выполнила работу: Ермакова В.А. ,учитель химии,
МБОУ «СОШ №106 г.Челябинска»
2. Повторение пройденного материала
• Что такое степень окисления?Степень окисления - условный заряд атомов в химическом соединении,
вычисленный исходя из предположения, что это соединение состоит из
простых ионов
• Как рассчитывается степень окисления по
формулам соединений?(вспомните правила)
1.Степень окисления кислорода почти всегда равна -2. (Кроме пероксидов, здесь степень
окисления кислорода равна -1, в OF2 степень кислорода равна +2.
2.Степень окисления водорода почти всегда равна +1. (В гидридах она равна -1.)
3.Степень окисления фтора в соединениях всегда равна -1: (HF-1, CaF-12).
4.Степень окисления металлов всегда положительна и в максимальном значении
почти всегда равна номеру группы.
5.Степень окисления свободных атомов и атомов в простых веществах всегда равна 0.
6.Суммарная степень окисления атомов всех элементов в соединении равна 0.
3. Повторение пройденного материала
• Вычислите степень окисления для атомауглерода в соединении
H2CO3
Степень окисления для водорода равна +1, для кислорода -2
Вычисляем степень окисления для углерода
(+1) · 2 + х + (-2) · 3 = 0
х=+4
4. Определения
• Атомы, ионы или молекулы, отдающиеэлектроны называются восстановителями
• Процесс
отдачи
электронов
называется
окислением
• Атомы, ионы или молекулы, принимающие
электроны называются окислителями
• Процесс принятия электронов называется
восстановлением.
5. Метод электронного баланса
• В ОВР число электронов отдаваемых восстановителем,равно числу электронов, принимаемых окислителем, то
есть соблюдается электронный баланс
План составления уравнений ОВР и электронного баланса к ним
1.
Записать схему реакции.
2.
Определить, атомы каких элементов изменяют степень
окисления.
3.
Составить электронные уравнения процессов окисления и
восстановления.
4.
Подобрать общее делимое для отданных и принятых
электронов и коэффициенты для электронных уравнений.
5.
Перенести эти коэффициенты в уравнение ОВР и подобрать
коэффициенты перед формулами других веществ.
6.
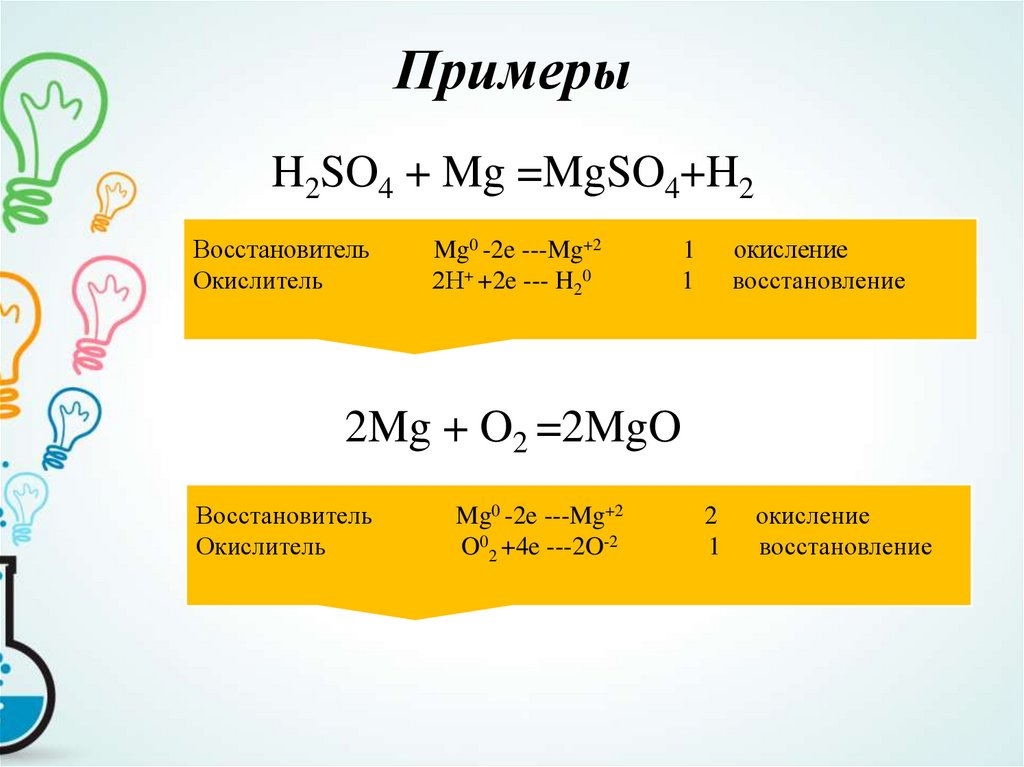
Рассмотрим пример:7. Примеры
H2SO4 + Mg =MgSO4+H2Восстановитель
Окислитель
Mg0 -2e ---Mg+2
2Н+ +2e --- H20
окисление
восстановление
1
1
2Mg + O2 =2MgO
Восстановитель
Окислитель
Mg0 -2e ---Mg+2
O02 +4e ---2O-2
2
1
окисление
восстановление
8. Домашнее задание
• Определить, чем является алюминий в даннойреакции (окислителем или восстановителем) и
расставить стехиометрические коэффициенты
H2SO4 + Al = Al2(SO4)3 + H2↑
• Определить, чем является хлор в данной
реакции (окислителем или восстановителем) и
расставить стехиометрические коэффициенты
Fe + Cl2 = FeCl3







 chemistry
chemistry








