Similar presentations:
Непредельные углеводороды. Этиленовые углеводороды (алкены)
1. Непредельные углеводороды
Углеводороды, в молекулах которыхесть атомы углерода, соединённые
двойной (=) или тройной (≡)
связью.
1
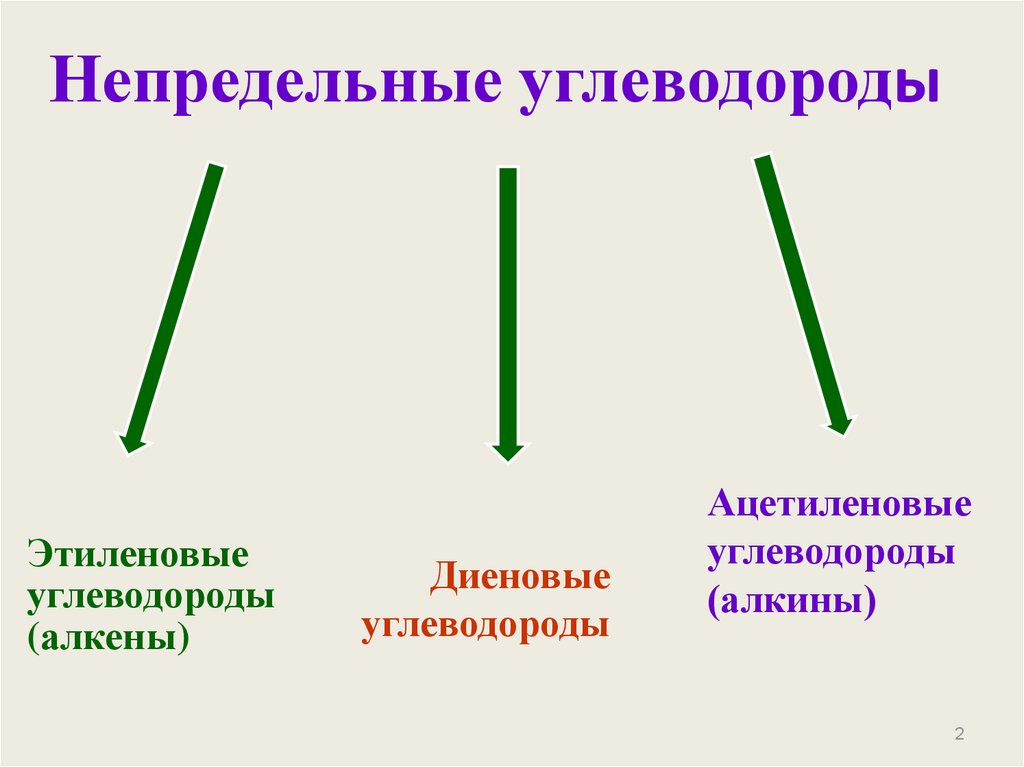
2. Непредельные углеводороды
Этиленовыеуглеводороды
(алкены)
Диеновые
углеводороды
Ацетиленовые
углеводороды
(алкины)
2
3.
НоменклатураСтроение
молекулы
Изомерия
Физические
свойства
CnH2n
Химические
свойства
Получение
Проверка
знаний
Применение
4.
CHАлкены – ациклические
n 2n
углеводороды, в молекуле
которых кроме одинарных
связей содержится одна двойная
связь между атомами углерода.
Общая формула: СnH2n
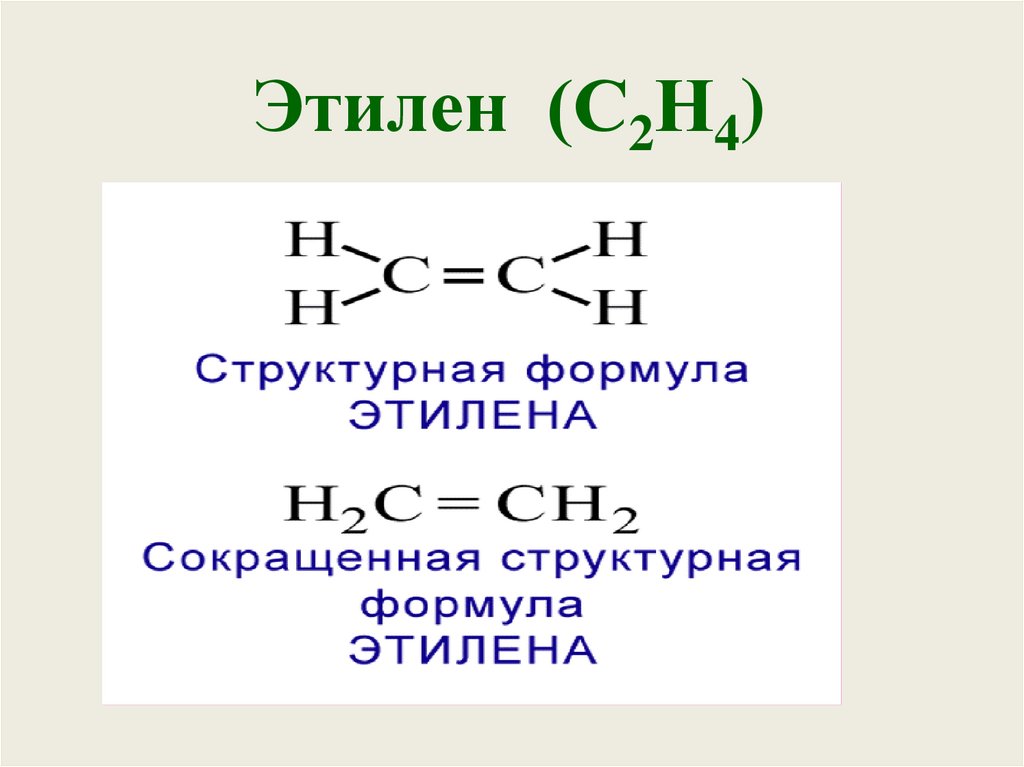
5. Этилен (С2Н4)
6.
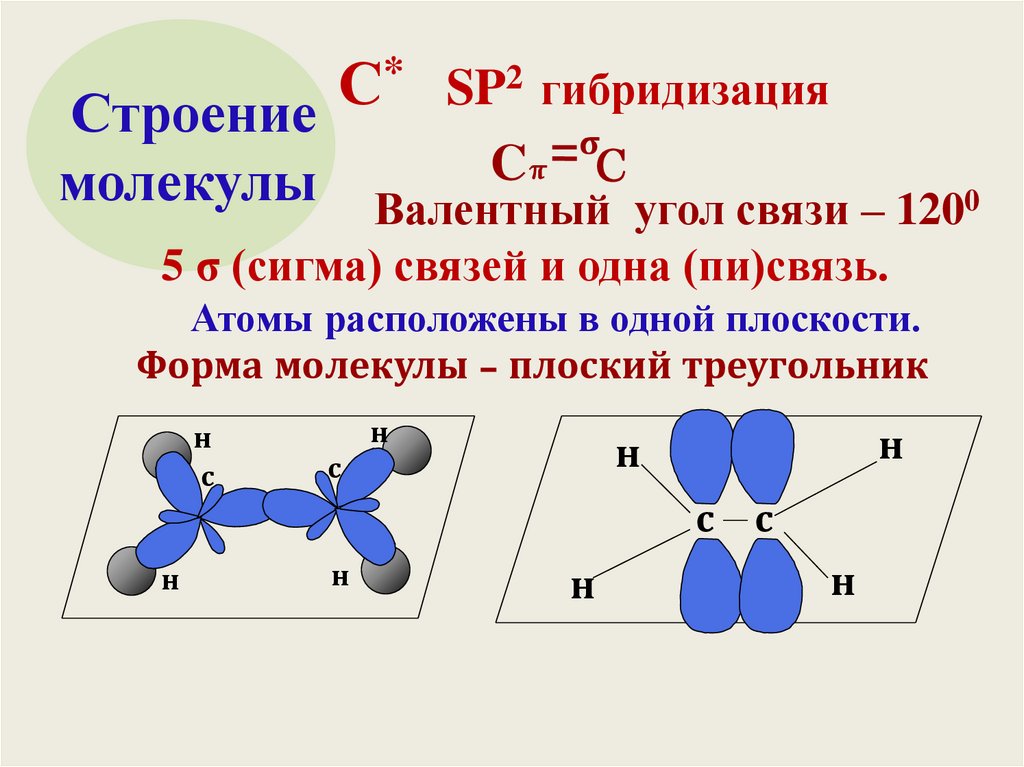
* SP2 гибридизацияС
Строение
σ
Cπ C
молекулы Валентный угол связи – 1200
5 σ (сигма) связей и одна (пи)связь.
Атомы расположены в одной плоскости.
Форма молекулы – плоский треугольник
н
с
н
н
н
с
с
н
н
н
с
н
7. Гомологический ряд этилена
С2Н4 этен, этилен, С3Н6 пропен,С4Н8 бутен, С5Н10 пентен, С6Н12 гексен,
С7Н14 гептен, С8Н16 октен, С9Н18 нонен,
С10Н20 декен
CnH2n общая формула алкенов
8.
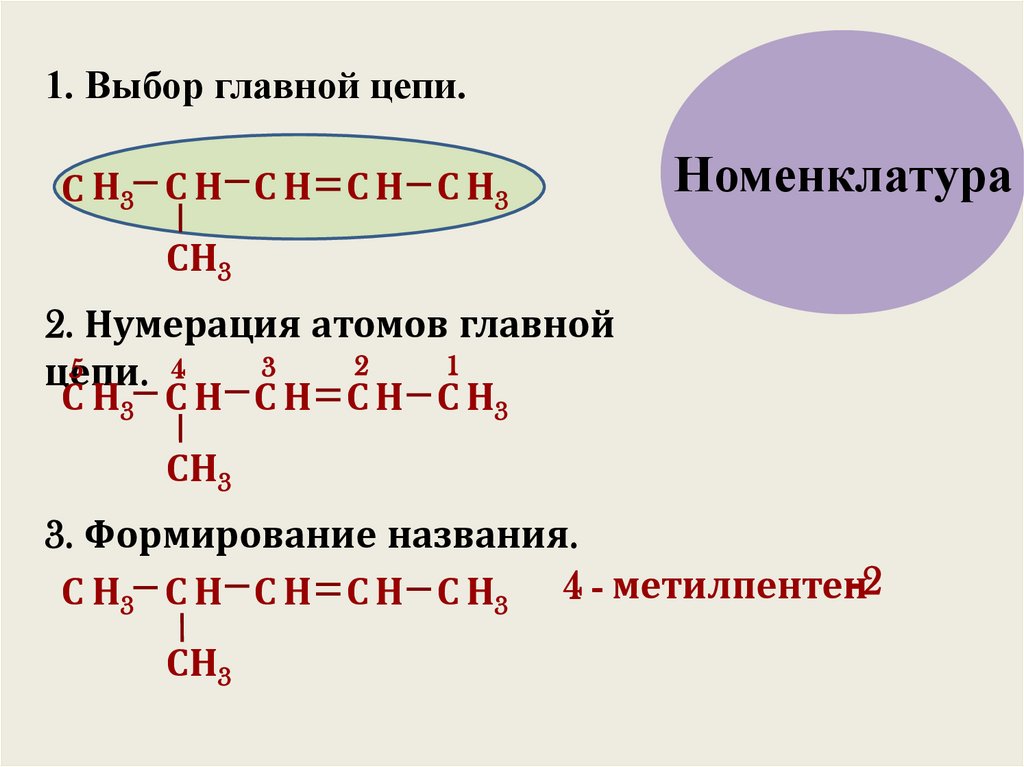
1. Выбор главной цепи.С Н3 С Н С Н С Н С Н3
Номенклатура
СН3
2. Нумерация атомов главной
2
1
3
5
4
цепи.
С Н3 С Н С Н С Н С Н3
СН3
3. Формирование названия.
С Н3 С Н С Н С Н С Н3 4 - метилпентен-2
СН3
9. Виды изомерии алкенов
1.Изомерия углеродного скелета1
2
3
4
СН2 = СН- СН2 - СН3 бутен-1
1
2
3
СН2 = С – СН3 2 метилпропен-1
СН3
9
10. 2. Изомерия положения кратной связи:
12
3
4
СН2= СН – СН2- СН3
1
2
3
бутен 1
4
СН3 – СН = СН – СН3 бутен 2
10
11. 3.Межклассовая изомерия
12
3
4
СН2 = СН – СН2 – СН3 бутен 1
(этиленовые углеводороды)
Н2С – СН2
│ │
Н2С - СН2
циклобутан
( циклопарафины)
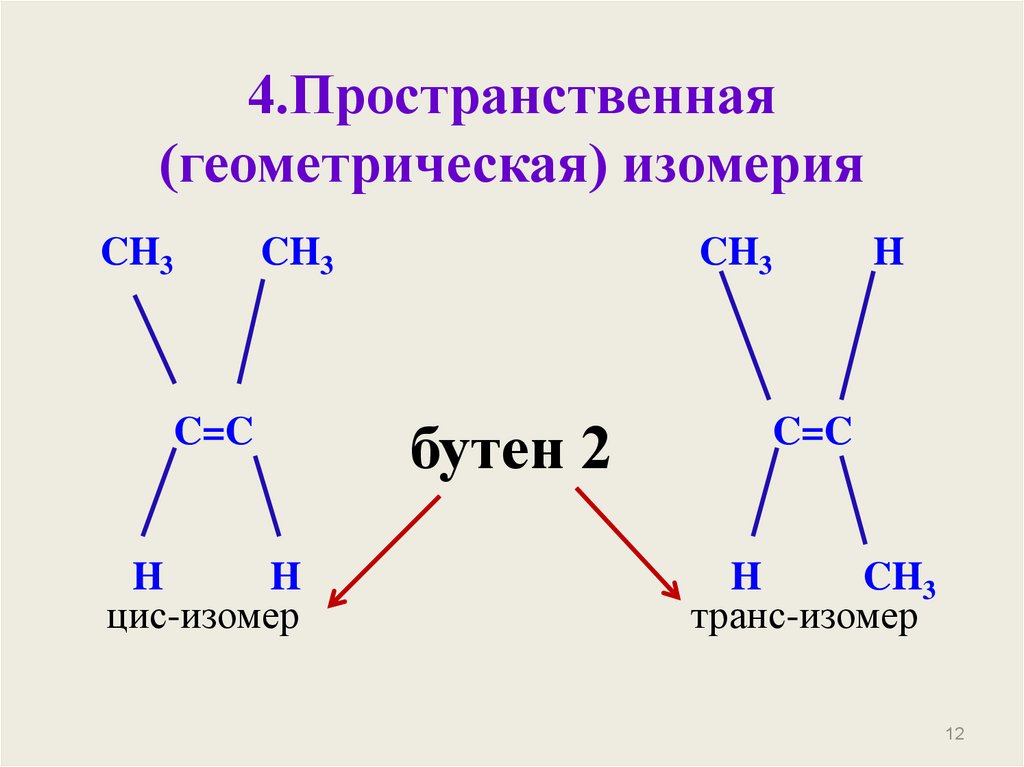
12. 4.Пространственная (геометрическая) изомерия
CH3CH3
C=C
H
H
цис-изомер
CH3
бутен 2
H
C=C
H
CH3
транс-изомер
12
13.
Агрегатноегазообразные
состояние:
С Н –С Н
2
4
4
8
С5Н10 – С18Н36
с С19Н38
Физические
свойства
вещества;
жидкости;
твердые вещества
С увеличением молекулярной массы соединений
температуры кипения и плавления закономерно
повышаются.
Этилен С2Н4
Плохо в
Н2О
0
T = - 169,20С
пл
Tкип = - 103,7 С
14.
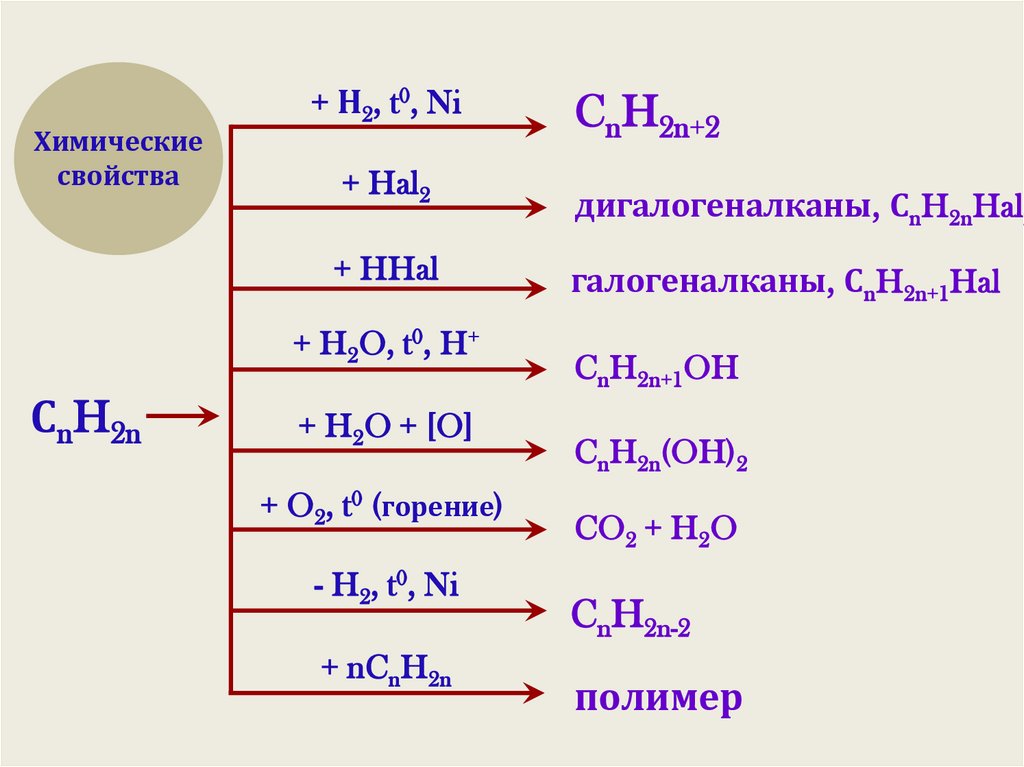
Химическиесвойства
+ Н2, t0, Ni
+ Hal2
дигалогеналканы, СnH2nHal2
+ HHal
галогеналканы, СnH2n+1Hal
+ H2O, t0, H+
СnH2n
CnH2n+2
+ H2O + [O]
+ O2, t0 (горение)
- H2, t0, Ni
+ nCnH2n
CnH2n+1OH
CnH2n(OH)2
CO2 + H2O
CnH2n-2
полимер
15.
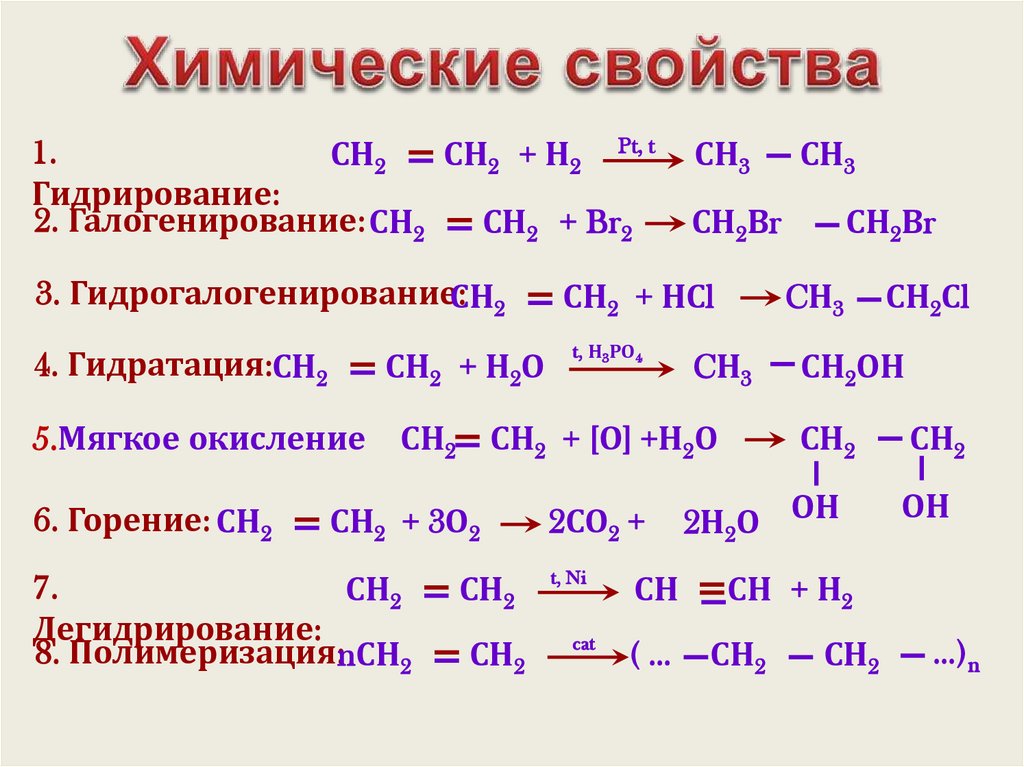
1.СН2
СН2 + Н2 Pt, t
Гидрирование:
2. Галогенирование: СН2
СН2 + Br2
СН3
СН2Вr
3. Гидрогалогенирование:СН2
СН2 + НСl
4. Гидратация:СН2
СН2 + Н2О
t, Н3РО4
5.Мягкое окисление
СН2 СН2 + [О] +Н2О
6. Горение: СН2
СН2 + 3О2
7.
СН2
Дегидрирование:
8. Полимеризация:nСН2
2СО2 +
СН3
СН2Вr
CН3
CН3
СН2Сl
СН2ОН
СН2
СН2
2Н2О ОН
ОН
СН2
t, Ni
СН
СН + Н2
СН2
cat
(…
СН2
СН2
…)n
16. Бромирование этилена
17.01.2024Кузнецова О.Н.
16
17. Окисление этилена раствором марганца
17.01.2024Кузнецова О.Н.
17
18. Получение алкенов
1. Реакция дегидрирования алкановС4 Н10 → С4 Н 8 + Н2 ( катализатор, температура)
2.Реакция дегидратации спиртов
С2Н5ОН → С2Н4 + Н2О ( катализатор Н2SО4, Т )
3. Из моногалогенопроизводных углеводородов
С2Н5Cl + KOH ( спирт. раствор) → С2Н4 +КСl + H2O
4. Из дигалогенопроизводных углеводородов
С5Н10 Cl2 + Zn → C5H10 + ZnCl2
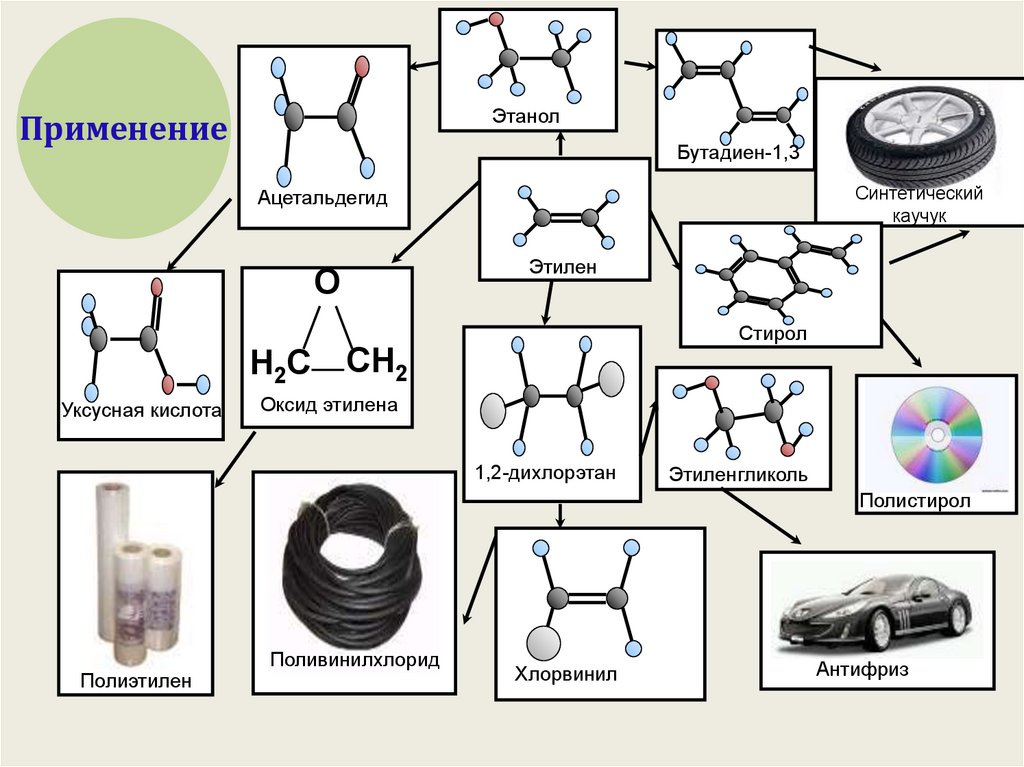
19.
ЭтанолПрименение
Бутадиен-1,3
Синтетический
каучук
Ацетальдегид
Этилен
О
Н2С
Уксусная кислота
Стирол
СН2
Оксид этилена
1,2-дихлорэтан
Этиленгликоль
Полистирол
Полиэтилен
Поливинилхлорид
Хлорвинил
Антифриз










 chemistry
chemistry








