Similar presentations:
Dobra praktyka wytwarzania
1. DOBRA PRAKTYKA WYTWARZANIA
PRODUKTÓW LECZNICZYCH WYTWARZANYCH Z KRWI I OSOCZALUDZKIEGO kurs przypominający
mgr E. Garbula
2. GMP a system jakości w służbie krwi
Art.11 dyrektywy 2002/98/WE i zaleceniaRady Europy obligują jednostki
organizacyjne służby krwi do ustanowienia
systemu jakości opartego na zasadach
dobrych praktyk
Jakość powstaje
podczas wytwarzania,
a nie podczas kontroli
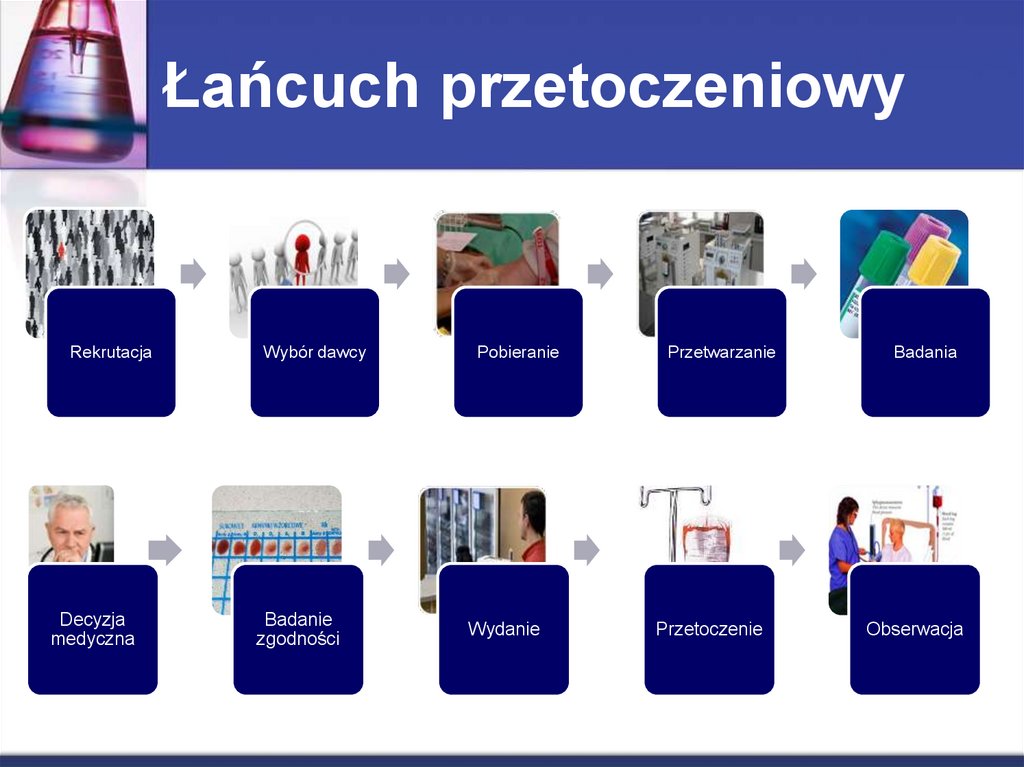
3. Łańcuch przetoczeniowy
RekrutacjaDecyzja
medyczna
Wybór dawcy
Pobieranie
Przetwarzanie
Badanie
zgodności
Wydanie
Przetoczenie
Badania
Obserwacja
4. GMP – Good Manufacturing Practice
Eliminuje błędyjakościowe
Eliminuje z procesu wytwarzania
jakąkolwiek improwizację i
przypadkowość ( z góry określone
procedury)
Wszystkie elementy GMP: , organizacja,
dokumentacja, szkolenia personelu, audyty,
samokontrole, kwalifikacje, walidacje są wbudowane
w strukturę organizacyjną placówki służby krwi
Zapewnia
standaryzację i
odpowiednią jakość
produktów
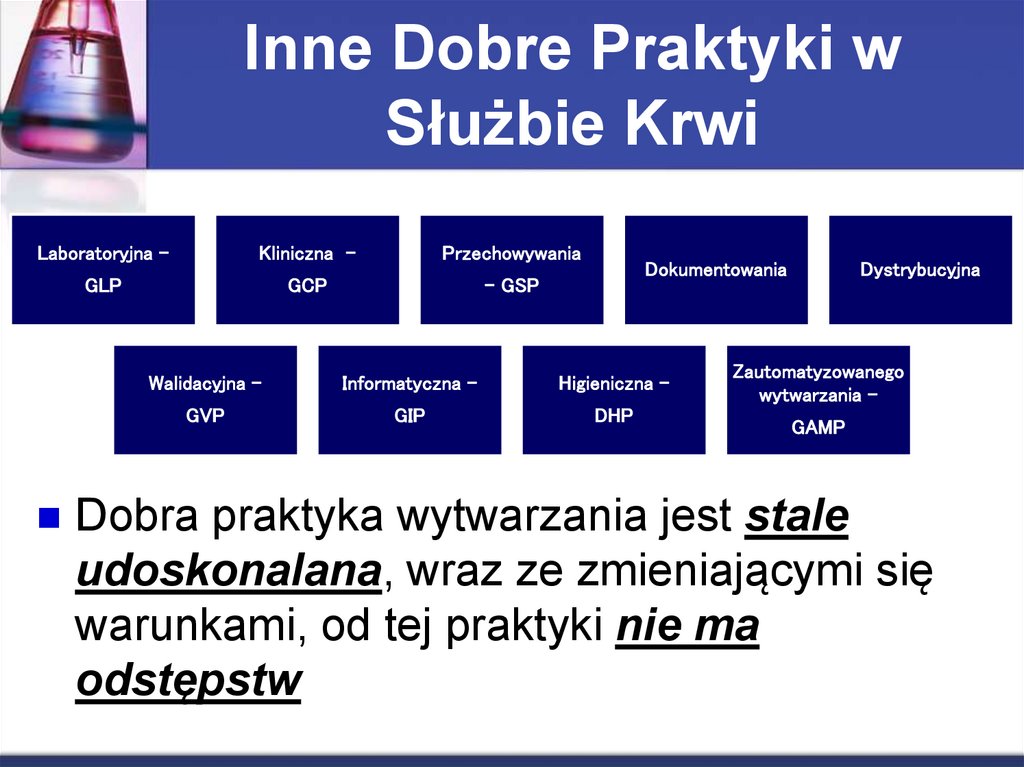
5. Inne Dobre Praktyki w Służbie Krwi
Laboratoryjna –Kliniczna -
Przechowywania
GLP
GCP
- GSP
Dokumentowania
Walidacyjna -
Informatyczna –
Higieniczna -
GVP
GIP
DHP
Dystrybucyjna
Zautomatyzowanego
wytwarzania –
GAMP
Dobra praktyka wytwarzania jest stale
udoskonalana, wraz ze zmieniającymi się
warunkami, od tej praktyki nie ma
odstępstw
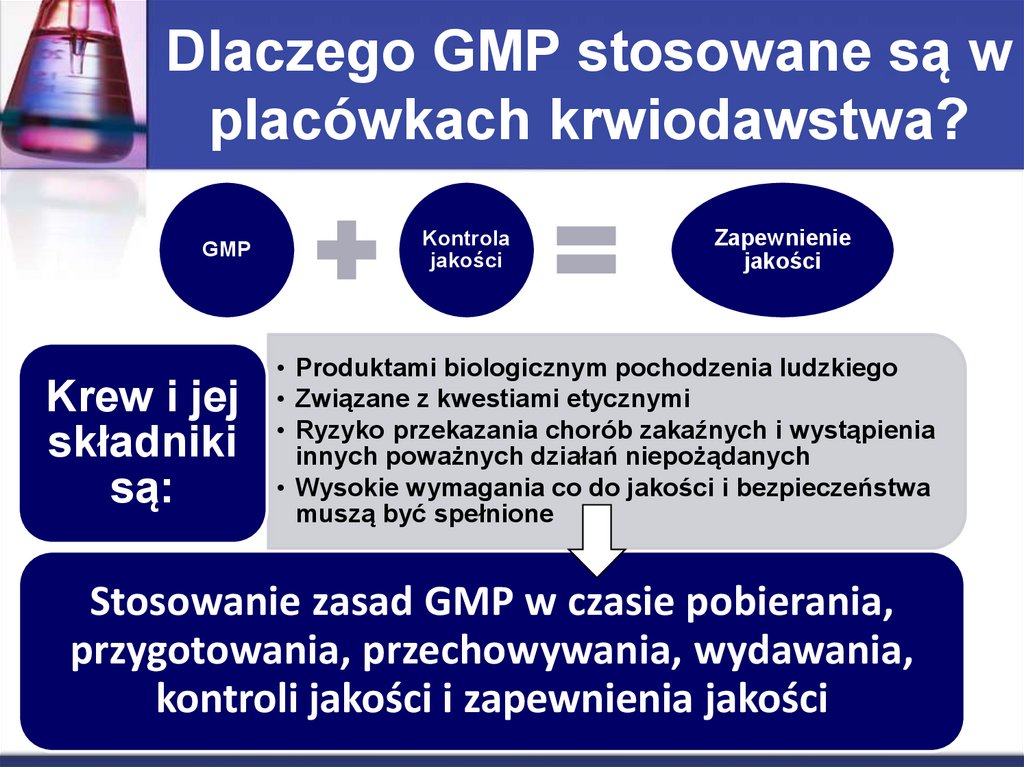
6. Dlaczego GMP stosowane są w placówkach krwiodawstwa?
GMPKrew i jej
składniki
są:
Kontrola
jakości
Zapewnienie
jakości
• Produktami biologicznym pochodzenia ludzkiego
• Związane z kwestiami etycznymi
• Ryzyko przekazania chorób zakaźnych i wystąpienia
innych poważnych działań niepożądanych
• Wysokie wymagania co do jakości i bezpieczeństwa
muszą być spełnione
Stosowanie zasad GMP w czasie pobierania,
przygotowania, przechowywania, wydawania,
kontroli jakości i zapewnienia jakości
7. Proces wytwarzania w świetle GMP
Składniki krwi• System musi umożliwiać prześledzenie
drogi każdej donacji, zarówno do przodu (od
dawcy) LB, jak i od tyłu (od produktu
gotowego)
• Musi również istnieć procedura opisująca
system wymiany informacji pomiędzy
jednostką pobierającą krew lub osocze, a
zakładem produkcyjnym lub frakcjonującym
w przypadkach „awaryjnych”- PID
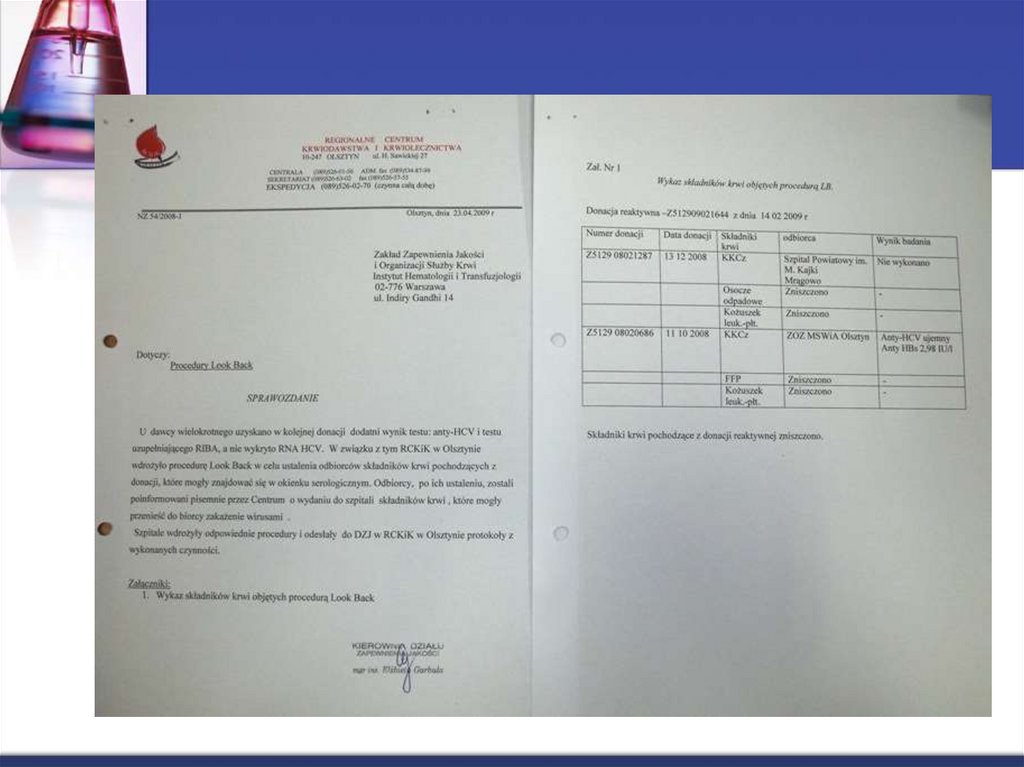
8. Procedura Look Back
Dotyczy dodatnich wyników badań w testach potwierdzenia• Badanie HbsAg w teście neutralizacyjnym lub DNA HBV
• Przeciwciał anty-HCV w teście WB przy ujemnym wyniku RNA HCV
• RNA HCV
• Przeciwciał anty-HIV1/2 w teście Western Blot
• RNA HIV
Obowiązuje
• Wszystkich dawców wielokrotnych
• Pierwszorazowych, którzy wrócili do oddawania krwi po przerwie dłuższej
niż 24 miesiące
9.
10. Postępowanie po potwierdzeniu testu
Zbadać próbki archiwalne w kierunku obecności materiaługenetycznego wirusa
Zniszczyć zatrzymane uprzednio składniki krwi
Powiadomić odbiorców klinicznych składników krwi i ustalić
komu przetoczono
Sporządzić protokół, archiwizować 30 lat
11.
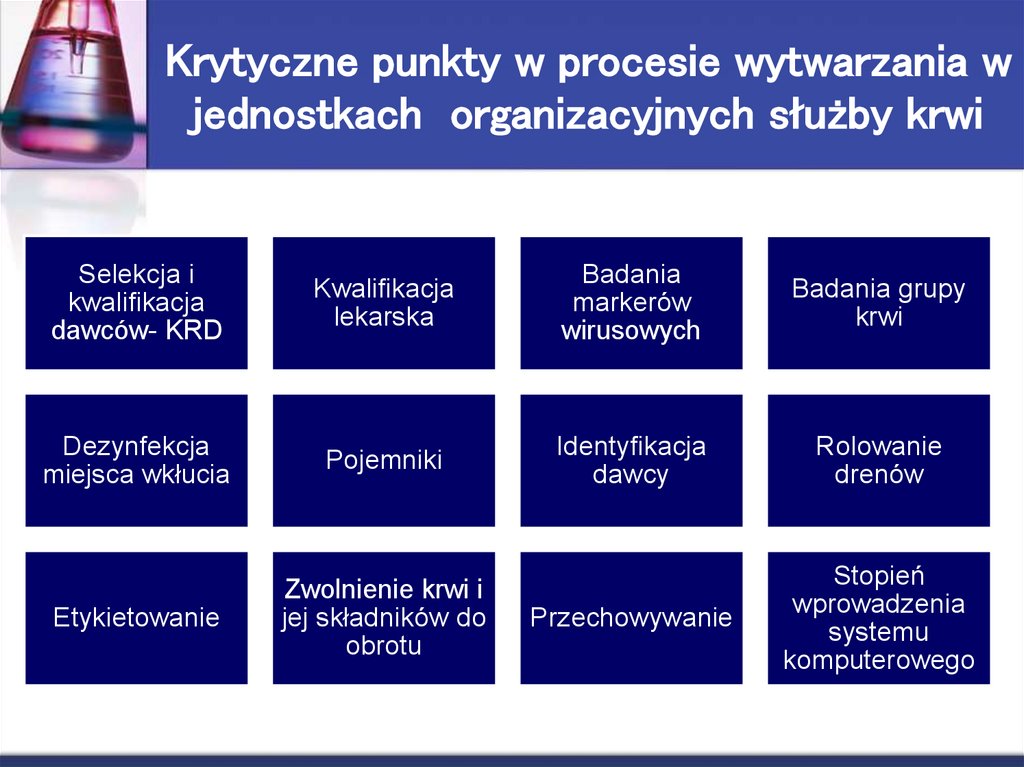
12. Krytyczne punkty w procesie wytwarzania w jednostkach organizacyjnych służby krwi
Selekcja ikwalifikacja
dawców- KRD
Kwalifikacja
lekarska
Badania
markerów
wirusowych
Badania grupy
krwi
Dezynfekcja
miejsca wkłucia
Pojemniki
Identyfikacja
dawcy
Rolowanie
drenów
Etykietowanie
Zwolnienie krwi i
jej składników do
obrotu
Przechowywanie
Stopień
wprowadzenia
systemu
komputerowego
13. Rejestr błędów
Błędy nie powodująceniepożądanego
zdarzenia – brak
powikłań u biorcy, np.
zamiana grupy krwi
Błędy near miss bliskie celu, błędy
zauważone i usunięte
przed przetoczeniem
składników krwi
Należy analizować
problemy w celu ich
identyfikacji i
eliminacji lub
minimalizacji
Działania naprawcze i
zapobiegawcze
należy monitorować w
celu potwierdzenia ich
skuteczności
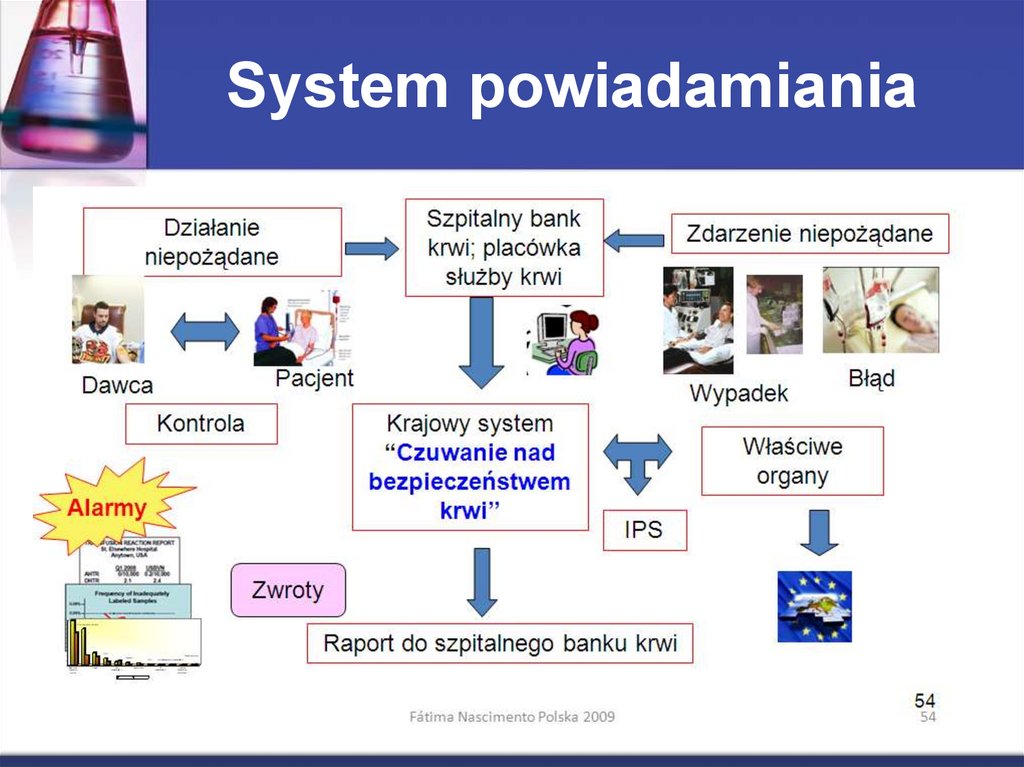
14. System powiadamiania
15. Czuwanie nad bezpieczeństwem krwi
Identyfikuje, analizuje, poszerza i integrujewiedzę z praktyką przetoczeniową
Tworzy przepisy i przyczynia się do rozwoju
standardów i wytycznych klinicznych
BEZPIECZNA OPIEKA KLINICZNA
Ciągła poprawa jakości










 medicine
medicine






