Similar presentations:
Электролитическая диссоциация. Распад электролитов на ионы при растворении
1.
Электролитическаядиссоциация
2.
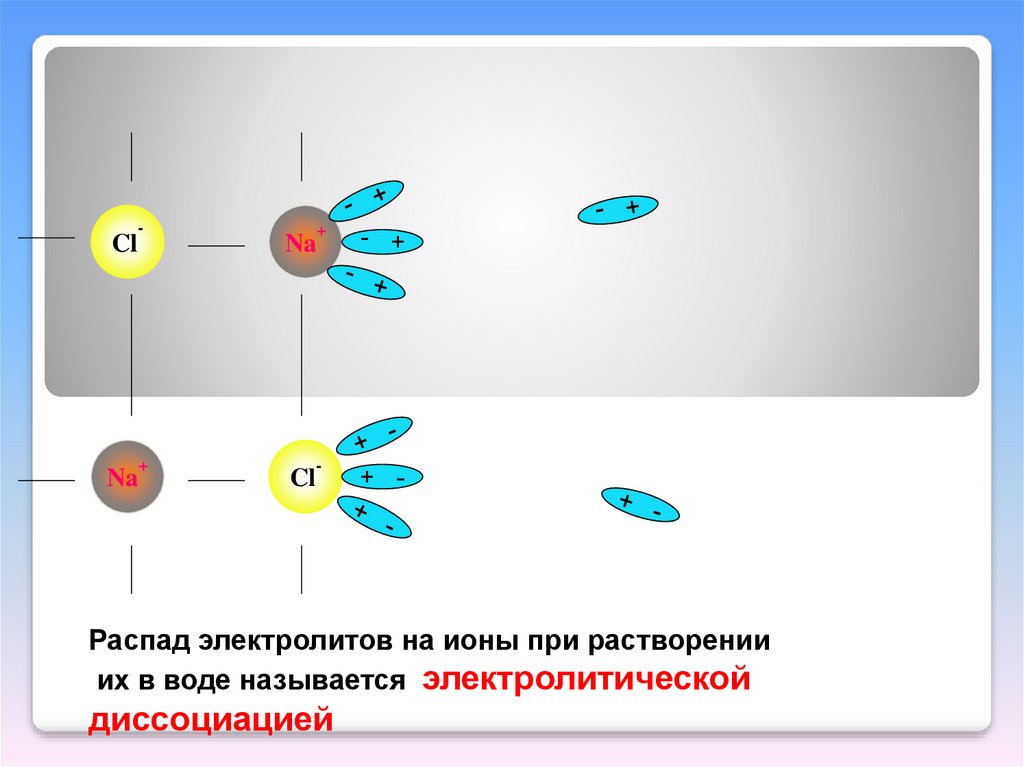
-+
Na
+
Na
Cl
-
+ -
Cl
+ -
Распад электролитов на ионы при растворении
их в воде называется электролитической
диссоциацией
3.
Все вещества по отношению кэлектрическому току
можно разделить на две группы:
- электролиты;
- неэлектролиты.
Электролиты характеризуются
тем, что их растворы
и расплавы проводят электрический
ток.
Неэлектролиты – вещества,
растворы и расплавы
которых не проводят электрический
ток
4.
Прибор для определения электрической проводимостираствора
4
3
2
1
1 - раствор, 2 - угольные стержни (электроды)
3 - электрическая лампа, 4 - электрическая сеть
5.
Легче всего диссоциируютэлектролиты, имеющие ионную
структуру. При их растворении молекулы
воды, представляющие заряженные
диполи, ориентируются вокруг ионов,
расположенных на поверхности
кристалла. В результате чего силы
притяжения между ионами кристалла
ослабевают, и они переходят в раствор.
Аналогично диссоциируют
вещества содержащие полярные
ковалентные связи.
6.
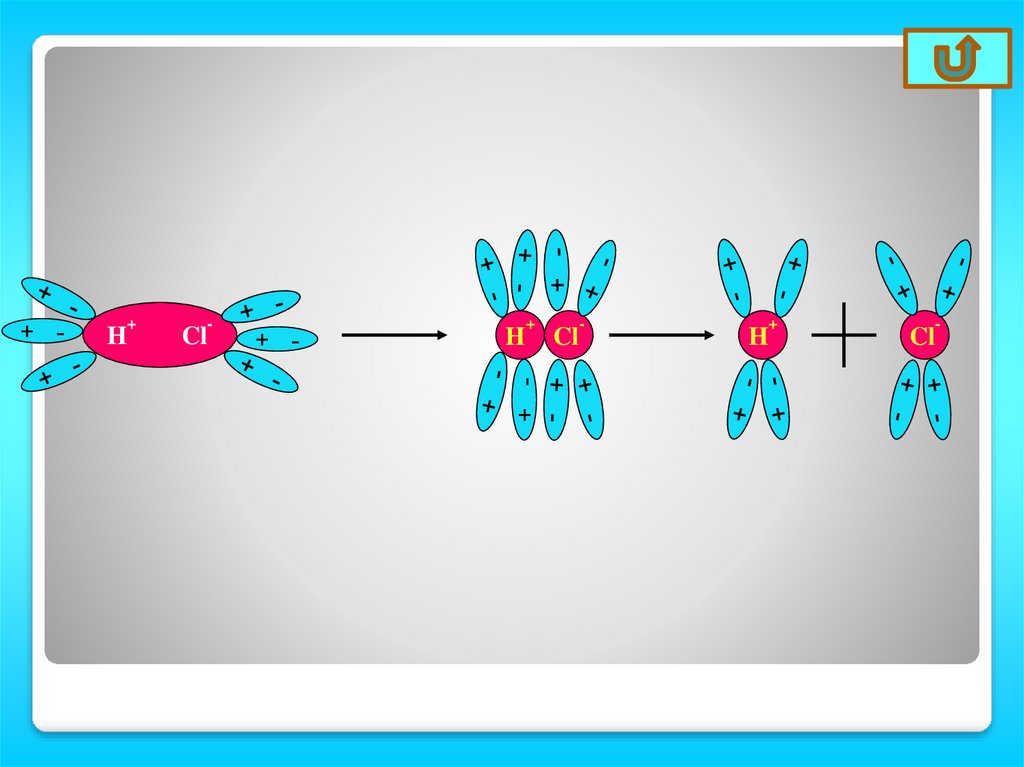
H+
Cl
-
+ -
H
+
+ -
+ -
Cl
-
H
+
Cl
-
7.
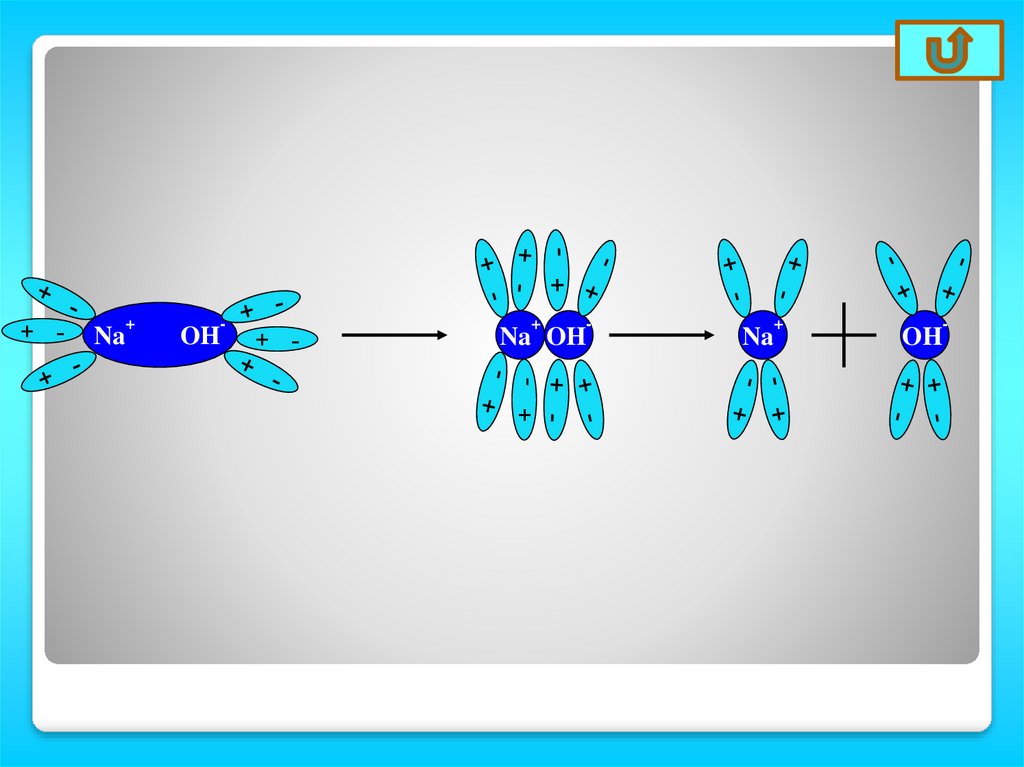
Na+
OH
-
+ -
+
Na OH
+ -
+ -
-
+
Na
OH
-
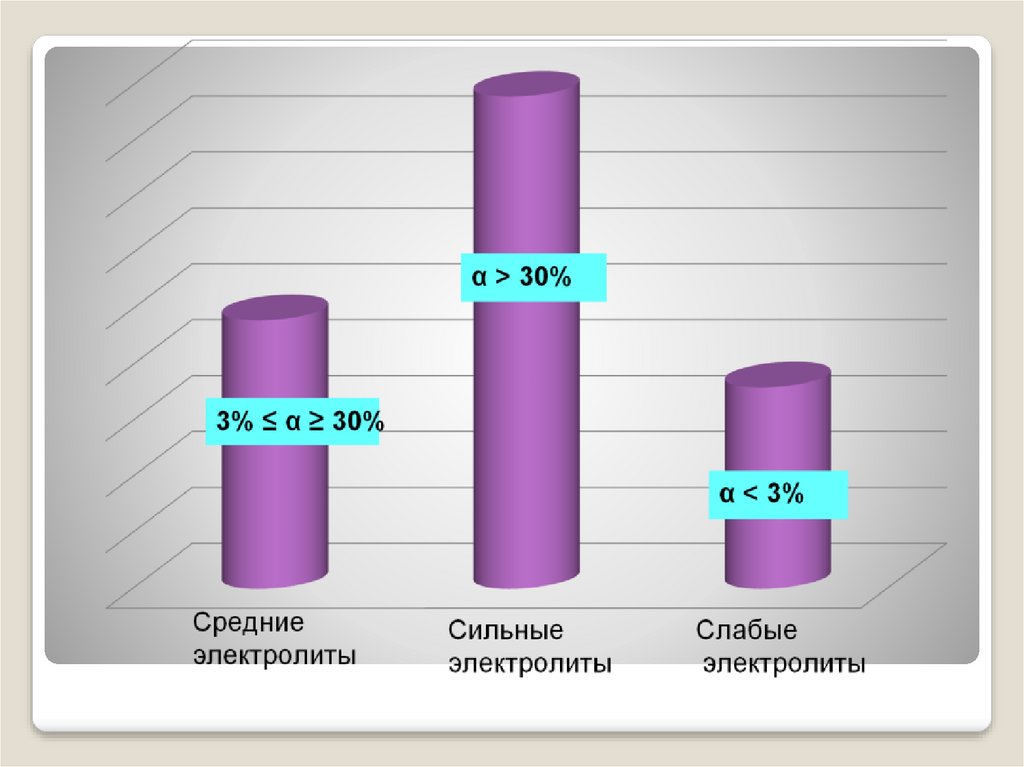
8. Количественная оценка диссоциации Полнота протекания процесса диссоциации характеризуется степенью диссоциации. Степень
диссоциации представляетотношение числа молекул распавшихся на
ионы к общему числу молекул
электролита в исходном растворе.
α=n/N
В соответствии со степенью диссоциации
электролиты делятся:
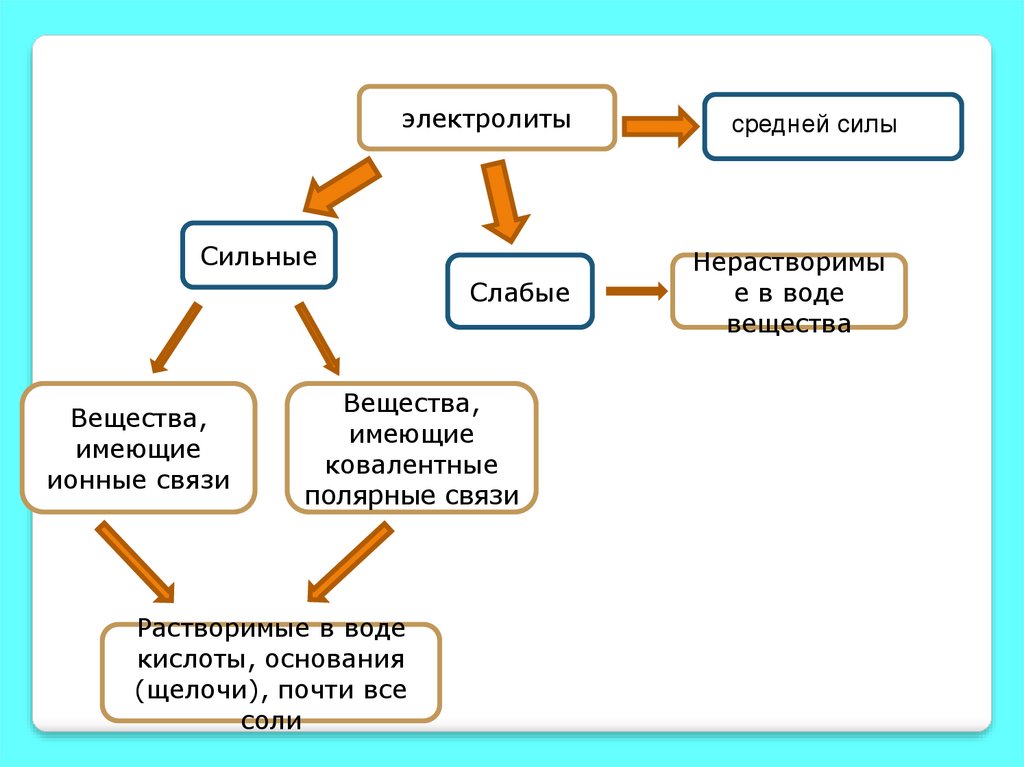
9.
электролитыСильные
Слабые
Вещества,
имеющие
ионные связи
Вещества,
имеющие
ковалентные
полярные связи
Растворимые в воде
кислоты, основания
(щелочи), почти все
соли
средней силы
Нерастворимы
е в воде
вещества
10.
11.
Уравнения электролитическойдиссоциации
NaCl = Na+ + ClHNO3 = H+ + NO3-
12.
Задание: Найди себе пару.Разбросаны ионы – составить молекулы.
Cl -
2H+
Mg2+
CО32-
NO -
Ca2+
2OH -
Na+
ДВАЖДЫ ИСПОЛЬЗОВАТЬ ИОНЫ НЕЛЬЗЯ!
Составить молекулы.
Определить сильные или слабые электролиты по таблице
растворимости.
13.
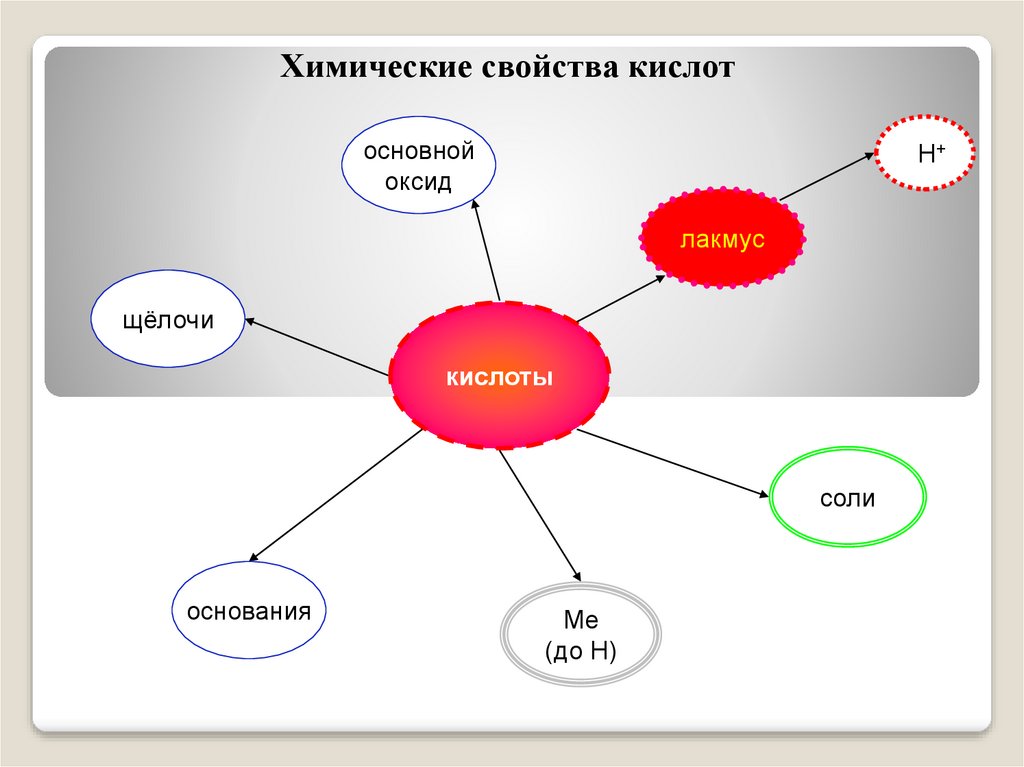
Химические свойства кислотосновной
оксид
H+
лакмус
щёлочи
кислоты
соли
основания
Me
(до H)
14.
Химические свойства основанийOHкислота
фенолфталеин
гидроксид
кислотный
оксид
соли
15.
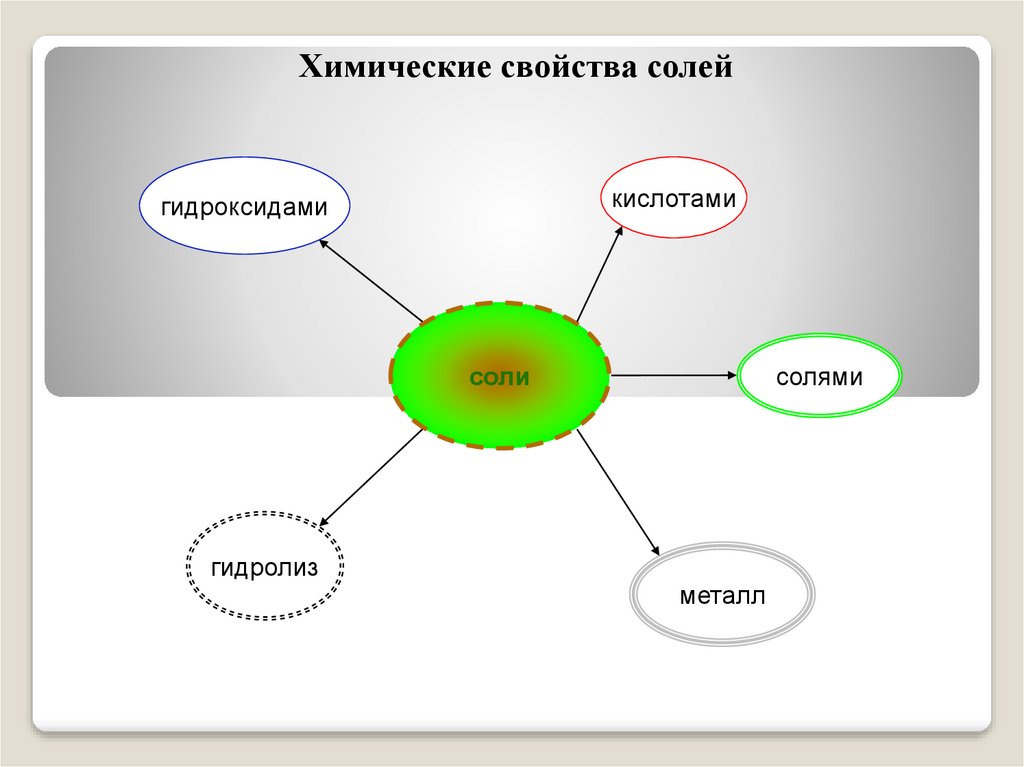
Химические свойства солейкислотами
гидроксидами
солями
соли
гидролиз
металл








 chemistry
chemistry








