Similar presentations:
1-ый Закон термодинамики, его применение к различным изопроцессам; уравнение теплового баланса
1.
1-ый закон термодинамики,его применение к
различным изопроцессам;
Уравнение теплового
баланса;
2.
Первый закон термодинамики — это законсохранения энергии, распространённый
на тепловые явления.
3.
Механическая энергия системы не сохраняется, частьеё превращается во внутреннюю энергию.
4.
Закон сохранения энергииЭнергия в природе не возникает
из ничего и не исчезает: количество
энергии неизменно, она только
переходит из одной формы
в другую.
5.
Закон сохранения энергииявляется фундаментальным
законом природы.
Он выполняется всегда
и везде, применительно
к любым явлениям природы.
6.
7.
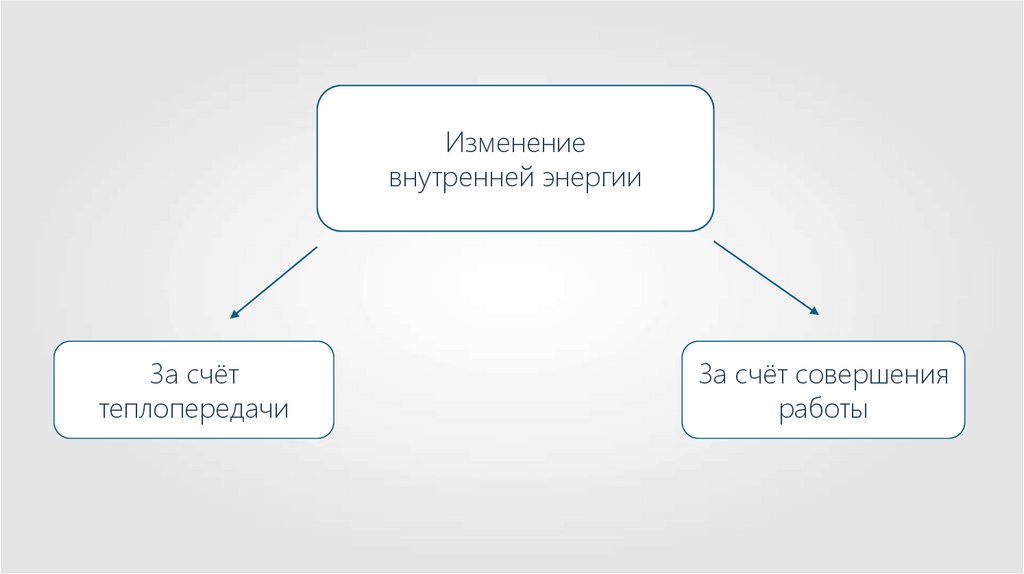
Изменениевнутренней энергии
За счёт
теплопередачи
За счёт совершения
работы
8.
9.
Первый закон термодинамикиИзменение внутренней энергии
системы при переходе её из одного
состояния в другое равно сумме
работы внешних сил над системой и
переданного ей количества теплоты
извне.
10.
Первый закон термодинамикиМожно рассмотреть работу
системы над внешними силами.
11.
Первый закон термодинамикиКоличество теплоты, переданное
системе, идёт на совершение
системой работы против внешних
сил и на увеличение её внутренней
энергии.
12.
Если система являетсяизолированной, то внешние тела
не взаимодействуют с системой,
а, значит, работа внешних сил
равна нолю, и система
не обменивается теплотой
с окружающими телами.
13.
Из первого закона термодинамикиследует, что создание вечного
двигателя невозможно. Если
к системе не поступает энергия, то
работа над внешними телами может
быть совершена только за счёт
уменьшения внутренней энергии.
После того как внутренняя энергия
системы окажется равна нолю,
двигатель перестанет работать.
14.
Внутренняя энергия системы тел изменяетсяпри совершении работы против внешних сил
и при передаче теплоты другим телам.
15.
Первый закон термодинамикипозволяет делать важные
выводы о характере
протекающих процессов.
16.
Идеальный газПри изохорном процессе
объём газа не меняется,
и поэтому работа газа
равна нолю.
17.
Идеальный газQ
18.
Идеальный газQ
19.
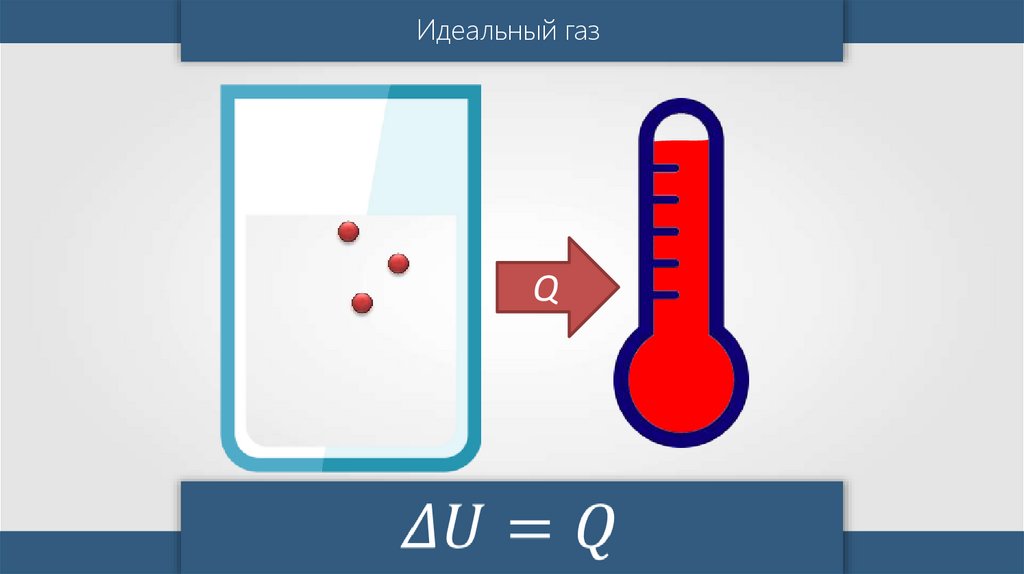
Идеальный газПри изотермическом
процессе температура
газа не изменяется, значит,
не меняется внутренняя
энергия идеального газа.
20.
Согласно первому законутермодинамики, всё
переданное газу количество
теплоты идёт на совершение
работы газа против внешних
сил.
21.
При изобарном процессе согласно первому закону термодинамики,передаваемое газу количество теплоты идёт на изменение его внутренней
энергии и на совершение им работы при постоянном давлении.
22.
ΔU=A*адиабатный процесс- это
термодинамический
процесс в
макроскопической
системе, при котором
система не обменивается
теплотой с окружающим
пространством.
При адиабатном процессе по первому закону термодинамики
изменение внутренней энергии происходит только
за счёт совершения работы.
23.
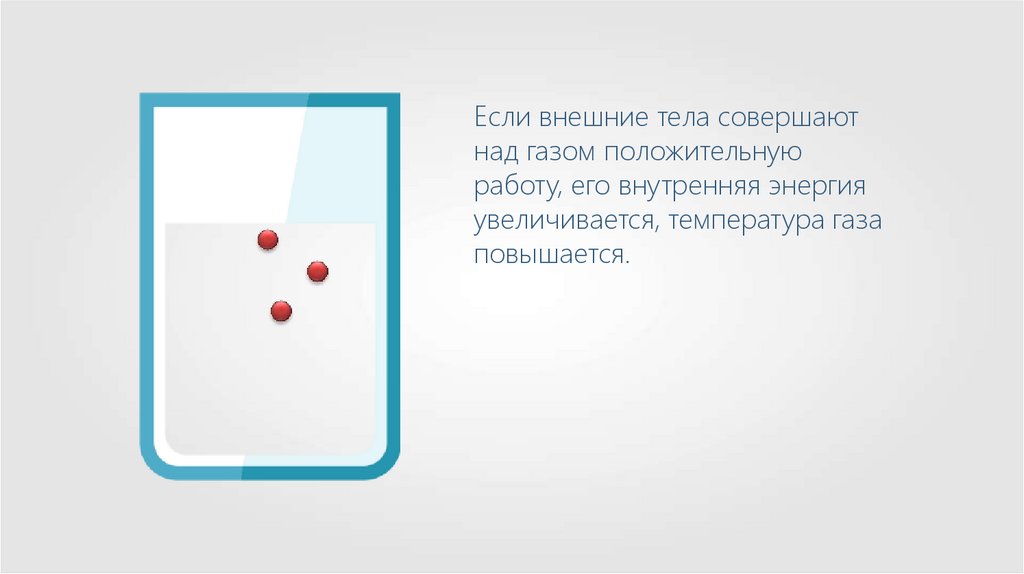
Если внешние тела совершаютнад газом положительную
работу, его внутренняя энергия
увеличивается, температура газа
повышается.
24.
Если внешние тела совершаютнад газом положительную
работу, его внутренняя энергия
увеличивается, температура газа
повышается.
И наоборот, если сам газ
совершает положительную
работу над внешними телами,
то его внутренняя энергия
уменьшается и газ охлаждается.
25.
После наступления тепловогоравновесия, по первому закону
термодинамики, увеличение
внутренней энергии ложки
в стакане будет равно количеству
теплоты, отданному водой.
26.
В изолированной системе суммарная внутренняя энергияне меняется. А, значит, и сумма количеств теплоты, полученных
и отданных телами изолированной системы, равна нолю.
27.
Уравнение теплового баланса28.
Внутренняя энергия идеального газане изменяется только при изотермическом
процессе. При изохорном она изменяется
за счёт теплообмена, а при изобарном
процессе внутренняя энергия газа
изменяется как за счёт теплопередачи,
так и за счёт совершения работы.
В теплоизолированной системе
происходит адиабатный процесс.
29.
ЗАДАЧА №1Условие: идеальный газ
Решение: согласно первому
получил количество теплоты
закону термодинамики, тепло,
300 Дж и совершил работу 100 переданное системе, идет на
Дж. Чему равно изменение
изменение внутренней энергии
внутренней энергии газа?
и совершение работы против
Ответ дайте в джоулях.
внешних сил:
∆U=Q+A; Отсюда находим
изменение внутренней энергии
газа - ∆U=Q–A=
300 ДЖ–100 ДЖ=200ДЖ
30.
Задача №2Условие: при
изотермическом сжатии газ
передал окружающим
телам теплоту 800 Дж.
Какую работу совершил газ?
Какую работу совершили
внешние силы?
Решение: ∆U = Q + A;
Т.к. ∆U=3mR∆T/2M, по
условию задачи Т=const,
∆Т=0, ∆U=0;
Тогда 1-ый закон
термодинамики примет
вид: Q=-A и Q=A’ или Q=800 Дж и Q=800 Дж
31.
Задача №3Условие: для
изобарного нагревания
газа, количество
вещества которого 400
моль на 300 К ему
сообщили количество
теплоты 5,4 МДж.
Определите работу газа
и изменение
внутренней энергии.
Решение: запишем первый закон
термодинамики: Q=ΔU+A’
Работа газа при постоянном
давлении: А’=pΔV=m/M⋅ RΔT,
откуда следует, что А’=vRΔT=400
моль⋅8,31 Дж/моль⋅К⋅300 К=997200
Дж ≈ 10^6 Дж;
ΔU=Q-A=5,4⋅10^6 Дж – 997200 Дж ≈
4,4⋅ 10^6 Дж;



























 physics
physics








