Similar presentations:
Минералы. Лекция 2
1. минералы
Лекция 2.минералы
2. МИНЕРАЛЫ
3. План
1.2.
3.
4.
5.
6.
Минералогия как наука.
Морфология минеральных агрегатов.
Физические свойства минералов.
Основы минералогической систематики.
Генезис минералов.
Использование минералов в строительном
деле.
4. Определения
• «Минерал – это природное химическое соединениекристаллической структуры, образующееся на Земле
как результат геологических и геохимических
процессов или эквивалентных процессов на
внеземных телах Вселенной» (1995).
• В результате становится совершенно очевидным, что
большинство ученых сходится во мнении - минералы – это
лишь твердые образования, но В.И. Вернадский и
некоторые другие специалисты в своих трудах указывают,
что минералы могут быть жидкими и газообразными (вода,
ртуть и т.д.).
Наука о минералах – минералогия – является одной из
древнейших отраслей геологического знания.
5.
• В настоящее время установлено около4900 минеральных видов (одобрены
Международной минералогической
ассоциацией - IMA).
6.
• Большая часть минералов встречаетсяочень редко и только некоторые из них
(около 100) составляют основную массу
пород, руд и различных минеральных
тел.
• Они называются
породообразующими (кварц, полевые
шпаты, глинистые минералы,
карбонаты, сульфаты, пироксены,
амфиболы).
7. Происхождение минералов.
• По происхождению все минералыделятся на три группы:
• магматические,
• экзогенные (осадочные) и
• метаморфические
• в зависимости от условий, в которых
произошло их образование.
8. Морфологический облик минералов
• В природе минералы могут встречаться в виде• кристаллов с хорошо выраженными гранями,
• неправильных зерен или
• аморфных тел.
• Кристаллы –
геометрически
правильные твердые
тела, в которых атомы
и молекулы расположены
в строго заданном
геометрическом порядке.
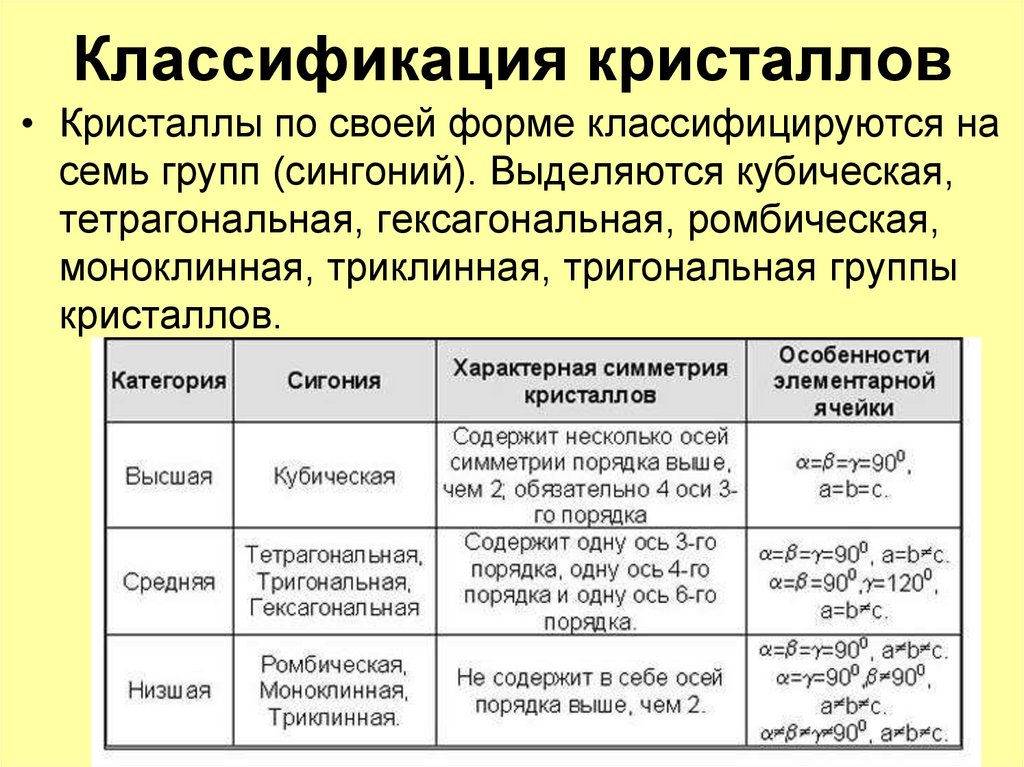
9. Классификация кристаллов
• Кристаллы по своей форме классифицируются насемь групп (сингоний). Выделяются кубическая,
тетрагональная, гексагональная, ромбическая,
моноклинная, триклинная, тригональная группы
кристаллов.
10. Свойства кристаллов
1. Явление анизотропии зависимость физических свойствкристалла от направления.
Свойства: прочность, твердость,
теплопроводность, скорость
распространения света,
электропроводность
Примеры: 1) Анизотропия прочности
кристалла слюды
2) Анизотропность твердости
кристаллов у минерала дистена
(Al2O[SiO4]). В продольном
направлении твердость =4,5, в
поперечном =6.
11. 2. Полиморфизм.
• Способность вещества существовать вразличных кристаллических структурах,
называемых полиморфными
модификациями (их принято
обозначать греческими буквами α, β, γ и
т. д.).
• Пример: карбонат кальция - две
модификации кальцит и арагонит.
12.
13.
3. Однородность кристаллических веществ.4. Изоморфизм - свойство элементов замещать
друг друга в структуре кристалла.
14.
• 5. Физические свойства кристаллов –• твердость,
• спайность,
• излом,
• цвет,
• блеск,
• цвет черты,
• удельный вес,
• растворимость, прочность, вкус, ощущение
на ощупь, запах,
• габитус.
15. Формы нахождения минералов в природе
1. В виде отдельныхкристаллов
2. В виде сростков
(двойников).
3. В виде минеральных
скоплений.
4. В виде минеральных
агрегатов.
16. Морфология минеральных агрегатов
• Зернистые агрегаты представляютсобой сплошные массы произвольно
сросшихся зерен одного или нескольких
минералов.
17. Морфология минеральных агрегатов
• Друзы (щетки) - это группы кристаллов,наросших перпендикулярно или почти
перпендикулярно к поверхности
трещин, стенке жилы или полости в
горной породе.
18. Параллельно-шестоватые и волокнистые агрегаты
• Их образование происходит в открытых трещинах(рисунок 5):сначала на стенках по принципу
геометрического отбора нарастают друзы;
разрастаясь навстречу друг другу, они смыкаются и
образуют параллельно-шестоватые или волокнистые
агрегаты.
19. Секреции и конкреции
• Секреции образуются при заполнении минеральнымвеществом полости в горной породе. Часто в центре
секреций располагаются друзы (а).
• Конкреции - это шаровидные агрегаты радиальнолучистого строения (б).
20. Физические свойства минералов.
• Каждый минерал имеет особыепризнаки, позволяющие отличить его от
других минералов.
• Наиболее выразительными из них
являются:
• цвет (окраска), цвет черты, блеск,
прозрачность, удельный вес
(плотность), спайность, излом,
твердость.
21. Физические свойства минералов
• Цвет (окраска)минералов
• Свойство, которое
прежде всего обращает
на себя внимание
любого исследователя это цвет или окраска
минералов. Существуют
минералы с постоянной
окраской (таблица) и
минералы меняющие
свою окраску,
например, турмалин.
Цвет
Минерал
Синий
Азурит
Зеленый
Малахит
Красный
Киноварь
Желтый
Золото
22. Цвет черты.
• Более надежный диагностическийпризнак минералов, чем цвет.
• Цвет черты – это цвет минерала в
порошке,
• он определяется, если уголком
испытуемого образца минерала
потереть пластинку шероховатого
неглазурованного фарфора – бисквита.
23.
• Диагностическим признаком являетсярасхождение в цвете минерала и цвете
его черты.
• Например, цвет черты у черных
кристаллов гематита – вишнево-красный,
• у золотисто-желтого пирита – черный с
зеленоватым оттенком,
• у флюорита – независимо от его желтой,
зеленой или фиолетовой окраски –
всегда белый.
24. Блеск
• Блеск - оптическое свойство, тесно связанное с явлениямиотражения и преломления света, можно определить как
внешний вид минерала в отраженном свете. Различают
два основных типа блеска минералов - металлический и
неметаллический.
• Металлический блеск. Минералы, сильно поглощающие
видимый свет, непрозрачные или почти непрозрачные даже
в очень тонких осколках (хотя, возможно, и пропускающие
инфракрасные лучи), как правило, имеют металлический
блеск.
• Неметаллический блеск. Различают несколько его
разновидностей:
• Алмазный блеск - яркий блеск, типичный для алмаза.
• Стеклянный блеск - почти все силикаты, большая часть
солей кислородных кислот (карбонатов, фосфатов,
сульфатов и т.д.), галоиды, окислы и гидроокислы легких
элементов (например, алюминия и магния).
• Жирный, восковой, шелковистый, перламутровый и
матовый блеск - разновидности неметаллического блеска.
25. Светопроницаемость (прозрачность)
• Прозрачным называют минерал, способныйпропускать свет; сквозь такой минерал можно
ясно видеть другие объекты.
• Просвечивающими считаются минералы,
способные пропускать свет; однако сквозь
такие минералы нельзя ясно различать те
или иные предметы, а можно лишь смутно
видеть их общие очертания. Непрозрачным
называется минерал, не способный
пропускать свет.
26. Удельный вес, плотность.
• Удельный вес – это безразмернаявеличина, которая представляет собой
отношение плотности минерала к
плотности воды.
• Следовательно, минерал с плотностью
2,6 в 2,6 раза тяжелее такого же
объема воды.
• Плотность – это масса единичного
объёма вещества (в г/см3).
27.
• Удельный вес и плотность используют каксинонимы, поскольку плотность воды равна 1
г на 1 см3, поэтому удельный вес численно
равен плотности.
• Удельный вес минерала зависит от его
химического состава и кристаллической
структуры.
• Минералы с переменным химическим
составом имеют непостоянную
плотность.
28.
• Плотность минералов, горных пород ируд колеблется от 1 до 20.
• Минералы плотностью ниже 2 относятся
к легким (например, янтарь – 0,1),
• от 2 до 4 – характеризуются как
нормальные (например, кварц – 2,6; гипс
– 2,3; полевые шпаты – 2,5-2,7),
• выше 4,0 – характеризуются как
тяжелые (например, барит – 4,5; пирит –
5,0; галенит – 7,5).
29. Спайность
• – это способность некоторых минераловраскалываться или расщепляться по
определенным направлениям с
образованием гладких (зеркальных)
поверхностей, называемых плоскостями
спайности.
• Спайность зависит от строения
кристаллической решетки.
30.
• Спайность• В зависимости от легкости, с какой
раскалывается минерал, различают
• весьма совершенную (слюда, тальк,
гипс),
• совершенную (кальцит, галенит),
• среднюю (полевой шпат, флюорит) и
• несовершенную (гранат) спайность.
• Встречаются минералы, которые вообще
лишены спайности (кварц).
31.
Слюда имеет совершенную спайность32. Излом поверхности
• раковистый (кварц, обсидиан),• занозистый,
• волокнистый (для волокнистых
минералов типа асбеста),
• ровный,
• неровный,
• ступенчатый и
• землистый (каолинит) излом.
33. Твердость.
• - под твердостью минерала понимаютсопротивление, которое оказывает его
поверхность при попытке поцарапать ее
другим минералом или иным предметом.
• Твердость природных кристаллов сильно
различается – от 2,4 кг/мм2 (тальк) до
10060 кг/мм2 (алмаз).
34.
• Немецкий минералог Фридрих Моос(1773-1839) предложил шкалу, согласно
которой минералы группируются в
соответствии с их относительной
твердостью по десятибалльной шкале.
• Путем сравнения с этой шкалой может
быть установлена твердость любого
минерала – твердость по Моосу.
35.
36.
37.
38. Прочие свойства минералов
• Свечение. Многие минералы, несветящиеся в обычных условиях,
начинают светиться при некоторых
воздействиях (при нагревании,
облучении рентгеновскими,
ультрафиолетовыми и катодными
лучами, при разламывании, царапании)
39.
• Различают фосфоресценцию,люминесценцию, термолюминесценцию
и триболюминесценцию минералов.
• Фосфоресценция - способность
минерала светиться после воздействия
на него какими-либо лучами (виллемит).
• Люминесценция - способность светиться
в момент облучения (шеелит, кальцит,
благородный опал и др. при облучении
ультрафиолетовыми и катодными
лучами).
40.
41.
• Термолюминесценция - свечение принагревании (флюорит, апатит).
• Триболюминесценция - свечение в
момент царапания иглой или
раскалывания (слюды, корунд).
42. Радиоактивность минералов
• Около 100 природных минераловсодержат радиоактивные изотопы.
• Наиболее радиоактивен гранитный
слой литосферы, поэтому содержание
радиоактивных минералов наибольшее
в гранитах и глинах (продуктах
выветривания гранитов).
43. Особые свойства минералов
• Растворимые в воде соли имеют свойвкус (галит – соленый, сильвин – горькосоленый).
• Растворимость в кислотах – породы,
содержащие карбонаты (мрамор, мел,
известняк, лесс), вскипают от соляной
кислоты (холодная соляная кислота
растворяет кальцит, горячая – доломит).
44.
• Специфический запах имеет сера ижелваки фосфорита.
• Магнитными свойствами обладает
магнитный железняк.
• Электропроводностью – некоторые
рудные минералы.
45. Основы минералогической систематики
В настоящее время в минералогии принята
кристаллохимическая классификация
минералов. Крупнейшей систематической
единицей является тип, который
объединяет минералы с близким
характером химических соединений,
родственным типом химической связи.
По типу химических соединений М. - простые тела (самородные элементы);
М. - составные (бинарные и прочие).
46. Основы минералогической систематики
Типы делятся на классы, объединяющие минералы с болееблизкими химическими свойствами и типом связи.
• Классификация минералов
• Самородные: золото, сера, графит.
• Сульфиды: пирит.
• Галогениды: галит, сильвин.
• Оксиды и гидроксиды: кварц, опал, лимонит, гематит.
• Карбонаты: кальцит, магнезит, доломит, малахит.
• Сульфаты: барит, гипс.
• Фосфаты: апатит.
• Силикаты: оливин, родонит, тальк, серпентинит,
каолинит, полевые шпаты (ортоклаз, плагиоклазы),
нефелин.
47. Класс 1. Самородные элементы
• В самородном состоянии в природе известно около 50химических
элементов
(простых
веществ),
но
большинство из них встречаются редко. По подсчетам
В.И. Вернадского, на долю самородных элементов
приходится не более 0,1% веса земной коры.
Нахождение элементов в самородном виде связано со
строением
их
атомов,
имеющих
устойчивые
электронные оболочки.
48.
• Структура самородных элементов во многихслучаях атомная координационная (алмаз, медь,
золото и др.); наблюдается также листовая,
цепочечная и молекулярная (сера).
49.
• В тесной связи со структурой находятсяфизические свойства. Большинство самородных
элементов химически устойчивы, имеют
пониженную твердость, металлический и
алмазный блеск, большой удельный вес.
50.
• Формы выделений самородных элементовразнообразны: каплевидные зерна, самородки,
идиоморфные или нитевидные кристаллы, проволочновытянутые или плоские дендриты, ксеноморфные
угловатые или пластинчатые (пленочные) образования (по
границам сопутствующих минеральных индивидов и по
трещинам).
51.
• По происхождению самородные элементы могут бытьглубинными, вплоть до магматических (алмаз, платина) и
поверхностными (гипергенными). Простые элементы
нередко ассоциируют в горных породах с карбидами
металлов, углеродистыми веществами и образуются в
восстановительных условиях. Некоторые самородные
элементы имеют космическое происхождение или связаны
с земными магматитами, а также с процессами их
метаморфизма (Fe, Ni, Co и др.)
52. Класс 2. Сульфиды
• Соединения разных химических элементов ссерой.
• Класс сульфидов подразделяется на 4 больших группы: 1.
Сульфиды металлов; 2. Сульфосоли; 3. Сульфиды
полуметаллов; 4. Оксисульфиды.
53.
• Сульфидычасто
месторождения
–
гидротермального типа.
образуют
крупные
полиметаллические
• При разработке сернистых месторождений сульфидные
руды используются комплексно, поскольку они обычно
многоминеральны и составляющие их минералы
содержат не один, а несколько ценных элементов.
54. Класс 3. Галогениды (галоидные)
• К галоидным минералам относятся фтористые,хлористые, бромистые и иодистые соединения,
представляющие собой соли галоидоводородных кислот
или же соединения со сложными анионными группами.
• Наибольшее распространение имеют соединения F и Cl.
• Элементы Br и J, чаще замещают хлор в галоидных
соединениях.
• Все минералы этого класса обладают ионной связью
(гетерополярной) с катионами легких металлов. Фтор
образует в природе чаще всего соединение с кальцием в
виде флюорита CaF. Остальные фториды редки.
Фтористые минералы в большинстве светлые,
небольшого удельного веса и твердости, с низкими
показателями преломления.
55.
56.
• Флюорит (плавиковый шпат), криолит и отчастивиллиомит имеют наибольшее практическое значение в
металлургической отрасли и применяются как флюс для
облегчения плавки металлов. Оптический флюорит
используется для изготовления линз и призм в точных
приборах. Галит (каменная соль) используется как
пищевой продукт и в кожевенном деле. Сильвин и
карналлит незаменимое сырье для химической
промышленности и сельского хозяйства. Бишофит с
успехом используется в медицине и химии.
57. Класс 4. Оксиды и гидроксиды
• Окислы – это простейшие соединения металлов с О2 игидроксилом - ОН. Содержание О2 в земной коре – более 49%.
• В соединение с кислородом входят около 40 химических
элементов.
• Важнейший из оксидов – кварц – на его долю приходится 12%
массы земной коры.
• Образуются в коре выветривания рудных месторождений, в
болотах, озерах, морях (конкреции, болотные руды).
58.
• В кристаллическом отношении окислы имеют атомныерешетки, для которых характерна ионная связь структурных
единиц. В кристаллических решетках этих соединений
катионы всегда находятся в окружении анионов кислорода
(гидроксила). Химическая устойчивость у окислов самая
высокая среди минералов, так как окисленным веществам
разрушаться дальше некуда.
59.
• Кислородные соединения с ионной связьюхарактеризуются очень прочным кристаллическим
строением. Это выражается в их повышенной твердости 6,
7, 8, 9, высокой химической стойкости, тугоплавкости,
нерастворимости и т.д. Гидраты со слоистыми атомными
решетками имеют слабые связи и поэтому менее прочны.
Окислы имеют аллохроматические окраски, часто
бесцветны, примеси Fe, Mn, Cr дают черные и темные
цвета. Окислы Sn, Nb, Ta и U отличаются большим
удельным весом. Окислы, содержащие U и Th,
характеризуются радиоактивностью.
60.
• Происхождение окислов магматическое,пегматитовое, гидротермальное, регионально- и
контактово-метаморфическое. Часто в
поверхностных условиях окислы образуются при
окислении сульфидов и процессах выветривания,
поэтому они устойчивы и накапливаются в
россыпях.
61.
• Класс окислов подразделяется на простые окислы (рядметаллов) и сложные окислы. Большинство окислов
являются рудами черных и цветных металлов (куприт,
тенорит, бромеллит, цинкит, рутил, брукит, анатаз,
торианит, касситерит, пиролюзит, манганит, уранинит,
гематит, магнетит, ильменит, колумбит, эвксенит,
самарскит), а также драгоценными камнями, такими как
опал, цитрин, аметист, рубин, сапфир, александрит,
шпинель и другие.
62. Класс 5. Карбонаты
- соли угольной кислоты.
Карбонатных минералов насчитывается около 80 видов.
По массе они составляют 1,7% веса земной коры.
Наиболее распространенными являются карбонат кальция и магния.
Из других известны карбонаты железа, натрия, бария, стронция и
цветных металлов - меди, свинца и цинка.
• Известны карбонаты простые (без дополнительных анионов) и
сложные (с дополнительными анионами), безводные и водные.
63.
• Физические свойства позволяют точно диагностировать этиминералы и отличать их от других.
• Карбонаты характеризуются небольшой твердостью (не выше
4,5), неметаллическим блеском, светлой окраской, от
бесцветных до яркоокрашенных в присутствии меди, марганца,
никеля и др.
• Удельный вес зависит главным образом от химического состава.
• Все карбонаты вскипают с большей или меньшей легкостью в
соляной и азотной кислотах с выделением углекислого газа.
Легкость вскипания – важный диагностический признак
отдельных минералов.
64.
• Форма выделений карбонатов очень разнообразна –кристаллы, друзы, зернистые массы, натеки, сталактиты с
гелектитами, корочки, иногда туфы.
• Только кальцит, кристаллизующийся в тригональной
сингонии, образует свыше 850 разных кристаллических
форм.
• В карбонатном процессе важная роль принадлежит
угольной кислоте, при участии которой образуются
бикарбонаты, обычно более растворимые в воде, чем
соответствующие средние соли.
• Растворимость углекислого газа в воде и вместе с этим
растворимость карбонатов увеличивается с увеличением
давления и с понижением температуры.
• Уменьшение давления и повышение температуры,
напротив, вызывает отдачу углекислоты растворами и
выделение карбонатов.
65.
• Многие карбонаты, особенно группыкальцита, обладают способностью светиться
или люминесцировать в темноте при
облучении ультрафиолетовым светом.
66.
• В большинстве карбонаты являются гипергеннымипродуктами гидрохимических реакций.
• Некоторые образуются в связи с жизнедеятельностью
организмов, например карбонат кальция известняков.
• Гидротермальные карбонаты распространены в жилах, в
контактово-метасоматических зонах, в отложениях
минеральных источников, в миндалинах вулканических
пород.
67.
• Многие карбонаты имеют практическое значение как рудыжелеза, цинка, свинца, меди. Большие массы карбонатов –
известняки, мраморы, доломиты, магнезиты используются
как строительный материал и в сельском хозяйстве.
Известняки являются прекрасным флюсом для
металлургического производства. Карбонаты в большом
количестве распространены по всему миру.
68. Класс 6. Фосфаты
• Соли фосфорной кислоты.• Самые важные минералы этой группы –
апатит и фосфорит.
• Входят в состав удобрений.
69. Класс 7. Сульфаты
• Соли серной кислоты – гипс, ангидрит,барит – довольно широко
распространены.
70. Распространение минералов в земной коре
• В природе наиболее распространены:• минералы класса силикатов - около 25 % от
общего числа минералов;
• окислы и гидроокислы - около 12%;
• сульфиды и их аналоги - около 13 %;
• фосфаты, арсенаты (ванадаты) - около 18 %;
• прочие природные химические соединения - 32 %.
• Земная кора на 92 % сложена силикатами,
окислами и гидроокислами.
71. Генезис минералов
Современное понятие "генезис минералов" включаетхарактеристику ряда явлений, обусловливающих
возникновение минерала:
• а) химизм процесса;
• б) фазовое состояние среды минералообразования;
• в) физико-химические параметры системы, при которых
происходило возникновение минерала(температура,
давление, активность компонентов, кислородный
потенциал, режим основности — кислотности);
• г) механизм зарождения, роста и развития минерала
(свободная кристаллизация, метасоматическое
развитие, перекристаллизация, раскристаллизация
гелей и др.);
• д) процессы последующего изменения минерала и
явления метаморфизма;
• е) источник вещества.
72. Генезис минералов
М. возникают при• эндогенных,
• экзогенных,
• метаморфогенных процессах.
73. Применение минералов
• Применение минералов оченьразнообразно – в быту, использование
в пищу, в промышленности, как
драгоценные камни и мн.др.
74. САМОРОДНАЯ СЕРА
SulphurS
75.
ПолимерыПроизводство
серной кислоты
Эбониты продукты
вулканизации
каучука
76. УГОЛЬ. ГРАФИТ. АЛМАЗ
УглеродCarboneum
C
77. КВАРЦ
Оксид кремнияSiO2
78.
РаухтопазЦитрин
Аметист
Морион
Сердолик
79. КОРУНД
Al2O3Оксид алюминия
80. ПИРОЛЮЗИТ
Диоксид марганцаMnO2
81. ЖЕЛЕЗНАЯ РУДА
Курская магнитнаяаномалия (КМА) самый мощный в
мире железорудный
бассейн.
82. ГЕМАТИТ, МАГНЕТИТ, ЛИМОНИТ
Fe2O3 *nH2OFe2O3
FeO *Fe2О3
Оксиды железа
83. Серный колчедан, железный колчедан
ПИРИТ, ХАЛЬКОПИРИТCuFeS2
Медный колчедан
FeS2
Серный колчедан,
железный колчедан
84. Свинцовый блеск с цинковой обманкой (галенит + сфалерит)
PbS + ZnS85. Галит, сильвин
NaClKCl
Отложения в соляной толще на
глубине 250 метров древнего
Пермского моря
Верхнекамского калийного
месторождения
86. ФЛЮОРИТ
CaF2Плавиковый шпат
87. КАЛЬЦИТ
Исландскийшпат
CaCO3
Мел
88. МАЛАХИТ
Сu2СО3(ОН)289. АПАТИТ
Сa5 [РO4]3F (Cl)АПАТИТ
90. гипс
CaSO4*2H2O91. «Горный лен»
Mg6[Si4O10] [OH]8хризотил, серпентин


























































































 chemistry
chemistry








