Similar presentations:
Использование техники биоконьюгации в иммунохимическом анализе
1.
Прикладные аспектыиммунологии
Использование техники биоконьюгации в
иммунохимическом анализе
к.х.н., доцент кафедры микробиологии
Герловский Денис Олегович
Минск, 2018
2.
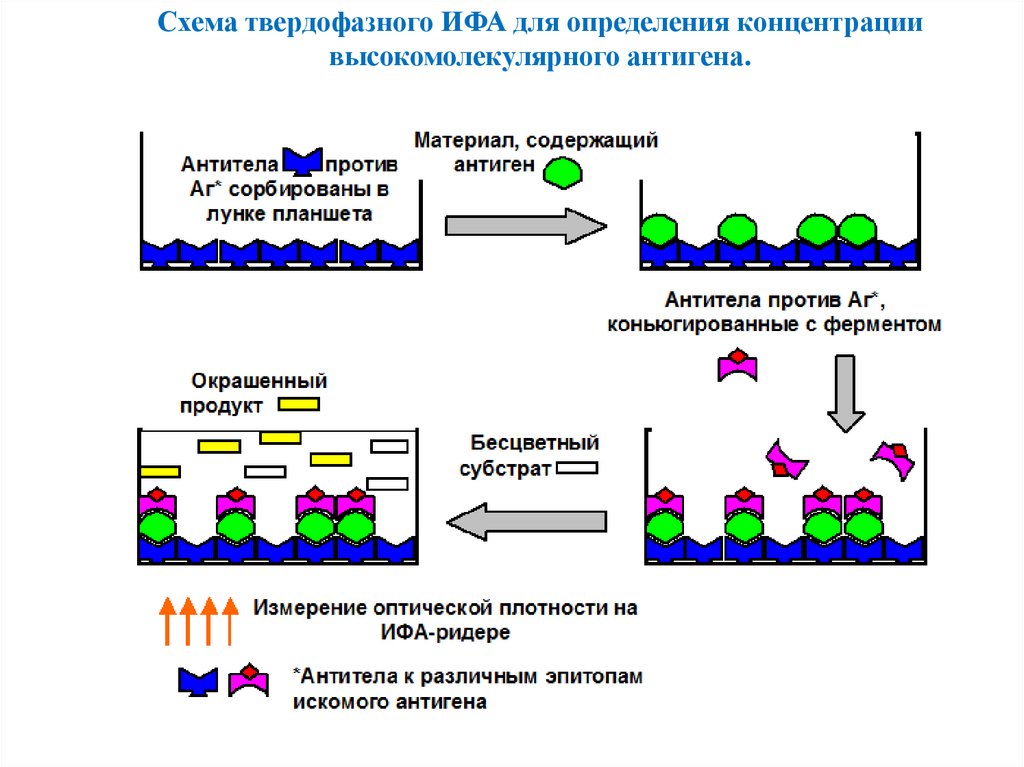
Схема твердофазного ИФА для определения концентрациивысокомолекулярного антигена.
3.
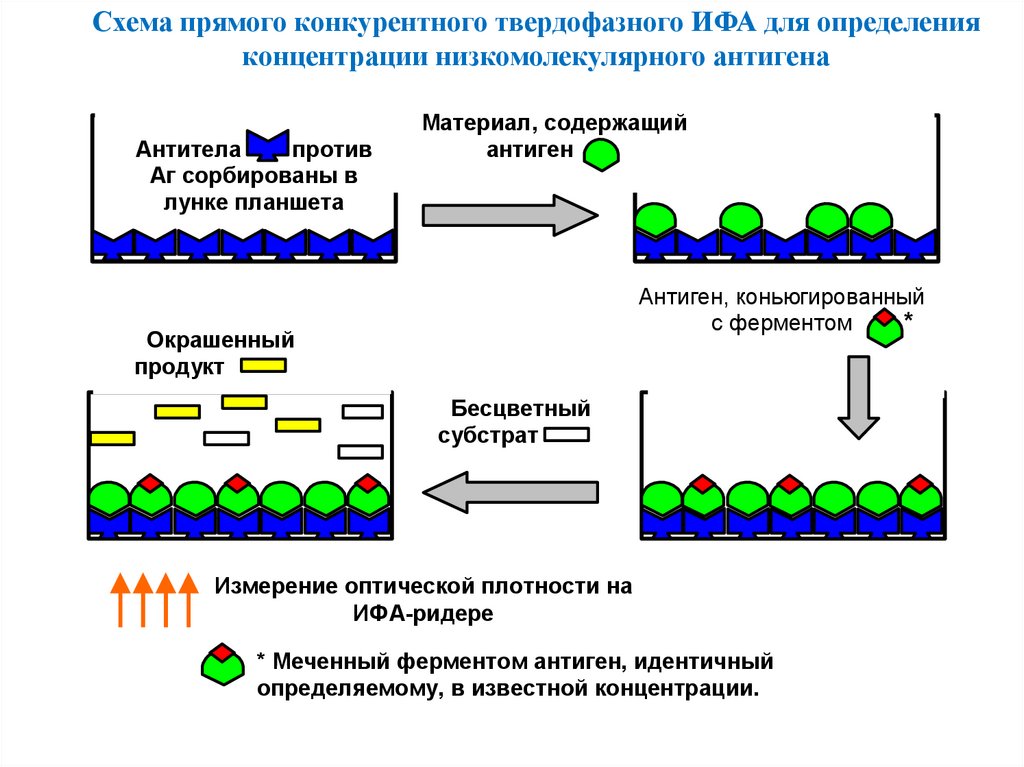
Схема прямого конкурентного твердофазного ИФА для определенияконцентрации низкомолекулярного антигена
Антитела
против
Аг сорбированы в
лунке планшета
Материал, содержащий
антиген
Антиген, коньюгированный
с ферментом
*
Окрашенный
продукт
Бесцветный
субстрат
Измерение оптической плотности на
ИФА-ридере
* Меченный ферментом антиген, идентичный
определяемому, в известной концентрации.
4.
БИОКОНЬЮГАЦИЯ:А + Б = А-Б
1. Получение моноклональных и поликлональных антител.
Увеличение молекулярной массы и размера молекулы
гаптена. Синтез коньюгатов гаптен-носитель.
2. Иммобилизация иммуноглобулина на твердой фазе.
Иммобилизация
с
использованием
техники
биоконьюгации.
3. Синтез коньюгатов фермент-иммуноглобулин (меткаиммуноглобулин).
4. Синтез коньюгатов гаптен-фермент (гаптен-метка).
5.
Техника биоконьюгации и способы введенияметок в макромолекулы
• бычий сывороточный альбумин (БСА),
• альбумин сыворотки человека,
• овальбумин,
• тироглобулин,
• синтетические пептиды типа полилизина.
6.
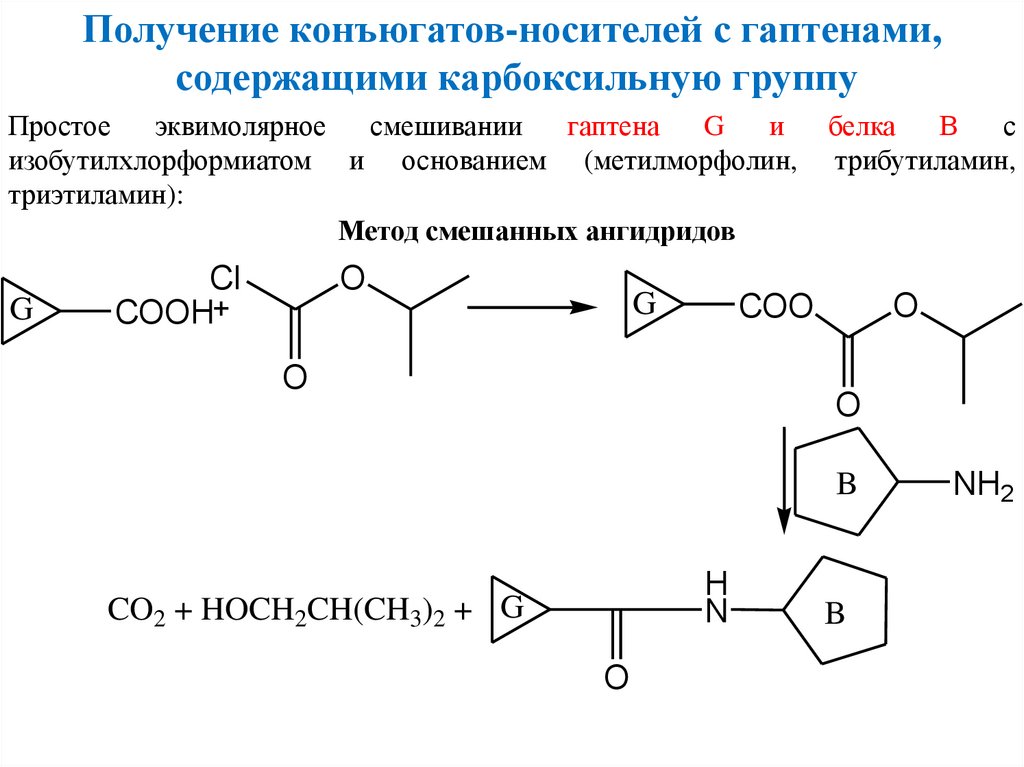
Получение конъюгатов-носителей с гаптенами,содержащими карбоксильную группу
Простое
эквимолярное
смешивании
гаптена
G
и
изобутилхлорформиатом и основанием (метилморфолин,
триэтиламин):
Метод смешанных ангидридов
G
Cl
COOH
O
G
белка
В
с
трибутиламин,
O
COO
O
O
B
H
N
CO2 + HOCH2CH(CH3)2 + G
O
B
NH2
7.
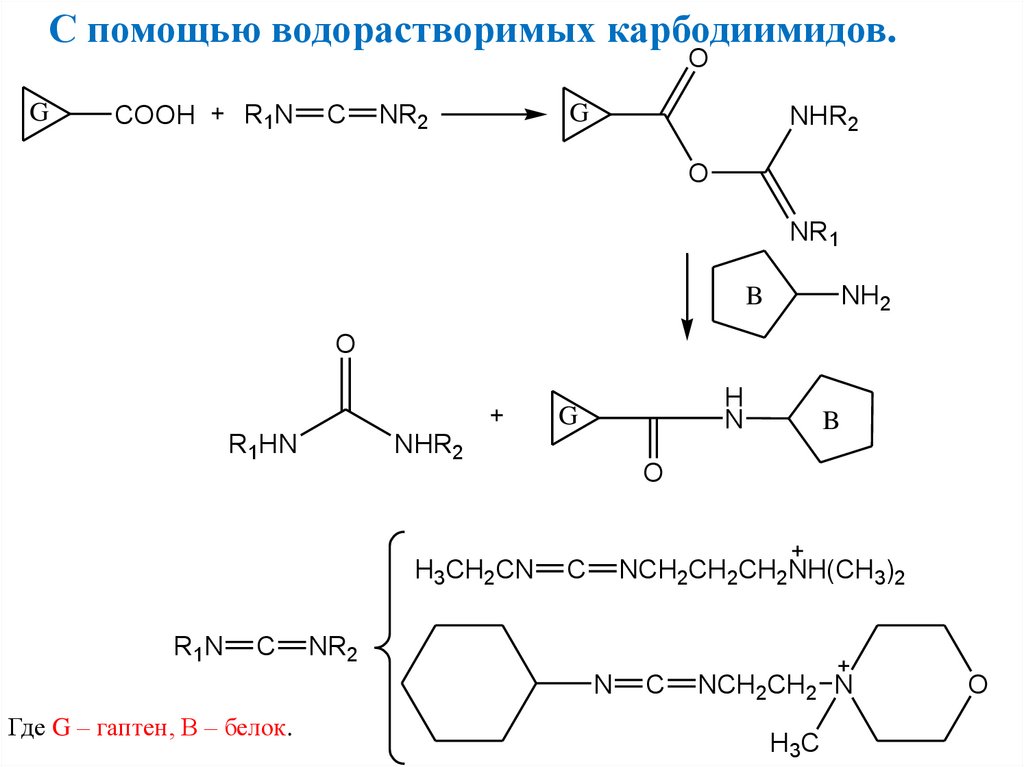
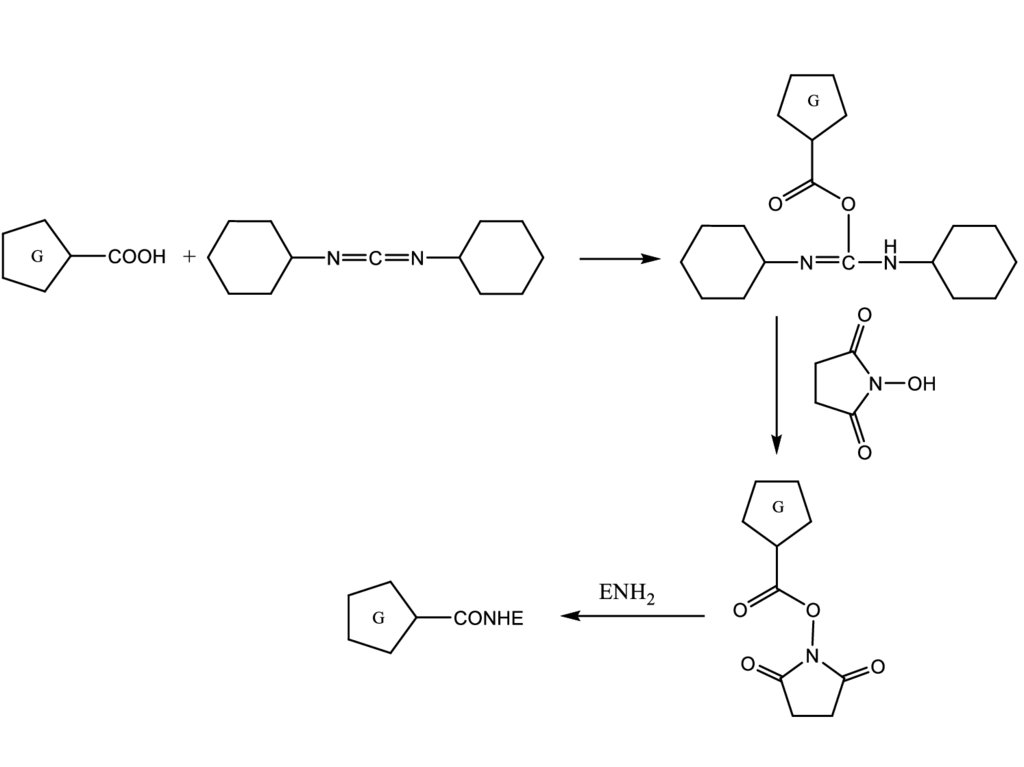
С помощью водорастворимых карбодиимидов.O
G
COOH
R1N
C
NR2
G
NHR2
O
NR1
NH2
B
O
H
N
G
R1HN
NHR2
H3CH2CN
R1N
C
O
C
NCH2CH2CH2NH(CH3)2
NR2
N
Где G – гаптен, В – белок.
B
C
NCH2CH2 N
H3C
O
8.
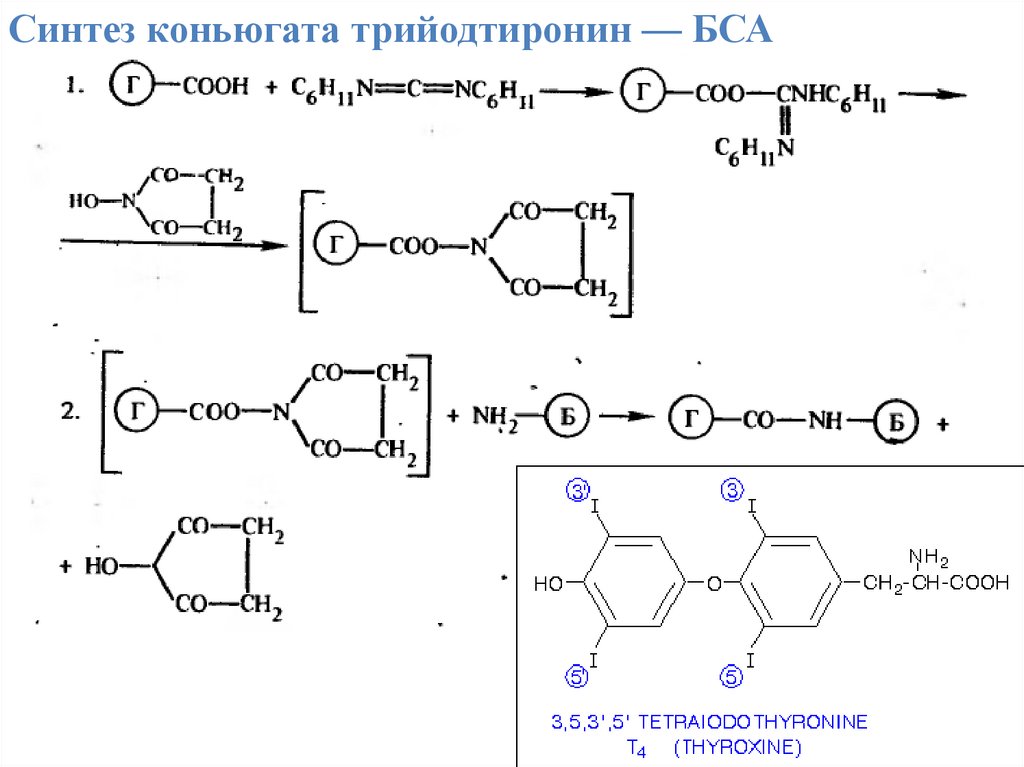
Синтез коньюгата трийодтиронин — БСА9.
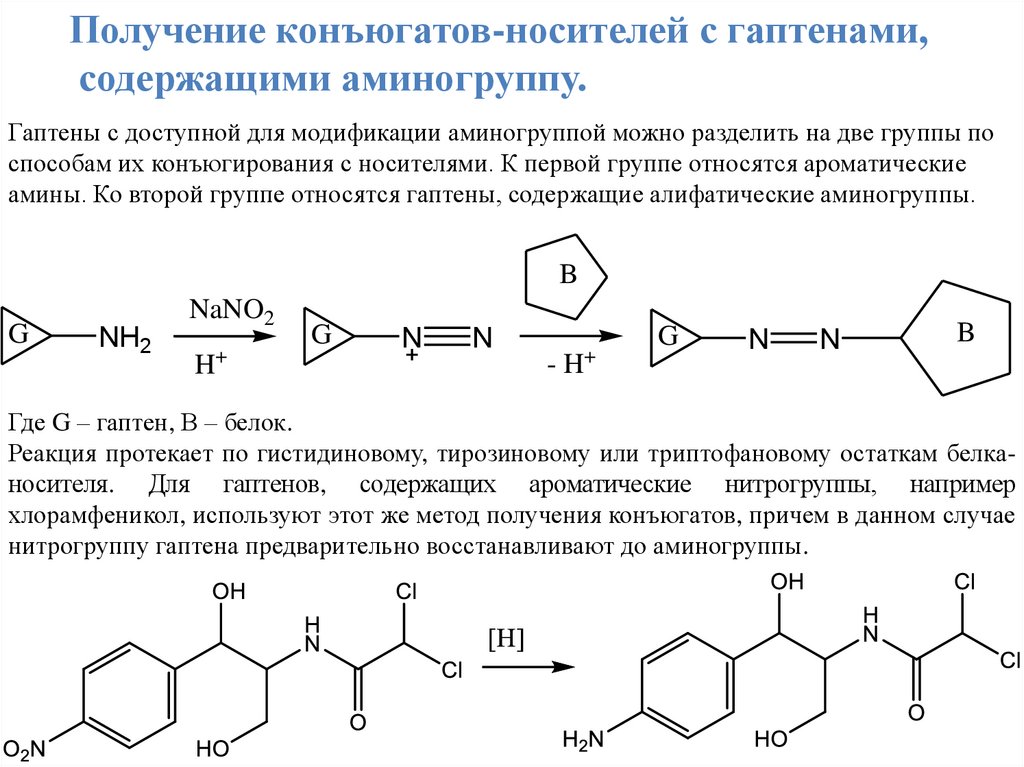
Получение конъюгатов-носителей с гаптенами,содержащими аминогруппу.
Гаптены с доступной для модификации аминогруппой можно разделить на две группы по
способам их конъюгирования с носителями. К первой группе относятся ароматические
амины. Ко второй группе относятся гаптены, содержащие алифатические аминогруппы.
B
G
NH2
NaNO2
+
H
G
N
N
+
-H
G
N
N
B
Где G – гаптен, В – белок.
Реакция протекает по гистидиновому, тирозиновому или триптофановому остаткам белканосителя. Для гаптенов, содержащих ароматические нитрогруппы, например
хлорамфеникол, используют этот же метод получения конъюгатов, причем в данном случае
нитрогруппу гаптена предварительно восстанавливают до аминогруппы.
10.
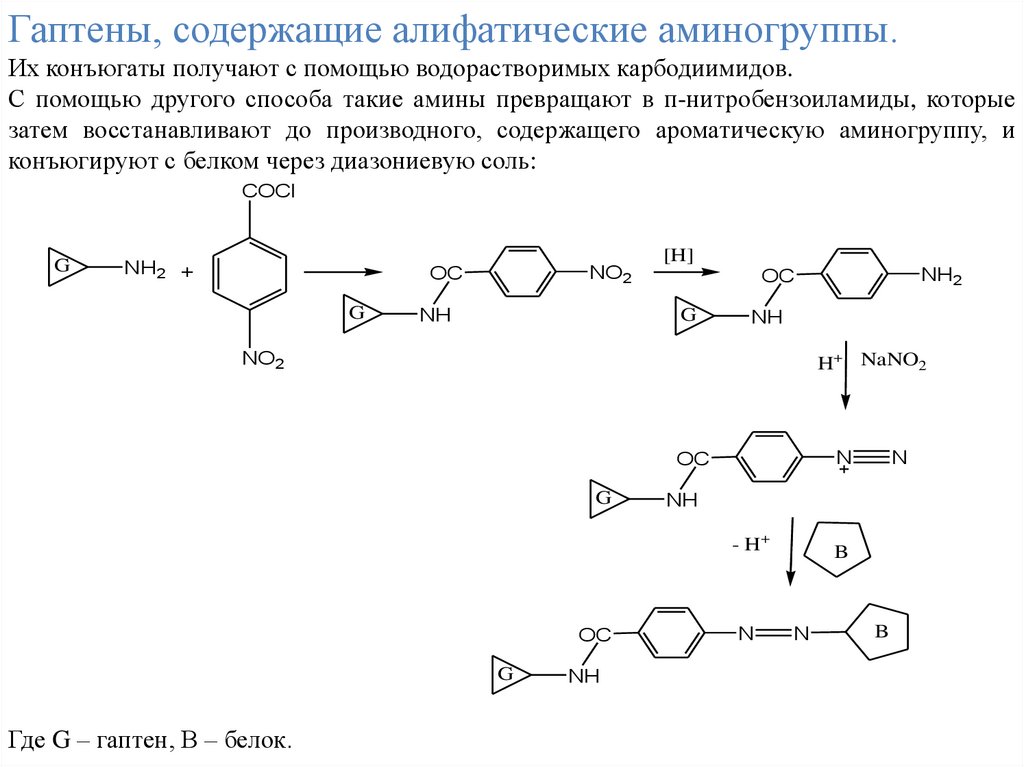
Гаптены, содержащие алифатические аминогруппы.Их конъюгаты получают с помощью водорастворимых карбодиимидов.
С помощью другого способа такие амины превращают в п-нитробензоиламиды, которые
затем восстанавливают до производного, содержащего ароматическую аминогруппу, и
конъюгируют с белком через диазониевую соль:
COCl
G
NH2 +
NO2
OC
G
NH
[H]
G
NH
NO2
H+ NaNO2
N
OC
G
OC
G
NH
N
NH
- H+
Где G – гаптен, В – белок.
NH2
OC
N
B
N
B
11.
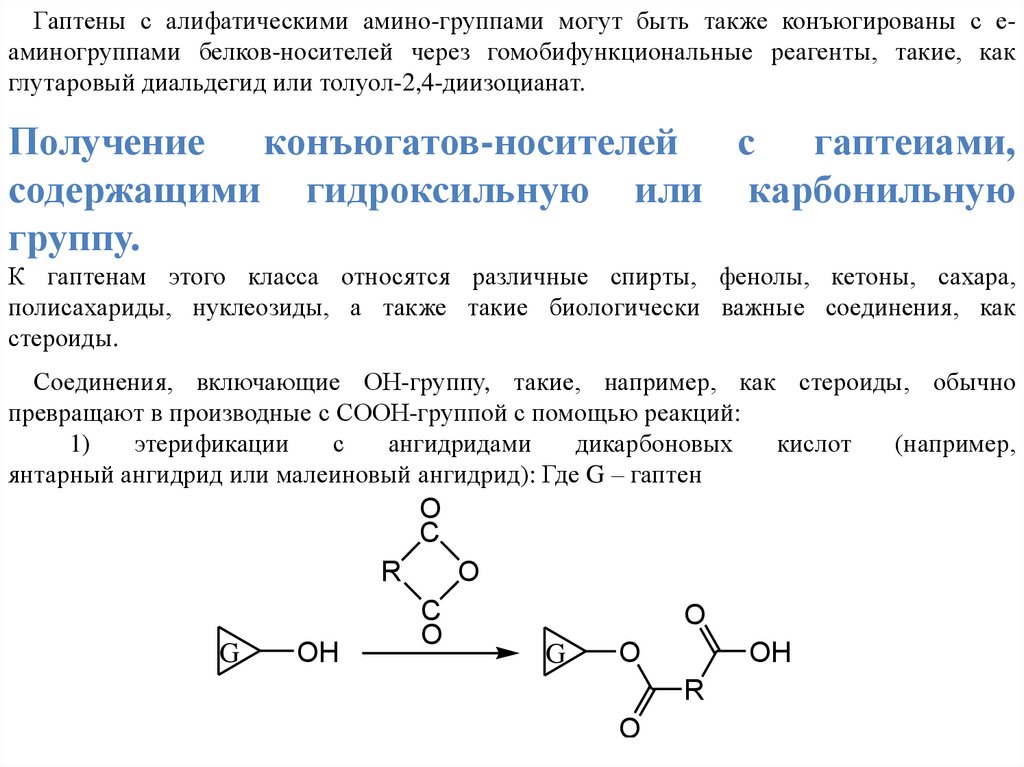
Гаптены с алифатическими амино-группами могут быть также конъюгированы с еаминогруппами белков-носителей через гомобифункциональные реагенты, такие, какглутаровый диальдегид или толуол-2,4-диизоцианат.
Получение конъюгатов-носителей с гаптеиами,
содержащими гидроксильную или карбонильную
группу.
К гаптенам этого класса относятся различные спирты, фенолы, кетоны, сахара,
полисахариды, нуклеозиды, а также такие биологически важные соединения, как
стероиды.
Соединения, включающие ОН-группу, такие, например, как стероиды, обычно
превращают в производные с СООН-группой с помощью реакций:
1)
этерификации
с
ангидридами
дикарбоновых
кислот
(например,
янтарный ангидрид или малеиновый ангидрид): Где G – гаптен
O
C
R
G
OH
O
C
O
O
G
O
OH
R
O
12.
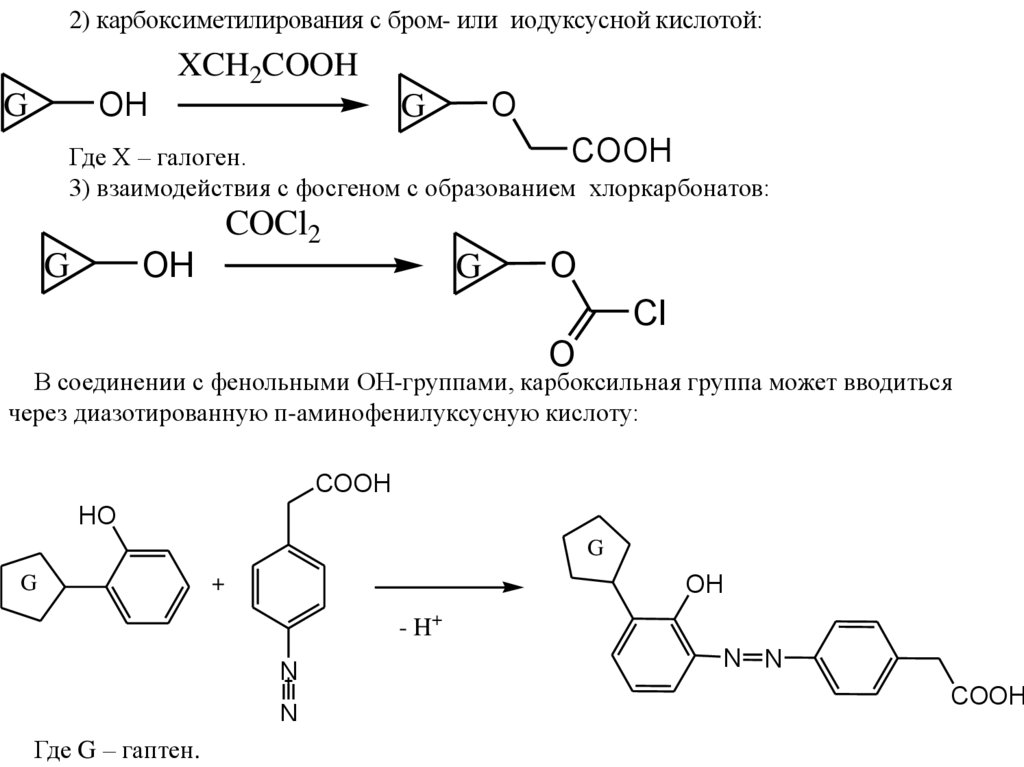
2) карбоксиметилирования с бром- или иодуксусной кислотой:XCH2COOH
OH
G
O
G
COOH
Где Х – галоген.
3) взаимодействия с фосгеном с образованием хлоркарбонатов:
COCl2
OH
G
G
O
Cl
O
В соединении с фенольными ОН-группами, карбоксильная группа может вводиться
через диазотированную п-аминофенилуксусную кислоту:
COOH
HO
G
G
+
OH
- H+
N
N
Где G – гаптен.
N N
COOH
13.
Способы нахождения количества молекул гаптена,пришитых к носителю:
• спектрофотометрический способ
• электрофорез в полиакриламидном геле в присутствии
додецилсульфата натрия
• по аминокислотному гидролизу конъюгата
• титрование свободных аминогрупп в исходном белке и
конъюгате
• радиоизотопный метода, в котором используют
меченный радиоактивным изотопом гаптен.
14.
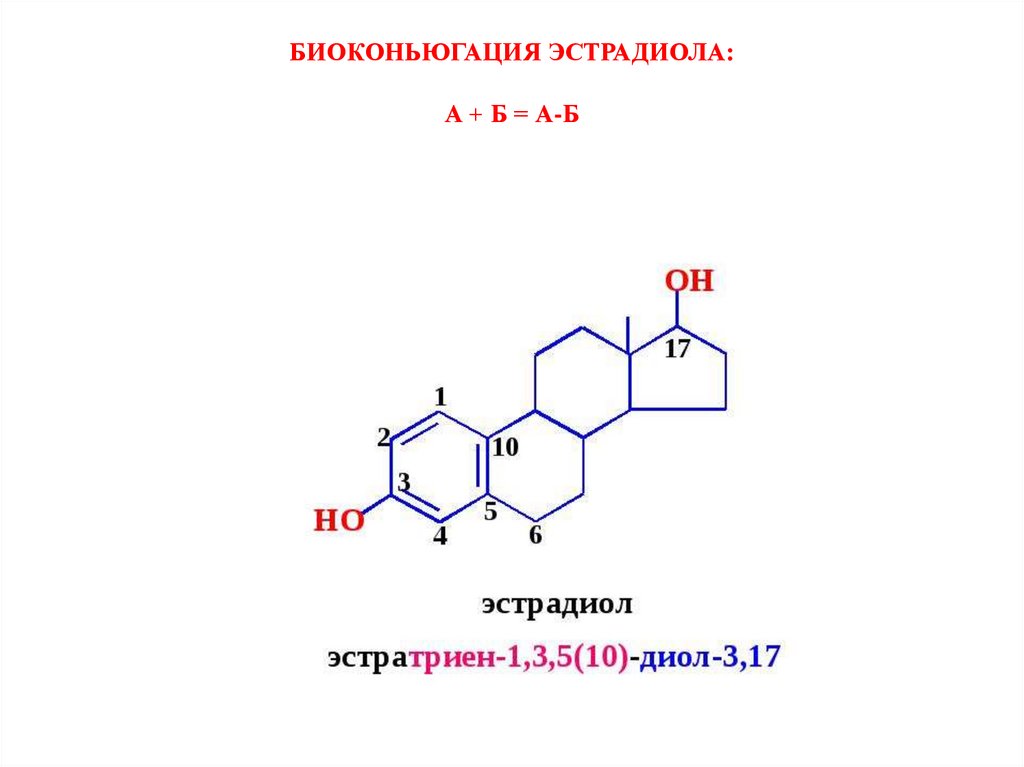
БИОКОНЬЮГАЦИЯ ЭСТРАДИОЛА:А + Б = А-Б
15.
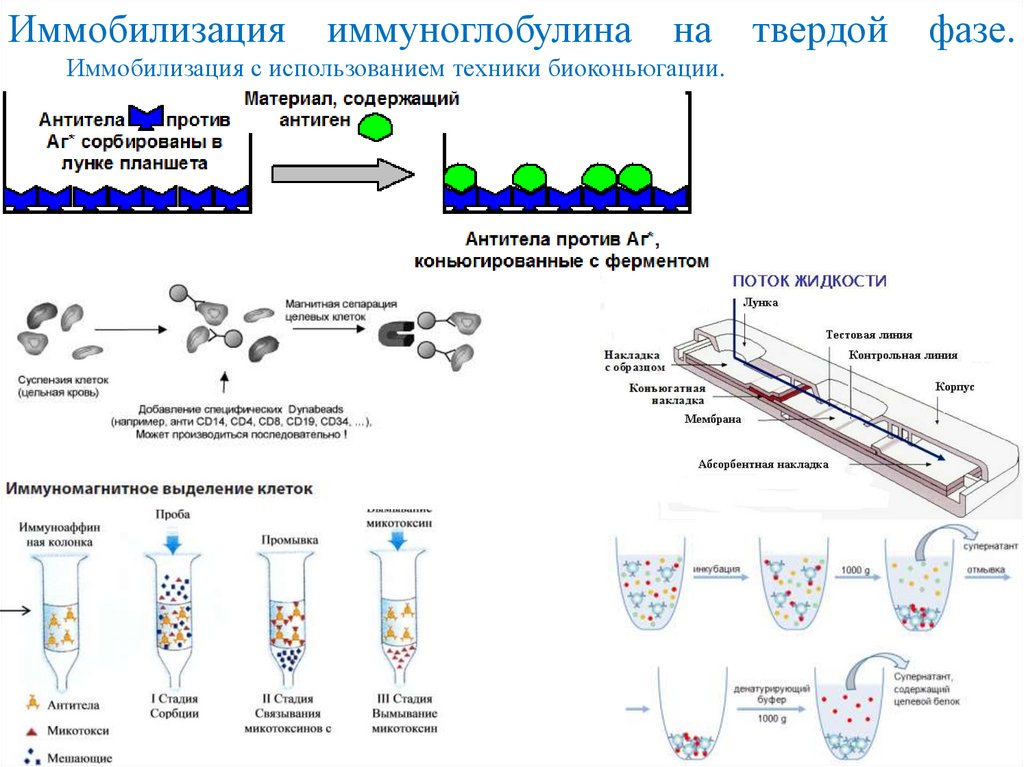
Иммобилизацияиммуноглобулина
на
Иммобилизация с использованием техники биоконьюгации.
твердой
фазе.
16.
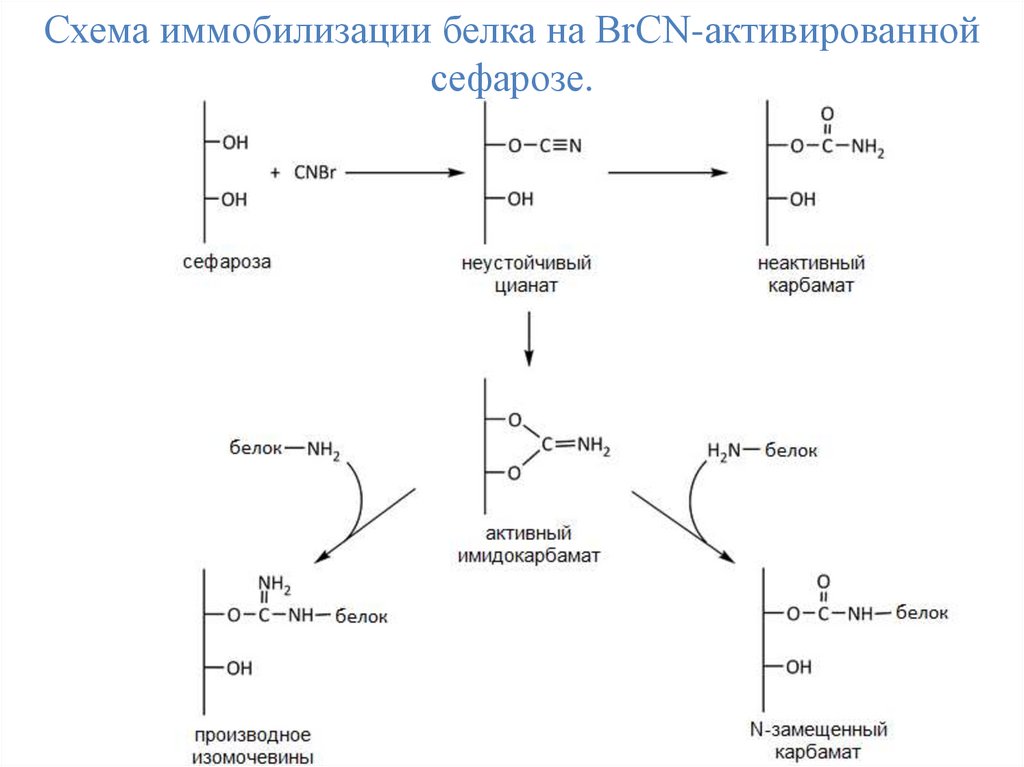
Одним из наиболее распространенных носителей, используемых в биохимии ужена протяжении нескольких десятилетий, является сефароза – специальным
образом обработанные сферические гранулы агарозы. Известно несколько
способов активации сефарозы, однако чаще других применяют метод активации
сефарозы с использованием бромциана (BrCN).
Активацию сефарозы осуществляют в процессе инкубации раствора бромциана с
водной суспензией сефарозы. Бромциан взаимодействует с гидроксильными
группами сефарозы, в результате чего образуется имидокарбонат, содержащий
электрофильный атом углерода. Помимо этого в ходе реакции образуется
неактивный карбамат, не способный к реакции с нуклеофильными боковыми
группами аминокислот. При взаимодействии имидокарбоната с нуклеофильными
группами, прежде всего с e-аминогруппами лизина, происходит образование
прочной ковалентной связи белка с активированной матрицей через остаток
изомочевины или N-замещенного карбамата.
Нужно заметить, что активными нуклеофилами, кроме e-аминогрупп лизина,
являются также SH-группа цистеина, концевые аминогруппы белков и ОН-группа
тирозина (по активности данные группы располагаются в следующем порядке:
SH-, концевая NH2-, OH-группа тирозина)
17.
Схема иммобилизации белка на BrCN-активированнойсефарозе.
18.
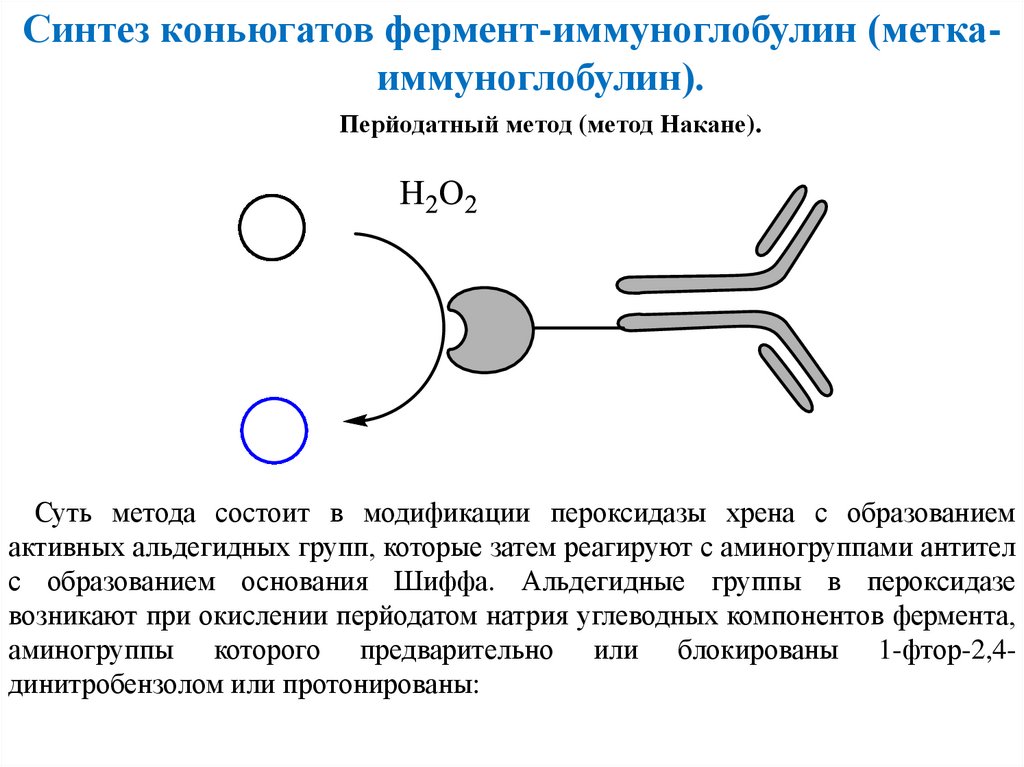
Синтез коньюгатов фермент-иммуноглобулин (меткаиммуноглобулин).Перйодатный метод (метод Накане).
Суть метода состоит в модификации пероксидазы хрена с образованием
активных альдегидных групп, которые затем реагируют с аминогруппами антител
с образованием основания Шиффа. Альдегидные группы в пероксидазе
возникают при окислении перйодатом натрия углеводных компонентов фермента,
аминогруппы которого предварительно или блокированы 1-фтор-2,4динитробензолом или протонированы:
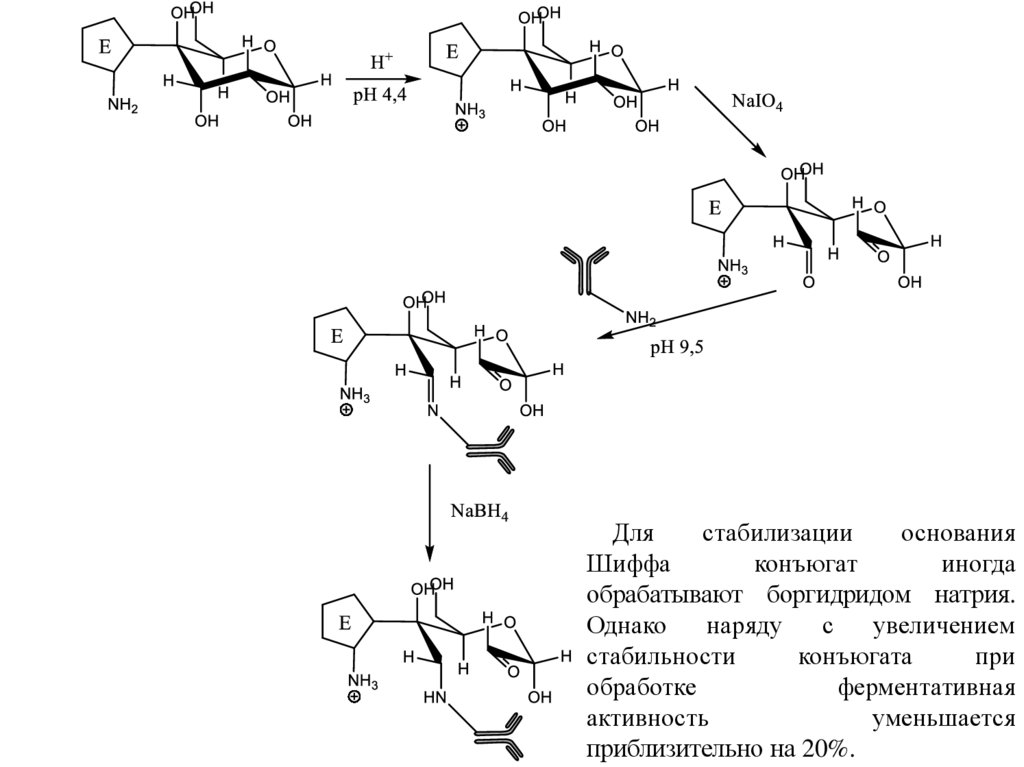
19.
Длястабилизации
основания
Шиффа
конъюгат
иногда
обрабатывают боргидридом натрия.
Однако
наряду
с
увеличением
стабильности
конъюгата
при
обработке
ферментативная
активность
уменьшается
приблизительно на 20%.
20.
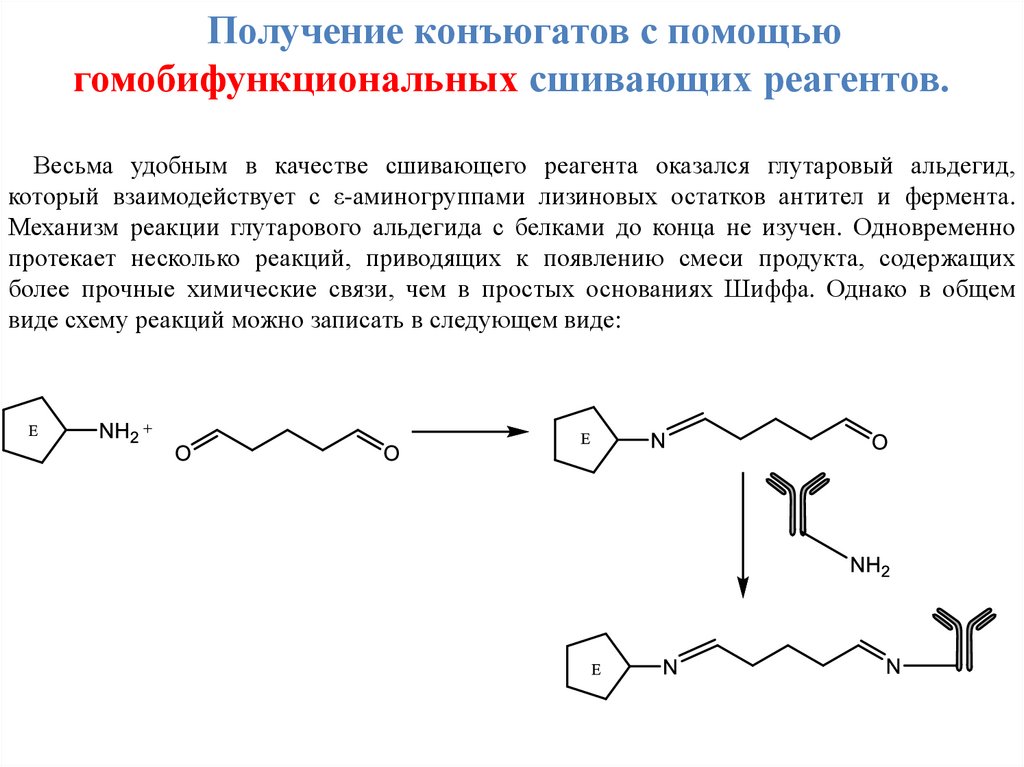
Получение конъюгатов с помощьюгомобифункциональных сшивающих реагентов.
Весьма удобным в качестве сшивающего реагента оказался глутаровый альдегид,
который взаимодействует с ε-аминогруппами лизиновых остатков антител и фермента.
Механизм реакции глутарового альдегида с белками до конца не изучен. Одновременно
протекает несколько реакций, приводящих к появлению смеси продукта, содержащих
более прочные химические связи, чем в простых основаниях Шиффа. Однако в общем
виде схему реакций можно записать в следующем виде:
21.
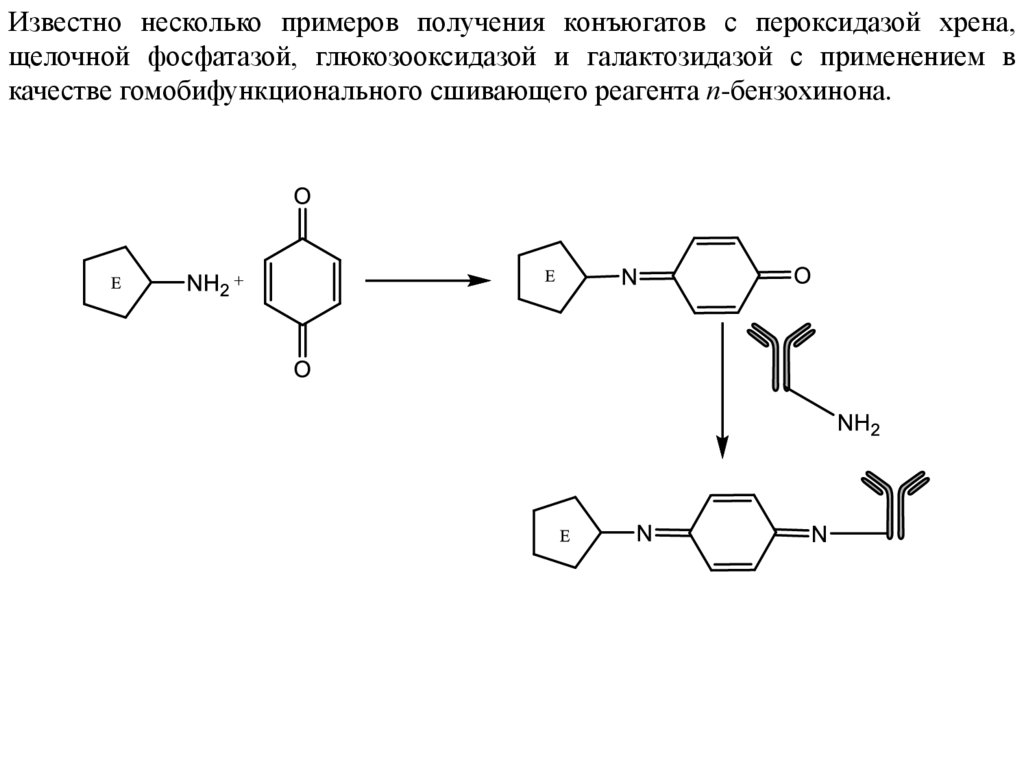
Известно несколько примеров получения конъюгатов с пероксидазой хрена,щелочной фосфатазой, глюкозооксидазой и галактозидазой с применением в
качестве гомобифункционального сшивающего реагента п-бензохинона.
22.
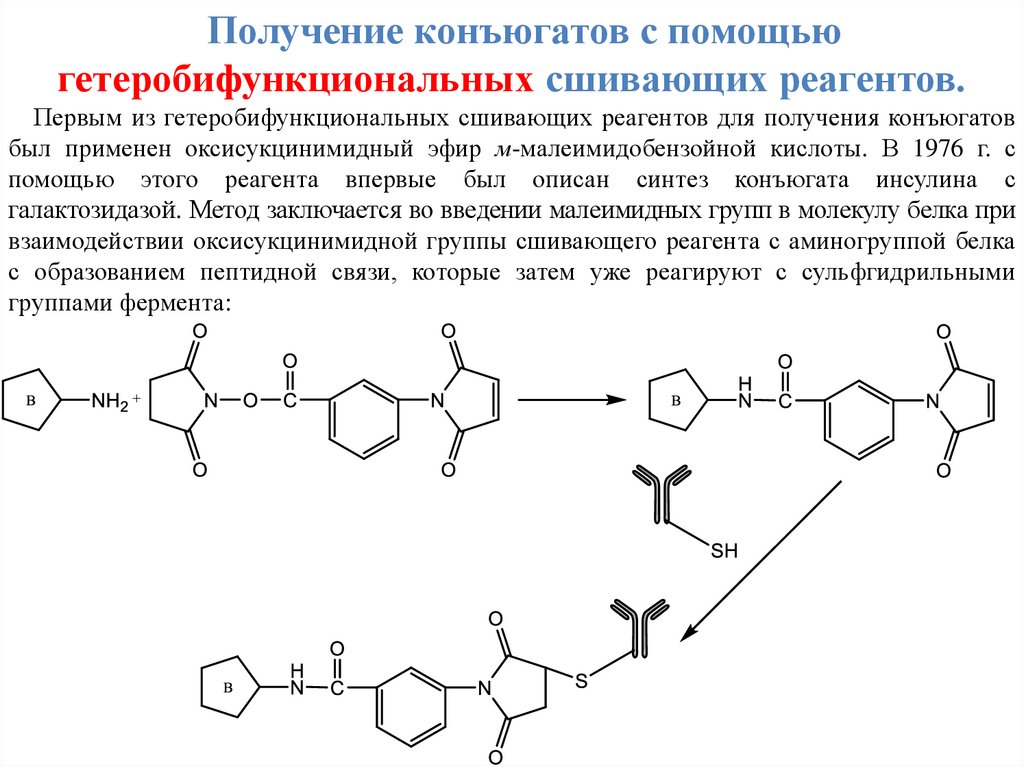
Получение конъюгатов с помощьюгетеробифункциональных сшивающих реагентов.
Первым из гетеробифункциональных сшивающих реагентов для получения конъюгатов
был применен оксисукцинимидный эфир м-малеимидобензойной кислоты. В 1976 г. с
помощью этого реагента впервые был описан синтез конъюгата инсулина с
галактозидазой. Метод заключается во введении малеимидных групп в молекулу белка при
взаимодействии оксисукцинимидной группы сшивающего реагента с аминогруппой белка
с образованием пептидной связи, которые затем уже реагируют с сульфгидрильными
группами фермента:
23.
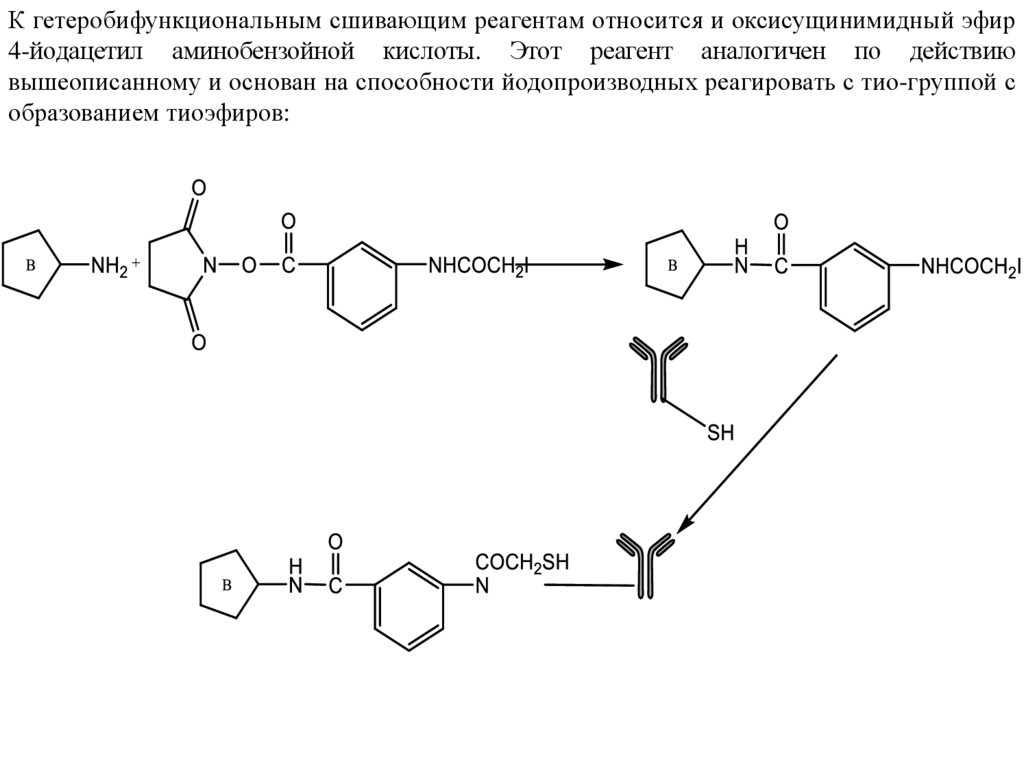
К гетеробифункциональным сшивающим реагентам относится и оксисущинимидный эфир4-йодацетил аминобензойной кислоты. Этот реагент аналогичен по действию
вышеописанному и основан на способности йодопроизводных реагировать с тио-группой с
образованием тиоэфиров:
24.
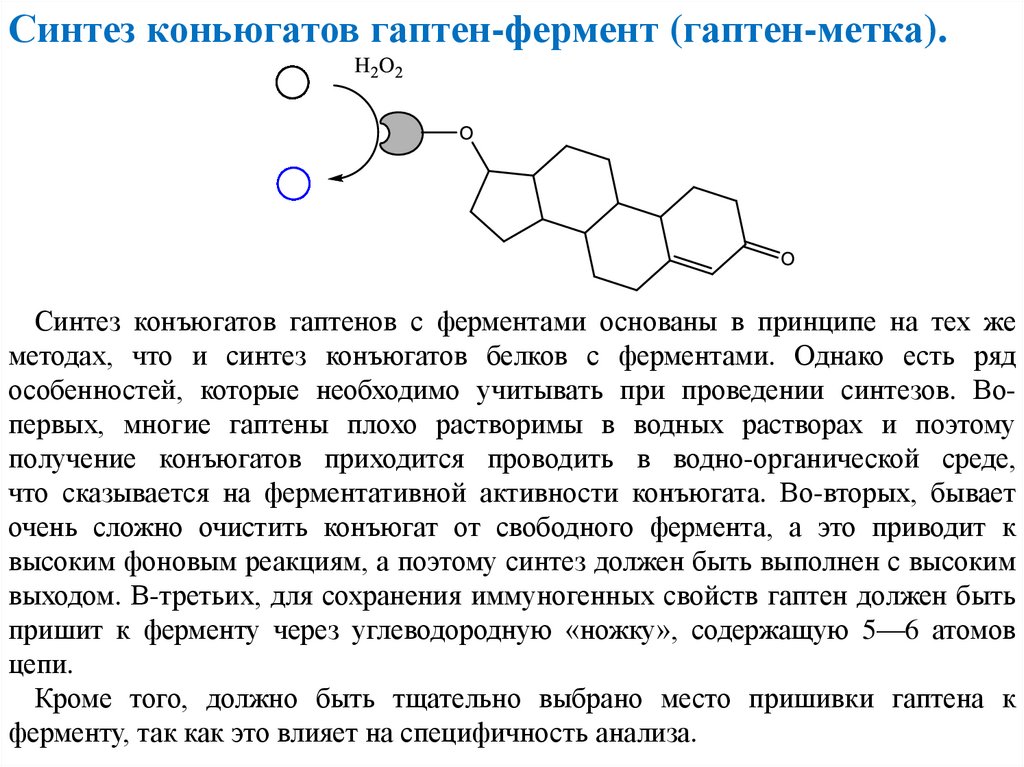
Синтез коньюгатов гаптен-фермент (гаптен-метка).Синтез конъюгатов гаптенов с ферментами основаны в принципе на тех же
методах, что и синтез конъюгатов белков с ферментами. Однако есть ряд
особенностей, которые необходимо учитывать при проведении синтезов. Вопервых, многие гаптены плохо растворимы в водных растворах и поэтому
получение конъюгатов приходится проводить в водно-органической среде,
что сказывается на ферментативной активности конъюгата. Во-вторых, бывает
очень сложно очистить конъюгат от свободного фермента, а это приводит к
высоким фоновым реакциям, а поэтому синтез должен быть выполнен с высоким
выходом. В-третьих, для сохранения иммуногенных свойств гаптен должен быть
пришит к ферменту через углеводородную «ножку», содержащую 5—6 атомов
цепи.
Кроме того, должно быть тщательно выбрано место пришивки гаптена к
ферменту, так как это влияет на специфичность анализа.
25.
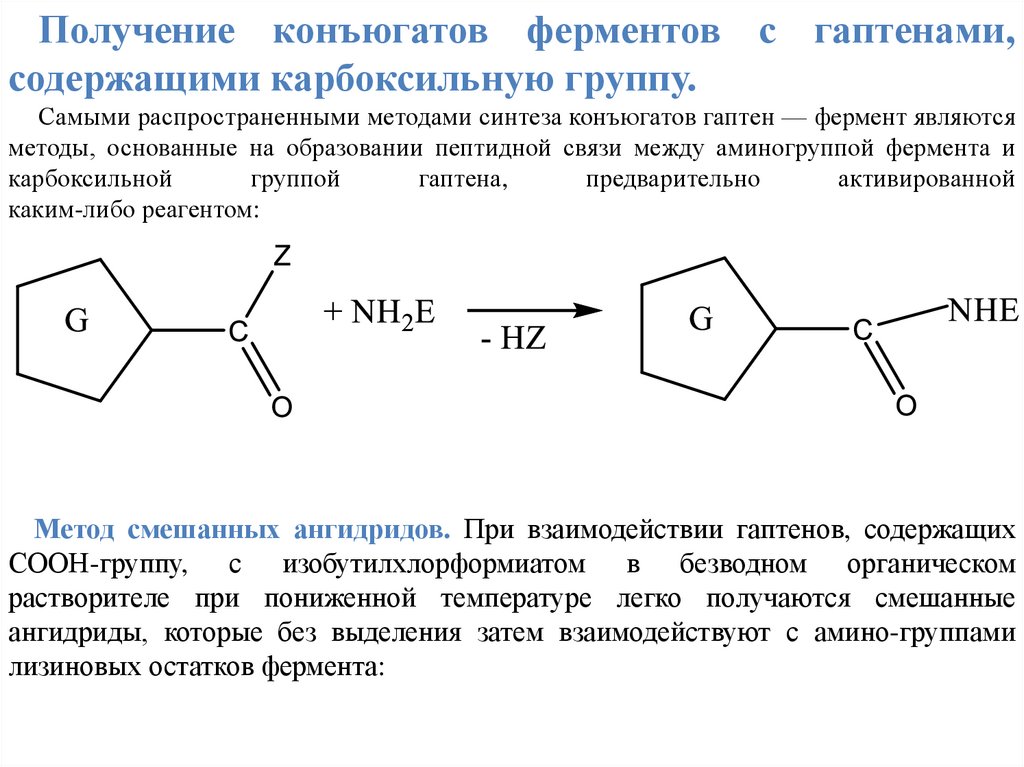
Получение конъюгатов ферментов с гаптенами,содержащими карбоксильную группу.
Самыми распространенными методами синтеза конъюгатов гаптен — фермент являются
методы, основанные на образовании пептидной связи между аминогруппой фермента и
карбоксильной
группой
гаптена,
предварительно
активированной
каким-либо реагентом:
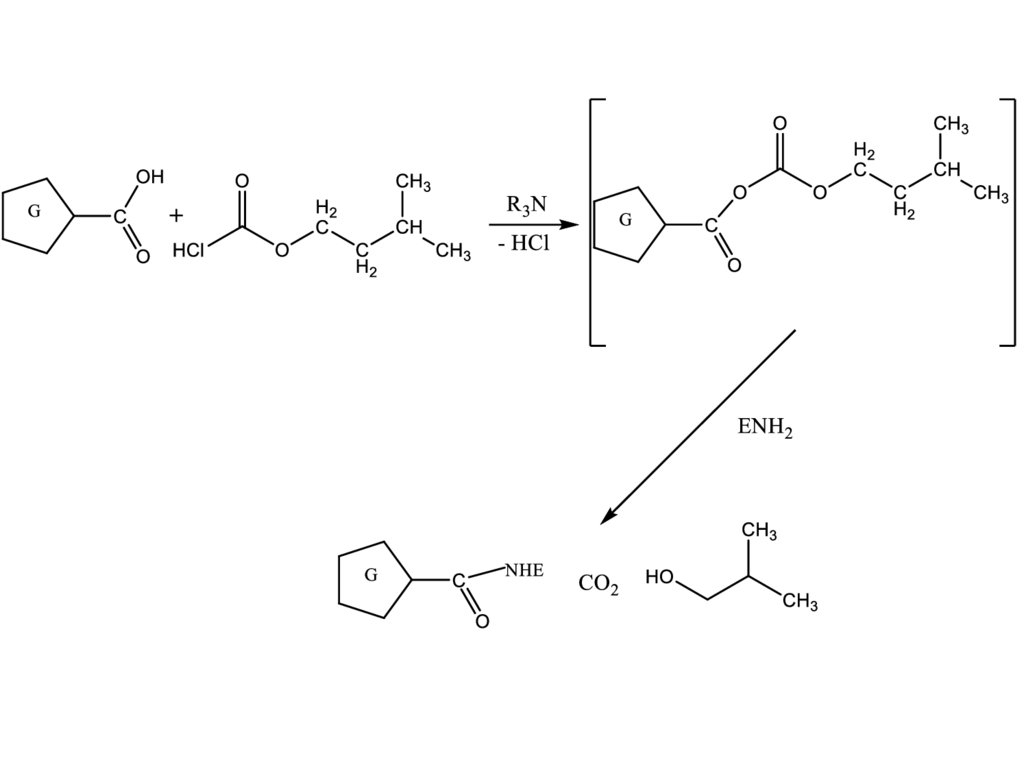
Метод смешанных ангидридов. При взаимодействии гаптенов, содержащих
СООН-группу, с изобутилхлорформиатом в безводном органическом
растворителе при пониженной температуре легко получаются смешанные
ангидриды, которые без выделения затем взаимодействуют с амино-группами
лизиновых остатков фермента:
26.
27.
28.
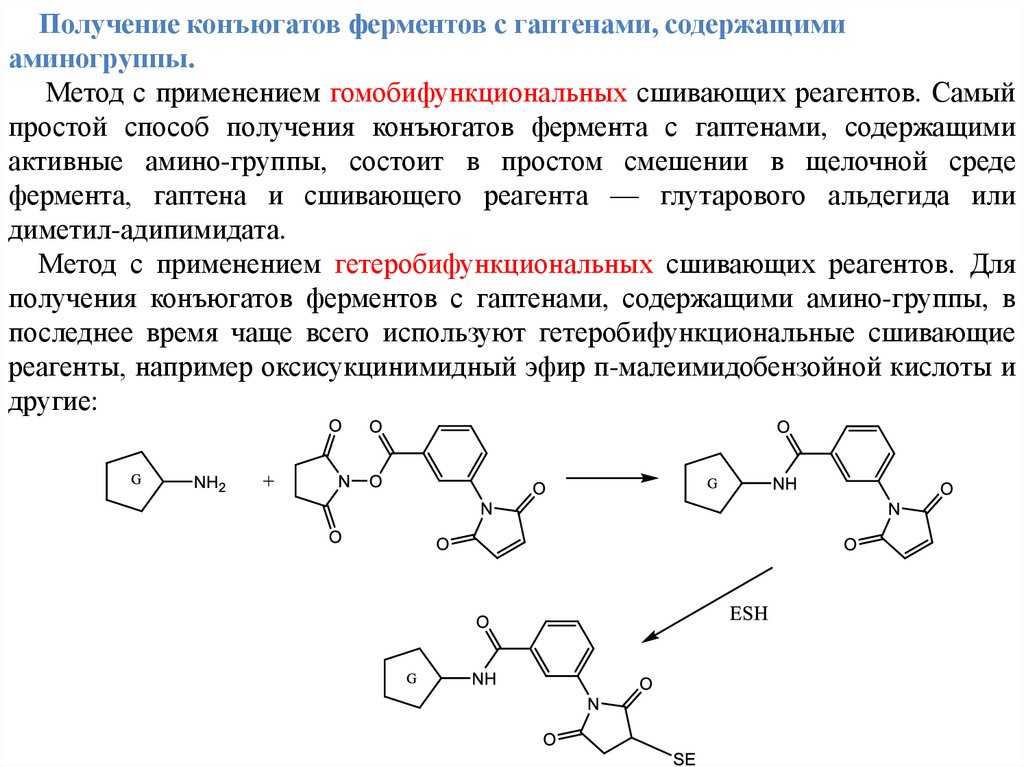
Получение конъюгатов ферментов с гаптенами, содержащимиаминогруппы.
Метод с применением гомобифункциональных сшивающих реагентов. Самый
простой способ получения конъюгатов фермента с гаптенами, содержащими
активные амино-группы, состоит в простом смешении в щелочной среде
фермента, гаптена и сшивающего реагента — глутарового альдегида или
диметил-адипимидата.
Метод с применением гетеробифункциональных сшивающих реагентов. Для
получения конъюгатов ферментов с гаптенами, содержащими амино-группы, в
последнее время чаще всего используют гетеробифункциональные сшивающие
реагенты, например оксисукцинимидный эфир п-малеимидобензойной кислоты и
другие:
29.
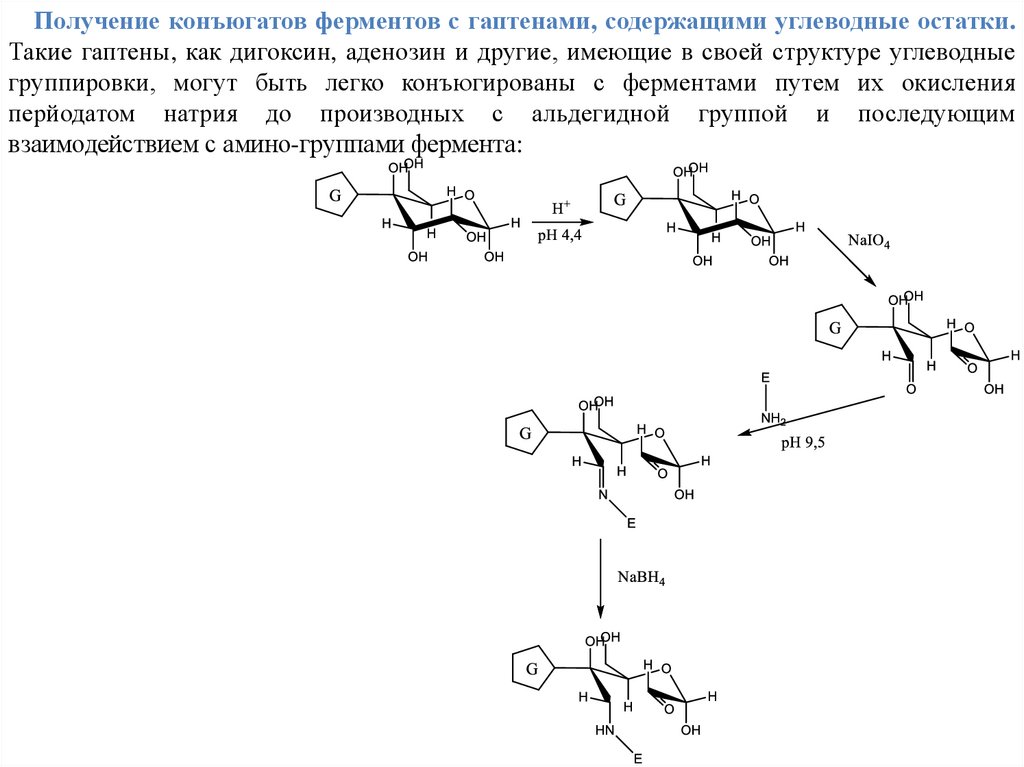
Получение конъюгатов ферментов с гаптенами, содержащими углеводные остатки.Такие гаптены, как дигоксин, аденозин и другие, имеющие в своей структуре углеводные
группировки, могут быть легко конъюгированы с ферментами путем их окисления
перйодатом натрия до производных с альдегидной группой и последующим
взаимодействием с амино-группами фермента:
30.
Методы введения радиоактивной метки.Существуют следующие четыре основных метода внутреннего маркирования:
1)
Бомбардировка соединения нейтронами в атомном реакторе. Обычно к
этому методу редко прибегают, поскольку он не обладает избирательностью (т.е.
может вызывать изменения многих атомов с образованием самых разных
изотопных форм); кроме того, бомбардировка нейтронами может, по-видимому,
приводить к разрушению молекул.
2)
Химический синтез. Молекулу синтезируют из более простых молекул
или элементов, из которых один или несколько находятся в форме радиоактивного
изотопа. Такой подход применяется в случае небольших пептидных гормонов;
примером может служить синтез вазопрессина из составляющих его аминокислот
с применением 3Н-тирозина.
3)
Биологический синтез. Молекула синтезируется в биологической системе
in vivo или in vitro из радиоактивных предшественников; в качестве примера
можно привести синтез простагландина из меченной тритием арахидоновой
кислоты.
4)
Реакции изотопного обмена. Среди методов этого типа наиболее известен
метод Вилцбаха, который состоит в том, что вещество, предназначенное для
маркировки, распределяют по стенкам сосуда и выдерживают в атмосфере
газообразного трития (3Н) при комнатной температуре в течение недели.
31.
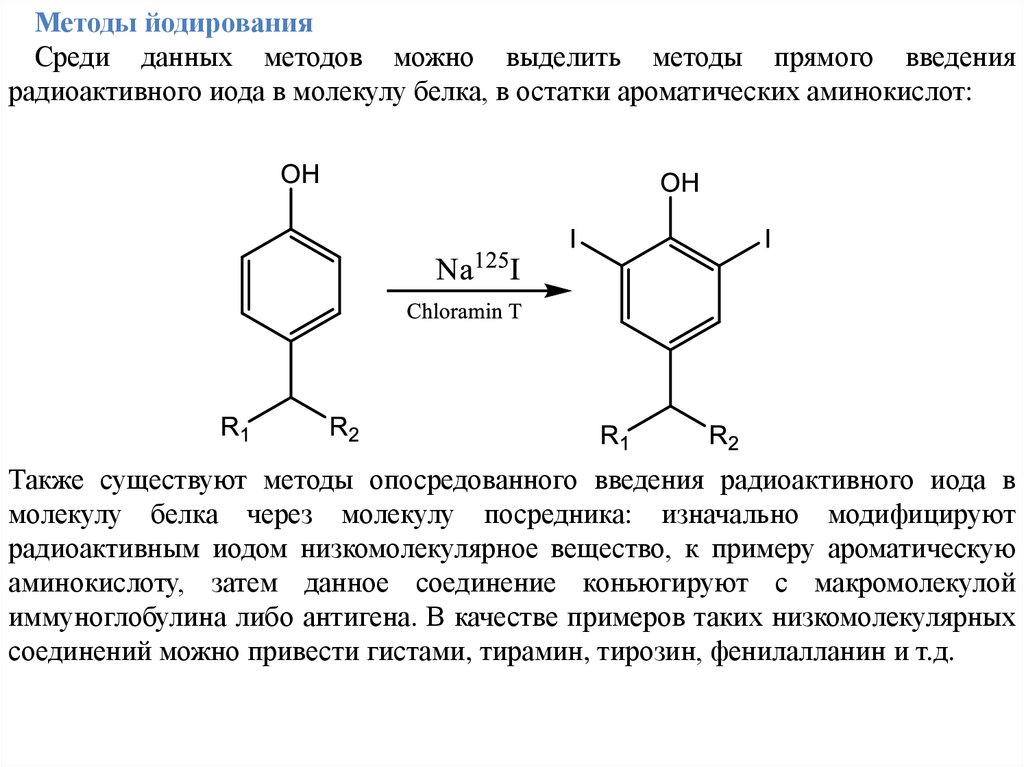
Методы йодированияСреди данных методов можно выделить методы прямого введения
радиоактивного иода в молекулу белка, в остатки ароматических аминокислот:
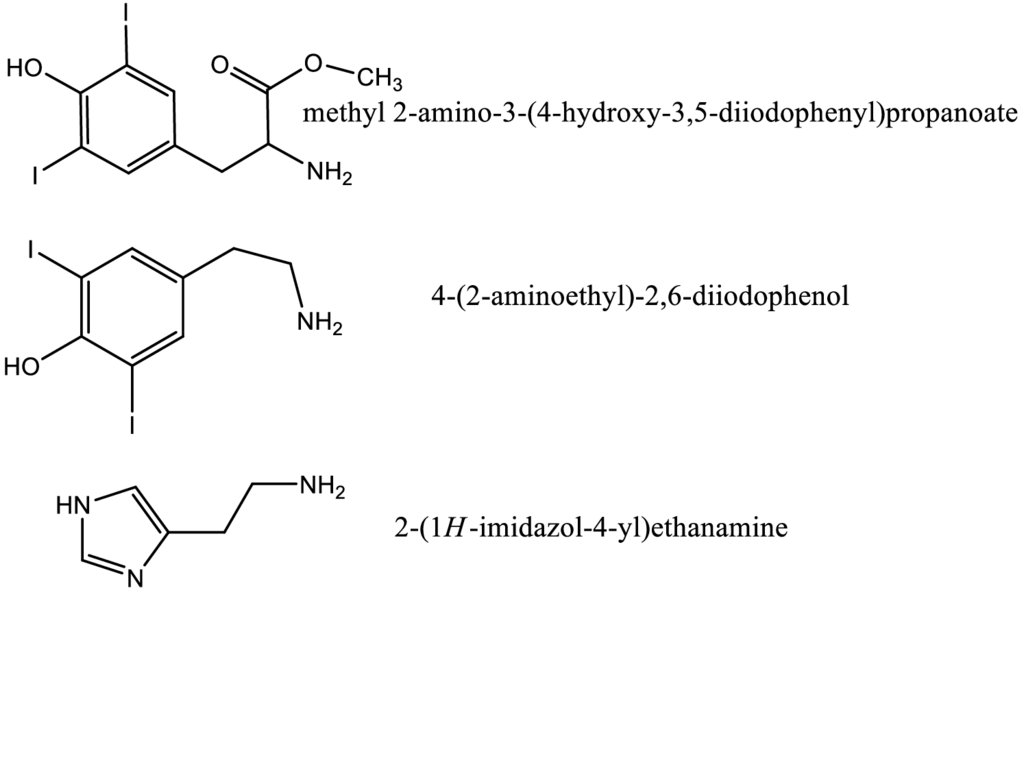
Также существуют методы опосредованного введения радиоактивного иода в
молекулу белка через молекулу посредника: изначально модифицируют
радиоактивным иодом низкомолекулярное вещество, к примеру ароматическую
аминокислоту, затем данное соединение коньюгируют с макромолекулой
иммуноглобулина либо антигена. В качестве примеров таких низкомолекулярных
соединений можно привести гистами, тирамин, тирозин, фенилалланин и т.д.
32.
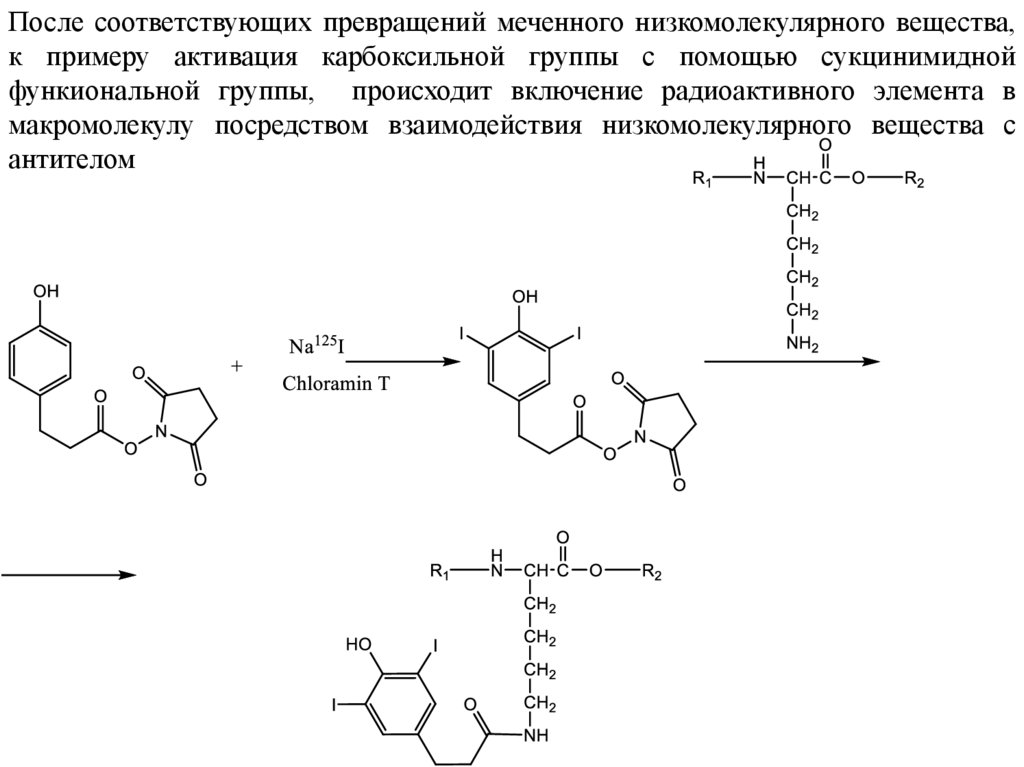
33.
После соответствующих превращений меченного низкомолекулярного вещества,к примеру активация карбоксильной группы с помощью сукцинимидной
функиональной группы, происходит включение радиоактивного элемента в
макромолекулу посредством взаимодействия низкомолекулярного вещества с
антителом
34.
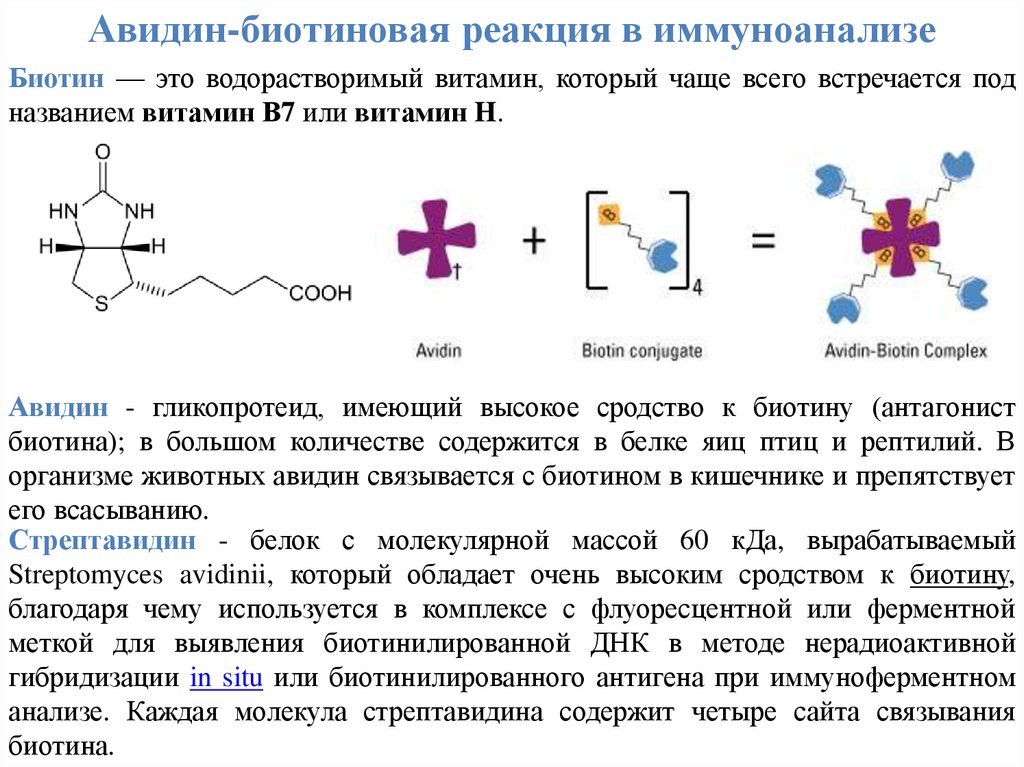
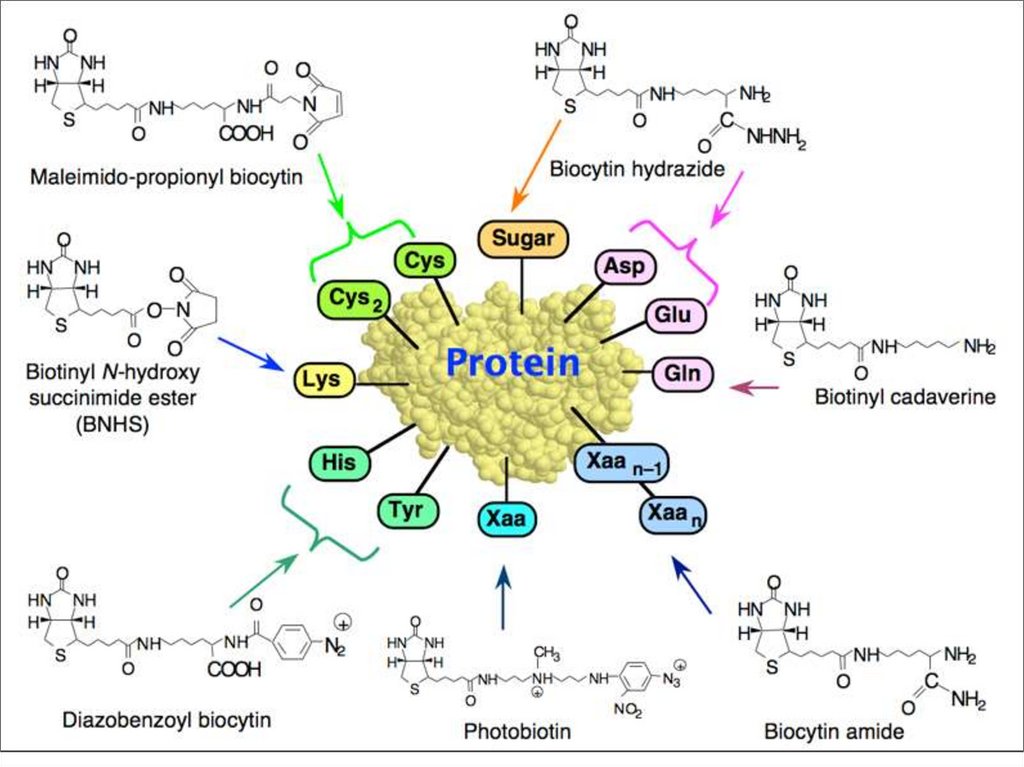
Авидин-биотиновая реакция в иммуноанализеБиотин — это водорастворимый витамин, который чаще всего встречается под
названием витамин В7 или витамин H.
Авидин - гликопротеид, имеющий высокое сродство к биотину (антагонист
биотина); в большом количестве содержится в белке яиц птиц и рептилий. В
организме животных авидин связывается с биотином в кишечнике и препятствует
его всасыванию.
Стрептавидин - белок с молекулярной массой 60 кДа, вырабатываемый
Streptomyces avidinii, который обладает очень высоким сродством к биотину,
благодаря чему используется в комплексе с флуоресцентной или ферментной
меткой для выявления биотинилированной ДНК в методе нерадиоактивной
гибридизации in situ или биотинилированного антигена при иммуноферментном
анализе. Каждая молекула стрептавидина содержит четыре сайта связывания
биотина.
35.
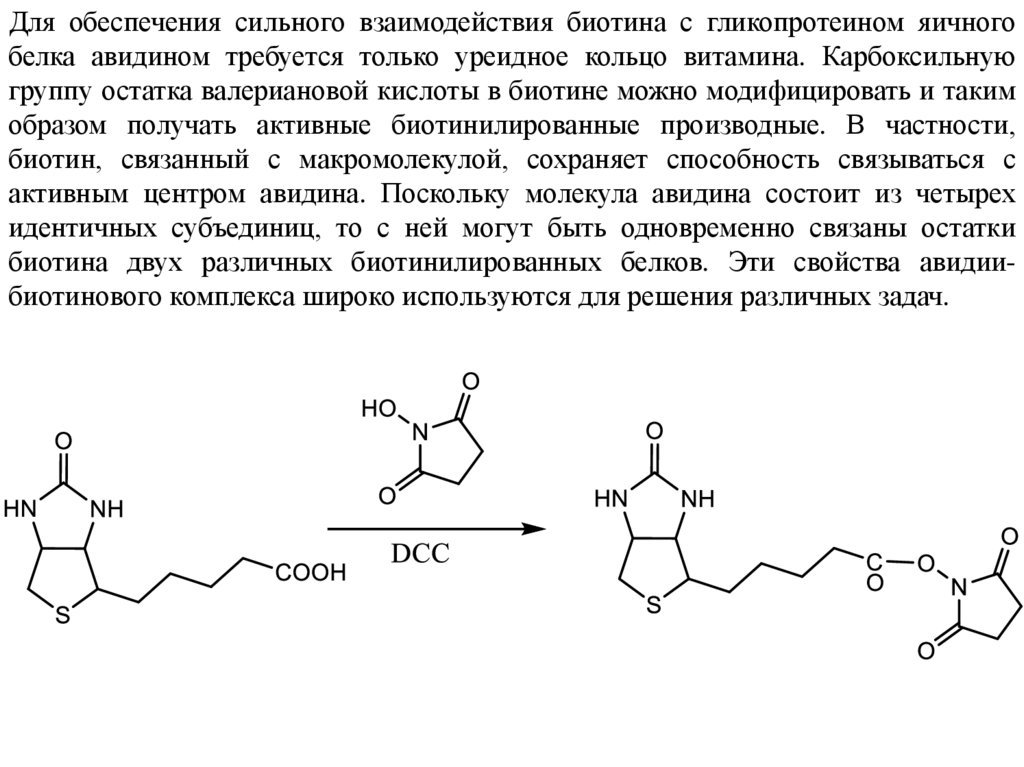
Для обеспечения сильного взаимодействия биотина с гликопротеином яичногобелка авидином требуется только уреидное кольцо витамина. Карбоксильную
группу остатка валериановой кислоты в биотине можно модифицировать и таким
образом получать активные биотинилированные производные. В частности,
биотин, связанный с макромолекулой, сохраняет способность связываться с
активным центром авидина. Поскольку молекула авидина состоит из четырех
идентичных субъединиц, то с ней могут быть одновременно связаны остатки
биотина двух различных биотинилированных белков. Эти свойства авидиибиотинового комплекса широко используются для решения различных задач.
36.
37.
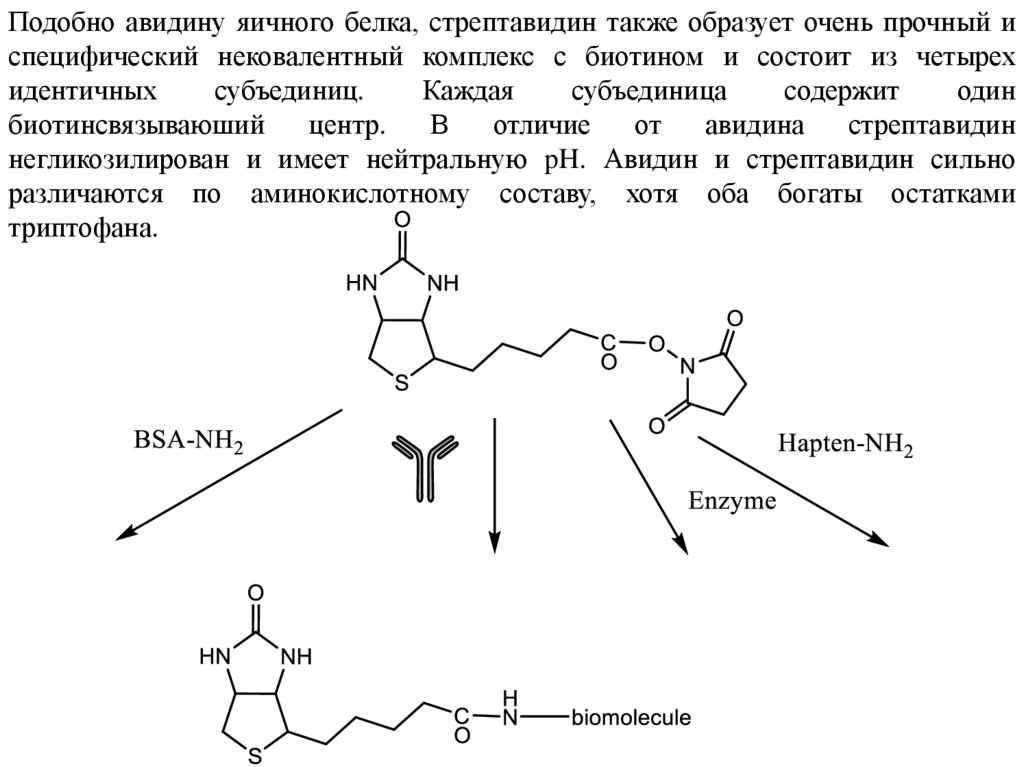
Подобно авидину яичного белка, стрептавидин также образует очень прочный испецифический нековалентный комплекс с биотином и состоит из четырех
идентичных
субъединиц.
Каждая
субъединица
содержит
один
биотинсвязываюший
центр.
В
отличие
от
авидина
стрептавидин
негликозилирован и имеет нейтральную pH. Авидин и стрептавидин сильно
различаются по аминокислотному составу, хотя оба богаты остатками
триптофана.
38.
39.
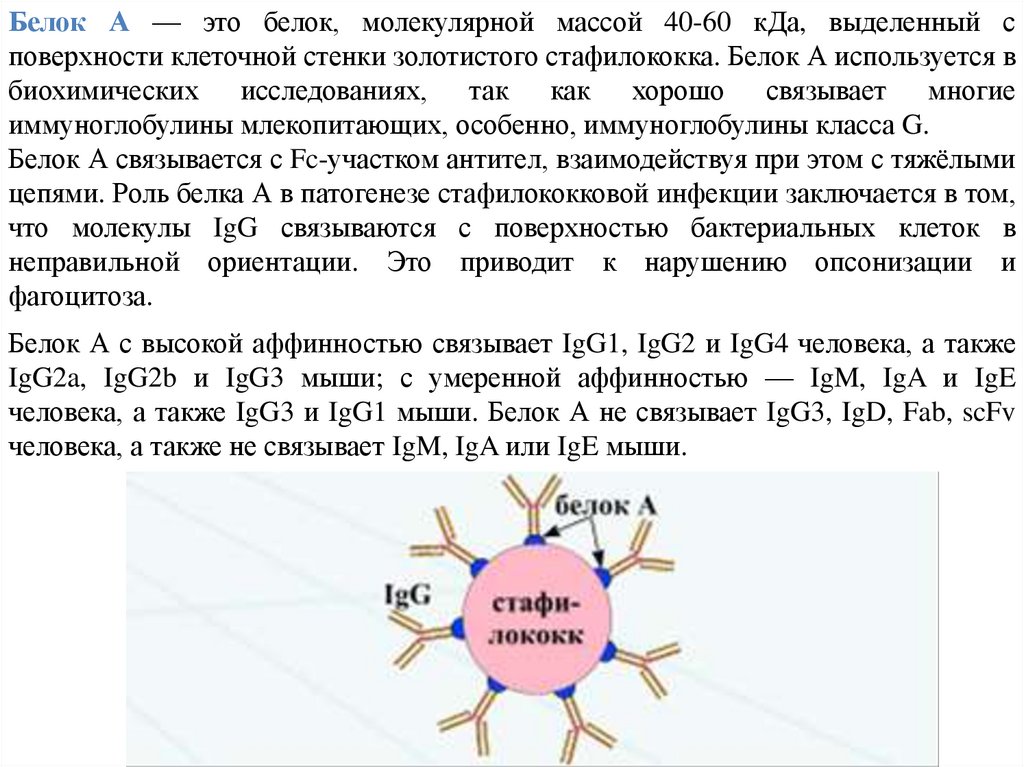
Белок А — это белок, молекулярной массой 40-60 кДа, выделенный споверхности клеточной стенки золотистого стафилококка. Белок А используется в
биохимических исследованиях, так как хорошо связывает многие
иммуноглобулины млекопитающих, особенно, иммуноглобулины класса G.
Белок А связывается с Fc-участком антител, взаимодействуя при этом с тяжёлыми
цепями. Роль белка А в патогенезе стафилококковой инфекции заключается в том,
что молекулы IgG связываются с поверхностью бактериальных клеток в
неправильной ориентации. Это приводит к нарушению опсонизации и
фагоцитоза.
Белок А с высокой аффинностью связывает IgG1, IgG2 и IgG4 человека, а также
IgG2a, IgG2b и IgG3 мыши; с умеренной аффинностью — IgM, IgA и IgE
человека, а также IgG3 и IgG1 мыши. Белок А не связывает IgG3, IgD, Fab, scFv
человека, а также не связывает IgM, IgA или IgE мыши.
40.
Метки используемые в биоконьюгацииСуществующее разнообразие маркеров крайне велико и классифицируется
разными способами. Все маркеры можно разделить на индивидуальные молекулы
(радиоактивные метки, ферменты, красители), молекулярные кластеры
(наночастицы разной природы) и метки со сложной структурой (латексные или
кремниевые частицы с инкапсулированными красителями). Из этого
разнообразия можно выделить маркеры, удовлетворяющие требованиям
современных тест-методов. Маркеры, используемые в иммунохимических тестметодах, должны обладать следующими характеристиками:
- простота детекции;
- высокая чувствительность детекции (высокое значение отношения сигнал /
шум) в широком диапазоне условий;
- сохранение детектируемых свойств при работе со сложными матриксами;
- стабильность конъюгата маркер–иммунореагент при хранении.
41.
Ферменты.Фермент в качестве маркера обеспечивает эффективное усиление
аналитического сигнала, трансформируя большое число молекул субстрата (для
ряда ферментов число оборотов при катализе достигает нескольких тысяч в
минуту). С использованием ферментов в качестве маркеров реализовано
несколько
видов
иммунохимических
тест-методов
–
твердофазный
иммуноферментный анализ, иммунофильтрационные тесты, иммуноаффинные
колонки. В большинстве тест-методов в качестве ферментативного маркера
используется пероксидаза; это обусловлено ее высокой каталитической
активностью, а также рядом детально охарактеризованных реакций
окислительной трансформации хромогенов, применяемых в иммуноферментных
аналитических наборах.
Для ферментативной метки антигенов или антител могут быть применены
разнообразные ферменты: пероксидаза хрена, щелочная фосфотаза, βгалактозидаза и т. д. Пероксидаза катализирует реакцию:
AH2 + H2O2 → A + 2H2O
В качестве AH2 могут быть разные соединения. Так, восстановленный
бесцветный о-фенилендиамин в пероксидазной реакции превращается в
окисленную окрашенную форму с максимумом оптического поглощения при 435
нм, регистрируемую фотометрически. В качестве субстратов используют: 5аминосалициловую кислоту, п-оксифенилпропионовую кислоту, окисление иодид
ионов.
42.
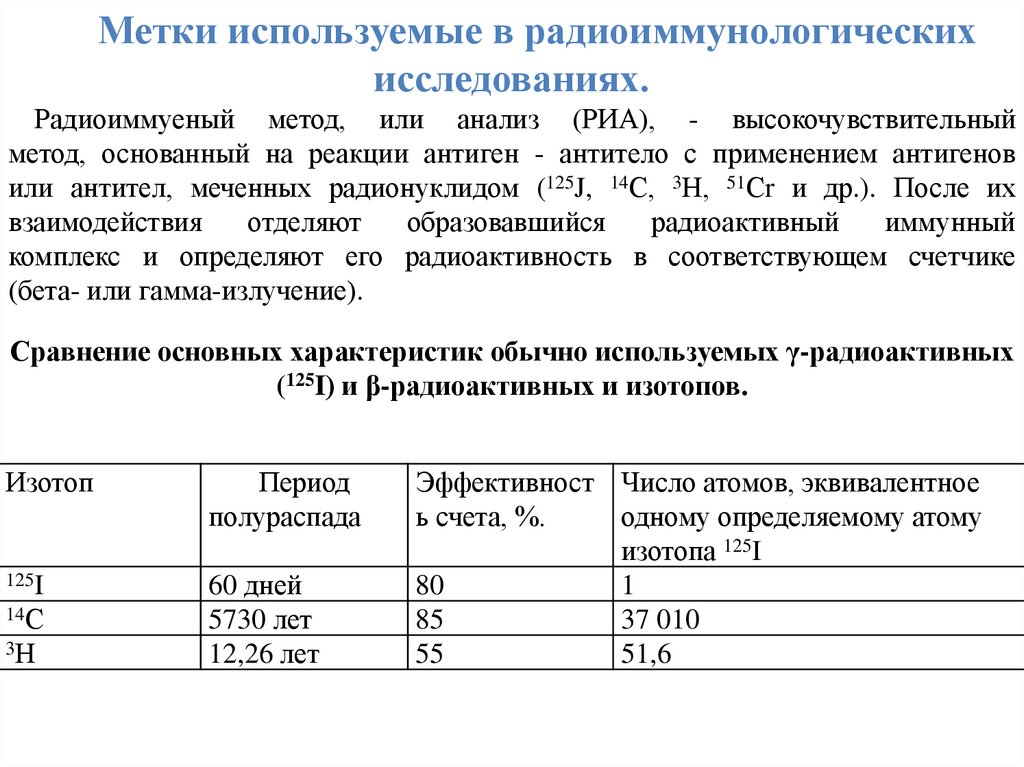
Метки используемые в радиоиммунологическихисследованиях.
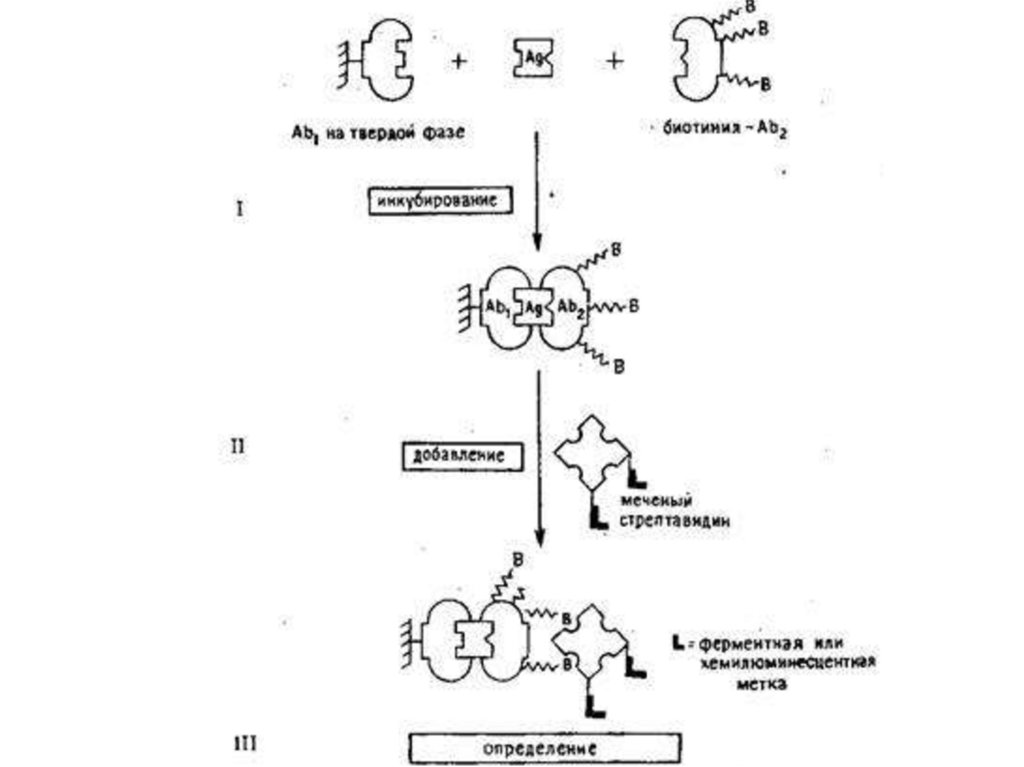
Радиоиммуеный метод, или анализ (РИА), - высокочувствительный
метод, основанный на реакции антиген - антитело с применением антигенов
или антител, меченных радионуклидом (125J, 14С, 3Н, 51Сr и др.). После их
взаимодействия
отделяют
образовавшийся
радиоактивный
иммунный
комплекс и определяют его радиоактивность в соответствующем счетчике
(бета- или гамма-излучение).
Сравнение основных характеристик обычно используемых γ-радиоактивных
(125I) и β-радиоактивных и изотопов.
Изотоп
Период
полураспада
125I
60 дней
5730 лет
12,26 лет
14С
3Н
Эффективност Число атомов, эквивалентное
ь счета, %.
одному определяемому атому
изотопа 125I
80
1
85
37 010
55
51,6
43.
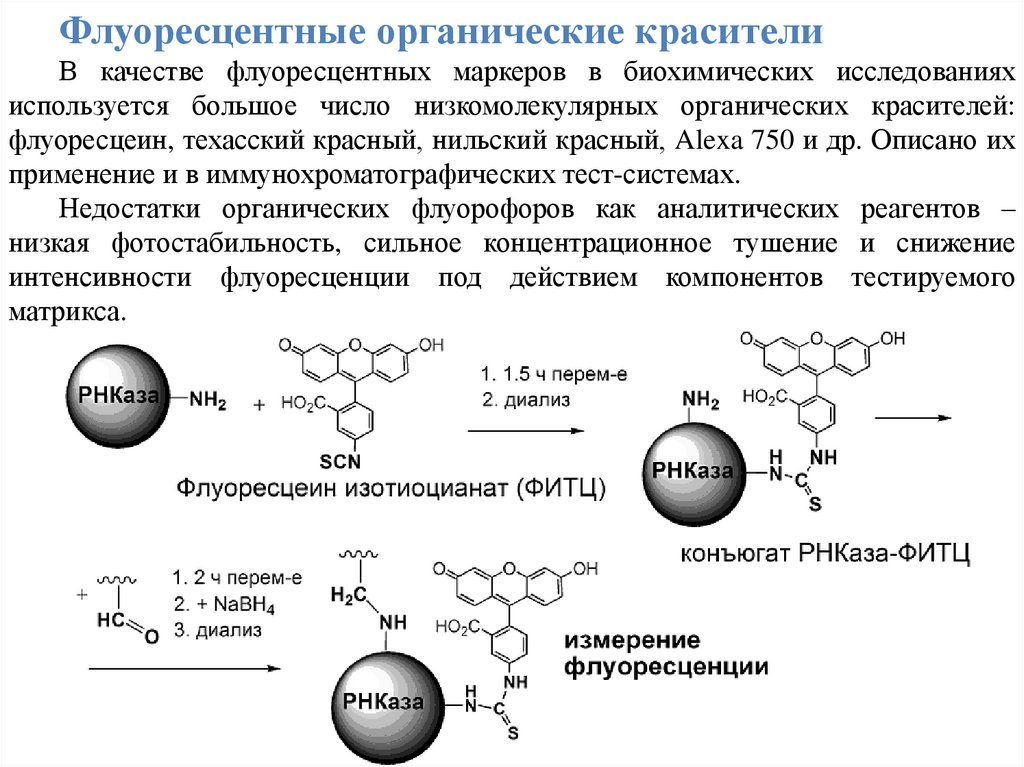
Флуоресцентные органические красителиВ качестве флуоресцентных маркеров в биохимических исследованиях
используется большое число низкомолекулярных органических красителей:
флуоресцеин, техасский красный, нильский красный, Alexa 750 и др. Описано их
применение и в иммунохроматографических тест-системах.
Недостатки органических флуорофоров как аналитических реагентов –
низкая фотостабильность, сильное концентрационное тушение и снижение
интенсивности флуоресценции под действием компонентов тестируемого
матрикса.
44.
Коллоидное золотоНа сегодняшний день КЗ является самым распространенным маркером в
мембранных системах иммуноанализа благодаря доступности, простоте
получения реагентов и детектирования.
Интенсивная окраска частиц КЗ обусловлена эффектом поверхностного
плазмонного резонанса. Конъюгаты наночастиц КЗ с иммунореагентами могут
быть получены посредством как прямой адсорбции, так и иммобилизации тиолсодержащих реагентов с последующей ковалентной модификацией.
Варьируя условия синтеза КЗ, можно получить препараты различной формы
и размера. Вопрос об оптимальном маркере для тест-систем до сих пор остается
открытым. Имеются эмпирические рекомендации по использованию в
иммунохроматографии наночастиц КЗ со средним диаметром 30-40 нм, но
особенности определяемого соединения и формата анализа могут существенно
влиять на этот выбор. В иммунохроматографии могут применяться препараты КЗ
как малого диаметра – 3-5 нм (с практически эквимолярным соотношением
антитело : коллоид в конъюгате), так и большого диаметра – до 50 нм. Переход к
более крупным частицам КЗ требует специальных решений по обеспечению их
стабильности в растворе и предотвращению агрегации.
45.
Наночастицы серебраДля наночастиц серебра, как и для КЗ, характерны интенсивное поглощение
света, возможность варьирования размеров наночастиц и зависящих от размеров
спектров поглощения. При использовании в тест-системах наночастицы серебра
могут детектироваться колориметрическими и вольтамперометрическими
способами, а также по изменению оптических свойств в процессе агрегации.
Следует учитывать, что нестабилизированные наночастицы серебра в
растворах подвергаются быстрому окислению и легко агрегируют. Поэтому ряд
работ посвящен изучению взаимодействия коллоидного серебра с различными
средами и разработке методов стабилизации таких частиц.
46.
Углеродные наночастицыУглеродные наночастицы разнообразны по структуре: наносажа, графен,
одностенные и многостенные нанотрубки, фуллерены, аморфный углерод. В 1993
г. van Аmerongen А. и соавторы впервые использовали наночастицы аморфного
углерода как метки для иммунохроматографических тест-систем. Данный подход
был успешно применен и в ряде последующих работ, преимущественно – той же
научной группы. Основные достоинства углеродного маркера – высокая
стабильность и контрастность окрашивания на мембране (черные частицы на
белом фоне). Высокий коэффициент экстинкции наночастиц обеспечивает крайне
низкий предел их обнаружения, который для приборной регистрации достигает
пикомолярных концентраций (2 пМ). Кроме оптических свойств, для регистрации
углеродных наночастиц используют и их электрические характеристики,
разрабатывая методы анализа с амперометрической и вольамперометрической
детекцией.
47.
Магнитные наночастицыЭффективным аналитическим реагентом являются растворы парамагнитных
частиц – коллоидные препараты кластеров металлов или их оксидов, способные
перемещаться в магнитном поле. Наиболее широкое распространение в
аналитических системах получили ферромагнетики – смеси оксидов железа Fe2O3
и FeO. Магнитные свойства наночастиц могут быть использованы как для
концентрирования аналитических реагентов, так и для выявления специфических
комплексов.
Применение магнитных наночастиц в иммунохроматографии описано в ряде
работ. Маркер может детектироваться как по отклику (намагничивание) на
внешнее магнитное поле, так и по окраске (ферромагнитные частицы –
интенсивного коричневого цвета). Магнитные детекторы выявляют маркеры во
всем объеме мембраны, без каких бы то ни было эффектов экранирования,
характерных для оптических методов.
48.
Преобразующие флуорофорыПреобразующие флуорофоры (up-converting phosphors (UCP)) представляют
собой комбинацию иона-донора и иона-акцептора энергии в одной субмикронной
кристаллической структуре. При инфракрасном облучении ион-донор
высвобождает энергию, квант энергии переходит на акцептор, который в свою
очередь испускает фотон в видимой или ближней инфракрасной области в
зависимости от состава кристалла. При детекции маркера эти испускаемые
фотоны регистрируются.
При получении преобразующих флуорофоров в качестве донора широко
применяются кристаллы итрий-фторида натрия (NaYF4) с гексагональной
кристаллической решеткой. Роль акцептора в большинстве случаев играют
комплексы трехвалентных лантанидов – самарий, иттербий и др. Благодаря
эмиссии в ближней инфракрасной области тест-системы на основе лантанидных
комплексов характеризуются низким фоновым сигналом, что позволяет с их
помощью тестировать различные сложные матриксы, такие как кровь, слюна,
экстракты пищевых продуктов.
49.
Инфракрасные маркерыВ качестве инфракрасных маркеров в тест-системах используются
композитные материалы Y2O3:Nd3+ или YF3: Er3+. При облучении светом в
видимом диапазоне (500-900 нм) эти соединения флуоресцируют в ближней
инфракрасной области спектра (900-1100 нм).
Как и для преобразующих флуорофоров, для данных соединений характерно
высокое соотношение сигнал : шум, обеспечиваемое благодаря низкому
собственному свечению носителя. Главный недостаток инфракрасных маркеров
на основе лантанидов – нестабильность из-за тушения флуоресценции, которое
можно снизить введением меток в латексные, полимерные или кремниевые
наночастицы.
50.
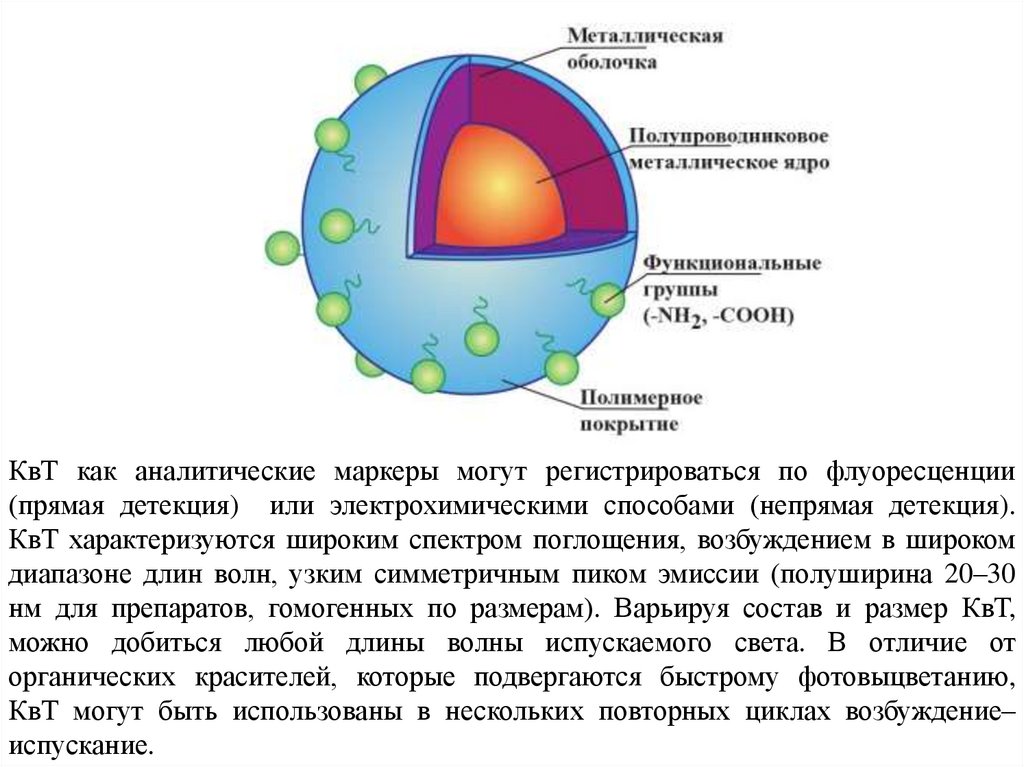
Квантовые точкиКак правило, в состав квантовых точек, кроме ядра, входят и дополнительные
компоненты – металлическая оболочка и полимерное покрытие. Ядро,
формирующееся из таких соединений, как CdS, CdSe, InP и др., обеспечивает
флуоресцентные свойства КвТ, причем спектры эмиссии в существенной степени
зависят от состава ядра. Металлическая оболочка (ZnS, ZnSe и др.) препятствует
неизлучательному переходу энергии, стабилизирует наночастицу и усиливает
флуоресценцию. Кроме того, металлическая оболочка предотвращает фотоокислительную деградацию ядра, концентрирует свободные электроны в объеме.
Для большей стабильности, водорастворимости квантовых точек и исключения
негативного влияния металлических поверхностей на биомолекулы КвТ
покрывают полимерными оболочками. В состав таких покрытий вводят амино-,
карбокси- или другие функциональные группы, обеспечивающие возможность
конъюгирования КвТ с биомолекулами. Модификация поверхности КвТ
полимерами и биомолекулами практически не влияет на их оптические свойства.
51.
КвТ как аналитические маркеры могут регистрироваться по флуоресценции(прямая детекция) или электрохимическими способами (непрямая детекция).
КвТ характеризуются широким спектром поглощения, возбуждением в широком
диапазоне длин волн, узким симметричным пиком эмиссии (полуширина 20–30
нм для препаратов, гомогенных по размерам). Варьируя состав и размер КвТ,
можно добиться любой длины волны испускаемого света. В отличие от
органических красителей, которые подвергаются быстрому фотовыцветанию,
КвТ могут быть использованы в нескольких повторных циклах возбуждение–
испускание.
52.
ЛипосомыЛипосомы представляют собой структуры из амфифильных молекул,
формирующие в результате самосборки оболочку и внутреннюю полость. Во
внутреннем слое оболочки находятся гидрофобные части молекул, образующих
липосому, тогда как гидрофильные части выходят на ее поверхность (наружную
либо внутреннюю). Для аналитических целей используются липосомы размером
от 50 до 800 нм. В аналитических системах липосомы используются для
концентрирования маркера и его присоединения к селективному реагенту
(обычно – антителу, иммобилизуемому на внешней поверхности липосомы).
Маркерами, инкапсулированными внутри липосомы, могут быть цветные
красители, флуоресцентные красители, ферменты, электроактивные компоненты
и др. Включение в липосому значительного числа молекул маркера позволяет
снизить предел обнаружения на 2-3 порядка по сравнению с непосредственным
мечением иммунных комплексов.
Главным недостатком липосом является низкая стабильность при хранении и
работе в сложных матриксах. Липосомы легко подвергаются лизису при
добавлении поверхностно-активных веществ и разрушаются при использовании
стандартных протоколов высушивания.
53.
Латексные наночастицыЛатексные наночастицы представляют собой частицы из полистирола,
полиметилметакрилата и других полимерных материалов диаметром от 50 до 500
нм (т.е. находятся у верхней границы нанодиапазона, а порой – и за ее
пределами). Существуют методы синтеза цельных и полых латексных частиц.
Основная область аналитического использования латексов – агглютинация.
В состав латексных частиц могут входить маркеры разных типов – красители,
флуорофоры, магнитные наночастицы и др. При этом возможна как
иммобилизация маркеров на поверхности частицы, так и их включение в объем
частицы при синтезе и диспергировании. Имеется ряд коммерчески доступных
латекстных частиц, меченных флуорофорами. Некоторые красители и
флуорофоры сложно ковалентно присоединить к антителам или антигенам, так
как у них отсутствуют активные группы, а модификация ухудшает
флуоресценцию. Применение латексов решает эту проблему, позволяя включить
маркер в частицу в немодифицированном виде. Латексы, как и липосомы, могут
концентрировать большое число маркеров, амплифицируя аналитический сигнал.
Еще одним преимуществом является возможность сочетания в латексной частице
маркеров разных цветов (что позволяет одновременно идентифицировать до
сотни соединений) или объединения в ее составе маркера и средства разделения
детектируемых комплексов (например, флуорофоров и магнитных частиц).
Наконец, важное достоинство латексных частиц – доступность и низкая
стоимость.


















 biology
biology








