Similar presentations:
Кислородсодержащие соединения серы (IV)
1.
Домашнее задание• Параграф 19 (+ описать применение
сернистого газа.)
• Решить цепочку:
S → H2S → S → SO2 → K2SO3 → SO2 → SO3
2.
1. SO22. H2SO4
3. KHS
4. H2SO3
5. SO3
6. CuSO4
3.
Кислородсодержащиесоединения серы (IV)
4.
Оксид серы (IV) - SO2• Другие названия: сернийстый газ, диоксид
серы, сернистый ангидрид.
• Физические свойства:
- газ с резким запахом
- тяжелее воздуха
- хорошо растворяется в воде (40 объем SO2
растворяется в 1объеме воды)
- при температуре -10оС превращается в
бесцветную жидкость.
5.
Способы получения SO21. Горение серы (голубое пламя):
S + O2 = SO2 ↑
2. Горение H2S в избытке кислорода:
2Н2S + 3O2 = 2SO2↑ + 2Н2О
3. Обжиге сульфидных руд:
2ZnS + 3O2 = 2ZnO + 2SO2
В том числе при обжиге пирита :
FeS2 + O2 = SO2↑ + Fe2O3
4FeS2 + 11O2 = 8SO2↑ + 2 Fe2O3
6.
Способы получения SO2Лабораторные способы получения:
4. При взаимодействии меди с серной
кислотой
Cu + 2H2SO4(конц) = CuSO4 + SO2↑ + 2H2O
5. Взаимодействие сульфитов с серной
кислотой.
Na2SO3 + H2SO4 = NaSO4 + H2O + SO2↑
7.
Воздействие на организмСернистый газ ядовит и вызывает одышку,
бронхит, а так же оказывает
раздражающее действие на слизистые
оболочки.
8.
Сернистая кислота - H2SO3Неустойчивое соединение, легко
распадающееся на сернистый газ и воду.
Получение: SO2 + Н2O → Н2SO3
Диссоциация:
1 ступень: H2SO3 → H+ + HSO32 ступень: HSO3- → H+ + SO32
9.
Химические свойстваОбщие для кислот и кислотных оксидов:
1. С основными оксидами
SO2 + Na2O → Na2SO3
H2SO3+ Na2O → Na2SO3 + H2O
2. С основаниями
SO2 + 2NaOH → Na2SO3 + H2O
H2SO3 + 2NaOH → Na2SO3 + 2H2O
3. С водными растворами более слабых кислот.
SO2 + Na2CO3 → Na2SO3 + СO2↑
10.
Химические свойстваСоединения, в которых сера промежуточную
степень окисления +4 могут быть и
окислителями и восстановителями:
S-2 ← S0 ← S+4→S+6
восстановление
окисление
11.
Химические свойства4. Восстановительные свойства
SO2:
SO2 + 2H2O + I2 → H2SO4 +2HI
2SO2 + O2 → 2SO3
H2SO3: H2SO3 + Br2 + H2O → H2SO4 +2HBr
12.
Химические свойства4. Окислительные свойства
SO2:
SO2 + 2H2S → 2H2O + 2S↓
H2SO3: H2SO3 + 2H2S → 3H2O + 3S↓
13.
Химические свойства5. Качественная реакция на сернистую
кислоту и ее соли – любая реакция с
сильной кислотой.
Na2SO3 +2HCl → 2NaCl + SO2↑ + H2O
14.
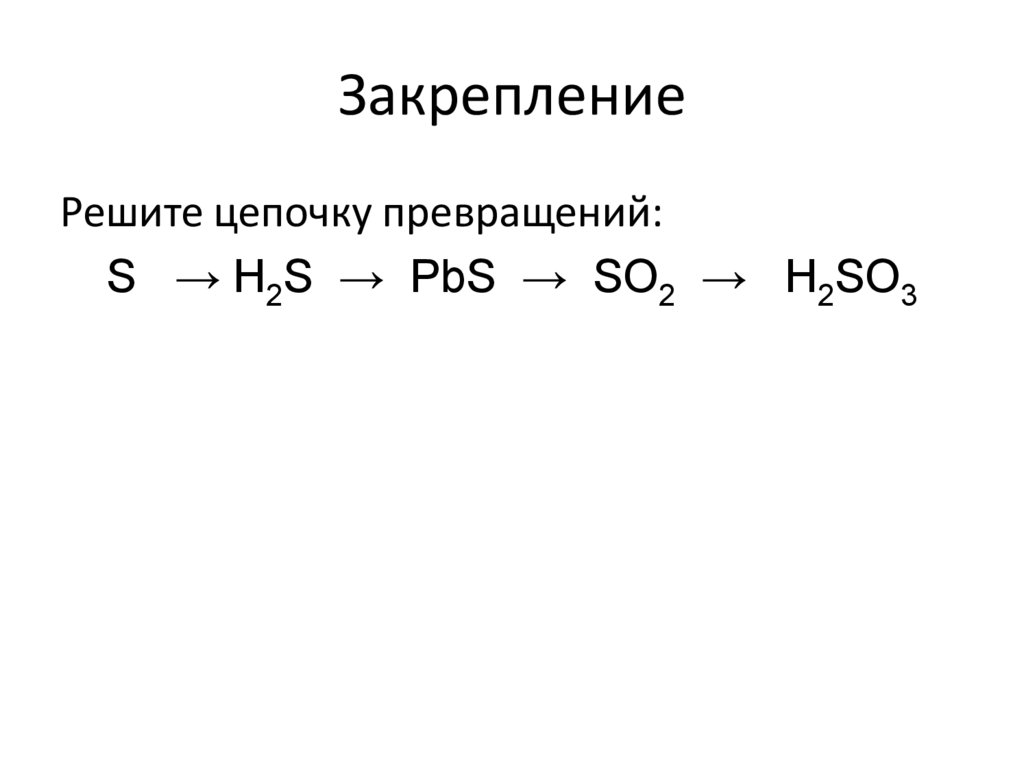
ЗакреплениеРешите цепочку превращений:
S → H2S → PbS → SO2 → H2SO3













 chemistry
chemistry








