Similar presentations:
Окислительно-восстановительные реакции
1.
2.
Окислительно –восстановительные
реакции
3.
Цель урока:1.Сформировать понятие об окислительновосстановительных реакциях.
2.Научиться уравнивать записи ОВР
методом электронного баланса.
4.
Фронтальный опрос:1.Валентность.
2.Степень окисления.
3.Типы химических
реакций
.
5.
Реакции, в результате которыхизменяются степени окисления
атомов всех или некоторых
элементов, входящих в состав
реагирующих веществ, называются
окислительно-восстановительными.
Например:
2Cu0 + O2 =2 Cu2+O2-
2H+Cl- + Zn0 = Zn2+Cl2- + H20
6.
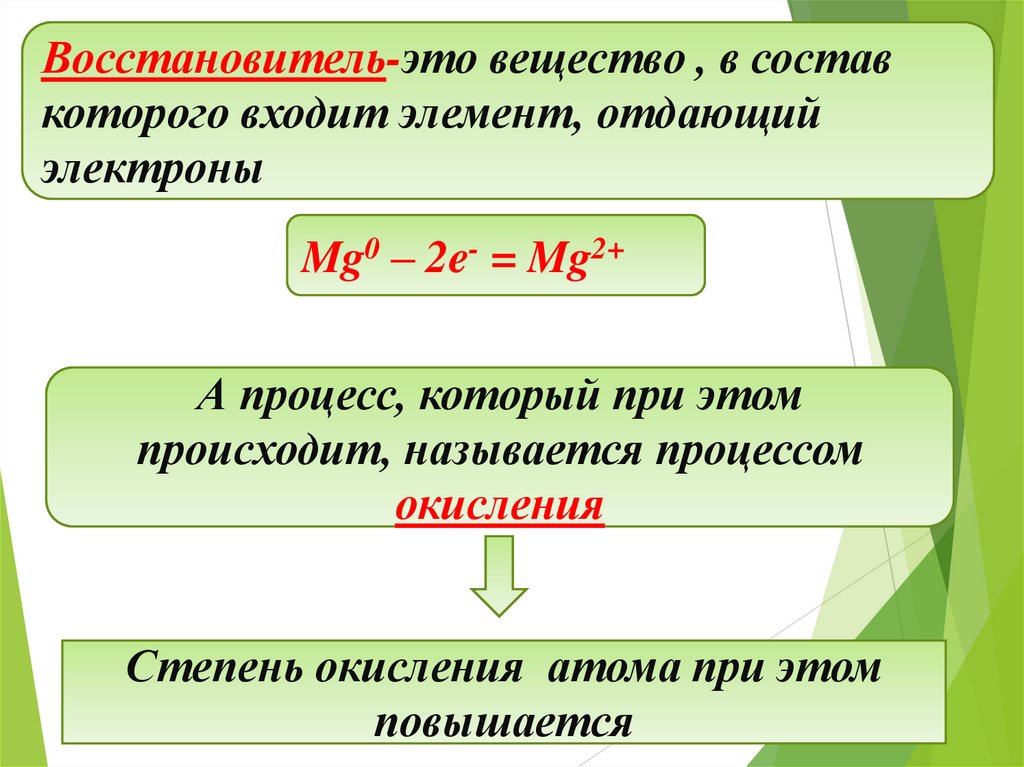
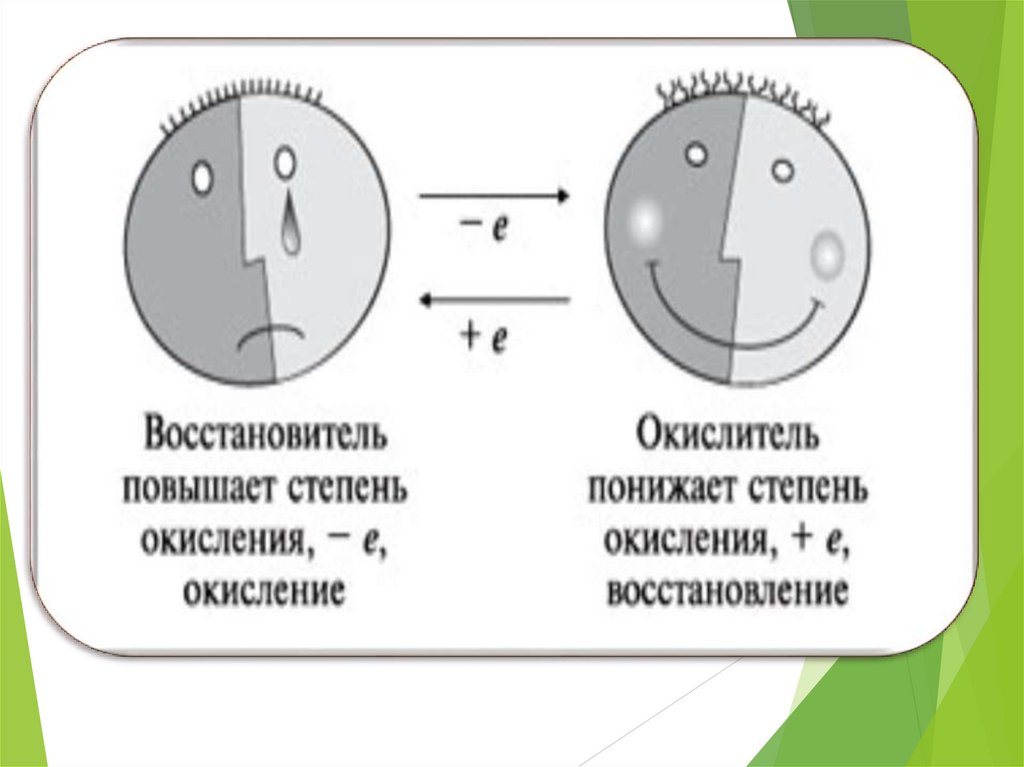
Восстановитель-это вещество , в составкоторого входит элемент, отдающий
электроны
Mg0 – 2e- = Mg2+
А процесс, который при этом
происходит, называется процессом
окисления
Степень окисления атома при этом
повышается
7.
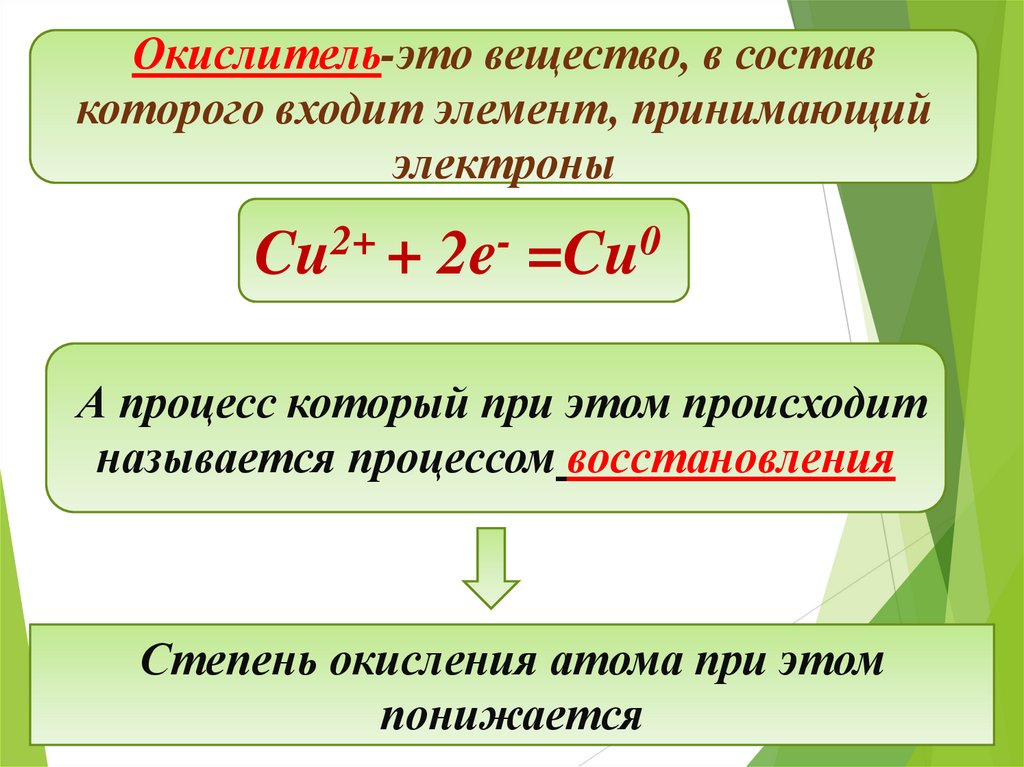
Окислитель-это вещество, в составкоторого входит элемент, принимающий
электроны
2+
Cu +
2e
0
=Cu
А процесс который при этом происходит
называется процессом восстановления
Степень окисления атома при этом
понижается
8.
9.
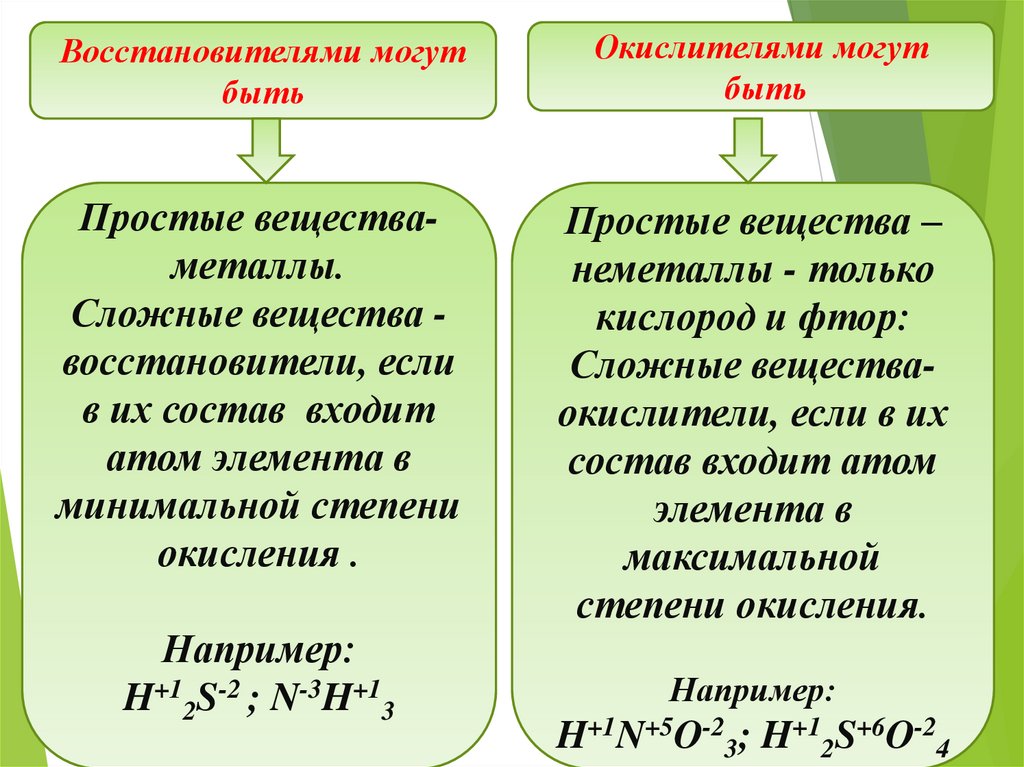
Восстановителями могутбыть
Окислителями могут
быть
Простые веществаметаллы.
Сложные вещества восстановители, если
в их состав входит
атом элемента в
минимальной степени
окисления .
Простые вещества –
неметаллы - только
кислород и фтор:
Сложные веществаокислители, если в их
состав входит атом
элемента в
максимальной
степени окисления.
Например:
H+12S-2 ; N-3H+13
Например:
H+1N+5O-23; H+12S+6O-24
10.
План составления окислительно восстановительной реакции1. Записываем схему химической реакции
Ca + O2
2. Расставляем степени окисления атомов,
участвующих в химической реакции
Ca0 + O20
Ca2+O2-
3.Находим атомы, которые изменяют свою
степень окисления
Ca0 и O20
11.
4.Составляем электронный баланс, записываяпроцесс отдачи и присоединения электронов
Ca0 – 2e- = Ca2+
O20 + 4e- = 2O25.
Ca0– 2e-=Ca2+ 4
O20 + 4e- = 2O2- 2
2
восстановитель
1
окислитель
6. Расставляем цифры, полученные в электронном
балансе в химическое уравнение
2Ca + O2= 2CaO
12.
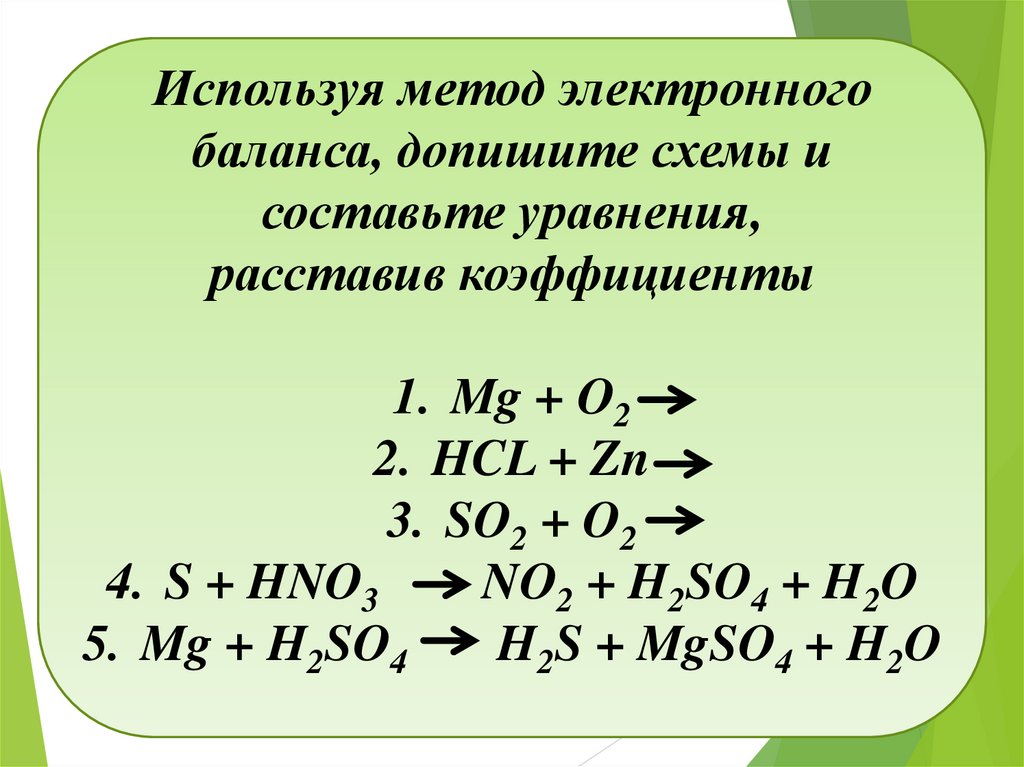
Используя метод электронногобаланса, допишите схемы и
составьте уравнения,
расставив коэффициенты
1. Mg + O2
2. HCL + Zn
3. SO2 + O2
4. S + HNO3
NO2 + H2SO4 + H2O
5. Mg + H2SO4
H2S + MgSO4 + H2O








 chemistry
chemistry








