Similar presentations:
Сера. Нахождение в природе
1.
2. «Немало сера знаменита, И в древности ее Гомер воспел, С ней много тысяч лет прожито, И человек в ней пользу разглядел»
3.
4.
Нахождение вприроде
Применение
серы
Физические
свойства
Положение в
Периодической
системе
химических
элементов
Круговорот серы
в природе
Химические
свойства
5.
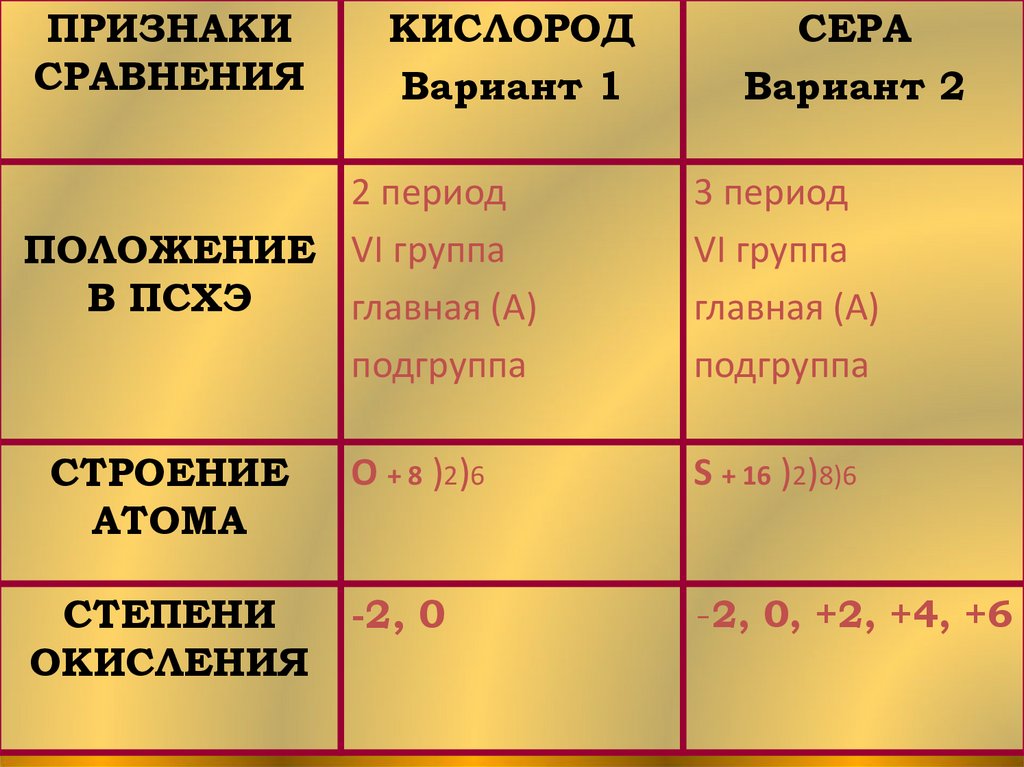
ПРИЗНАКИСРАВНЕНИЯ
КИСЛОРОД
Вариант 1
2 период
ПОЛОЖЕНИЕ VI группа
В ПСХЭ
главная (А)
подгруппа
СТРОЕНИЕ
АТОМА
СТЕПЕНИ
ОКИСЛЕНИЯ
СЕРА
Вариант 2
3 период
VI группа
главная (А)
подгруппа
О + 8 )2)6
S + 16 )2)8)6
-2, 0
-2, 0, +2, +4, +6
6.
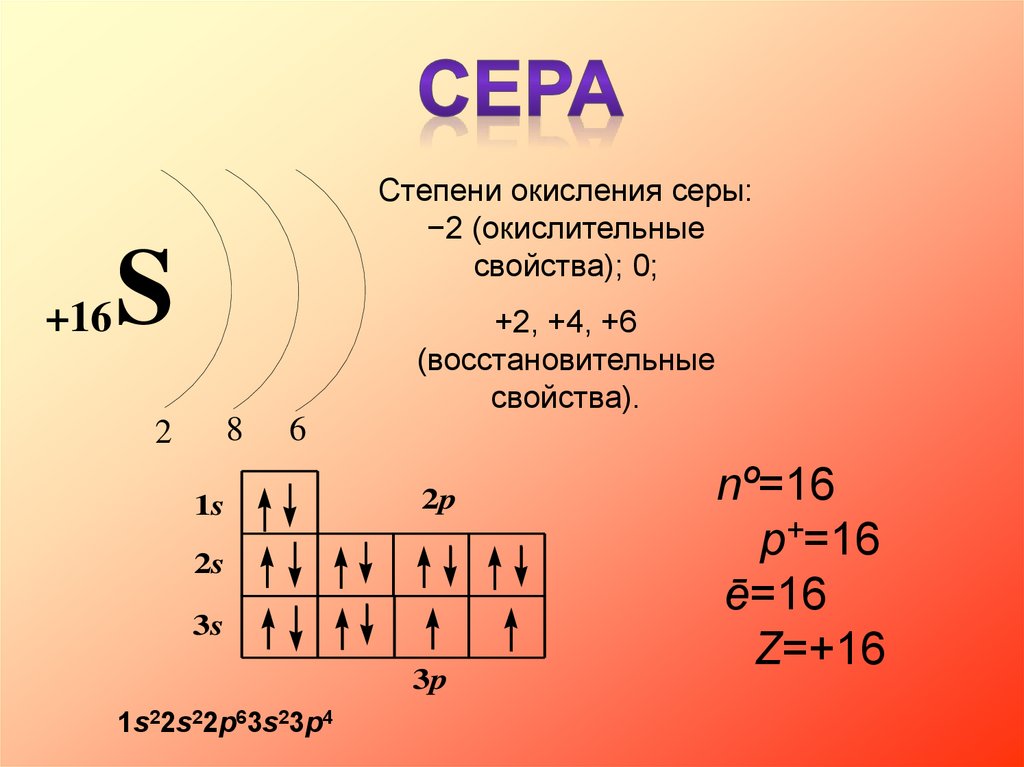
+16Степени окисления серы:
−2 (окислительные
свойства); 0;
S
+2, +4, +6
(восстановительные
свойства).
8
2
6
1s
2p
2s
3s
3p
1s22s22p63s23p4
nº=16
p+=16
ē=16
Z=+16
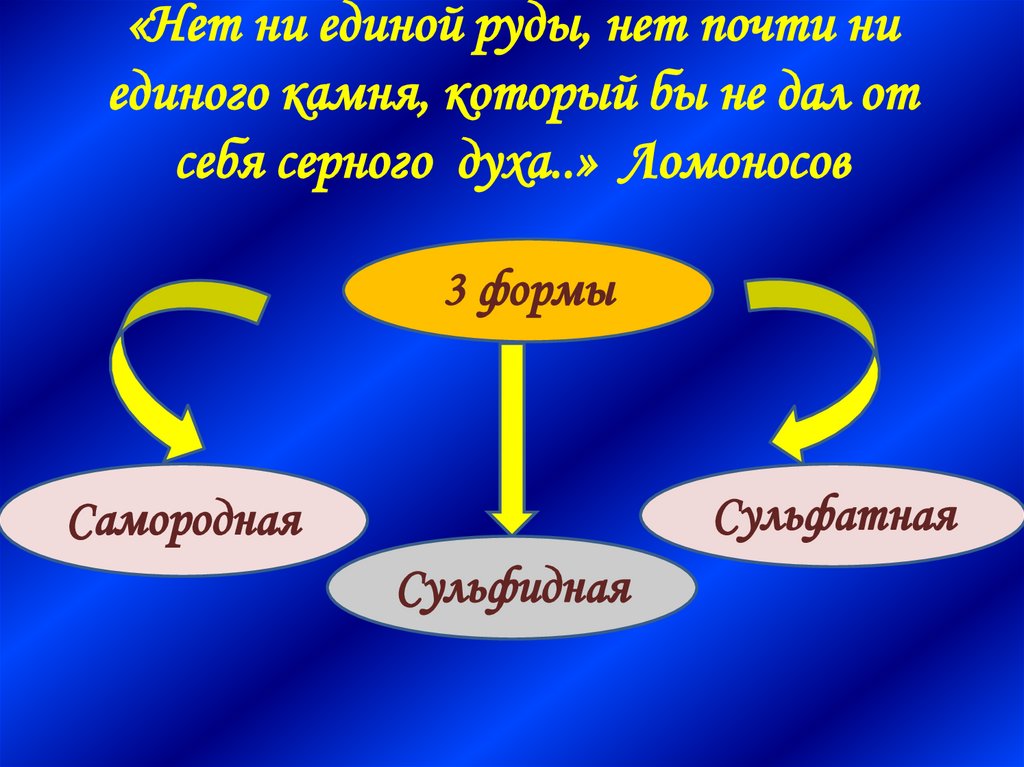
7. «Нет ни единой руды, нет почти ни единого камня, который бы не дал от себя серного духа..» Ломоносов
3 формыСульфатная
Самородная
Сульфидная
8.
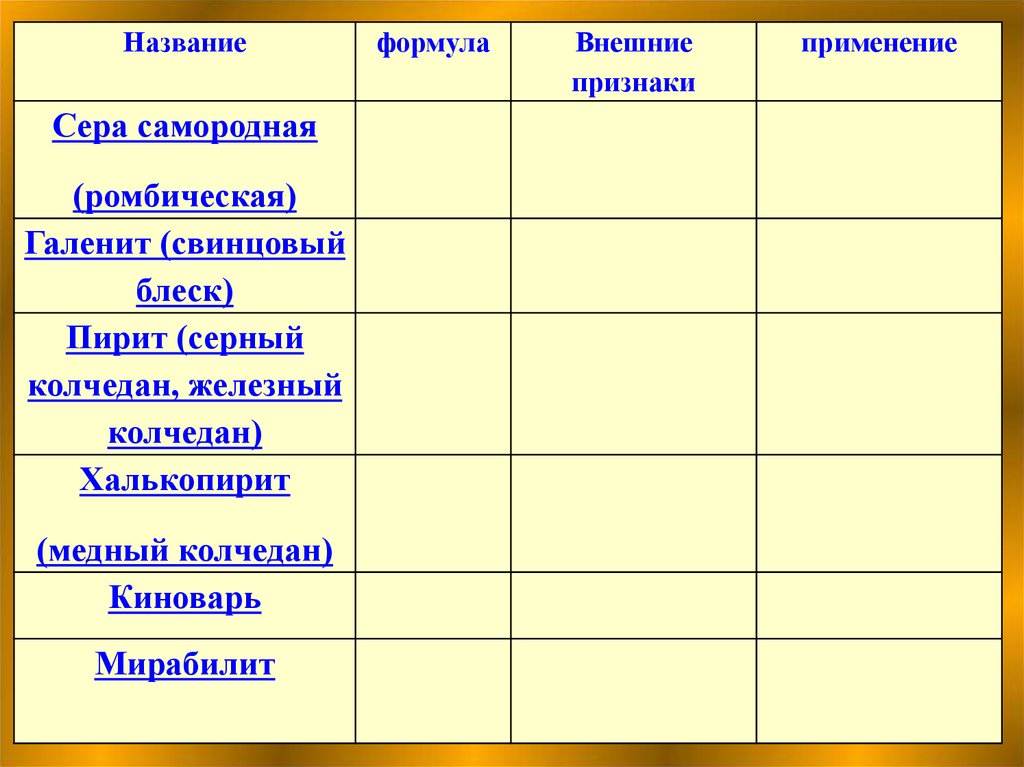
НазваниеСера самородная
(ромбическая)
Галенит (свинцовый
блеск)
Пирит (серный
колчедан, железный
колчедан)
Халькопирит
(медный колчедан)
Киноварь
Мирабилит
формула
Внешние
признаки
применение
9. Сера самородная
10. Галенит (свинцовый блеск)
11. ПИРИТ - FeS2
12. ХАЛЬКОПИРИТ - CuFeS2.
13. КИНОВАРЬ - HgS.
14. МИРАБИЛИТ - Na2SO4 • 10H2O
15.
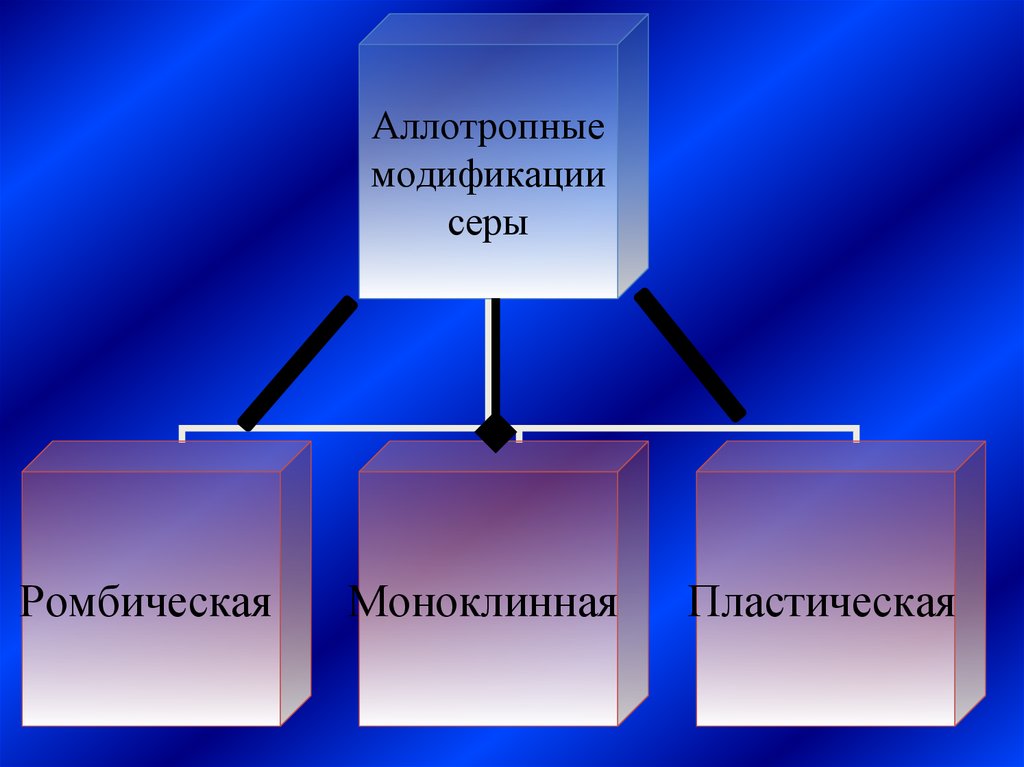
Аллотропныемодификации
серы
Ромбическая
Моноклинная
Пластическая
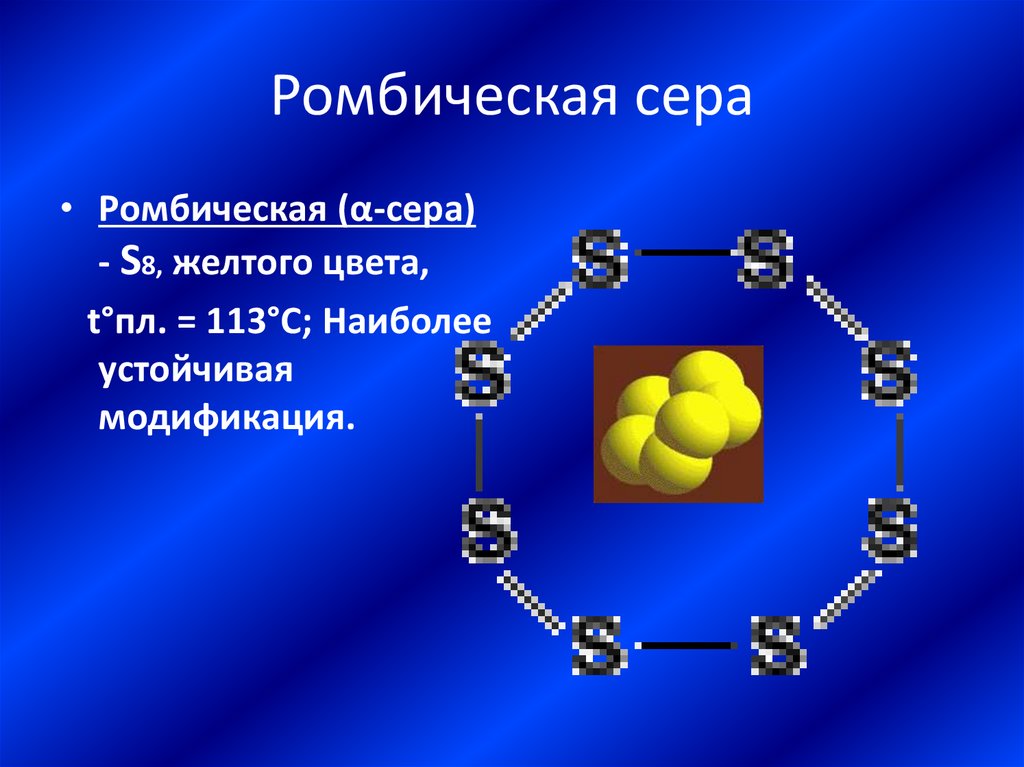
16. Ромбическая сера
• Ромбическая (α-сера)- S8, желтого цвета,
t°пл. = 113°C; Наиболее
устойчивая
модификация.
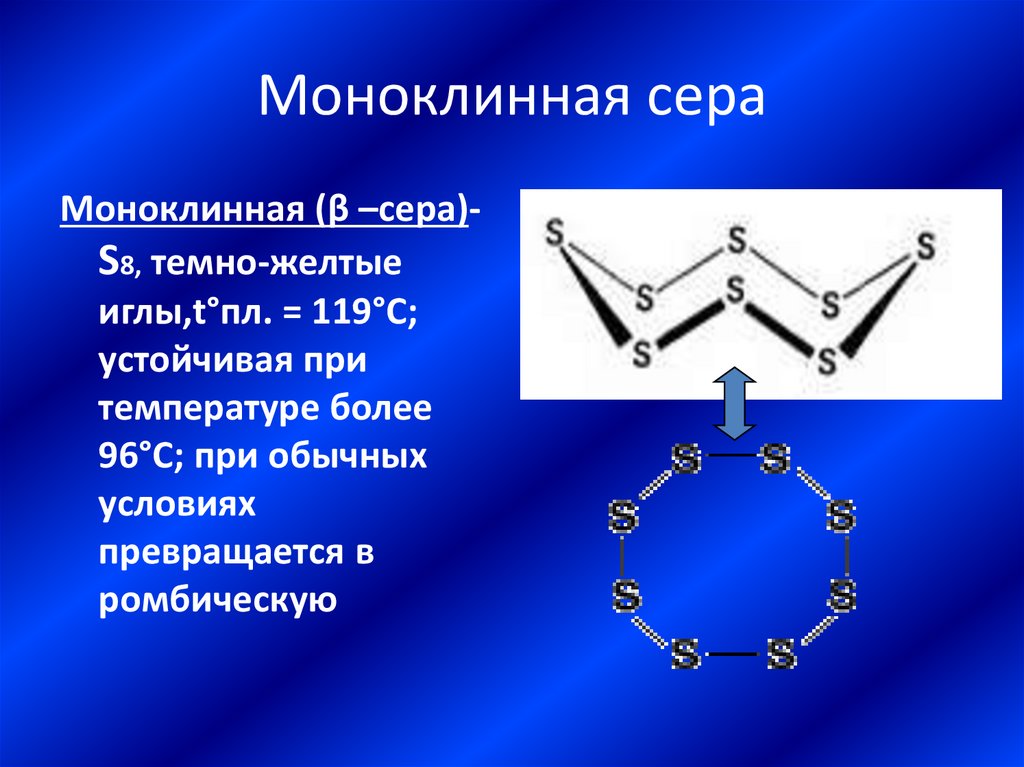
17. Моноклинная сера
Моноклинная (β –сера)S8, темно-желтыеиглы,t°пл. = 119°C;
устойчивая при
температуре более
96°С; при обычных
условиях
превращается в
ромбическую
18. Пластическая сера
Пластическая серакоричневаярезиноподобная
(аморфная) масса.
Она неустойчива и через
некоторое время
становится хрупкой,
приобретёт желтый
цвет, т.е
превращается в
ромбическую серу.
19. Физические свойства
Рассмотрите образец серы, определите:• Агрегатное состояние;
• Цвет;
• Растворимость в воде (опустите кусочек серы в
стакан с водой, затем порошок серы в пробирку
с водой, сделайте вывод);
• Температура плавления;
• Температура кипения.
20. Флотация –это (фр. flottation, от flotter — плавать) — процесс разделения мелких твёрдых частиц (главным образом, минералов),
Флотация –это (фр. flottation,от flotter — плавать) — процесс
разделения мелких твёрдых
частиц (главным образом,
минералов), основанный на
различии их в смачиваемости
водой.
21.
Химические свойства серыокислительные
восстановительные
22. ДЕМЕРКУРИЗАЦИЯ (от франц. démercurisation < mercure — ртуть) — система специальных мероприятий по очищению помещений, емкостей
ДЕМЕРКУРИЗАЦИЯ (от франц.démercurisation < mercure — ртуть)
— система специальных
мероприятий по очищению
помещений, емкостей и т. п. от
разлитой ртути.
23.
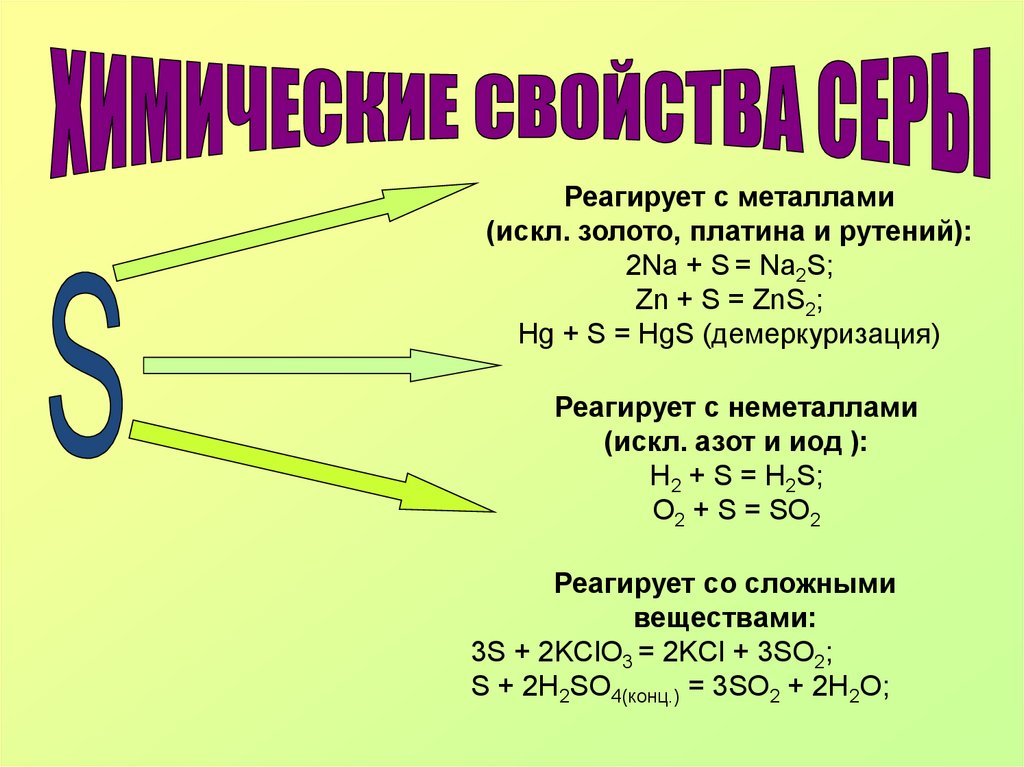
Реагирует с металлами(искл. золото, платина и рутений):
2Na + S = Na2S;
Zn + S = ZnS2;
Нg + S = HgS (демеркуризация)
Реагирует с неметаллами
(искл. азот и иод ):
H2 + S = H2S;
O2 + S = SO2
Реагирует со сложными
веществами:
3S + 2KClO3 = 2KCl + 3SO2;
S + 2H2SO4(конц.) = 3SO2 + 2H2O;
24.
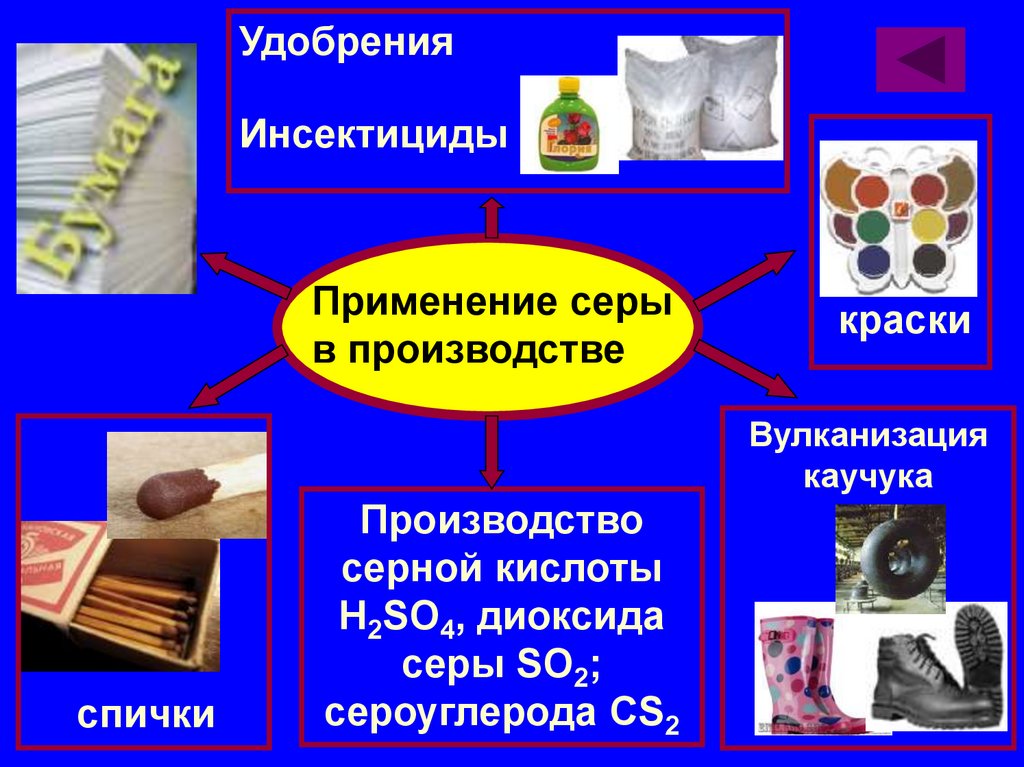
УдобренияИнсектициды
Применение серы
в производстве
краски
Вулканизация
каучука
спички
Производство
серной кислоты
H2SO4, диоксида
серы SO2;
сероуглерода CS2
25. Домашнее задание
• Параграф 21, упр.1,3• Сообщения индивидуально, по темам:
1. Сера жизненно важный химический элемент.
2. Применение серы.













 chemistry
chemistry








