Similar presentations:
Важнейшие представители предельных монокарбоновых кислот
1.
Бирюкова СветланаЕвгеньевна
МОУ «СОШ №4»
г. Железногорск
Высшая категория
Стаж работы 22 года
Учитель химии
2. Тема урока: «Важнейшие представители предельных монокарбоновых кислот»
Цель урока:● Рассмотреть способы получения, физические и
важнейшие химические свойства, практическое
применение муравьиной и уксусной кислот.
●Сообщить сведения об истории открытия и
применения этих веществ, о токсикологических
свойствах этих кислот и способах безопасного для
здоровья человека их применения.
● Уметь составлять уравнения химических реакций,
характеризующих химические свойства
карбоновых кислот, проводить химические
эксперименты, развивать навыки обучающихся по
подготовке устных сообщений.
3. Содержание
• Состав и классификация карбоновыхкислот
• Изомерия и номенклатура
• Органические кислоты в природе
• Физические свойства
• Получение
• Химические свойства
• Применение
4. Все карбоновые кислоты имеют функциональную группу.
Что называется карбоновымикислотами?
Классификация карбоновых
кислот:
1) В зависимости от числа
карбоксильных групп
● одноосновные – уксусная
● двухосновные – щавелевая
● многоосновные - лимонная
5. 2) В зависимости от природы радикала ● предельные – пропионовая ● непредельные – акриловая ● ароматические – бензойная
Проверь свои знания 1Изомерия карбоновых
кислот
Проверь свои знания 2
6. Многие кислоты имеют исторически сложившиеся или тривиальные названия, связанные главным образом с источником их получения.
7.
Органические кислоты в природе8. Муравьиная кислота в природе
Муравей и крапивакусаются муравьиной
кислотой
Ядовитые производные
муравьиной кислоты
используются животными в
качестве лекарств
9. Муравьиная кислота в природе
Муравьиная кислота – одноиз действенных средств
против варроатоза пчёл
10.
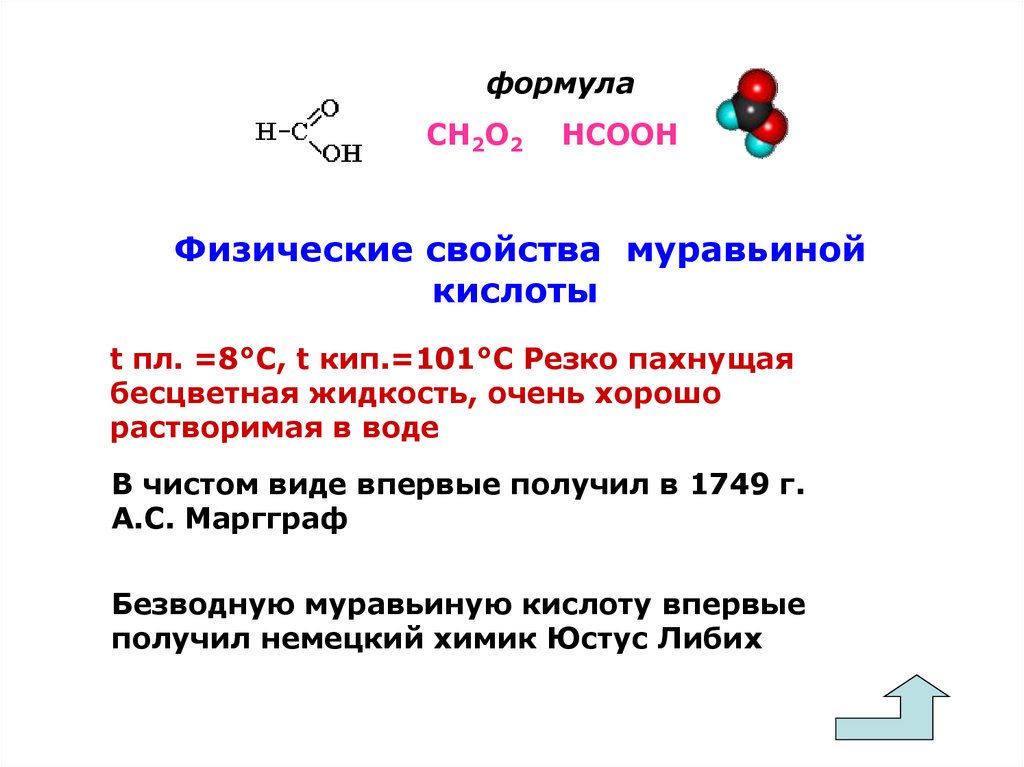
формулаСН2О2
НСООН
Физические свойства муравьиной
кислоты
t пл. =8°С, t кип.=101°С Резко пахнущая
бесцветная жидкость, очень хорошо
растворимая в воде
В чистом виде впервые получил в 1749 г.
А.С. Маргграф
Безводную муравьиную кислоту впервые
получил немецкий химик Юстус Либих
11.
формулаС 2 Н 4 О2
СН3СООН
Физические свойства уксусной
кислоты
При t =16,8°С, и выше бесцветная
жидкость с резким запахом,
растворимая в воде
3-7% водный раствор – столовый
уксус
70-80% водный раствор – уксусная
эссенция
При t<17°C – бесцветные кристаллы,
похожие на лёд
1788 г. Т. Ловиц выделил уксусную кислоту в
чистом виде
12.
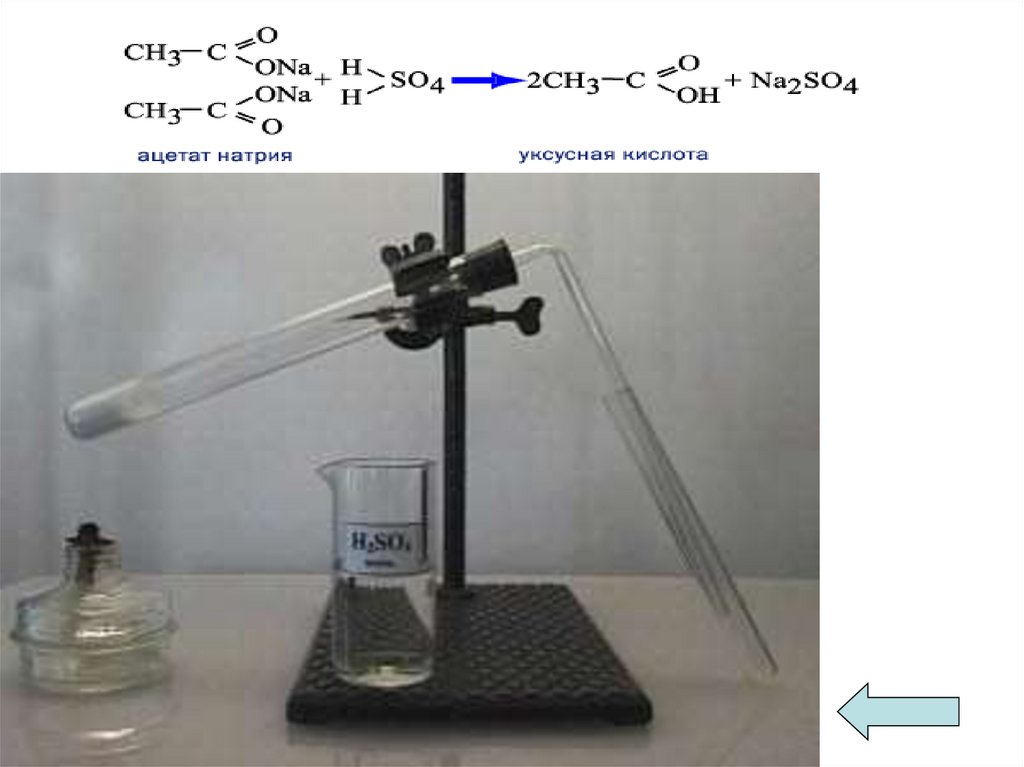
Получение муравьиной кислоты1. Муравьиную кислоту получают действием
разбавленной серной кислоты на соли – формиаты
(при нагревании)
HCOONa + H2SO4 → HCOOH + NaHSO4
2. Известен также способ получения муравьиной
кислоты каталитическим окислением метана (t, кат.)
2CH4 + 3O2 →
2HCOOH + 2H2O
13.
Химические свойства муравьиной кислоты1. Важнейшим специфическим свойством муравьиной
кислоты является её способность вступать в реакцию
«серебряного зеркала» с гидроксидом диамминсеребра (I)
НСООН + 2 [Ag(NH3)2]OH = CO2 + 2H2O+ 2Ag↓ + 4NH3
2. Ещё одно отличительное химическое свойство муравьиной
кислоты – способность разлагаться под действием
концентрированной серной кислоты на воду и угарный газ
НСООН = СО + Н2О
3. Кроме того, муравьиная кислота окисляется хлором:
НСООН + Сl2
→ СО2 + 2HCl.
14.
Получение уксусной кислоты1. Древнейший способ получения уксусной кислоты –
окисление этилового спирта кислородом воздуха при
участии бактерий:
С2Н5ОН + О2 → СН3СООН + Н2О
2. В настоящее время уксусную кислоту получают
окислением ацетальдегида кислородом в
присутствии катализатора ацетата марганца (II)
2СН3СНО + О2 → 2СН3СООН
3. Уксусную кислоту получают каталитическим
окислением бутана кислородом воздуха:
2С4Н10 + 5O2 → 4СН3СООН + 2Н2О.
Существуют и другие способы получения карбоновых
кислот
Видео
15.
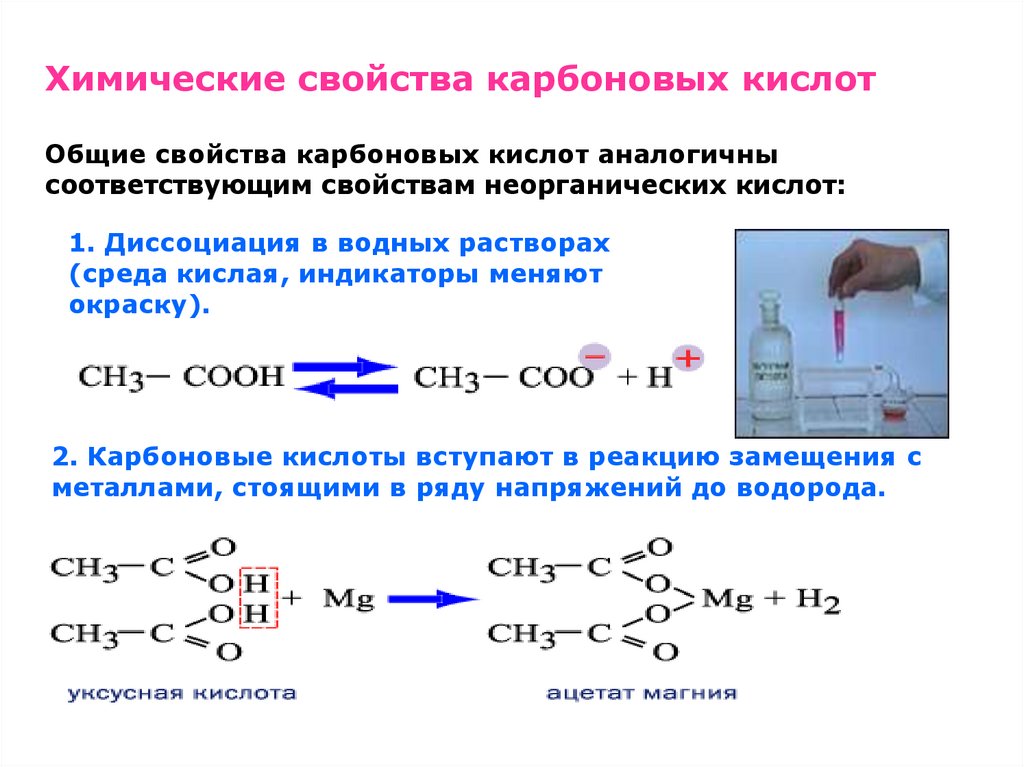
Химические свойства карбоновых кислотОбщие свойства карбоновых кислот аналогичны
соответствующим свойствам неорганических кислот:
1. Диссоциация в водных растворах
(среда кислая, индикаторы меняют
окраску).
2. Карбоновые кислоты вступают в реакцию замещения с
металлами, стоящими в ряду напряжений до водорода.
16.
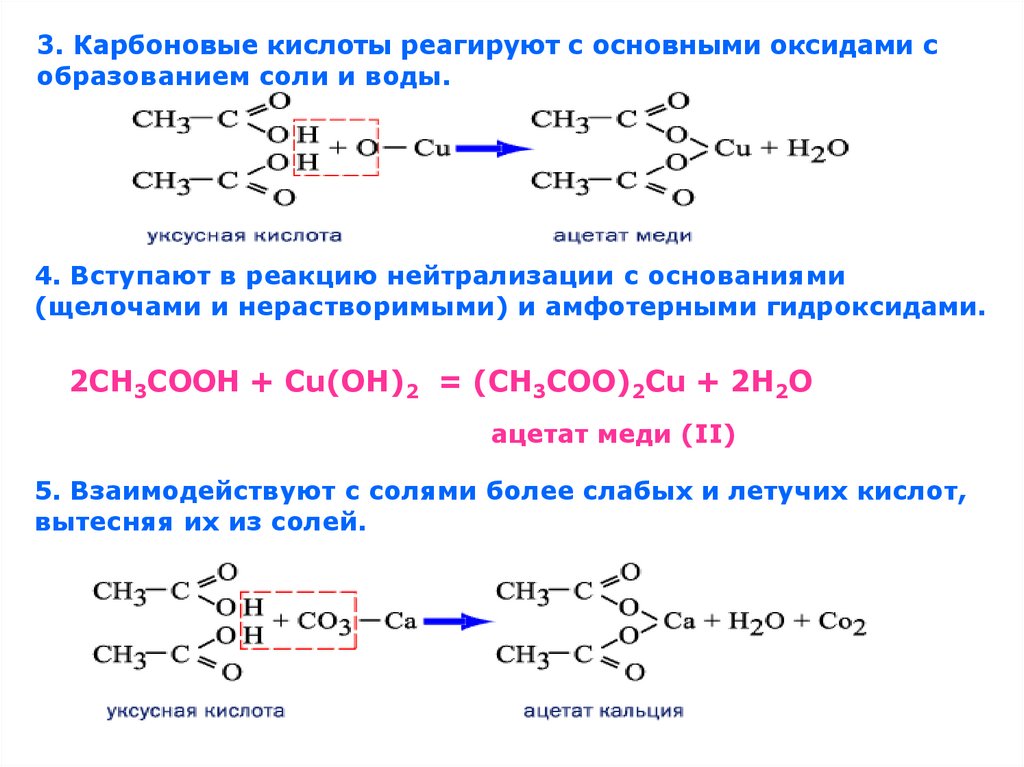
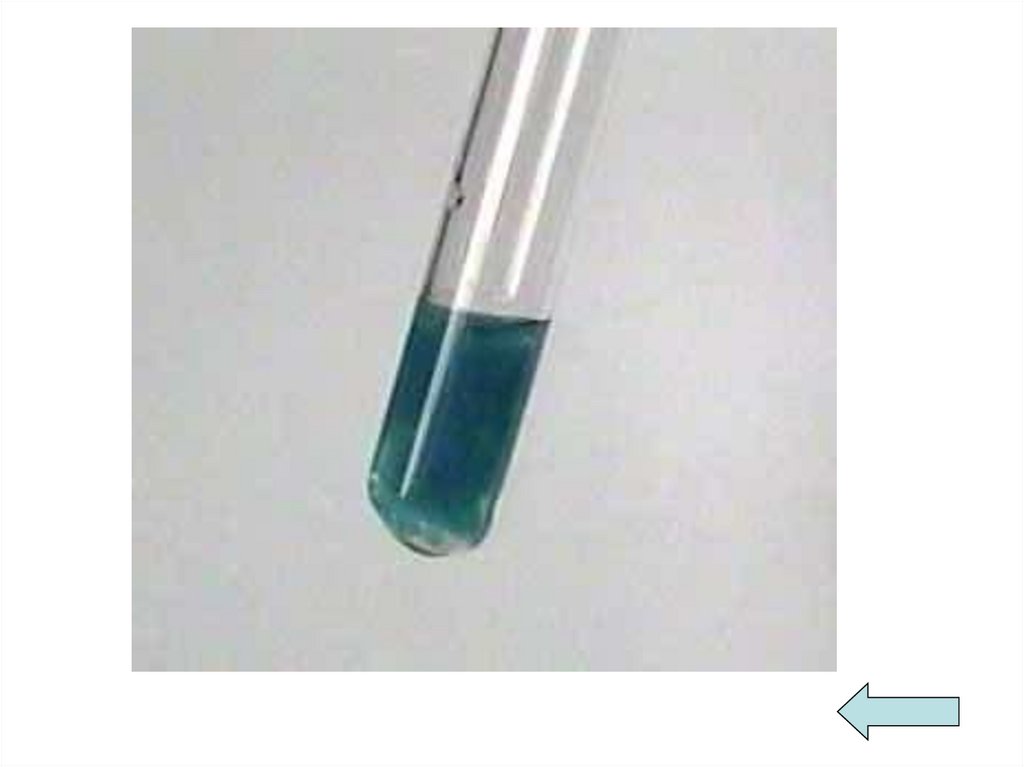
3. Карбоновые кислоты реагируют с основными оксидами собразованием соли и воды.
4. Вступают в реакцию нейтрализации с основаниями
(щелочами и нерастворимыми) и амфотерными гидроксидами.
2СН3СООН + Cu(OH)2 = (CH3COO)2Cu + 2H2O
ацетат меди (II)
5. Взаимодействуют с солями более слабых и летучих кислот,
вытесняя их из солей.
17.
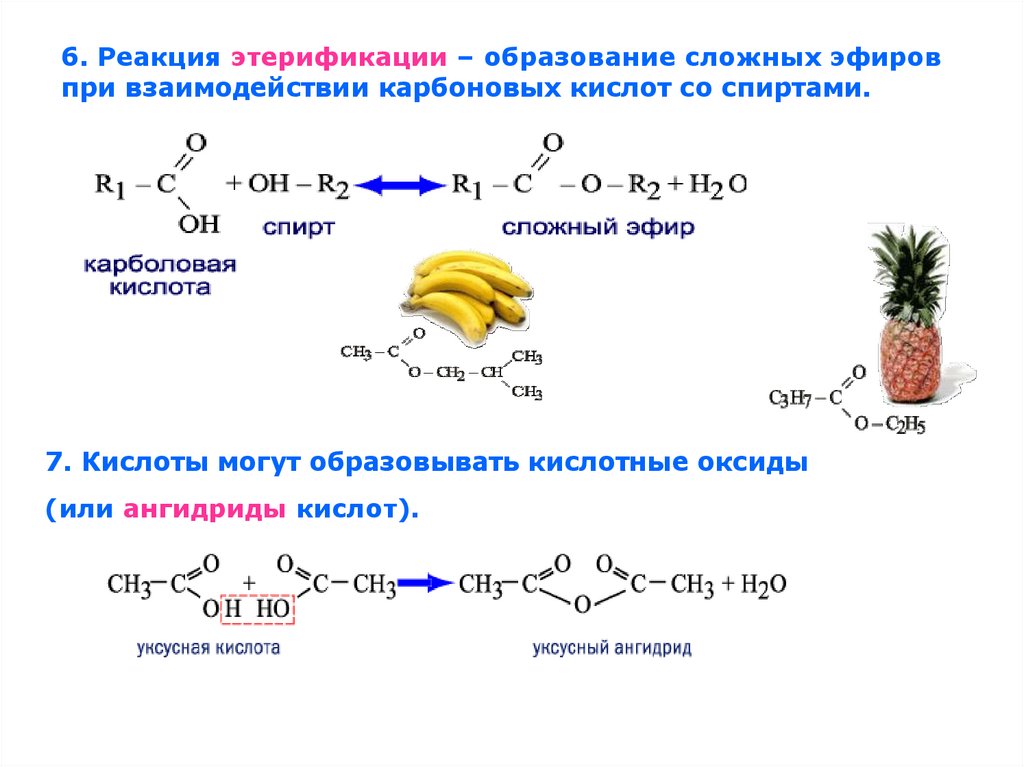
6. Реакция этерификации – образование сложных эфировпри взаимодействии карбоновых кислот со спиртами.
7. Кислоты могут образовывать кислотные оксиды
(или ангидриды кислот).
18.
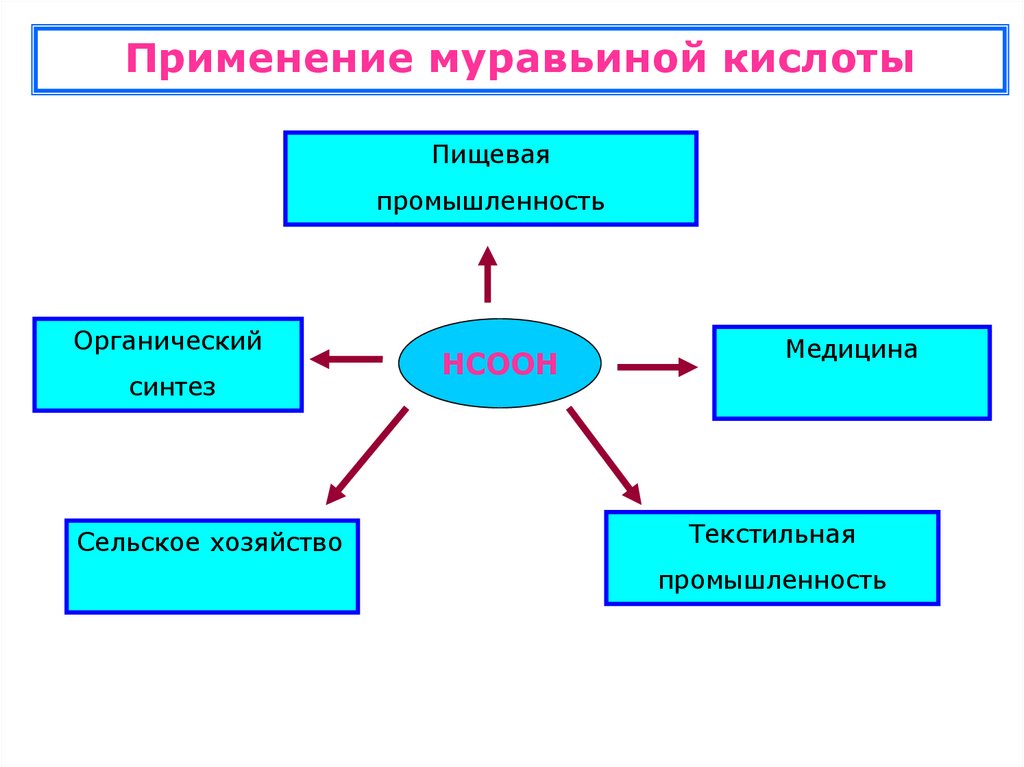
Применение монокарбоновых кислот19.
Применение муравьиной кислотыПищевая
промышленность
Органический
синтез
Сельское хозяйство
НСООН
Медицина
Текстильная
промышленность
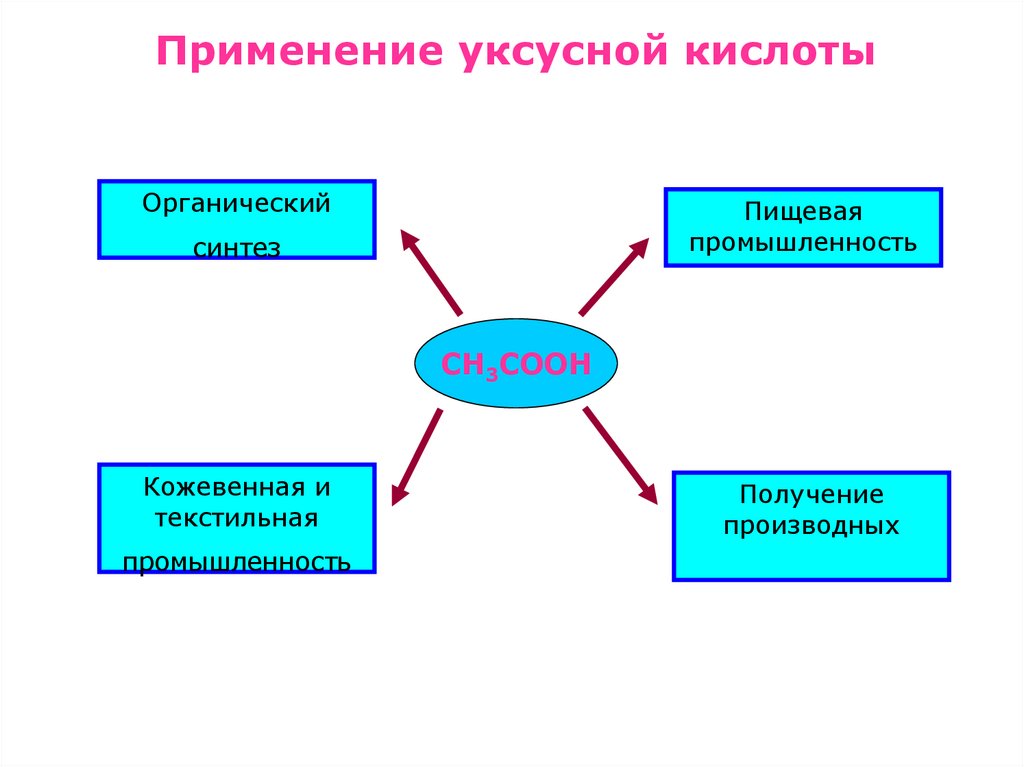
20.
Применение уксусной кислотыОрганический
Пищевая
промышленность
синтез
СН3СООН
Кожевенная и
текстильная
промышленность
Получение
производных
21.
Проверь свои знания покарбоновым кислотам
Реши задачу
Реши кроссворд
Тестирование
22.
Реши задачи домаЗадача 1
Одноосновная карбоновая кислота имеет следующий
состав: углерод – 40%, водород – 6,67%, кислород –
53,33%. Плотность паров этой кислоты по аргону равна
1,5. Исходя из этих данных, найдите молекулярную
формулу этой кислоты.
*Задача 2.
При окислении 69 г 5% раствора муравьиной кислоты
раствором оксида серебра выделился газ. Какая масса
осадка образуется при пропускании этого газа через
раствор, содержащий 7,4 г гашёной извести.
23.
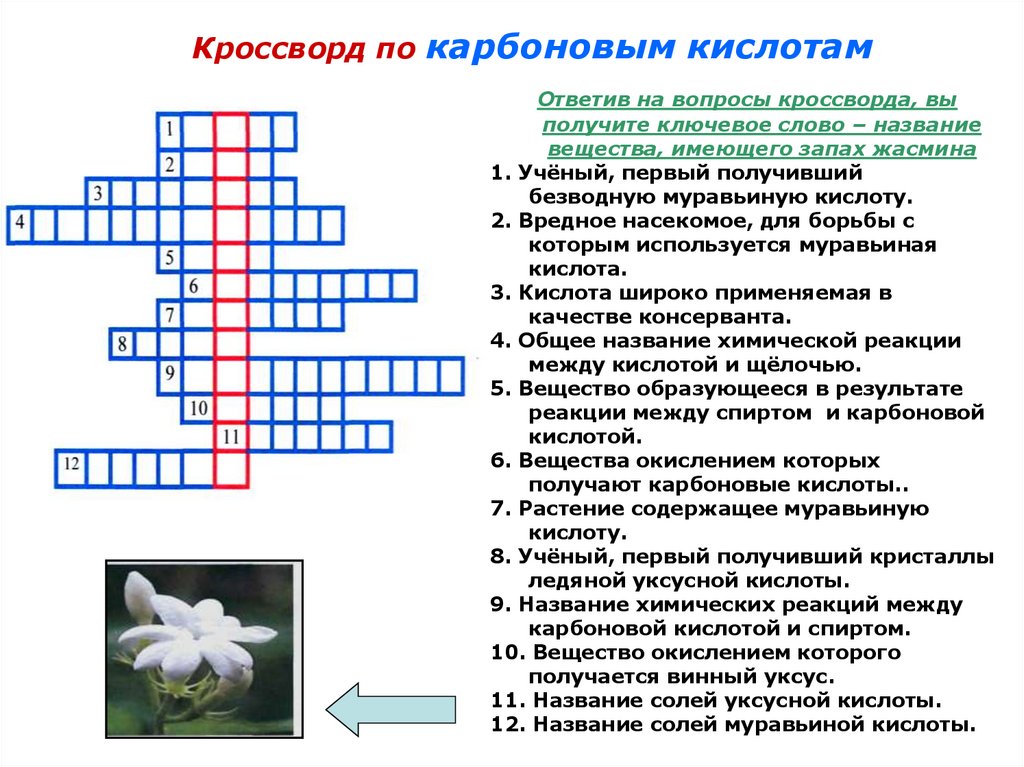
Кроссворд по карбоновым кислотамОтветив на вопросы кроссворда, вы
получите ключевое слово – название
вещества, имеющего запах жасмина
1. Учёный, первый получивший
безводную муравьиную кислоту.
2. Вредное насекомое, для борьбы с
которым используется муравьиная
кислота.
3. Кислота широко применяемая в
качестве консерванта.
4. Общее название химической реакции
между кислотой и щёлочью.
5. Вещество образующееся в результате
реакции между спиртом и карбоновой
кислотой.
6. Вещества окислением которых
получают карбоновые кислоты..
7. Растение содержащее муравьиную
кислоту.
8. Учёный, первый получивший кристаллы
ледяной уксусной кислоты.
9. Название химических реакций между
карбоновой кислотой и спиртом.
10. Вещество окислением которого
получается винный уксус.
11. Название солей уксусной кислоты.
12. Название солей муравьиной кислоты.
24.
Тестирование1. Укажите 2 класса соединений, имеющих общую формулу СnН2nО2
А) простые эфиры и спирты;
Б) альдегиды и кетоны;
В) карбоновые кислоты и сложные эфиры
2. Распределение электронной плотности в карбоксильной группе отражает
схема:
О
А) R – C
Б) R
δ+C
О-Н
ОδВ) R
О
Н
δ-C
Оδ+
О
Н
3. Какие признаки, верно отражают физические
свойства уксусной кислоты:
→
1) при комнатной температуре бесцветная жидкость; 2) газообразное вещество;
3) не имеет запаха; 4) имеет характерный запах;
5) слабый электролит; 6) плохо растворим в воде
А) 1, 3, 5;
Б) 1, 4, 5;
В) 2, 4, 6.
4. Взаимодействие уксусной кислоты с этиловым спиртом называется реакцией:
А) гидратация;
Б) гидрирование;
В) этерификация
5. С помощью какого реагента можно различить метановую и этановую кислоты
А) Ag2O;
Б) CuO;
В) Cu(OH)2
25.
Домашнее задание•Глава 4, §20;
•Решить задачи со слайда
•Решить кроссворд со слайда
26.
27.
Юстус Либих1803-1873
Немецкий химик. Исследования главным
образом посвящены органической химии.
Впервые получил хлороформ. Совместно с
Ф. Вёлером установил правильную формулу
бензойной кислоты. Открыл уксусный
альдегид впервые предложил термин
«альдегид». Определил органические
кислоты как соединения способные
образовывать соли путём замещения
водорода на металл. Предложил делить
пищевые продукты на белки, жиры и
углеводы. Установил что жиры и углеводы
служат для организма своего рода топливом.
Предложил теорию питания растений.
28.
Торий Егорович Ловиц1757 - 1804
Ловиц Товий (Иоганн Тобиас) Егорович, русский
химик и фармацевт, академик Петербургской АН
(1793). По происхождению немец. В Россию приехал
в 1768. Учился в академической гимназии в
Петербурге; там же работал в Главной аптеке,
преподавал химию и фармацию в Медицинской
школе и Медико-хирургической академии. В 1785
открыл адсорбцию растворённых веществ углём и
предложил использовать его для очистки спирта и
др. веществ; получил ледяную уксусную кислоту
(1789), кристаллогидраты ряда солей, абсолютный
спирт; разработал метод разделения бария,
стронция и кальция на основе растворимости их
хлоридов в абсолютном спирте (1795).
29.
30.
31.
32.
33.
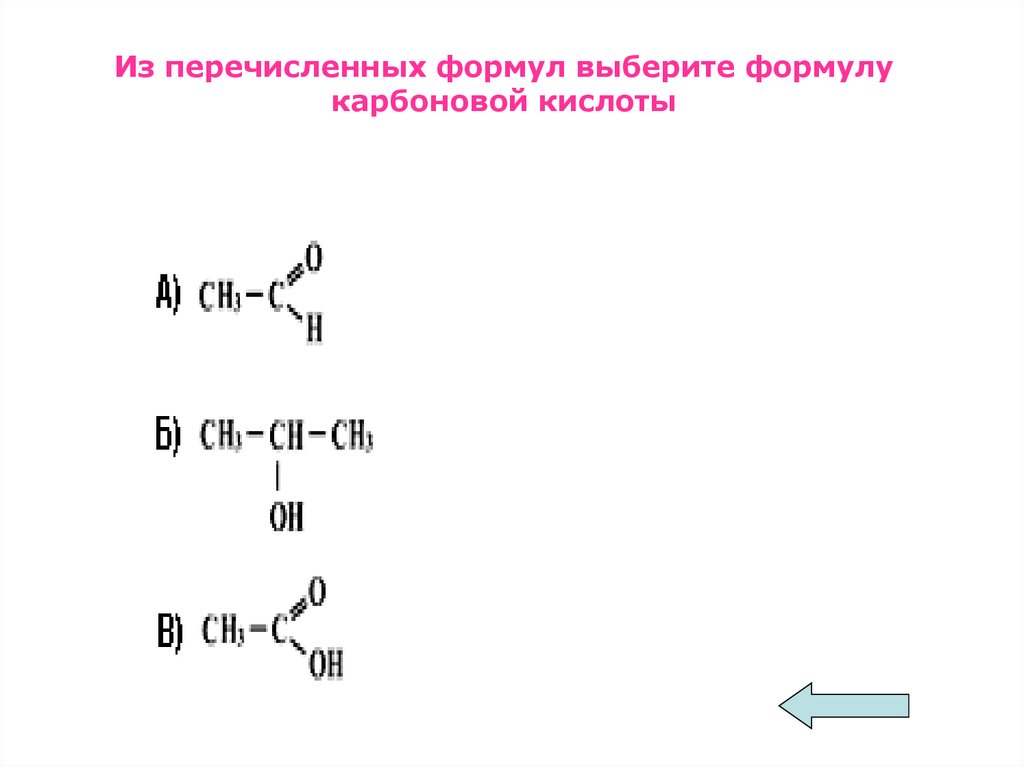
Из перечисленных формул выберите формулукарбоновой кислоты
34.
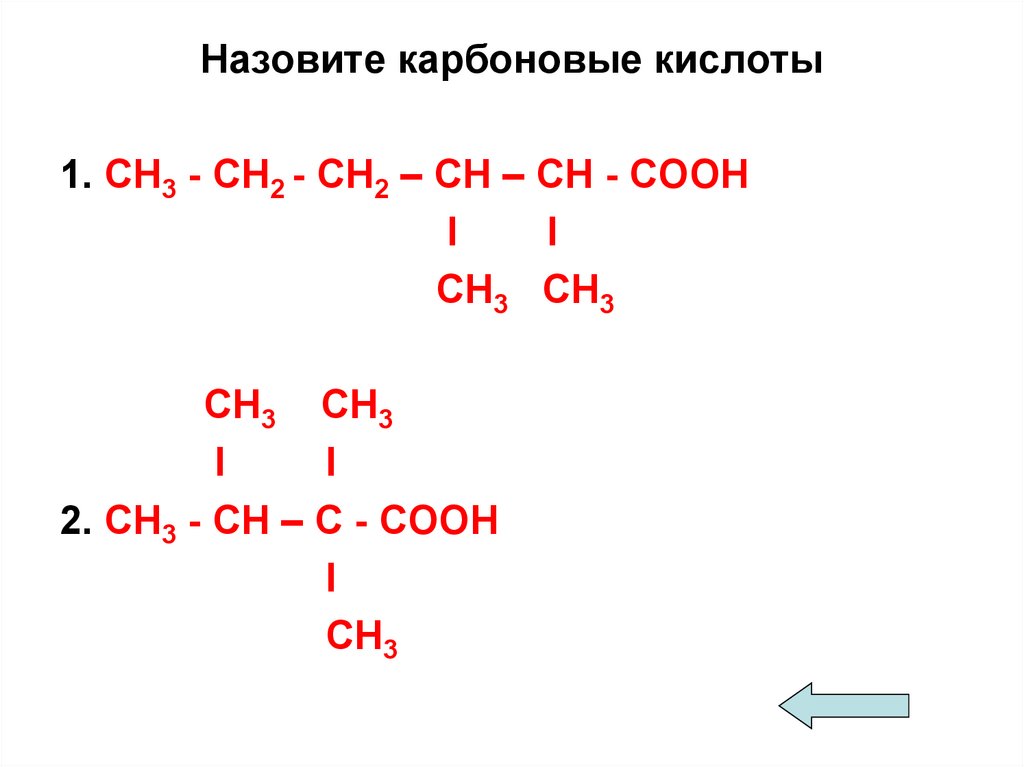
Назовите карбоновые кислоты1. СН3 - СН2 - СН2 – СН – СН - СООН
l
l
СН3 СН3
СН3 СН3
l
l
2. СН3 - СН – С - СООН
l
СН3





















 chemistry
chemistry








