Similar presentations:
Электролиты. Реакции в растворах электролитов
1.
ЭЛЕКТРОЛИТЫ.РЕАКЦИИ В РАСТВОРАХ
ЭЛЕКТРОЛИТОВ
2.
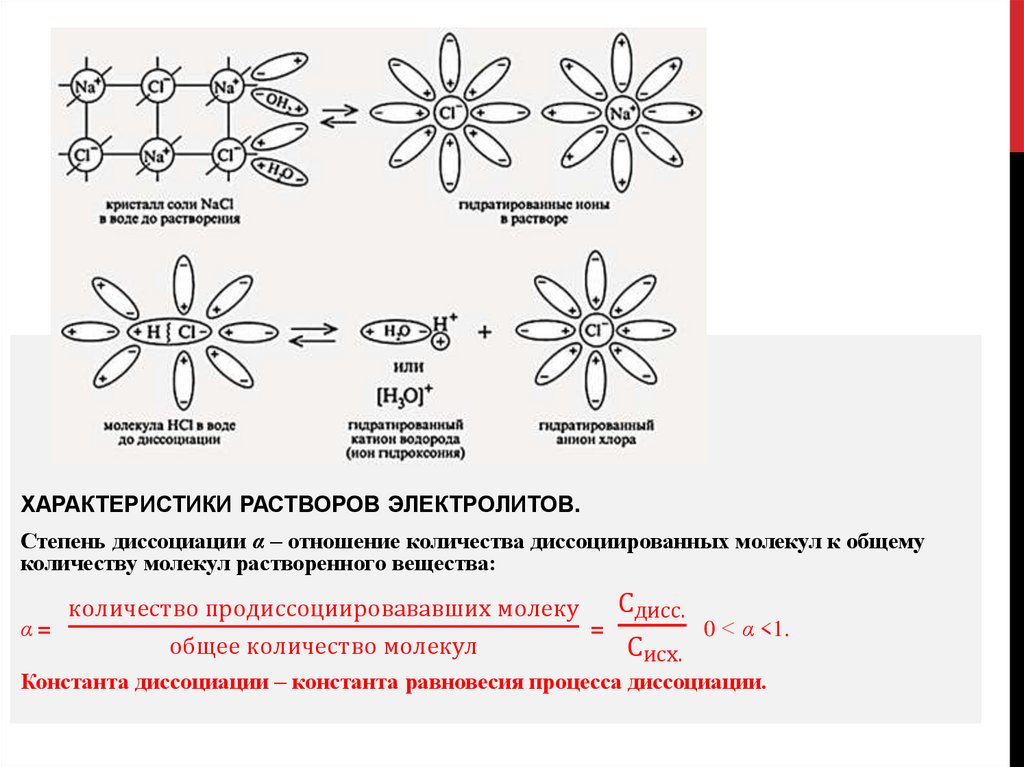
ХАРАКТЕРИСТИКИ РАСТВОРОВ ЭЛЕКТРОЛИТОВ.Степень диссоциации α – отношение количества диссоциированных молекул к общему
количеству молекул растворенного вещества:
Сдисс.
количество продиссоциировававших молеку
α=
=
0 < α <1.
общее количество молекул
Сисх.
Константа диссоциации – константа равновесия процесса диссоциации.
3.
КОНСТАНТА ДИССОЦИАЦИИ КИСЛОТ (КОНСТАНТА КИСЛОТНОСТИ)Константа диссоциации – константа равновесия процесса диссоциации.
α1
α2
α3
Н3РО4 ↔ Н+ + Н2РО4― ↔ 2 Н+ + НРО42― ↔ 3Н+ + РО43―
Кк1
Кк2
Кк3
α1>> α2>> α3
Кк1 >>Кк2 >>Кк3
pK = - lgKk
[Н+]•[Н2РО4―]
Кк1 = —————— = 7,5 •10-3 ,
pK = 2,12
[Н3РО4]
[Н+]•[НРО42―]
Кк2 = ——————— = 6,3 •10-8 ,
pK = 7,20
Кк = Кк1 •Кк2 •Кк3
[Н2РО4―]
[Н+]•[РО43―]
Кк3 = —————— = 1,3 •10-12 , pK = 11,89
[НРО42―]
КОНСТАНТЫ ПРОТОЛИЗА НЕКОТОРЫХ НЕОРГАНИЧЕСКИХ КИСЛОТ, [моль/л]
CH3COOH ― Кк = 2 .10-5, HNO2 ― Кк = 4.10-4 , HNO3 ― Кк = 44,
HMnO4 ― Кк = 200, H2SO4 ― Кк = 1000, HCl ― Кк = 107, HI ― Кк = 1011.
4.
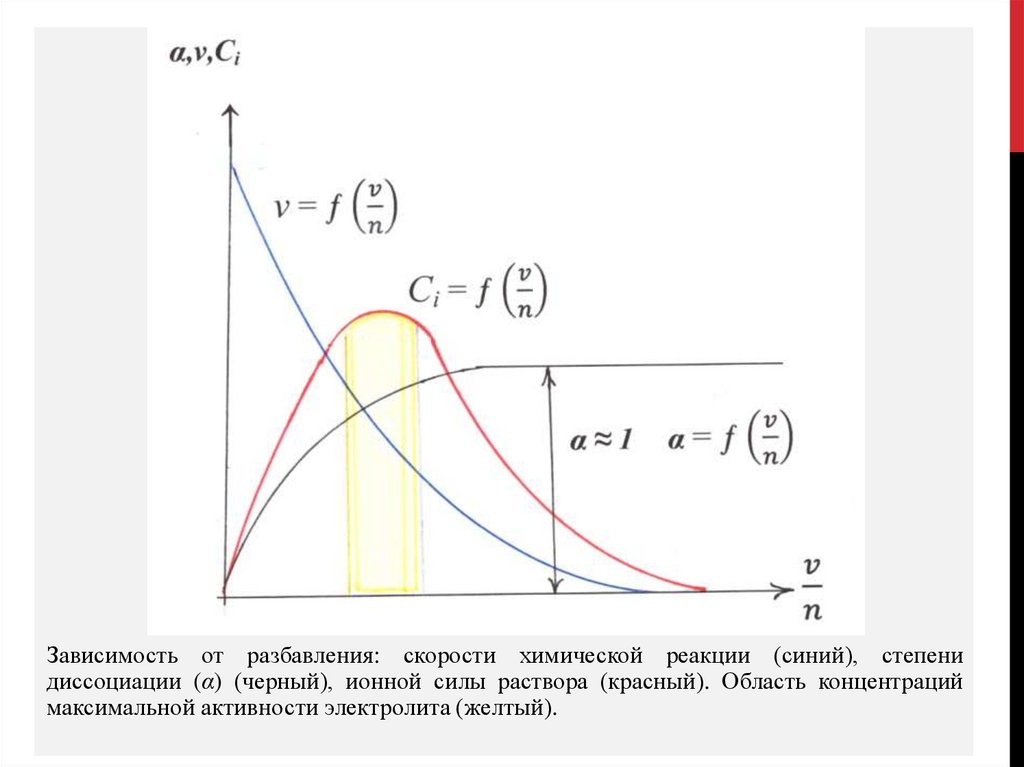
ЗАКОН РАЗБАВЛЕНИЯ ОСТВАЛЬДАСтепень диссоциации α зависит от диэлектрической проницаемости растворителя и
растворенного вещества, от температуры и концентрации.
Концентрационная зависимость α : СН3СООН ↔ Н+ + СН3СОО–
Кд = [Н+]•[СН3СОО–] ⁄ [СН3СООН]
п – моль растворили в объеме v, установилась степень диссоциации α. Распалось на
1−










 chemistry
chemistry








