Similar presentations:
Эпика. Эффективность применения. Исследование клинических аспектов
1.
ЭПИКАЭффективность Применения.
Исследование Клинических
Аспектов
Энергия инноваций для здоровья
Energy of innovations for health
PHARMASOFT
2.
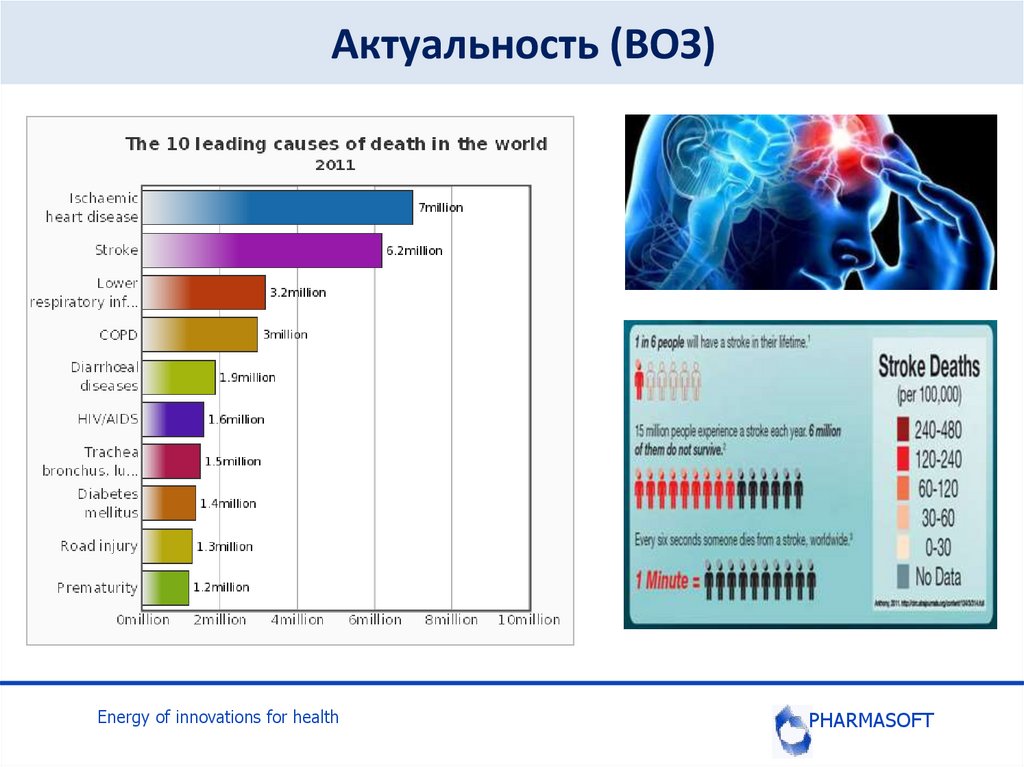
Актуальность (ВОЗ)Energy of innovations for health
PHARMASOFT
3.
Эпидемиология ОНМКЕжегодная смертность от инсульта в России — одна из
наиболее высоких в мире (175 случаев на 100 тыс.
населения в год).
Доля острых нарушений мозгового кровообращения
(ОНМК) в структуре общей смертности в нашей стране
составляет 21,4%.
Ранняя 30-дневная летальность после инсульта составляет
34,6%, а в течение года умирают около 50% больных, т.е.
каждый второй заболевший. Инвалидизация после
перенесенного инсульта достигает 3,2 на 10 тыс. населения,
занимая первое место среди всех причин первичной
инвалидизации, т.е. из выживших лишь 20% в состоянии
вернуться к прежней работе.
Клинические рекомендации по ведению больных с ишемическим инсультом и транзиторными ишемическими
атаками, 2017
4.
Руководство по раннему лечению ишемического инсульта у взрослыхМарт 2013
5.
Нейропротекторные агенты• Нейропротекция
относится
к
терапевтической
концепции
непосредственного воздействия на мозговую ткань с целью ее
сохранения или отсрочивания инфаркта в зоне пенумбры (в отличии от
реперфузии ткани мозга).
• Ввиду того, что большинство потенциальных нейропротекторов,
по всей видимости, безопасны и потенциально эффективны как при
геморрагическом,
так
и
при
ишемическом
инсульте,
идеальная нейропротективная терапия должна начинаться
как можно раньше, включаться в догоспитальный этап
лечения и комбинироваться с такими подходами как
нейровизуализация с последующей фибринолитической
терапией или эндоваскулярной реваскуляризацией.
6.
7.
8.
Мультицентровое рандомизированное двойное слепоеплацебо-контролируемое в параллельных группах
исследование эффективности и безопасности препарата
МЕКСИДОЛ® при длительной последовательной терапии
у пациентов с полушарным ишемическим инсультом в
остром и раннем восстановительном периодах
ЭПИКА
Эффективность Применения.
Исследование Клинических Аспектов.
9.
Стаховская Л.В., Шамалов Н.А., Хасанова Д.Р. , Мельникова Е.В. с соавт. Журнал неврологии ипсихиатрии. 2017; 3-2:55-64
10.
Мультицентровое рандомизированное двойноеслепое плацебо-контролируемое в параллельных
группах исследование эффективности и
безопасности препарата МЕКСИДОЛ® при
длительной последовательной терапии у пациентов
с полушарным ишемическим инсультом в остром и
раннем восстановительном периодах
11.
Клинические центры исследования1.
Российский
национальный
исследовательский
медицинский
университет имени Н. И. Пирогова, Москва
2. Межрегиональный клинико-диагностический центр, Казань
3. Городская больница №26, Санкт-Петербург
4. Городская больница №40 Курортного административного района,
Санкт-Петербург
5. Городская многопрофильная больница №2, Санкт-Петербург
6. Казанский государственный медицинский университет»
7. Николаевская больница, Санкт-Петербург
8. Всеволожская клиническая межрайонная больница, Ленинградская
область
9. Городская клиническая больница № 1 имени Н.И. Пирогова, Самара
10. Самарская областная клиническая больница им. В.Д. Середавина,
Самара
11. Научно-исследовательский институт экспериментальной и клинической
медицины», Новосибирск
Energy of innovations for health
PHARMASOFT
12.
Мультицентровое рандомизированное двойноеслепое плацебо-контролируемое в параллельных
группах исследование эффективности и
безопасности препарата МЕКСИДОЛ® при
длительной последовательной терапии у пациентов
с полушарным ишемическим инсультом в остром и
раннем восстановительном периодах
13.
Рандомизированное14.
Мультицентровое рандомизированное двойноеслепое плацебо-контролируемое в параллельных
группах исследование эффективности и
безопасности препарата МЕКСИДОЛ® при
длительной последовательной терапии у пациентов
с полушарным ишемическим инсультом в остром и
раннем восстановительном периодах
15.
Двойное слепое16.
Мультицентровое рандомизированное двойноеслепое плацебо-контролируемое в параллельных
группах исследование эффективности и
безопасности препарата МЕКСИДОЛ® при
длительной последовательной терапии у пациентов
с полушарным ишемическим инсультом в остром и
раннем восстановительном периодах
17.
Плацебоконтролируемое18.
Мультицентровое рандомизированное двойноеслепое плацебо-контролируемое в параллельных
группах исследование эффективности и
безопасности препарата МЕКСИДОЛ® при
длительной последовательной терапии у пациентов
с полушарным ишемическим инсультом в остром и
раннем восстановительном периодах
19.
Мультицентровое рандомизированное двойноеслепое плацебо-контролируемое в параллельных
группах исследование эффективности и
безопасности препарата МЕКСИДОЛ® при
длительной последовательной терапии у пациентов
с полушарным ишемическим инсультом в остром и
раннем восстановительном периодах
20.
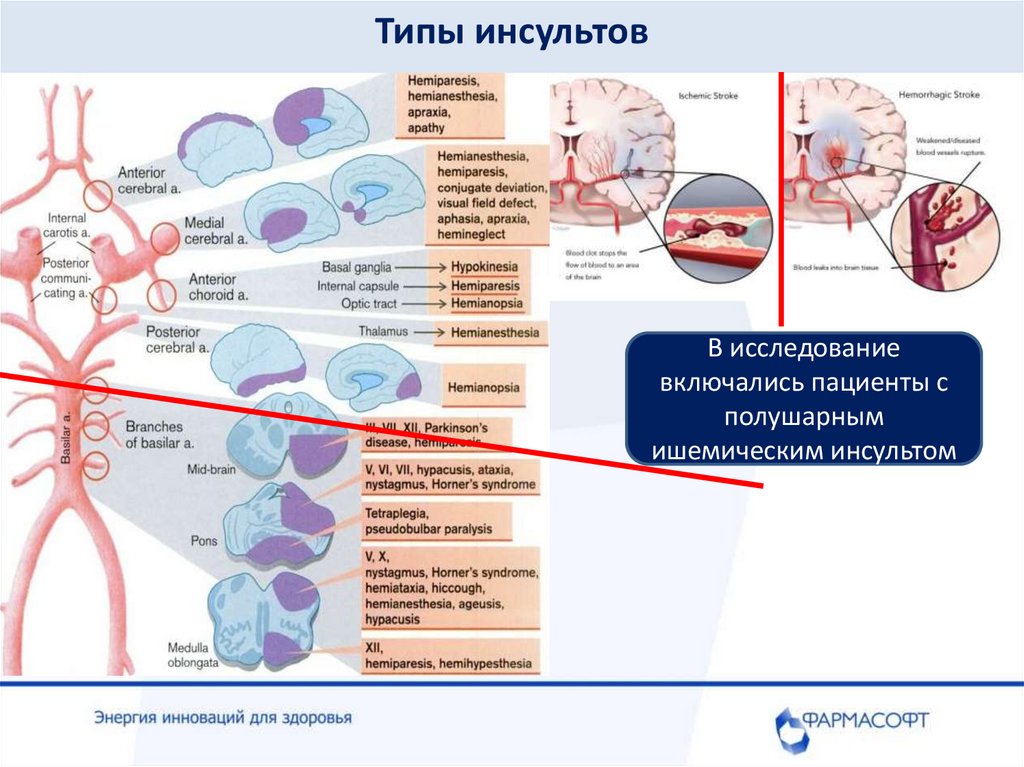
Типы инсультовВ исследование
включались пациенты с
полушарным
ишемическим инсультом
21.
Мультицентровое рандомизированное двойноеслепое плацебо-контролируемое в параллельных
группах исследование эффективности и
безопасности препарата МЕКСИДОЛ® при
длительной последовательной терапии у пациентов
с полушарным ишемическим инсультом в остром и
раннем восстановительном периодах
22.
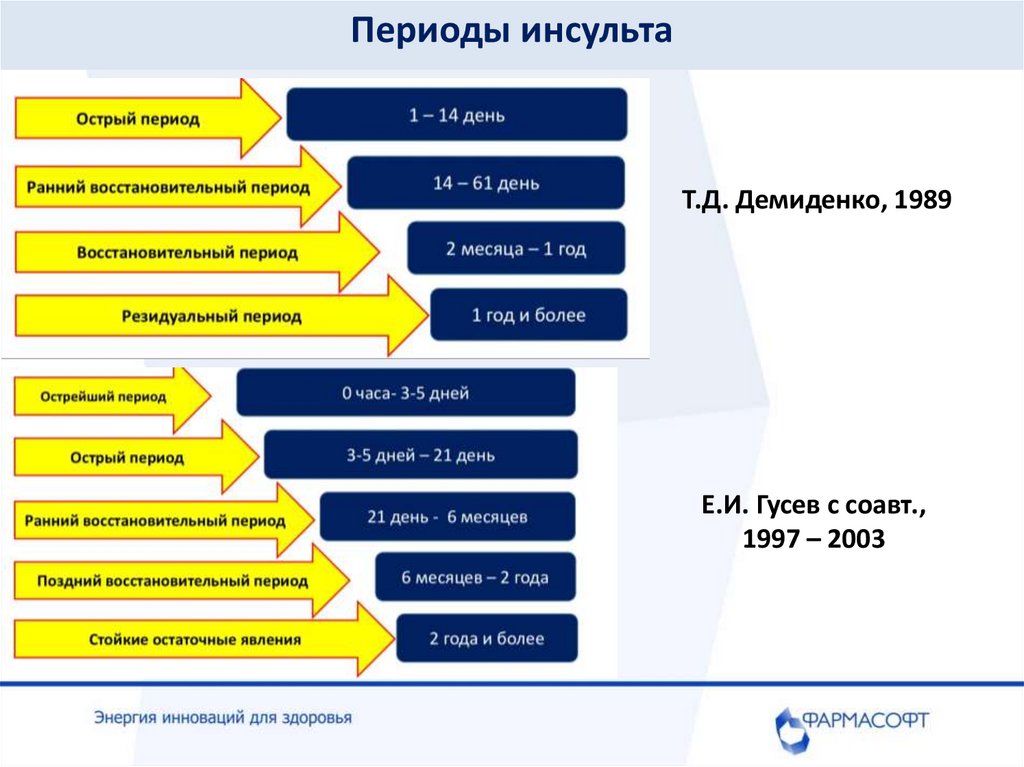
Периоды инсультаТ.Д. Демиденко, 1989
Е.И. Гусев с соавт.,
1997 – 2003
23.
Исследование выполнено в соответствиис требованиями GCP
24.
Цель исследованияОценить эффективность и безопасность
длительной последовательной терапии
препаратом Мексидол® (раствор для в/в и в/м
введения /таблетки) у пациентов с
полушарным ишемическим инсультом в
остром и раннем восстановительном
периодах
25.
Критерии включения1. Полушарный ишемический инсульт, первичный, подтверждённый
методами нейровизуализации (КТ или МРТ)
2. Пациенты обоего пола, от 40 до 80 лет
3. Пациенты, способные понимать цели настоящего исследования и
соблюдать требования Протокола
4. Время от начала развития инсульта – не более 72 часов
5. Оценка по шкале Рэнкина от 3 и более баллов на момент
включения в исследование
6. Оценка по шкале NIHSS от 5 до 20 баллов
7. Оценка по шкале депрессии Бека < 19 баллов
8. Подписанное информированное согласие
9. Наличие отрицательного теста на беременность у женщин
детородного возраста
10.Согласие на использование адекватных методов контрацепции
26.
Критерии включения• Модифицированная шкала Рэнкина (mRS, modified
Rankin Scale), позволяющая оценить степень нарушения
жизнедеятельности (инвалидизации) – первичный
критерий эффективности!!!
• NIHSS (The National Institutes of Health Stroke Scale шкале инсульта Национального института здоровья),
характеризует степень выраженности неврологического
дефицита
• Beck Depression Inventory (шкала депрессии Бека - тестопросник депрессии), характеризует степень выраженности
депрессии
• EQ-5D (EuroQoL Quality of Life Scale - опросник оценки
качества жизни)
27.
Приказ МЗ РФ от 10 мая 2017 г N203н “Об утверждениикритериев оценки качества медицинской помощи“
3.9. Критерии качества при болезнях системы кровообращения
3.9.1. Критерии качества специализированной медицинской помощи взрослым при
остром нарушении мозгового кровообращения (коды по МКБ-10: I60 - I63; G45; G46)
N
п/п
Критерии качества
Оценка
выполнения
Выполнена оценка степени нарушения сознания и комы по шкале
12. Глазго и неврологического статуса по шкале инсульта NIH не
позднее 3 часов от момента поступления в стационар
Да/Нет
18.
Выполнена оценка по шкале Рэнкин в первые 24 часа от момента
поступления в стационар и на момент выписки из стационара
Да/Нет
19.
Оценка по шкале Рэнкин уменьшилась не менее чем на 1 балл за
время пребывания в стационаре
Да/Нет
28.
Критерии невключения1. Отсутствие диагноза: Полушарный ишемический инсульт,
первичный, подтверждённый методами нейровизуализации (КТ
или МРТ)
2. Возраст < 40 и > 80 лет
3. Оценка по шкале NIHSS <5, или > 20 баллов
4. Геморрагический
инсульт
(подтверждённый
методами
нейровизуализации (КТ или МРТ)
5. Геморрагический
инфаркт
(ишемический
инсульт
с
геморрагическим пропитыванием)
6. Повторный ишемический инсульт
7. Тяжелые заболевания нервной системы (болезнь Паркинсона,
эпилепсия, демиелинизирующие заболевания нервной системы,
наследственно-дегенеративные заболевания ЦНС, инфекционные
заболевания ЦНС, травматические повреждения головного мозга)
29.
Критерии невключения8. Тяжелые заболевания сердечно-сосудистой системы (нестабильная
стенокардия напряжения, инфаркт миокарда, давностью менее 3
мес, ХСН IV ФК, Атриовентрикулярная блокада II-III степени.
9. Острая хирургическая патология.
10. Тяжелые, декомпенсированные заболевания сердца, печени,
почек,
легких,
острая/хроническая
почечная/печеночная
недостаточность.
11. Наличие
в
анамнезе
онкологических
заболеваний,
иммунодепрессивных состояний, туберкулеза, алкогольной или
наркотической зависимости, психических заболеваний.
12. Острые инфекционные заболевания (грипп, ОРВИ, и др.) менее чем
за 4 недели до начала исследования.
13. Аллергические реакции на компоненты препарата
14. Беременность, период лактации.
30.
Критерии исключения1. Впервые выявленные состояния и/или заболевания, описанные
в критериях невключения
2. Впервые
выявленная
гиперчувствительность
к
этилметилгидроксипиридина сукцинату
3. Некомплаентность пациента процедурам исследования
4. Желание пациента выйти из исследования
5. Любое состояние пациента, требующее, по обоснованному
мнению
врача-исследователя,
вывода
пациента
из
исследования
31.
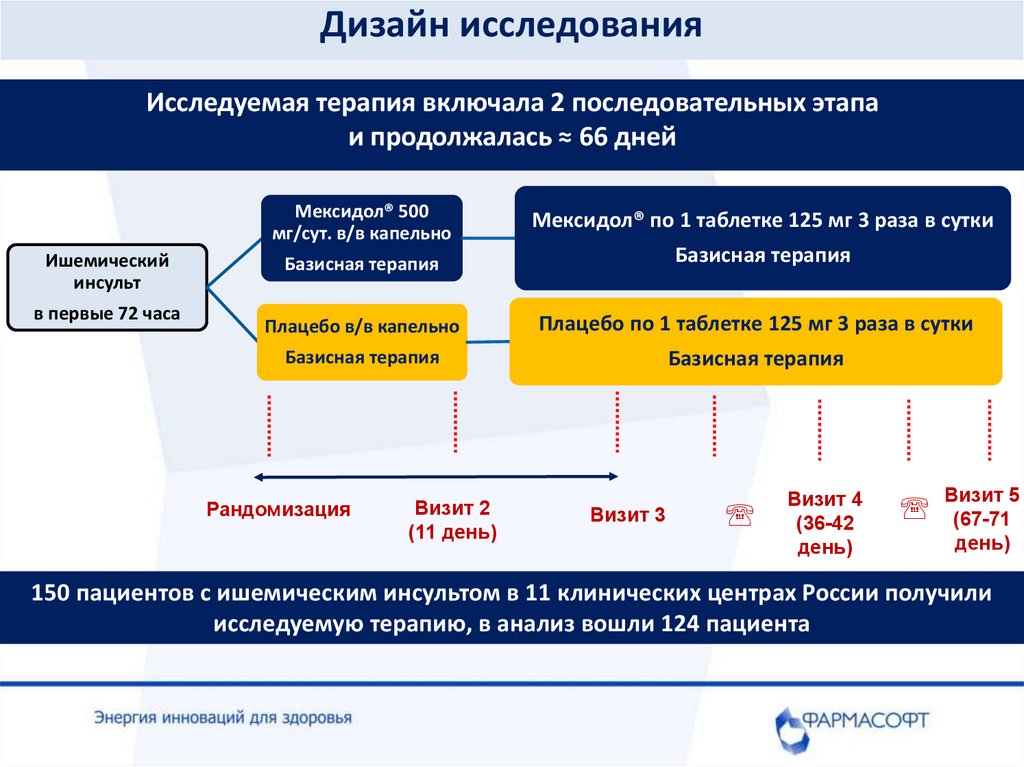
Дизайн исследованияИсследуемая терапия включала 2 последовательных этапа
и продолжалась ≈ 66 дней
Ишемический
инсульт
в первые 72 часа
Мексидол® 500
мг/сут. в/в капельно
Мексидол® по 1 таблетке 125 мг 3 раза в сутки
Базисная терапия
Базисная терапия
Плацебо в/в капельно
Плацебо по 1 таблетке 125 мг 3 раза в сутки
Базисная терапия
Базисная терапия
Рандомизация
Визит 2
(11 день)
Визит 3
Визит 4
(36-42
день)
Визит 5
(67-71
день)
150 пациентов с ишемическим инсультом в 11 клинических центрах России получили
исследуемую терапию, в анализ вошли 124 пациента
32.
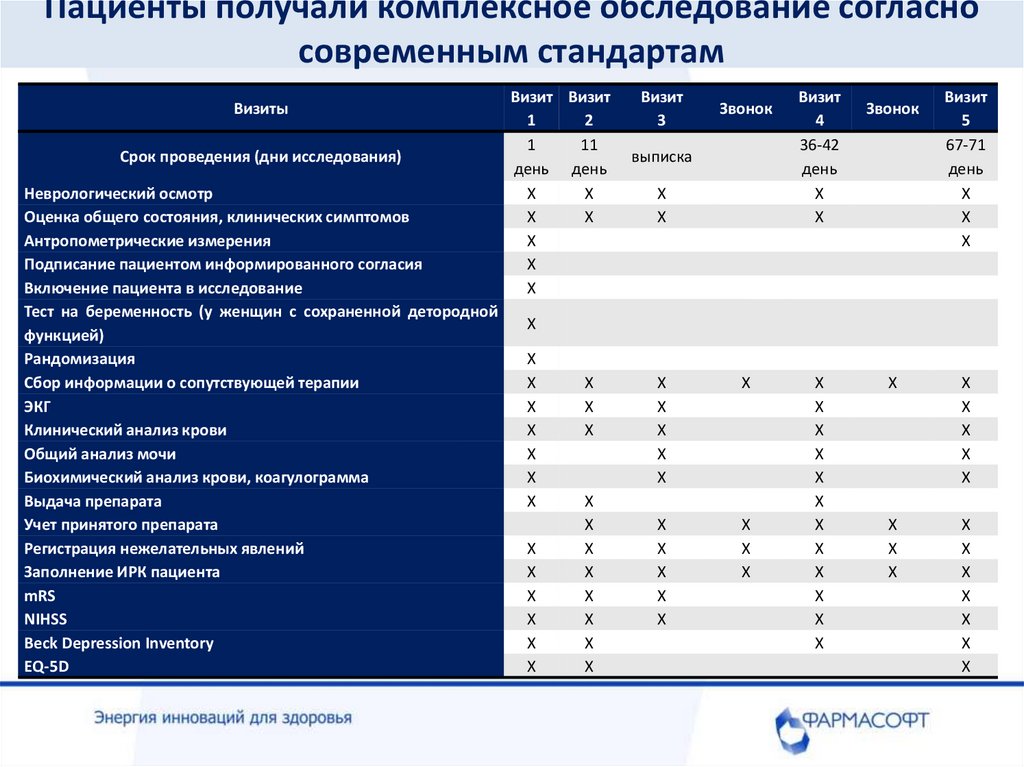
Пациенты получали комплексное обследование согласносовременным стандартам
Визиты
Срок проведения (дни исследования)
Неврологический осмотр
Оценка общего состояния, клинических симптомов
Антропометрические измерения
Подписание пациентом информированного согласия
Включение пациента в исследование
Тест на беременность (у женщин с сохраненной детородной
функцией)
Рандомизация
Сбор информации о сопутствующей терапии
ЭКГ
Клинический анализ крови
Общий анализ мочи
Биохимический анализ крови, коагулограмма
Выдача препарата
Учет принятого препарата
Регистрация нежелательных явлений
Заполнение ИРК пациента
mRS
NIHSS
Beck Depression Inventory
EQ-5D
Визит Визит
1
2
1
11
день день
X
X
X
X
X
X
X
Визит
3
Звонок
выписка
X
X
Визит
4
36-42
день
X
X
Звонок
Визит
5
67-71
день
X
X
X
X
X
X
X
X
X
X
X
X
X
X
X
X
X
X
X
X
X
X
X
X
X
X
X
X
X
X
X
X
X
X
X
X
X
X
X
X
X
X
X
X
X
X
X
X
X
X
X
X
X
X
X
X
X
X
X
X
X
X
X
X
X
X
X
X
X
X
33.
Базисная и сопутствующая терапияадекватна статусу, основному и сопутствующим заболеваниям
• Терапия, исключая:
– препараты, содержащие янтарную кислоту и её соли
– препараты, содержащие витамин В6 и/или его производные
– препараты,
относящиеся
к
группам
антиоксидантов
антигипоксантов
– препараты с ноотропным типом действия
и
• Тромболитическая терапия препаратом Альтеплаза по показаниям
• Базисная терапия включала в себя коррекцию нарушений
системной и церебральной гемодинамики, реологических и
свертывающих свойств крови, профилактику осложнений инсульта
• При выписке пациента из стационара Исследователь давал
подробную рекомендацию по дальнейшему лечению
34.
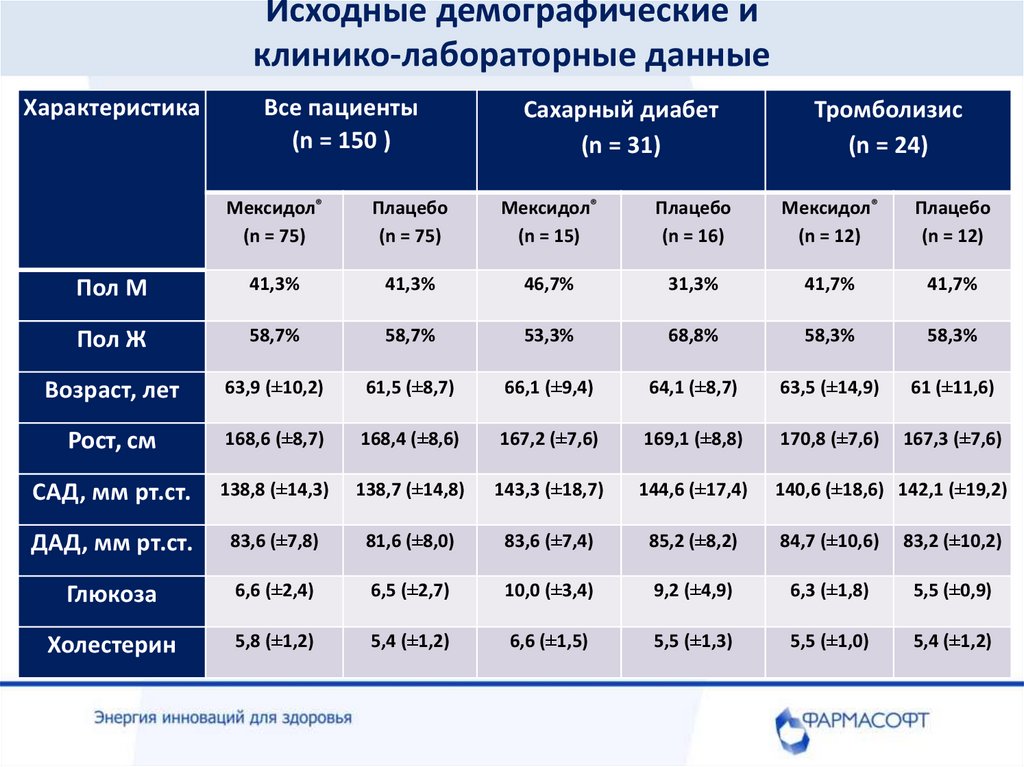
Исходные демографические иклинико-лабораторные данные
Характеристика
Все пациенты
(n = 150 )
Сахарный диабет
(n = 31)
Тромболизис
(n = 24)
Мексидол®
(n = 75)
Плацебо
(n = 75)
Мексидол®
(n = 15)
Плацебо
(n = 16)
Мексидол®
(n = 12)
Плацебо
(n = 12)
Пол М
41,3%
41,3%
46,7%
31,3%
41,7%
41,7%
Пол Ж
58,7%
58,7%
53,3%
68,8%
58,3%
58,3%
Возраст, лет
63,9 (±10,2)
61,5 (±8,7)
66,1 (±9,4)
64,1 (±8,7)
63,5 (±14,9)
61 (±11,6)
Рост, см
168,6 (±8,7)
168,4 (±8,6)
167,2 (±7,6)
169,1 (±8,8)
170,8 (±7,6)
167,3 (±7,6)
САД, мм рт.ст.
138,8 (±14,3)
138,7 (±14,8)
143,3 (±18,7)
144,6 (±17,4)
140,6 (±18,6) 142,1 (±19,2)
ДАД, мм рт.ст.
83,6 (±7,8)
81,6 (±8,0)
83,6 (±7,4)
85,2 (±8,2)
84,7 (±10,6)
83,2 (±10,2)
Глюкоза
6,6 (±2,4)
6,5 (±2,7)
10,0 (±3,4)
9,2 (±4,9)
6,3 (±1,8)
5,5 (±0,9)
Холестерин
5,8 (±1,2)
5,4 (±1,2)
6,6 (±1,5)
5,5 (±1,3)
5,5 (±1,0)
5,4 (±1,2)
35.
Методы оценки эффективности• Модифицированная шкала Рэнкина (mRS, modified
Rankin Scale), позволяющая оценить степень нарушения
жизнедеятельности (инвалидизации) – первичный
критерий эффективности!!!
• NIHSS (The National Institutes of Health Stroke Scale шкале инсульта Национального института здоровья),
характеризует степень выраженности неврологического
дефицита
• Beck Depression Inventory (шкала депрессии Бека - тестопросник депрессии), характеризует степень выраженности
депрессии
• EQ-5D (EuroQoL Quality of Life Scale - опросник оценки
качества жизни)
36.
Модифицированная шкала Рэнкина(mRS modified Rankin Scale )
0 – симптомы отсутствуют
1 – отсутствие существенных нарушений жизнедеятельности:
несмотря на наличие некоторых симптомов способен выполнять все
повседневные обязанности
2 – легкое нарушение жизнедеятельности: неспособен выполнять
Все справляется
пациенты с собственными
некоторые прежние обязанности, однако
делами без посторонней помощи
(n = 150 )
Характеристика
3 – умеренное
нарушение жизнедеятельности:
требуется некоторая
Мексидол®
Плацебо
помощь, однако способен ходить без посторонней помощи
(n = 75)
(n = 75)
4 – выраженное нарушение жизнедеятельности: неспособен ходить
mRSпомощи, 3,453
(±0,501) справляться
3,4 (±0,52) со своими
без посторонней
неспособен
физическими потребностями без посторонней помощи
5 – тяжелое нарушение жизнедеятельности: прикован к постели,
недержание мочи и кала, требует постоянной помощи и присмотра
персонала
6 – смерть
37.
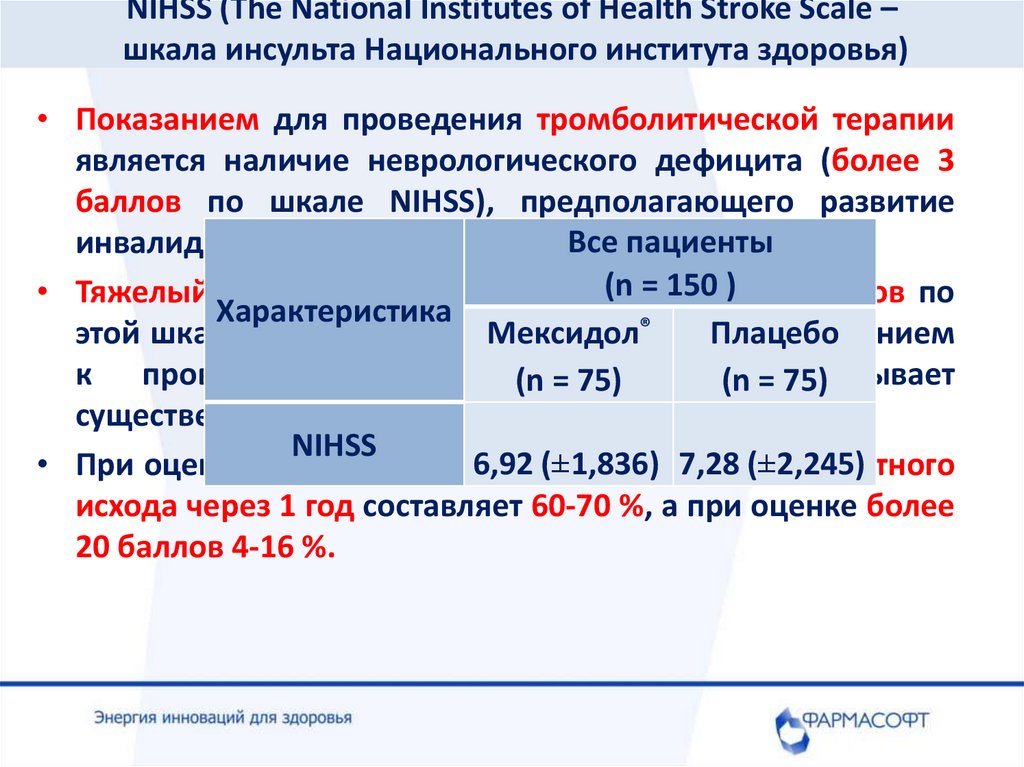
NIHSS (The National Institutes of Health Stroke Scale –шкала инсульта Национального института здоровья)
38.
NIHSS (The National Institutes of Health Stroke Scale –шкала инсульта Национального института здоровья)
• Показанием для проведения тромболитической терапии
является наличие неврологического дефицита (более 3
баллов по шкале NIHSS), предполагающего развитие
Все пациенты
инвалидизации.
(n (более
= 150 ) 25 баллов по
• Тяжелый неврологический дефицит
Характеристика
Мексидол®противопоказанием
Плацебо
этой шкале) является относительным
к проведению тромболизиса
оказывает
(n = 75) и не
(n = 75)
существенного влияния на исход заболевания.
NIHSS
6,92вероятность
(±1,836) 7,28
(±2,245)
• При оценке менее 10 баллов
благоприятного
исхода через 1 год составляет 60-70 %, а при оценке более
20 баллов 4-16 %.
39.
Beck Depression Inventory(шкала депрессии Бека - тест-опросник депрессии)
• Опросник состоит из двадцати одной группы симптомов,
каждая из которых разделена на четыре утверждения.
• Методика
разработана
с
целью
обеспечения
количественной оценки интенсивности депрессии.
• В методике выделяются две субшкалы:
когнитивно-аффективная субшкала (C-A)
субшкала соматических проявлений депрессии (S-P)
• Результаты теста интерпретируются следующим образом:
0–13 — вариации, считающиеся нормой
14–19 — лёгкая депрессия
20–28 — умеренная депрессия
29–63 — тяжёлая депрессия
40.
EQ-5D (EuroQoL Quality of Life Scale)• Предназначен для изучения качества жизни пациентов
• Опросник оценивает статус здоровья на основании 5
компонентов, связанных со следующими аспектами жизни:
- подвижность,
- самообслуживание,
- активность в повседневной жизни,
- боль или дискомфорт,
- беспокойство или депрессия.
41.
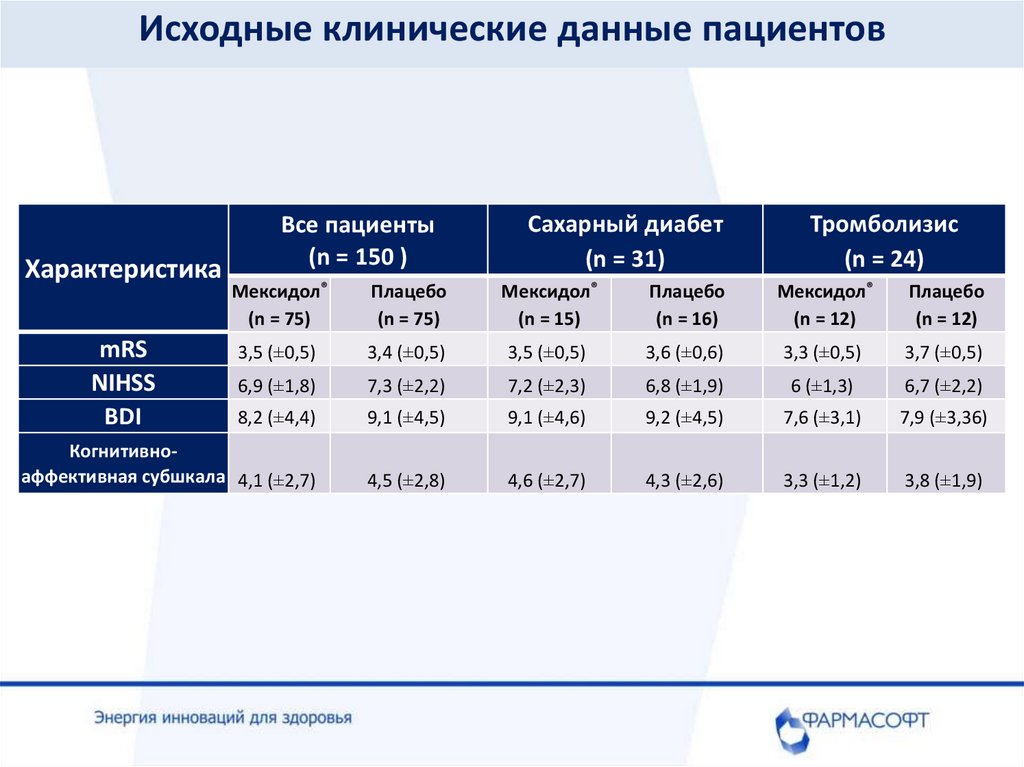
Исходные клинические данные пациентовХарактеристика
Все пациенты
(n = 150 )
Сахарный диабет
(n = 31)
Тромболизис
(n = 24)
Мексидол®
(n = 75)
Плацебо
(n = 75)
Мексидол®
(n = 15)
Плацебо
(n = 16)
Мексидол®
(n = 12)
Плацебо
(n = 12)
3,5 (±0,5)
3,4 (±0,5)
3,5 (±0,5)
3,6 (±0,6)
3,3 (±0,5)
3,7 (±0,5)
6,9 (±1,8)
7,3 (±2,2)
7,2 (±2,3)
6,8 (±1,9)
6 (±1,3)
6,7 (±2,2)
8,2 (±4,4)
9,1 (±4,5)
9,1 (±4,6)
9,2 (±4,5)
7,6 (±3,1)
7,9 (±3,36)
Когнитивноаффективная субшкала 4,1 (±2,7)
4,5 (±2,8)
4,6 (±2,7)
4,3 (±2,6)
3,3 (±1,2)
3,8 (±1,9)
mRS
NIHSS
BDI
42.
Кто же наш пациент, которого включили висследование?
60 летний пациент, дезадаптированный, с умеренным
неврологическим дефицитом, легкой депрессией и
сниженным качеством жизни
43.
Результаты44.
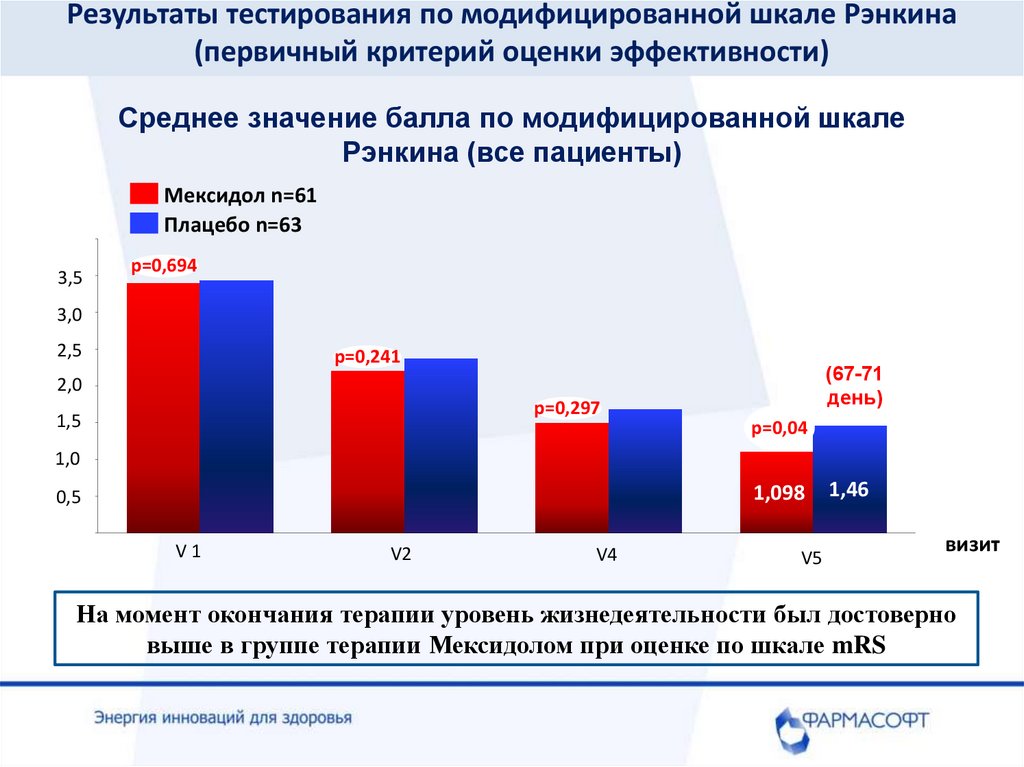
Результаты тестирования по модифицированной шкале Рэнкина(первичный критерий оценки эффективности)
Среднее значение балла по модифицированной шкале
Рэнкина (все пациенты)
Мексидол n=61
Плацебо n=63
3,5
p=0,694
3,0
2,5
p=0,241
(67-71
день)
2,0
p=0,297
1,5
p=0,04
1,0
1,098
0,5
V1
V2
V4
V5
1,46
визит
На момент окончания терапии уровень жизнедеятельности был достоверно
выше в группе терапии Мексидолом при оценке по шкале mRS
45.
Модифицированная шкала Рэнкина(mRS modified Rankin Scale )
0 – симптомы отсутствуют
1 – отсутствие существенных нарушений жизнедеятельности:
несмотря на наличие некоторых симптомов способен выполнять все
повседневные обязанности
2 – легкое нарушение жизнедеятельности: неспособен выполнять
некоторые прежние обязанности, однако справляется с собственными
делами без посторонней помощи
3 – умеренное нарушение жизнедеятельности: требуется некоторая
помощь, однако способен ходить без посторонней помощи
4 – выраженное нарушение жизнедеятельности: неспособен ходить
без посторонней помощи, неспособен справляться со своими
физическими потребностями без посторонней помощи
5 – тяжелое нарушение жизнедеятельности: прикован к постели,
недержание мочи и кала, требует постоянной помощи и присмотра
персонала
6 – смерть
46.
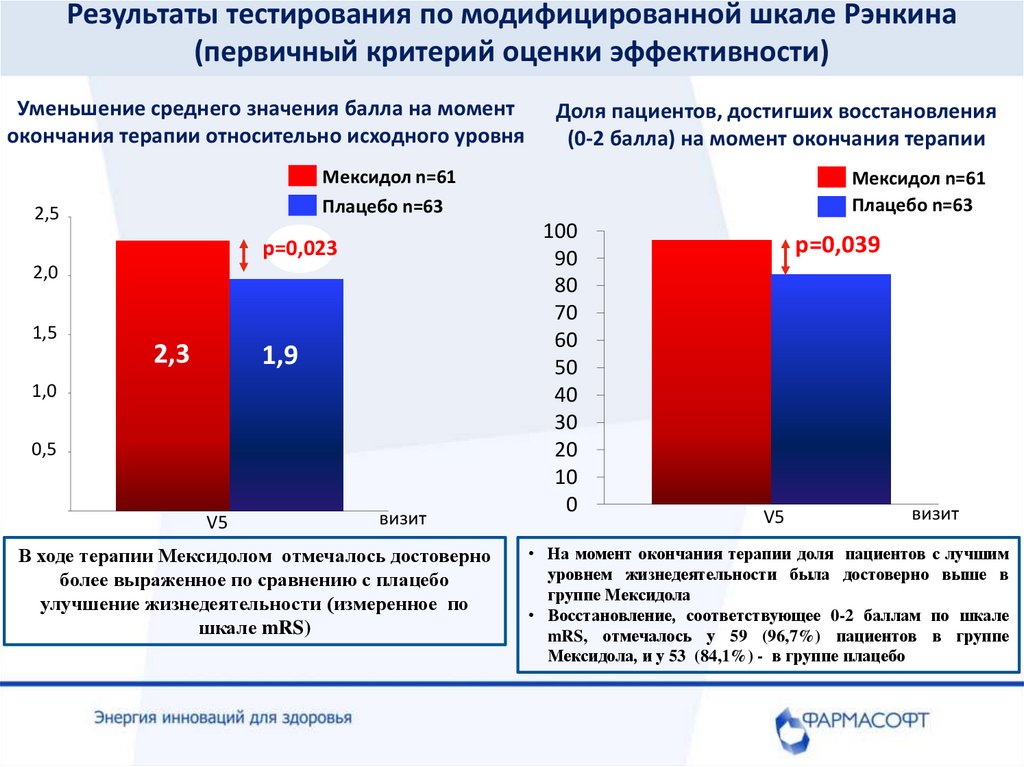
Результаты тестирования по модифицированной шкале Рэнкина(первичный критерий оценки эффективности)
Уменьшение среднего значения балла на момент
окончания терапии относительно исходного уровня
Мексидол n=61
Плацебо n=63
2,5
p=0,023
2,0
1,5
Доля пациентов, достигших восстановления
(0-2 балла) на момент окончания терапии
2,3
1,9
1,0
0,5
V5
визит
В ходе терапии Мексидолом отмечалось достоверно
более выраженное по сравнению с плацебо
улучшение жизнедеятельности (измеренное по
шкале mRS)
Мексидол n=61
Плацебо n=63
100
90
80
70
60
50
40
30
20
10
0
p=0,039
V5
визит
• На момент окончания терапии доля пациентов с лучшим
уровнем жизнедеятельности была достоверно выше в
группе Мексидола
• Восстановление, соответствующее 0-2 баллам по шкале
mRS, отмечалось у 59 (96,7%) пациентов в группе
Мексидола, и у 53 (84,1%) - в группе плацебо
47.
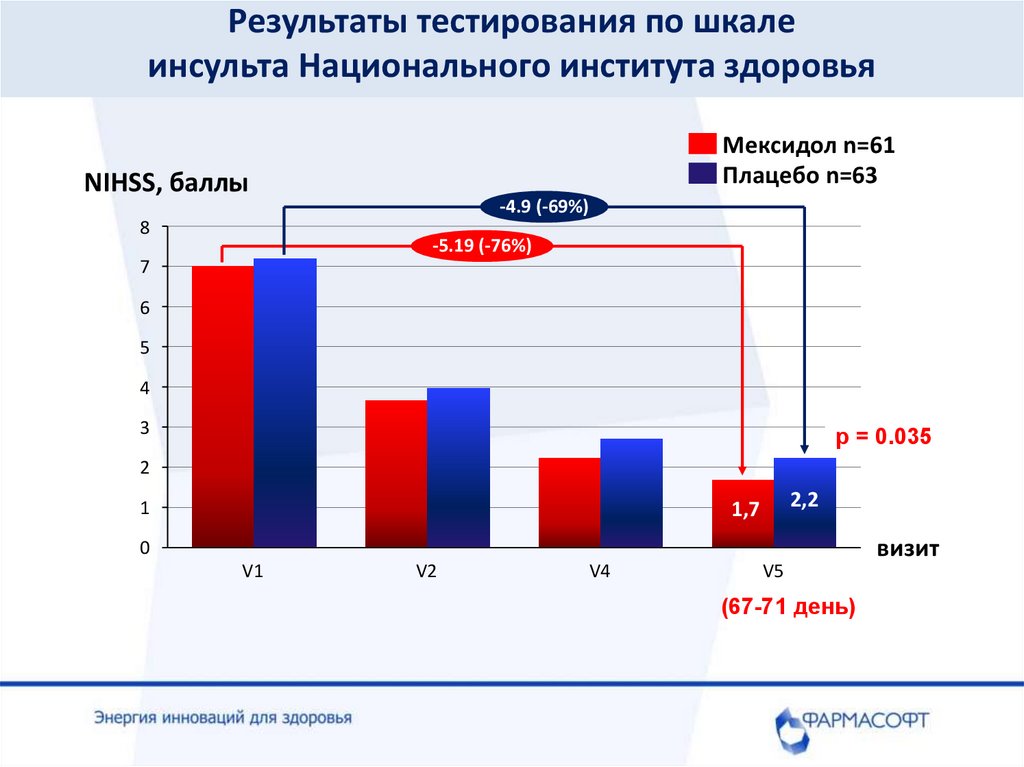
Результаты тестирования по шкалеинсульта Национального института здоровья
Мексидол n=61
Плацебо n=63
NIHSS, баллы
8
-4.9 (-69%)
-5.19 (-76%)
7
6
5
4
3
p = 0.035
2
2,2
1,7
1
визит
0
V1
V2
V4
V5
(67-71 день)
48.
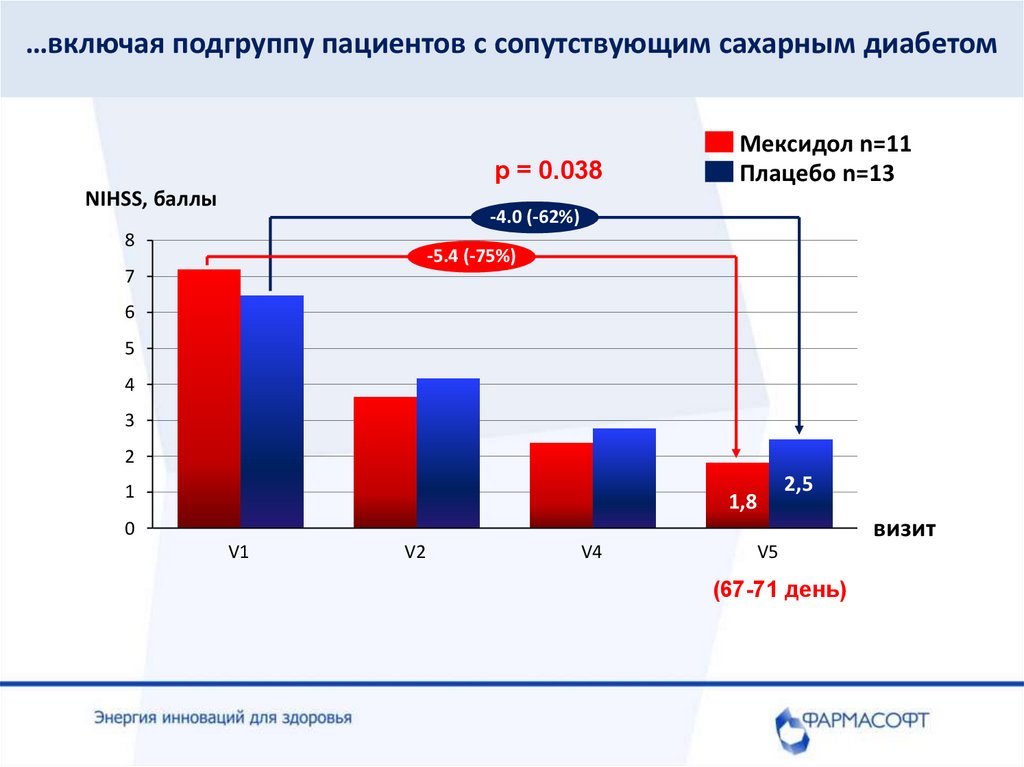
…включая подгруппу пациентов с сопутствующим сахарным диабетомp = 0.038
NIHSS, баллы
Мексидол n=11
Плацебо n=13
-4.0 (-62%)
8
-5.4 (-75%)
7
6
5
4
3
2
1
1,8
2,5
визит
0
V1
V2
V4
V5
(67-71 день)
49.
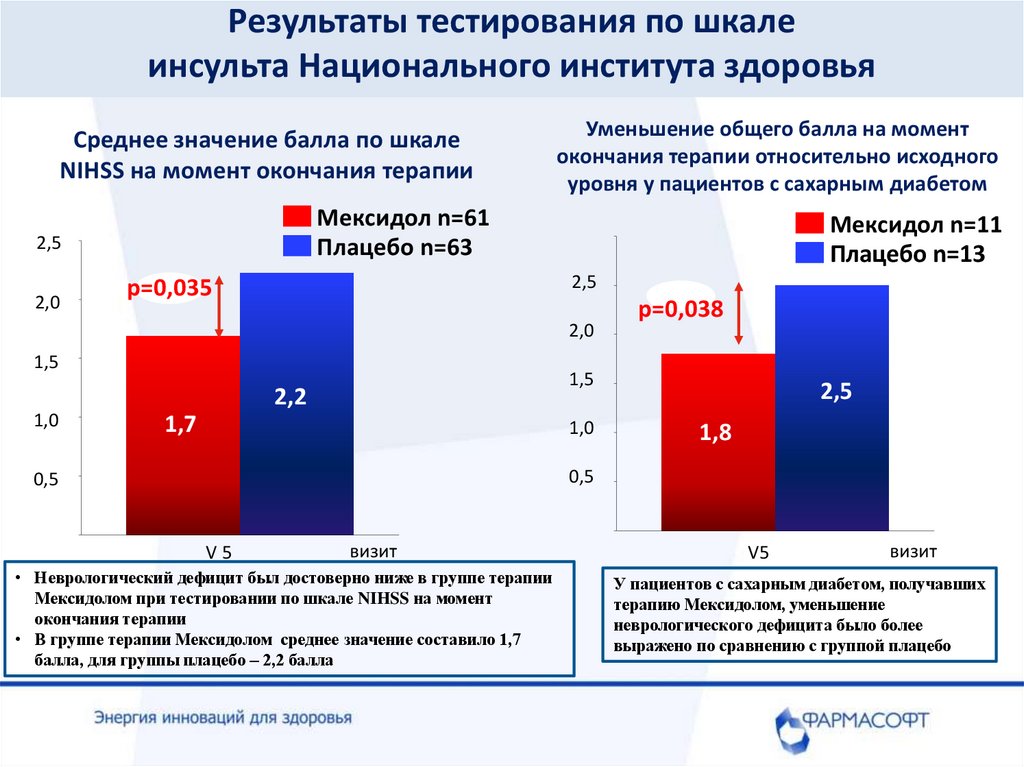
Результаты тестирования по шкалеинсульта Национального института здоровья
Среднее значение балла по шкале
NIHSS на момент окончания терапии
Мексидол n=61
Плацебо n=63
2,5
2,0
Уменьшение общего балла на момент
окончания терапии относительно исходного
уровня у пациентов с сахарным диабетом
Мексидол n=11
Плацебо n=13
2,5
p=0,035
2,0
1,5
1,5
2,2
1,0
p=0,038
1,7
1,0
2,5
1,8
0,5
0,5
V5
визит
• Неврологический дефицит был достоверно ниже в группе терапии
Мексидолом при тестировании по шкале NIHSS на момент
окончания терапии
• В группе терапии Мексидолом среднее значение составило 1,7
балла, для группы плацебо – 2,2 балла
V5
визит
У пациентов с сахарным диабетом, получавших
терапию Мексидолом, уменьшение
неврологического дефицита было более
выражено по сравнению с группой плацебо
50.
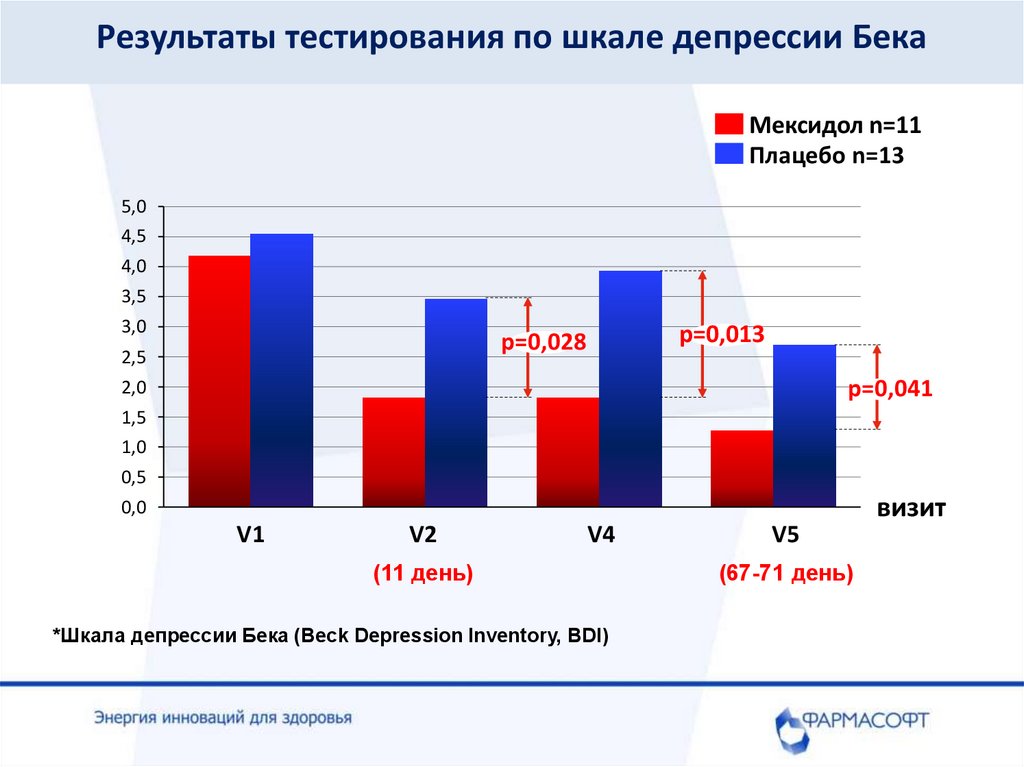
Результаты тестирования по шкале депрессии БекаМексидол n=11
Плацебо n=13
5,0
4,5
4,0
3,5
3,0
p=0,013
p=0,028
2,5
2,0
1,5
1,0
0,5
0,0
p=0,041
V1
V2
V4
(11 день)
*Шкала депрессии Бека (Beck Depression Inventory, BDI)
V5
(67-71 день)
визит
51.
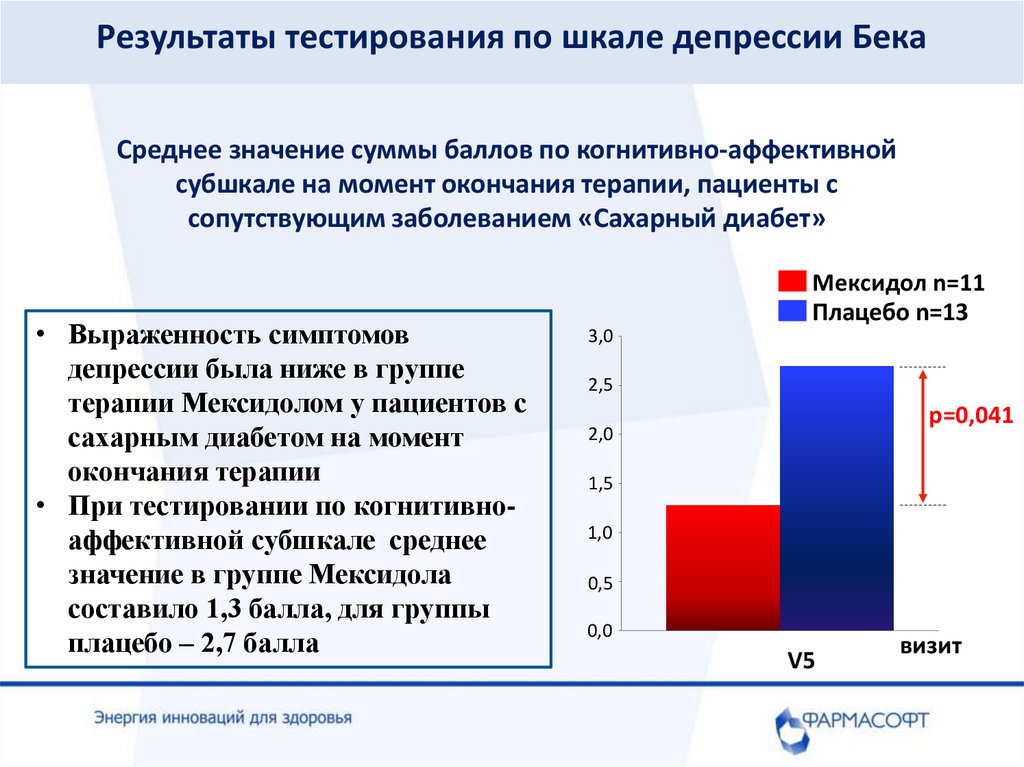
Результаты тестирования по шкале депрессии БекаСреднее значение суммы баллов по когнитивно-аффективной
субшкале на момент окончания терапии, пациенты с
сопутствующим заболеванием «Сахарный диабет»
• Выраженность симптомов
депрессии была ниже в группе
терапии Мексидолом у пациентов с
сахарным диабетом на момент
окончания терапии
• При тестировании по когнитивноаффективной субшкале среднее
значение в группе Мексидола
составило 1,3 балла, для группы
плацебо – 2,7 балла
Мексидол n=11
Плацебо n=13
3,0
2,5
p=0,041
2,0
1,5
1,0
0,5
0,0
V5
визит
52.
Стоимость лечения депрессии•19 940 руб. с легким депрессивным расстройством
•76 910 руб. с депрессией умеренной степени тяжести
•99 878 руб. с тяжелой степенью депрессии
Распространенность депрессий составляет 5% населения,
общее число пациентов - 7,095 млн. чел.
Легкая степень встречается у 20% из всех депрессий (1 419 000
чел.), средняя у 44% (3 121 800 чел.), тяжелая у 36% (2 554 200
чел.).
Куликов А.Ю., Дедюрина Ю.М. // Фармакоэкономика, Том 4, №1, 2011 г., стр. 2433
53.
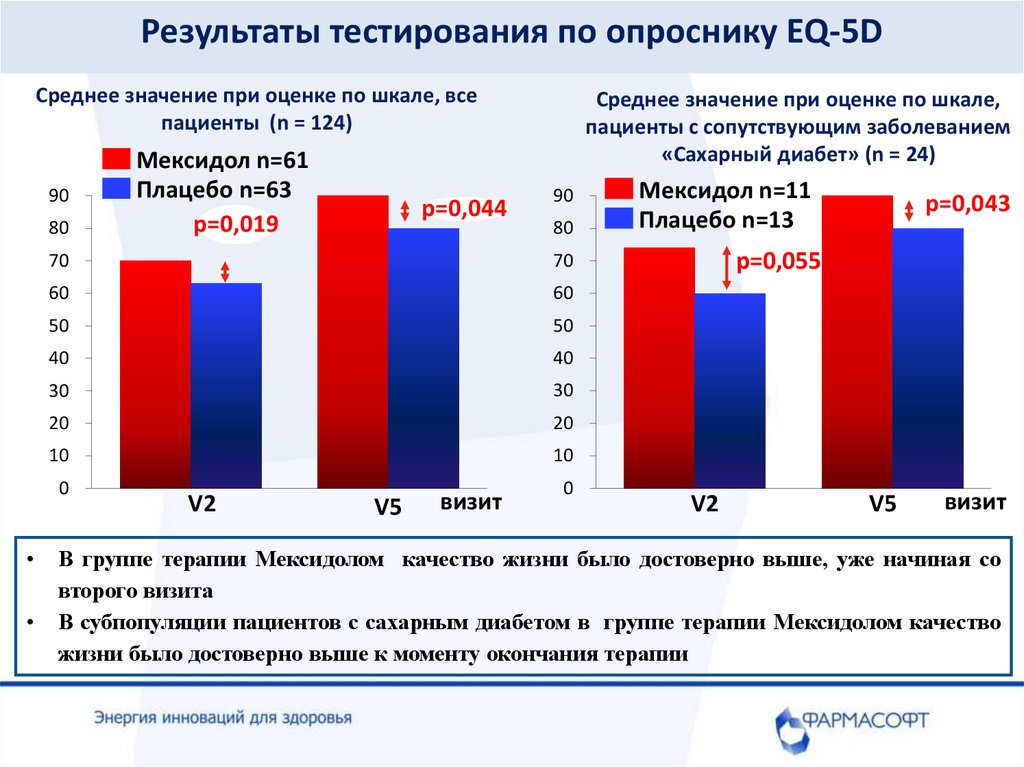
Результаты тестирования по опроснику EQ-5DСреднее значение при оценке по шкале, все
пациенты (n = 124)
80
Мексидол n=11
Плацебо n=13
70
70
p=0,055
60
60
50
50
40
40
30
30
20
20
10
10
90
80
0
Мексидол n=61
Плацебо n=63
p=0,019
Среднее значение при оценке по шкале,
пациенты с сопутствующим заболеванием
«Сахарный диабет» (n = 24)
V2
p=0,044
V5
визит
90
0
V2
p=0,043
V5
визит
В группе терапии Мексидолом качество жизни было достоверно выше, уже начиная со
второго визита
В субпопуляции пациентов с сахарным диабетом в группе терапии Мексидолом качество
жизни было достоверно выше к моменту окончания терапии
54.
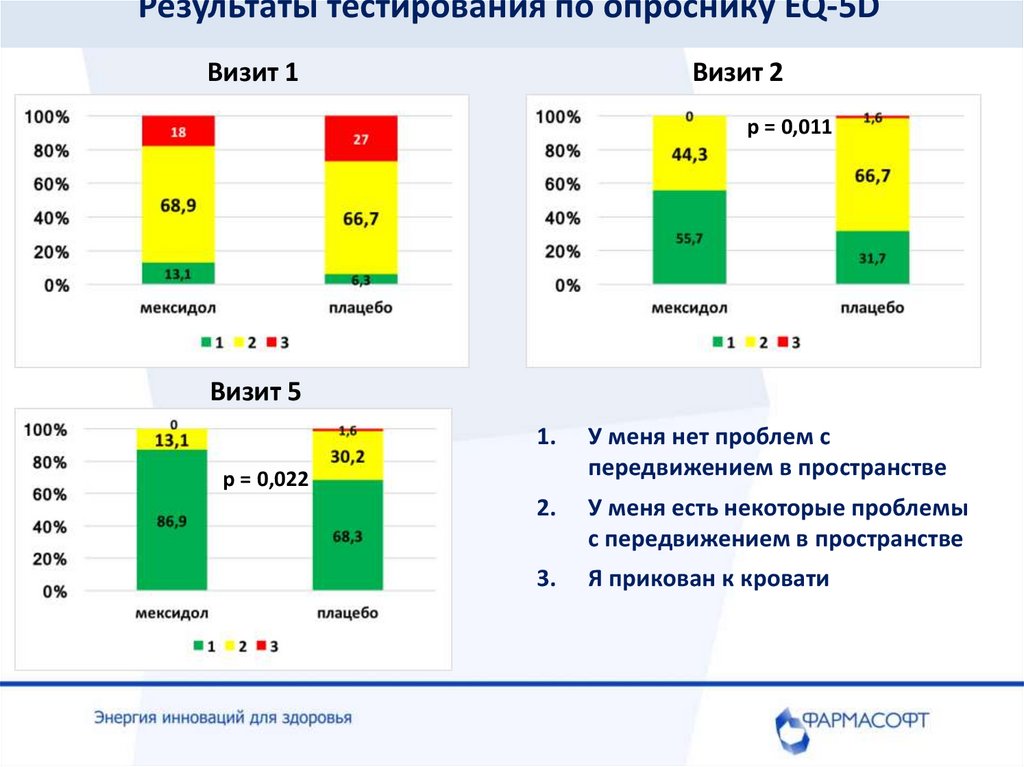
Результаты тестирования по опроснику EQ-5DВизит 1
Визит 2
p = 0,011
Визит 5
1.
У меня нет проблем с
передвижением в пространстве
2.
У меня есть некоторые проблемы
с передвижением в пространстве
3.
Я прикован к кровати
p = 0,022
55.
Профиль пациента группы терапии Мексидолом по данным EQ-5D намомент окончания терапии
Мобильность:
1. 87% пациентов, получавших терапию Мексидолом, отмечали, что у них не
возникает никаких проблем с передвижением
13%
2. У меня затруднения при передвижении
3. Я полностью прикован к постели
Самообслуживание
87%
21%
1. 79% отмечали, что у них не возникает проблем с самообслуживанием
2. у меня некоторые проблемы с умыванием либо одеванием
3. Я совершенно не могу самостоятельно мыться и одеваться
Бытовая активность
1. 71% пациентов считали, что у них нет проблем с выполнением повседневных
привычных обязанностей (работа, учеба, ведение домашнего хозяйства, отдых)
79%
29%
71%
2. У меня имеются некоторые проблемы с выполнением повседневных привычных
обязанностей
3. Я совершенно не могу выполнять повседневные привычные обязанности
Боль/Дискомфорт
1. 85% пациентов не испытывали болей либо дискомфорта
15%
2. Я испытываю умеренные боли либо дискомфорт
3. Я испытываю чрезвычайные боли и дискомфорт
Тревога/Депрессия
1. 89% пациентов не испытывали тревоги либо депрессии
2. Я испытываю умеренную тревогу либо депрессию
3. Я испытываю чрезвычайную тревогу либо депрессию
85%
11%
89%
Подавляющее большинство пациентов в группе терапии Мексидолом отмечали, что у них не
возникает никаких проблем с передвижением, самообслуживанием, выполнением повседневных
дел, не испытывали боли и дискомфорта, тревоги и депрессии
56.
Оценка безопасности• Данные физикального осмотра, жизненно важные
показатели
• Данные общеклинического, биохимического анализов
крови, коагулограмма, общий анализ мочи, ЭКГ
• Частота и выраженность нежелательных реакций на
препарат
• Данные КТ/МРТ (на Визите 1, далее по назначению
лечащего врача)
57.
Безопасность терапии Мексидолом и плацеборасценены как удовлетворительные
Зарегистрировано 41 НЯ у 32 пациентов
• 37 случаев НЯ у 28 больных
• 4 случая СНЯ у 4 пациентов
58.
Выводы• В ходе терапии Мексидолом отмечалось достоверно
более выраженное по сравнению с плацебо улучшение
жизнедеятельности, оцененное по шкале mRS
• Неврологический дефицит был достоверно ниже в группе
терапии Мексидолом при тестировании по шкале NIHSS на
момент окончания терапии по сравнению с плацебо
• Терапия Мексидолом способствовала достоверному
улучшению качества жизни (опросник EQ-5D) и снижению
депрессии (шкала Бэка) уже начиная со второго визита
• Показана безопасность длительной последовательной
терапии Мексидолом по сравнению с плацебо у пациентов
с ишемическим инсультом в остром и раннем
восстановительном периодах








































 medicine
medicine








